Введение
Холангиокарцинома — злокачественная опухоль, происходящая из эпителия билиарного дерева, занимающая второе место после гепатоцеллюлярного рака, первичных злокачественных опухолей печени [1–3]. Холангиокарциномы составляют до 3 % от всех злокачественных опухолей органов брюшной полости [2, 4, 5]. Ранее анатомически холангиокарциномы разделяли на три типа — внутрипеченочная холангиокарцинома, хилярная холангиокарцинома и дистальная холангиокарцинома [4, 6, 7]. В последнее время многие авторы используют термин «перихилярная холангиокарцинома». В 1965 году американский патолог Gerald Klatskin [8] впервые описал клинические особенности 13 пациентов с хилярной холангиокарциномой. Согласно 7-му изданию TNM классификации International Union Against Cancer (UICC), под перихилярной холангиокарциномой понимают холангиокарциномы с поражением желчных протоков портальных ворот печени, то есть желчные протоки, топологически располагающиеся между правым краем умбиликальной порции левой ветви воротной вены и устьем правой задней секционной ветви воротной вены, а дистально ограниченные местом впадения пузырного протока [9]. Таким образом, в современной хирургической литературе используются три равнозначных термина, определяющих одну и ту же локализацию холангиокарциномы конфлюенса желчных протоков, — «хилярная холангиокарцинома», «перихилярная холангиокарцинома» и «опухоль Клацкина». Перихилярная холангиокарцинома — наиболее часто встречающийся тип, выявляется от 50 до 70 % всех злокачественных опухолей желчных протоков [7, 10]. Распространенность внутрипеченочной и дистальной холангиокарциномы составляет 6–10 и 25–30 % соответственно. Одной из важных и характерных особенностей перихилярной холангиокарциномы является инвазия опухоли в область бифуркации воротной вены, которая встречается в 30–45 % случаев [11, 12]. Перихилярная холангиокарцинома — сложная онкологическая патология, и ее хирургическое лечение остается одной из трудных проблем хирургической гепатологии. Однако, поскольку резекционная хирургия печени является единственным радикальным методом лечения перихилярной холангиокарциномы, многие ведущие клиники мира приняли агрессивный подход. В последнее время развитие новых методов дооперационной диагностики и применение трансплантационных технологий хирургии печени привело к увеличению радикальных оперативных вмешательств и показателей отдаленной выживаемости.
Тем не менее все еще остается множество противоречий в подходах к лечению опухоли Клацкина. Это обусловлено небольшой распространенностью заболевания, относительно небольшими группами исследования в различных клиниках и отсутствием больших рандомизированных исследований.
Целью настоящего исследования явилось изучение результатов хирургического лечения пациентов с перихилярной холангиокарциномой с инвазией в воротную вену.
Материалы и методы
С 2003 по 2017 год в отделе хирургии и трансплантации печени Национального института хирургии и трансплантологии им. А.А. Шалимова НАМН Украины было обследовано 175 пациентов с перихилярной холангиокарциномой. В 43 (24,6 %) случаях в связи с выявлением отдаленных метастазов, карциноматозов или плохим функциональным состоянием печени радикальные оперативные вмешательства не выполняли. У 131 пациента выполнены радикальные резекции печени. В 61 (46,6 %) случае в связи с инвазией перихилярной холангиокарциномы в конфлюенс воротной вены резекцию печени дополняли резекцией и реконструкцией последней. Этот 61 (46,6 %) пациент включен в основную группу исследования. Группу сравнения составили 70 (53,4 %) пациентов, которым выполнили резекции печени без сосудистых реконструкций. Мужчин среди пациентов было 83 (63 %), женщин — 48 (37 %). Средний возраст пациентов основной группы составил 57 (37–81) лет, в группе сравнения — 57,1 (26–74) года (табл. 1).
/55-1.jpg)
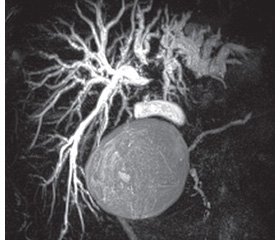
Всем больным проводилось дооперационное обследование, включающее общий, биохимический анализ крови, ультразвуковое исследование органов брюшной полости, фиброэзофагогастродуоденоскопию, колоноскопию, эхокардиографию. В обязательном порядке выполняли трехфазную компьютерную томографию органов брюшной полости и грудной клетки. По данным спиральной компьютерной томографии оценивали поражение паренхимы печени, инвазию в портальные сосуды, печеночные вены, наличие внепеченочных метастазов и рассчитывали объем остающейся части печени (рис. 1). Для оценки поражения желчного дерева всем пациентам выполняли магнитно-резонансную томографию и холангиографию (рис. 2).
Всем пациентам проводили серологическое исследование онкомаркеров. Наиболее специфичным онкомаркером при перихилярной холангиокарциноме являлся углеводный антиген CA 19–9. Средний показатель Са 19–9 в основной группе составил 288 (8–1000) Ед/мл, в группе сравнения — 262 Ед/мл
(10–612). Известно, что при повышении уровня СA 19–9 более 180 Ед/мл его чувствительность составляет 79 %, а специфичность — 98 % [13–15].
Обструкция желчных протоков может приводить к бактериальной транслокации, нарушению свертывающей системы крови, почечной недостаточности и повышению риска развития печеночной недостаточности в послеоперационном периоде [16, 17]. Уровень общего билирубина у пациентов основной группы составил 312 (43–621) мкмоль/л, в группе сравнения — 267 (10–612) мкмоль/л. Ввиду этого в предоперационном периоде 116 (88,5 %) пациентам выполняли декомпрессию желчных протоков, с помощью их наружного дренирования под рентгено- или ультразвуковым контролем либо проводили ретроградное эндобилиарное стентирование (табл. 2). Чреcкожную чреспеченочную холангиостомию правого долевого протока выполняли в 43 (32,8 %) случаях, левого долевого протока — в 35 (26,7 %), одновременно правого и левого долевых протоков — в 25 (19,1 %) случаях. У 13 (9,9 %) пациентов делали ретроградное эндобилиарное стентирование. Время от декомпрессии желчного дерева до выполнения оперативного вмешательства составило 50 (13–126) дней. Допустимым уровнем билирубинемии в предоперационном периоде считали < 60 мкмоль/л. Всем пациентам в предоперационном периоде с помощью компьютерной волюметрии оценивали объем остающейся части печени. В случаях, когда планируемый печеночный остаток был менее 35 % от общего объема печени, мы выполняли рентгенэндоваскулярную окклюзию ветвей воротной вены. В 27 (20,6 %) случаях у пациентов с перихилярной холангиокарциномой типа IIIа по Bismuth — Corlette делали эмболизацию правой долевой ветви воротной вены. В 7 (5,3 %) случаях у пациентов с перихилярной холангиокарциномой типа IV по Bismuth — Corlette выполнена эмболизация правой и сегментарной ветви Sg 4 воротной вены. В 2 (1,5 %) случаях при перихилярной холангиокарциноме типа IIIb по Bismuth — Corlette выполняли окклюзию левой долевой ветви воротной вены. На 21–28-е сутки для оценки степени регенерации печени этим пациентам делали повторную спиральную компьютерную томографию с волюметрией остающегося участка печени. С помощью эмболизации соответствующей ветви воротной вены достигали увеличения остающегося остатка печени в среднем на 25–35 %, что позволило уменьшить проявления печеночной недостаточности в после–операционном периоде.
/56-1.jpg)
Результаты
За период с 2003 по 2017 год в Национальном институте хирургии и трансплантологии выполнено 140 радикальных оперативных вмешательств при перихилярной холангиокарциноме. Во всех случаях первым этапом выполняли расширенную лимфодиссекцию лимфоузлов групп 5, 7, 8, 9, 12, 13, 14, 16 и 17 согласно японской классификации лимфатических узлов. При выборе объема оперативного вмешательства мы исходили из типа поражения желчного дерева по классификации Bismuth — Corlette, инвазии в портальные сосуды и глубины поражения печени. Так, при IIIa типе поражения желчных протоков в основной группе в 17 (27,9 %) случаях выполнили правостороннюю гемигепатэктомию, в 11 (18 %) случаях — правостороннюю трисекциоэктомию. При поражении желчного дерева IIIb типа по Bismuth — Corlette выполняли левостороннюю гемигепатэктомию в 26 (42,7 %) случаях и в одном случае — левостороннюю трисекциоэктомию. При IV типе выполнили 5 (8,2 %) правосторонних трисекциоэктомию и 1 (1,6 %) левостороннюю трисекциоэтомию печени. Характеристика оперативных вмешательств представлена в таблице 3. Реконструкцию воротной вены во всех случаях выполняли по типу конец в конец между стволом воротной вены и ветвью воротной вены остающейся части печени. Средняя длительность портопластики составила 28,4 (15–53) минуты. Длительность операции в основной группе — 518 (325–850) минут, а в группе сравнения — 485 (330–905) минут. Интра–операционная кровопотеря — 1133 (100–4090) мл в основной группе, в группе сравнения — 700 (250–2200) мл.
Гистологически опухоль в основной группе в 7 (11,5 %) случаях была высокодифференцированной, в 47 (77 %) — умеренно дифференцированной, в 7 (11,5 %) — низкодифференцированной (табл. 4). Согласно гистологическому исследованию, метастатическое поражение 1–3 регионарных лимфоузлов (N1) было выявлено у 9 (14,7 %) пациентов, 4 и более (N2) — у 2 (3,3 %) пациентов. Также исследовали тип роста опухолей в основной группе и группе сравнения. Так, наиболее часто выявляли интрадуктальный рост в 31 (50,8 %) случае, перидуктальный рост — в 18 (29,5 %) случаях, наименее частый тип роста — массформирующий (или нодулярный) выявлен в 12 (19,7 %) случаях.
/57-1.jpg)
Частота послеоперационных осложнений и летальности существенно не отличалась в обеих группах. Все осложнения были классифицированы согласно градации Dindo — Clavien (табл. 5). У 35 (57,4 %) пациентов отмечалось два осложнения и более. В основной группе, в послеоперационном периоде наиболее часто, у 10 (16,4 %) пациентов наблюдались явления печеночной недостаточности, требовавшие пребывания в отделении интенсивной терапии. У 5 (8,2 %) пациентов отмечалось желчеистечение из раневой поверхности печени, которое было дренировано под ультразвуковым контролем. У 2 (3,3 %) пациентов выявлена несостоятельность гепатикоеюноанастомоза, потребовавшая релапаротомии с формированием регепатикоеюностомии.
/58-2.jpg)
Послеоперационная летальность в основной группе составила 11,5 %. Причинами послеоперационной летальности в 3 случаях были полиорганная недостаточность и сепсис, в 1 случае — коагулопатические кровотечения, в 1 случае — острая сердечно-сосудистая недостаточность, в 1 случае — тромбоз печеночной артерии, в 1 случае — тромбоз воротной вены.
Общая 1-, 3-, 5-летняя выживаемость в исследуемой группе составила 86,8, 58, 50 % соответственно. В группе сравнения 1-, 3-, 5-летняя выживаемость составила 85,6, 56, 42 % соответственно (рис. 3).
Обсуждение
Хирургическое лечение перихилярной холангио–карциномы остается одной из самых острых проблем хирургической гепатологии, связанной с трудностью выполнения R0 резекции вследствие частой инвазии в сосуды печеночно-двенадцатиперстной связки.
Изначальная концепция изолированной резекции желчных протоков без резекции печени и паллиативных процедур приводила к возникновению локальных рецидивов в течение первого года у 76 % пациентов [18]. Miyazaki и соавт. в своем исследовании показали, что при изолированной резекции внепеченочных желчных протоков отсутствует пятилетняя выживаемость, в то время как пятилетняя выживаемость пациентов, которым выполнялась резекция печени, составила 27 % [19].
Последние достижения хирургической техники и периоперативного ведения пациентов, включающие анестезиологическое обеспечение, снижение интраоперационной кровопотери, управление центральным венозным давлением, нутритивную поддержку, привели к улучшению результатов хирургического лечения перихилярной холангиокарциномы [20, 21]. Периоперационная летальность снизилась с 90 до менее 10 %. Это развитие побудило многие ведущие хирургические центры к агрессивному подходу к лечению пациентов с перихилярной холангиокарциномой. В 1990 году Y. Nimura и соавт. предложили концепцию рутинной тотальной каудальной лобэктомии [22]. Эта идея связана с инфильтрацией опухоли вдоль желчного дерева и распространением на желчные протоки хвостатой доли печени. Такой подход привел к возможности выполнения R0 резекций печени при перихилярной холангиокарциноме и увеличению 5-летней выживаемости с 5 до 40 % [22–24]. С другой стороны, агрессивный подход и выполнение обширных резекций печени привели к увеличению частоты развития послеоперационной печеночной недостаточности [25]. Однако развитие эндоваскулярных технологий и возможность моделирования печеночного остатка на дооперационном периоде путем эмболизации ветвей воротной вены позволили снизить послеоперационную летальность в результате печеночной недостаточности до 20 %. Так, в 1982 году Makuuchi и соавт. впервые предложили методику эмболизации правой долевой ветви воротной вены для предотвращения послеоперационной печеночной недостаточности [26]. T. Ebata и соавт. сообщили о серии из 353 пациентов с перихилярной холангиокарциномой, которым выполнялась эмболизиция ветвей воротной вены удаляемой части печени перед расширенной гемигепатэктомией [27]. В этой серии резектабельность составила 83 %, послеоперационная летальность — 4 %, а пятилетняя выживаемость выросла до 40 %. Таким образом, применение дооперационной декомпрессии желчного дерева и моделирование печеночного остатка перед резекцией печени при перихилярной холангиокарциноме способствует увеличению резектабельности со снижением послеоперационной летальности [18, 28, 29].
Инвазия перихилярной холангиокарциномы в воротную вену остается основным препятствием к выполнению оперативных вмешательств. Однако развитие гепатобилиарной хирургии и внедрение трансплантационных технологий позволили расширить показания к радикальным оперативным вмешательствам. T. Ebata и соавт. в своем исследовании сообщают, что при инвазии перихилярной холангиокарциномы в воротную вену резекция воротной вены с последующей портопластикой приводит к увеличению 5-летней выживаемости с 10 до 37 % [30].
По мере развития концепции резекции воротной вены P. Neuhaus и соавт. предложили новую методику достижения радикального хирургического лечения перихилярной холангиокарциномы [31, 32]. Это так называемая hilar en block резекция, или non-touch техника, включающая в себя расширенную правостороннюю трисекциоэктомию (Sg 1, 4–8), резекцию бифуркации воротной вены, резекцию правой печеночной артерии и внепеченочных желчных протоков. В исследовании сообщается об увеличении пятилетней выживаемости до 58 % по сравнению со стандартной гемигепатэктомией (29 %). Однако недостатком методики являются высокий риск послеоперационной печеночной недостаточности, высокая послеоперационная летальность, ограниченность применения только для перихилярной холангиокарциномы IIIa и IV типа по Bismuth — Corlette.
Наш подход к выбору объема оперативного вмешательства основан на уровне поражения желчного дерева согласно классификации Bismuth — Corlette. Так, при IIIa типе поражения желчных протоков мы выполняем правостороннюю гемигепатэктомию или правостороннюю трисекциоэктомию. При поражении желчного дерева IIIb тип по Bismuth — Corlette — левостороннюю гемигепатэктомию или левостороннюю трисекциоэктомию. При IV типе выполнили правосторонние трисекциоэктомии или левосторонние трисекциоэктомии печени. Выбор объема удаляемой части печени зависел от уровня поражения воротной вены.
Выводы
1. Инвазия перихилярной холангиокарциномы в воротную вену диктует необходимость ее резекции и реконструкции и не является противопоказанием к радикальному оперативному лечению.
2. Агрессивная тактика, включающая резекцию желчных протоков, соответствующей паренхимы печени и обязательно хвостатой доли, с резекцией воротной вены, обеспечивает максимальную радикальность, позволяет увеличить резектабельность перихилярной холангиокарциномы.
3. Инновационные хирургические технологии лечения перихилярной холангиокарциномы позволяют получить удовлетворительные ближайшие и отдаленные результаты с приемлемым уровнем летальности и отдаленной выживаемости.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Blechacz B.R., Gores G.J. Cholangiocarcinoma // Clin. Liver Dis. — 2008. — № 12(1). — Р. 131-50.
2. Gatto M., Bragazzi M.C., Semeraro R., Napoli C., Gentile R., Torrice A. et al. Cholangiocarcinoma: update and future perspectives // Dig. Liver Dis. — 2010. — № 42(4). — Р. 253-60.
3. Sripa B., Pairojkul C. Cholangiocarcinoma: lessons from Thailand // Curr. Opin. Gastroenterol. — 2008. — № 24(3). — Р. 349-56.
4. Patel T. Cholangiocarcinoma // Nat. Clin. Pract. Gastroenterol. Hepatol. — 2006. — № 3(1). — Р. 33-42.
5. Shaib Y., El-Serag H.B. The epidemiology of cholangiocarcinoma // Semin. Liver Dis. — 2004. — № 24(2). — Р. 115-25.
6. Lazaridis K.N., Gores G.J. Cholangiocarcinoma // Gastroenterology. — 2005. — № 128(6). — Р. 1655-67.
7. Nakeeb A., Pitt H.A., Sohn T.A., Coleman J., Abrams R.A., Piantadosi S. et al. Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors // Ann. Surg. — 1996. — № 224(4). — Р. 463-73; discussion 73-5.
8. Klatskin G. Adenocarcinoma of the Hepatic Duct at Its Bifurcation within the Porta Hepatis. An Unusual Tumor with Distinctive Clinical and Pathological Features // The American journal of medicine. — 1965. — 38. — Р. 241-56.
9. (UICC) IUAC, editor. TNM classification of malignant tumors. 7th ed. — New York, 2009.
10. DeOliveira M.L., Cunningham S.C., Cameron J.L., Kamangar F., Winter J.M., Lillemoe K.D. et al. Cholangiocarcinoma: thirty-one-year experience with 564 patients at a single institution // Ann. Surg. — 2007. — № 245(5). — Р. 755-62.
11. Wu X.S., Dong P., Gu J., Li M.L., Wu W.G., Lu J.H. et al. Combined portal vein resection for hilar cho–langiocarcinoma: a meta-analysis of comparative studies // J. Gastrointest. Surg. — 2013. — № 17(6). — Р. 1107-15.
12. De Jong M.C., Marques H., Clary B.M., Bauer T.W., Marsh J.W., Ribero D. et al. The impact of portal vein resection on outcomes for hilar cholangiocarcinoma: a multi-institutional analysis of 305 cases // Cancer. — 2012. — № 118(19). — Р. 4737-47.
13. Yang W.L., Zhang X.C., Zhang D.W., Tong B.F. Diagnosis and surgical treatment of hepatic hilar cholangiocarcinoma // Hepatobiliary Pancreat. Dis. Int. — 2007. — № 6(6). — Р. 631-5.
14. Juntermanns B., Kaiser G.M., Reis H., Saner F.H., Radunz S., Vernadakis S. et al. Klatskin-mimicking lesions: still a diagnostical and therapeutical dilemma? // Hepatogastroenterology. — 2011. — № 58(106). — Р. 265-9.
15. Van Gulik T.M., Dinant S., Busch O.R., Ra–uws E.A., Obertop H., Gouma D.J. Original article: New surgical approaches to the Klatskin tumour // Aliment Pharmacol. Ther. — 2007. — № 26(Suppl. 2). — Р. 127-32.
16. Hemming A.W., Reed A.I., Fujita S., Foley D.P., Howard R.J. Surgical management of hilar cholangiocarcinoma // Ann. Surg. — 2005. — № 241(5). — Р. 693-9; discussion 9-702.
17. Oussoultzoglou E., Jaeck D. Patient preparation before surgery for cholangiocarcinoma // HPB (Oxford). — 2008. — № 10(3). — Р. 150-3.
18. Nimura Y., Kamiya J., Kondo S., Nagino M., –Uesaka K., Oda K. et al. Aggressive preoperative management and extended surgery for hilar cholangiocarcinoma: Nagoya experience // J. Hepatobiliary Pancreat. Surg. — 2000. — № 7(2). — Р. 155-62.
19. Miyazaki M., Ito H., Nakagawa K., Ambiru S., Shimizu H., Shimizu Y. et al. Aggressive surgical approaches to hilar cholangiocarcinoma: hepatic or local resection? // Surgery. — 1998. — № 123(2). — Р. 131-6.
20. Jarnagin W.R., Gonen M., Fong Y., DeMatteo R.P., Ben-Porat L., Little S. et al. Improvement in perioperative outcome after hepatic resection: analysis of 1,803 consecutive cases over the past decade // Ann. Surg. — 2002. — № 236(4). — Р. 397-406; discussion 7.
21. Melendez J.A., Arslan V., Fischer M.E., Wuest D., Jarnagin W.R., Fong Y. et al. Perioperative outcomes of major hepatic resections under low central venous pressure anesthesia: blood loss, blood transfusion, and the risk of postoperative renal dysfunction // J. Am. Coll. Surg. — 1998. — № 187(6). — Р. 620-5.
22. Nimura Y., Hayakawa N., Kamiya J., Kondo S., Shionoya S. Hepatic segmentectomy with caudate lobe resection for bile duct carcinoma of the hepatic hilus // World J. Surg. — 1990. — № 14(4). — Р. 535-43; discussion 44.
23. Dinant S., Gerhards M.F., Busch O.R., Obertop H., Gouma D.J., Van Gulik T.M. The importance of complete excision of the caudate lobe in resection of hilar cholangiocarcinoma // HPB (Oxford). — 2005. — № 7(4). — Р. 263-7.
24. Wahab M.A., Sultan A.M., Salah T., Fathy O., Elebidy G., Elshobary M. et al. Caudate lobe resection with major hepatectomy for central cholangiocarcinoma: is it of value? // Hepatogastroenterology. — 2012. — № 59(114). — Р. 321-4.
25. Abulkhir A., Limongelli P., Healey A.J., Damrah O., Tait P., Jackson J. et al. Preoperative portal vein embolization for major liver resection: a meta-analysis // Ann. Surg. — 2008. — № 247(1). —Р. 49-57.
26. Makuuchi M., Thai B.L., Takayasu K., Takayama T., Kosuge T., Gunven P. et al. Preoperative portal embolization to increase safety of major hepatectomy for hilar bile duct carcinoma: a preliminary report // Surgery. — 1990. — № 107(5). — Р. 521-7.
27. Ebata T., Yokoyama Y., Igami T., Sugawara G., Takahashi Y., Nagino M. Portal vein embolization before extended hepatectomy for biliary cancer: current technique and review of 494 consecutive embolizations // Dig. Surg. — 2012. — № 29(1). — Р. 23-9.
28. Kawasaki S., Imamura H., Kobayashi A., Noike T., Miwa S., Miyagawa S. Results of surgical resection for patients with hilar bile duct cancer: application of extended hepatectomy after biliary drainage and hemihepatic portal vein embolization // Ann. Surg. — 2003. — № 238(1). — Р. 84-92.
29. Sano T., Shimada K., Sakamoto Y., Yamamoto J., Yamasaki S., Kosuge T. One hundred two consecutive hepatobiliary resections for perihilar cholangiocarcinoma with zero mortality // Ann. Surg. — 2006. — № 244(2). — Р. 240-7.
30. Ebata T., Nagino M., Kamiya J., Uesaka K., Nagasaka T., Nimura Y. Hepatectomy with portal vein resection for hilar cholangiocarcinoma: audit of 52 consecutive cases // Ann. Surg. — 2003. — № 238(5). — Р. 720-7.
31. Neuhaus P., Jonas S., Settmacher U., Thelen A., Benckert C., Lopez-Hanninen E. et al. Surgical management of proximal bile duct cancer: extended right lobe resection increases resectability and radicality // Langenbecks Arch. Surg. — 2003. — № 388(3). — Р. 194-200.
32. Neuhaus P., Thelen A., Jonas S., Puhl G., Denecke T., Veltzke-Schlieker W. et al. Oncological superiority of hilar en bloc resection for the treatment of hilar cholangiocarcinoma // Ann. Surg. Oncol. — 2012. — № 19(5). — Р. 1602-8.

/55-1.jpg)
/54-1.jpg)
/54-2.jpg)
/56-1.jpg)
/57-1.jpg)
/58-2.jpg)
/58-1.jpg)