Резюме
Актуальність. Зустрічальність ожиріння і його ускладненого перебігу останніми роками, особливо серед дітей, які проживають у великих містах, збільшується з епідемічною швидкістю, а причини даного патоморфозу залишаються недостатньо вивченими. Зокрема, не відображено роль порушення дигестії лактози у формуванні інсулінорезистентності, асоційованої з ожирінням у дітей. Мета: вивчити асоціацію мальдигестії лактози з генотипами гена лактази (LCT) при ожирінні в дітей, дослідити ефективність лікування ожиріння з використанням низьколактозної дієти та препарату екзогенної лактази. Матеріали та методи. Проведено генотипування за поліморфним локусом гена лактази методом полімеразної ланцюгової реакції в реальному часі та визначено стан дигестії лактози за допомогою водневого дихального тесту (ВДТ) у 74 дітей з ожирінням та 16 здорових дітей віком 6–18 років. За результатами генотипування, ВДТ та призначеною терапією були сформовані групи спостереження: І групу (n = 11) становили діти з генотипом С/С 13910 та мальдигестією лактози, які отримували з першого дня лікування препарат екзогенної лактази, у ІІ групу (n = 11) увійшли діти з генотипом С/С 13910 та мальдигестією лактози, які отримували низьколактозну дієту, ІІІ групу (n = 11) становили діти з генотипом С/С 13910 без мальдигестії лактози, які отримували лише стандартну терапію згідно з національним протоколом лікування, і ІV групу (n = 11) становили діти з генотипом С/Т 13910 та мальдигестією лактози, які отримували низьколактозну дієту. Додатково дітям із груп спостереження визначали індекс НОМА-IR до та після різних видів лікування. Результати. При ожирінні в дітей середній рівень концентрації водню за даними ВДТ після навантаження лактозою при генотипі С/С 13910 становив (36,05 ± 4,73) pрm, при генотипі С/Т 13910 — (22,61 ± 4,10) pрm, при генотипі Т/Т 13910 — (1,33 ± 0,63) pрm, а в здорових дітей із генотипом С/С 13910 — (13,91 ± 3,75) pрm, р < 0,05. Найвищий рівень концентрації водню у видихуваному повітрі за ВДТ до лікування був зареєстрований у І групі спостереження — (39,40 ± 8,04) pрm, у ІІ групі він становив (32,70 ± 10,48) pрm (р > 0,05), у ІІІ групі — (8,60 ± 1,16) pрm (р < 0,05), у ІV групі — (26,30 ± 4,91) pрm (р < 0,05). Найвищий індекс НОМА-IR до лікування визначався також у І групі спостереження, він дорівнював 7,33 ± 0,38; у ІІ групі — 5,53 ± 0,70; у ІІI групі — 4,98 ± 0,76; у ІV групі — 4,85 ± 0,77, р < 0,05. Індекс НОМА-IR після лікування статистично значуще знизився в І та ІІ групах спостереження й становив 3,96 ± 0,60 та 3,17 ± 0,35 відповідно (р < 0,05). Висновки. Мальдигестія лактози сприяє підвищенню інсулінорезистентності при ожирінні в дітей та асоціюється з генотипом С/С 13910, р < 0,05. Лікування мальдигестії лактози при ожирінні в дітей із генотипом С/С 13910 з використанням препарату екзогенної лактази або низьколактозної дієти за допомогою створеної нами комп’ютерної програми Low-lactose diet має однакову ефективність та впливає на статистично значиме зниження індексу HOMA-IR.
Актуальность. Встречаемость ожирения и его осложненного течения в последние годы, особенно среди детей, проживающих в крупных городах, увеличивается с эпидемической скоростью, а причины данного патоморфоза остаются недостаточно изученными. В частности, не отражена роль нарушения дигестии лактозы в формировании инсулинорезистентности, ассоциированной с ожирением у детей. Цель: изучить ассоциацию мальдигестии лактозы с генотипами гена лактазы (LCT) при ожирении у детей, исследовать эффективность лечения ожирения с использованием низколактозной диеты и препарата экзогенной лактазы. Материалы и методы. Проведено генотипирование по полиморфному локусу гена лактазы методом полимеразной цепной реакции в реальном времени и определено состояние дигестии лактозы при помощи водородного дыхательного теста (ВДТ) у 74 детей с ожирением и 16 здоровых детей 6–18 лет. По результатам генотипирования, ВДТ и назначенной терапии были сформированы группы наблюдения: I группу (n = 11) составили дети с генотипом С/С 13910 и мальдигестией лактозы, получавшие с первого дня лечения препарат экзогенной лактазы, во II группу (n = 11) вошли дети с генотипом С/С 13910 и мальдигестией лактозы, получавшие низколактозную диету, III группу (n = 11) составили дети с генотипом С/С 13910 без мальдигестии лактозы, получавшие только стандартную терапию согласно национальным протоколам лечения, и IV группу (n = 11) составляли дети с генотипом С/Т 13910 и мальдигестией лактозы, получавшие низколактозную диету. Дополнительно детям из групп наблюдения определяли индекс НОМА-IR до и после различных видов лечения. Результаты. При ожирении у детей средний уровень концентрации водорода во время ВДТ после нагрузки лактозой при генотипе С/С 13910 составил (36,05 ± 4,73) ppm, при генотипе С/Т 13910 — (22,61 ± 4,10) ppm, при генотипе Т/Т 13910 — (1,33 ± 0,63) ppm, а у здоровых детей с генотипом С/С 13910 — (13,91 ± 3,75) ppm, р < 0,05. Наиболее высокий уровень концентрации водорода в выдыхаемом воздухе при ВДТ до лечения был зарегистрирован в І группе наблюдения — (39,40 ± 8,04) ppm, во II группе он составлял (32,70 ± 10,48) ppm (р > 0,05), в III группе — (8,60 ± 1,16) ppm (р < 0,05), в IV группе — (26,30 ± 4,91) ppm (р < 0,05). Наиболее высокий индекс НОМА-IR до лечения определялся также в І группе наблюдения и составлял 7,33 ± 0,38; во II группе — 5,53 ± 0,70; в ІІІ группе — 4,98 ± 0,76; в IV группе — 4,85 ± 0,77 (р < 0,05). Индекс НОМА-IR после лечения статистически значимо снизился в I и II группах наблюдения и составил 3,96 ± 0,60 и 3,17 ± 0,35 соответственно (р < 0,05). Выводы. Мальдигестия лактозы способствует повышению инсулинорезистентности при ожирении у детей и ассоциируется с генотипом С/С 13910, р < 0,05. Лечение мальдигестии лактозы при ожирении у детей с генотипом С/С 13910 с использованием препарата экзогенной лактазы или низколактозной диеты при помощи созданной нами компьютерной программы Low-lactose diet имеет одинаковую эффективность и влияет на статистически значимое снижение индекса HOMA-IR.
Background. In recent year, the occurrence of obesity and its complicated course increases with epidemic speed, especially among children living in large cities, and the causes of this pathomorphosis remain understudied. In particular, the role of lactose maldigestion in the formation of insulin resistance associated with obesity in children is not described. The objective was to study the association of lactose maldigestion with lactase gene genotypes in obese children, to investigate the effectiveness of treatment for obesity using low-lactose diet and exogenous lactase preparation. Materials and methods. Genotyping by the polymorphic locus of the lactase gene was carried out using real-time polymerase chain reaction, and the state of lactose digestion by hydrogen breath test (HBT) was determined in 74 obese children and 16 healthy children aged 6–18 years. Observation groups were formed following genotyping, НВT and prescribed therapy. Group I consisted of 11 children with C/C 13910 genotype and lactose maldigestion receiving exogenous lactase preparation from the first day of treatment. Group II included 11 children with C/C 13910 genotype and lactose maldigestion, who received low-lactose diet. Group III consisted of 11 children with C/C 13910 genotype and lactose maldigestion receiving only standard therapy according to the national treatment protocols, and group IV — 11 children with C/T 13910 genotype and lactose maldigestion, who received low-lactose diet. In addition, Homeostasis Model Assessment of Insulin Resistance (HOMA-IR) was used in children from the observation groups before and after various treatments. Results. For obesity in children, the average level of hydrogen concentration during HBT after lactose load in C/C 13910 genotype was (36.05 ± 4.73) ppm, in C/T 13910 genotype— (22.61 ± 4.10) ppm, in T/T 13910 genotype — (1.33 ± 0.63) ppm, and in healthy children with C/C 13910 genotype — (13.91 ± 3.75) ppm, p < 0.05. The highest level of hydrogen concentration in the exhaled air with HBT before treatment was registered in group I and was (39.40 ± 8.04) ppm, compared to (32.70 ± 10.48) ppm in group II (p > 0.05), in group III — (8.60 ± 1.16) ppm (р < 0.05), in group IV — (26.30 ± 4.91) ppm (р < 0.05). The highest HOMA-IR before treatment was also registered in observation group I and was (7.33 ± 0.38); in group II — (5.53 ± 0.70); in group ІІІ — (4.98 ± 0.76); in group IV — (4.85 ± 0.77) (p < 0.05). The value of HOMA-IR after treatment had a statistically significant decrease in groups I and II and was (3.96 ± 0.60) and (3.17 ± 0.35), respectively (p < 0.05). Conclusions. Lactose maldigestion increases insulin resistance in obese children and is associated with C/C 13910 genotype, p < 0.05. Treatment of lactose maldigestion in obese children with C/C 13910 genotype using exogenous lactase preparation or low-lactose diet with the help of our computer program “Low-lactose diet” has the same efficacy and affects statistically significant decrease in HOMA-IR.
Вступ
Порушення дигестії лактози залежить від численних біологічних чинників, серед них провідним є відповідність рівня лактозного навантаження ступеню продукції лактази. Лактаза кодується геном LCT, однонуклеотидні поліморфізми (single nucleotide polymorphisms — SNP) якого асоційовані з певними особливостями синтезу ферменту. Відповідно до сучасних уявлень, у більшості представників людства в положенні 13910 гену LCT знаходиться цитозин (С). Дане місцезнаходження цитозину приблизно на 14 kb вище за течією від місця початку транскрипції LCT, у регуляторній ділянці гена лактази — MCM6 (minichromosome maintenance complex component 6). Гомозиготний стан (C/C) індивідуума характеризується поступовим, починаючи приблизно з другого року життя, віковим зниженням рівня продукції лактази. Гомозиготний стан С/С 13910 реєструється більше ніж у 32 % кавказців, 99 % східних азіатів, 74 % південних азіатів та 59 % індивідуумів інших етнічних або змішаних груп [7]. Однонуклеотидне заміщення цитозину на тимін (Т) супроводжується втратою здатності до вікового зниження активності продукції лактази, тобто в індивідуумів з SNP гена LCT лактаза продукується протягом всього життя на достатньо високому рівні. Однонуклеотидні поліморфізми 13910 гена LCT призводять до появи двох варіантів генотипів: гетерозиготного C/Т та гомозиготного Т/Т, а оскільки алель Т є домінантною, обидва ці генотипи супроводжуються лактазною персистенцією (ЛП), рис. 1 [9, 10, 12].
Порушення дигестії лактози проявляється різними станами (табл. 1).
Коли лактозне навантаження в дієті перевищує можливості загальної каталітичної активності лактази, проявляються ознаки лактазної недостатності (ЛН). У фізіологічних умовах лактазна недостатність обумовлена абсолютним або відносним дефіцитом продукції лактази. Отже, лактазна недостатність — вроджений чи набутий дефіцит (гіполактазія) або повна відсутність (алактазія) лактази-флоризин-гідролази (EC 3.2.1.108) — ферменту, що експресується у щітковій облямівці кишкових ворсинок ентероцитів. Максимальний рівень експресії LCT відмічається в дванадцятипалій (121,7 RPKM (reads per kilobase per million, кілобаз на мільйон вимірювань, що читаються під час РНК-секвенування)) і порожній кишці (73,8 RPKM) та забезпечує гідроліз дисахариду лактози до двох моносахаридів — глюкози та галактози, здатних абсорбуватися інтестинальними ентероцитами [11].
Поширеність ЛН серед дитячого населення України сьогодні становить 5,8 % [6]. Найвищій рівень захворюваності на ЛН реєструється з 10–16 років, що збігається з формуванням фізіологічної інсулінорезистентності та критичним періодом ризику виникнення ожиріння в дітей, захворюваність на яке в цьому віковому періоді має найвищий рівень та становить, за даними ВООЗ (2017), серед українських підлітків 45,4 на 1000 дітей та 17,3 % у дитячій популяції в цілому [1, 3, 4, 23].
У той же час поширеність ЛП у світі сильно варіює: від 5 % у Східній Азії до 100 % серед північних європейців, вона ототожнюється з надбанням неолітичної еволюції зі збереження експресії лактази в дорослому житті. Більше того, інтенсивність природного відбору, що пов’язана з формуванням ЛП, була оцінена як найбільш сильна в геномі людини з коефіцієнтом відбору 0,04–0,05 [22]. У деяких індивідуумів за відсутності ЛП відмічається здатність до абсорбції лактозовмісних продуктів [8, 14, 15]. Це, можливо, пов’язане з існуванням й інших варіантів SNP, що здатні впливати на регуляцію транскрипційного фактора і/або трансфекцію гена лактази, наприклад, на сучасному етапі в європейській популяції ідентифіковані й інші SNP LCT, асоційовані з формуванням ЛП — 13907 C>G, 13915 T>C, 13779 G>C, 14010 G> C, 14011 C>T, 14028 T>C [16].
Цікавим також є той факт, що зустрічальність ЛП у географічних регіонах Європи має від’ємний обернений зв’язок з поширеністю ожиріння. Так, максимальна частота зустрічальності лактазної персистенції — понад 90 % — виявляється серед населення північноєвропейських країн Скандинавії та Нідерландів, а мінімальна — серед населення південної Європи (Італії й Іспанії). Найнижчий рівень поширеності надлишкової ваги та ожиріння в Європейському регіоні реєструється в Норвегії та становить серед дітей 7–8 років 15 % (у хлопчиків — 13,5 % та в дівчаток — 17,8 %), найвищий рівень виявляється в Італії та становить 36 % (серед хлопчиків — 37,2 %, серед дівчаток — 34,7 %) [24].
Мета дослідження: вивчити асоціацію мальдигестії лактози з генотипами гена лактази (LCT) при ожирінні в дітей, дослідити ефективність лікування ожиріння з використанням низьколактозної дієти та препарату екзогенної лактази.
Матеріали та методи
Проведено генотипування за поліморфним локусом гена LCT методом полімеразної ланцюгової реакції у реальному часі та визначено стан дигестії лактози за допомогою водневого дихального тесту (ВДТ) у 74 дітей з ожирінням, які перебували на лікуванні в ендокринологічному відділенні КЗ «Дніпропетровська МДКЛ № 1» ДОР, та 16 здорових дітей віком 6–18 років. Усі діти з ожирінням отримували стандартну терапію згідно з Наказом МОЗ України від 27.04.06 № 254 «Про затвердження протоколу надання медичної допомоги дітям за спеціальністю «Дитяча ендокринологія».
Дослідження генотипів гена LCT було виконано в сертифікованій лабораторії Synevo, як аналізатор використовувався детектор ДТ-96 тест-системи «ДНК-Технологія» (РФ). Матеріалом для дослідження була венозна кров.
Водневий дихальний тест із навантаженням лактозою (з розрахунку 1 г/кг, але не більше ніж 25 г лактози у вигляді 10% водного розчину) був проведений в ДУ «Інститут гастроентерології НАМН України» за допомогою газоаналізатора Gastro+Gastrolyser британської компанії Bedfont Scientific Ltd. Вміст водню визначався в мільйонних частках — parts per million (ppm). Позитивним вважався тест при збільшенні рівня водню в повітрі, що видихається, через 60 хвилин більше ніж на 20 ррm (0,002 %) порівняно з базальним рівнем і появі клінічних симптомів ЛН протягом трьох наступних годин спостереження [5, 13]. Підвищення рівнів Н2 у пробах повітря без виникнення характерних симптомів свідчило про мальдигестію лактози, з виникненням характерних симптомів — про лактозну інтолерантність. Хибнопозитивний результат був можливим при синдромі надлишкового бактеріального росту, прискореному кишковому транзиті. Хибнонегативний результат — у не-Н2-продуцентів [18].
Додатково дітям із груп спостереження визначали рівень інсулінорезистентності з розрахунком загальноприйнятого маркера резистентності тканин до дії інсуліну (індексу НОМА-IR, Homeostasis Model Assesment) до та після різних видів лікування за допомогою імунохімічного методу тестування з електрохемілюмінесцентною детекцією (ECLIA) в лабораторії Synevo. Матеріалом для дослідження була венозна кров. Наявність інсулінорезистентності реєструвалась при індексі НОМА-IR > 95-го перцентиля відповідно до перцентильних кривих, рекомендованих консорціумом IDEFICS для європейської популяції згідно з віком і статтю дитини [20].
За результатами генотипування, ВДТ та призначеної терапії були сформовані групи спостереження: першу групу (n = 11) становили діти з генотипом С/С 13910 та мальдигестією лактози, які отримували з першого дня лікування препарат екзогенної лактази по 3000 МО тричі на добу протягом 1 місяця. Другу групу (n = 11) становили діти з генотипом С/С 13910 та мальдигестією лактози, які отримували з першого дня лікування низьколактозну дієту за створеною нами комп’ютерною програмою Low-lactose diet [2]. Третю групу (n = 11) становили діти з генотипом С/С 13910 без ознак мальдигестії лактози, які отримували лише стандартну терапію, і в четверту групу (n = 11) увійшли діти з генотипом С/Т 13910 та мальдигестією лактози, які отримували низьколактозну дієту.
Критеріями ефективності лікування були: нормалізація індексу НОМА-IR < 95-го перцентиля для відповідного віку та статі згідно з перцентильними кривими, рекомендованими консорціумом IDEFICS, та ВДТ < 20 pрm.
Для статистичної обробки результатів дослідження використовувались методи варіаційної статистики за допомогою комп’ютерної програми Statistica (версія 6.1), адаптованої для медико-біологічних дослід–жень, з підрахунком парного критерію Стьюдента для порівняння ефективності різних методів лікування у дітей.
Результати та обговорення
При ожирінні у дітей 6–18 років генотип С/С 13910, що асоціюється з ЛН дорослого типу, реєструвався у 42 (56,8 %), генотип С/Т 13910, що асоціюється з відносною ЛП, — у 22 (29,7 %), а генотип Т/Т 13910, що асоціюється з абсолютною ЛП, відзначався в 10 пацієнтів (13,5 %), що відображено на рис. 2.
У дітей з ожирінням середній рівень концентрації водню у видихуваному повітрі за ВДТ при генотипі С/С 13910 становив (36,05 ± 4,73) pрm; при генотипі С/Т 13910 — (22,61 ± 4,10) pрm; при генотипі Т/Т 13910 — (1,33 ± 0,63) pрm; у здорових дітей із генотипом С/С 13910 — (13,91 ± 3,75) pрm, р < 0,05. Співвідношення рівнів концентрації водню у дітей з генотипами Т/Т, С/Т, С/С 13910 відповідало 1 : 17 : 27, що збігається з літературними джерелами [22].
Найвищий середній рівень концентрації водню у видихуваному повітрі до лікування був зареєстрований у І групі спостереження й становив (39,40 ± 8,04) pрm, у ІІ групі — (32,70 ± 10,48) pрm (р > 0,05), у ІІІ групі — (8,60 ± 1,16) pрm (р < 0,05), у ІV групі — (26,30 ± 4,91) pрm (р < 0,05).
Після лікування в дітей з ожирінням результати ВДТ мали такий вигляд: у дітей І групи середній рівень концентрації водню у видихуваному повітрі становив (22,38 ± 7,37) pрm, у дітей ІІ групи — (21,10 ± 6,34) pрm. Зміни результатів ВДТ, що відбулися на тлі лікування, свідчать, що застосування екзогенної лактази та низьколактозної дієти за створеною нами комп’ютерною програмою Low-lactose diet вірогідно (p < 0,05) сприяють дигестії лактози в пацієнтів з генотипом С/С 13910 та мальдигестією лактози.
У дітей ІІІ групи середній рівень концентрації водню у видихуваному повітрі після лікування становив (16,7 ± 6,3) pрm і характеризувався двократним підвищенням, p < 0,05, що свідчить про існуючий ризик виникнення мальдигестії лактози в дітей із генотипом С/С 13910 на фоні лише стандартної терапії. У дітей IV групи з вторинною ЛН після використання низьколактозної дієти цей показник зменшився до (13,39 ± 6,70) pрm (p < 0,05), що свідчить про доцільність дієтичного контролю над рівнем вживаної лактози при ожирінні в дітей із генотипом С/Т 13910 (рис. 3).
/36-2.jpg)
Було виявлено, що найвищий середній рівень індексу НОМА-IR 5,95 ± 0,87 реєструвався в дітей з ожирінням, асоційованим із ЛН дорослих (генотип С/С 13910). Ймовірно, це пояснюється специфічним гальмуванням надлишком лактози активності сигнального шляху Gal-9/Tim-3 та зниженням імуносупресивної дії з боку Treg-клітин. Інгібування сигнального шляху Gal-9/Tim-3 веде до активації низькорівневої прозапальної імунної відповіді та, як наслідок, до формування інсулінорезистентності [1, 19]. При генотипі С/Т 13910, що асоціюється з відносною ЛП, рівень індексу НОМА-IR становив 4,18 ± 0,12 і був вірогідно нижчим, ніж при генотипі С/С 13910 (р < 0,05). Найнижчий індекс НОМА-IR при ожирінні в дітей було виявлено при генотипі Т/Т 13910 — 3,17 ± 0,63 (р < 0,05), що асоціюється з повною формою ЛП. Отже, на формування інсулінорезистентності при ожирінні в дітей впливає стан дигестії лактози, асоційований із SNP LCT. Так, співвідношення індексу НОМА-IR у дітей із генотипами Т/Т, С/Т, С/С 13910 становить 1 : 1,1 : 2. Важливим є той факт, що рівень інсулінорезистентності при ожирінні в дітей із генотипом Т/Т 13910 не мав статистично значимої розбіжності з рівнем індексу НОМА-IR у дітей без ожиріння (індекс НОМА-IR = 2,22 ± 0,52; р > 0,05). Це може свідчити про те, що ЛП супроводжується високим рівнем гідролізу лактози в тонкому кишечнику, що підтверджується й результатами ВДТ у нашому дослідженні [8, 13].
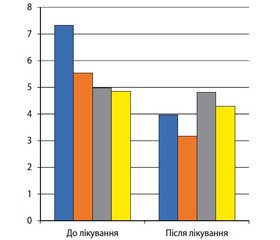
При вивченні ефективності лікування інсулінорезистентності в групах спостереження до лікування було виявлено асоціацію найвищих рівнів індексу НОМА-IR — 7,33 ± 0,38 та ВДТ у І групі, у яку увійшли діти з генотипом С/С 13910 та мальдигестією лактози. Після лікування з використанням препарату екзогенної лактази індекс НОМА-IR у І групі знизився в 1,85 раза — до 3,96 ± 0,60, р < 0,05 (рис. 4).
У дітей ІІ групи спостереження, які мали генотип С/С 13910 та мальдигестію лактози, індекс НОМА-IR до лікування становив 5,53 ± 0,70. Після лікування з використанням низьколактозної дієти індекс НОМА-IR у ІІ групі знизився в 1,74 раза та становив 3,17 ± 0,35 (р < 0,05).
У дітей з ІІІ групи спостереження, які мали генотип С/С 13910 без мальдигестії лактози, індекс НОМА-IR до лікування реєструвався на рівні 4,98 ± 0,76. Після лікування з використанням стандартної терапії індекс НОМА-IR у ІІІ групі становив 4,81 ± 0,59 (р > 0,05).
У дітей з IV групи порівняння, які мали генотип С/Т 13910 з мальдигестією лактози, індекс НОМА-IR до лікування становив 4,85 ± 0,77. Після лікування з використанням низьколактозної дієти індекс НОМА-IR у IV групі був на рівні 4,29 ± 1,34 (р > 0,05).
Отже, висока ефективність лікування зі статистично значимим зниженням показників інсулінорезистентності відмічалась у І та ІІ групах спостереження. Середнє значення індексу НОМА-IR у цих групах до експерименту становить 6,15 ± 1,66. Середнє значення показника після лікування становить 3,56 ± 0,56. Було показано однакову ефективність (p > 0,05) використання препарату екзогенної лактази порівняно з низьколактозною дієтою в дітей із генотипом С/С 13910 та мальдигестією лактози для конт–ролю над показниками інсулінорезистентності при ожирінні.
Висновки
1. Зустрічальність генотипу С/С 13910 була найвищою при ожирінні в дітей і становила 56,8 %, генотипу С/Т 13910 — 29,7 %, а генотип Т/Т 13910 реєструвався лише в 13,5 % дітей 6–18 років з ожирінням.
2. Ступінь мальдигестії лактози залежить від генотипу LCT. Так, співвідношення середніх рівнів концентрації водню у видихуваному повітрі дітей з генотипами Т/Т, С/Т, С/С 13910 становить 1 : 17 : 27.
3. На формування інсулінорезистентності при ожирінні в дітей 6–18 років впливає мальдигестія лактози, асоційована із SNP LCT. Наявність генотипу С/С 13910 збільшує ризик ускладненого перебігу ожиріння з патологічною базальною гіперінсулінемією в 2 рази порівняно з генотипом Т/Т 13910.
4. Лікування лактазної недостатності при ожирінні в дітей із генотипом С/С 13910 з використанням препарату екзогенної лактази або низьколактозної дієти, створеної за допомогою комп’ютерної програми Low-lactose diet, характеризується достатньо високим рівнем ефективності. Використання даних засобів лікування не тільки сприяє дигестії лактози, але й знижує рівень інсулінорезистентності.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Абатуров О.Є. Асоціація однонуклеотидного поліморфізму гена лактази з інсулінорезистентністю у дітей / О.Є. Абатуров, А.О. Нікуліна // Сучасні медичні технології. — 2016. — № 4(31). — С. 33-36.
2. Абатуров О.Є. Дієтотерапія при ожирінні у дітей, асоційованому з лактазною недостатністю дорослого типу /
O.Є. Абатуров, А.О. Нікуліна, Д.В. Логвінов, П.О. Колбасін // Здоровье ребенка. — 2017. — 12(6). — С. 657-662. doi: 10.22141/2224-0551.12.6.2017.112833.
3. Зелінська Н.Б. Статистично-аналітичний довідник дитячого ендокринолога / Н.Б. Зелінська, Н.Г. Руденко,
О.Г. Руденко / ДЗ «Центр статистичної медицини МОЗ України». — К., 2016. — С. 22.
4. Леженко Г.А. Роль остеопонтина и адипонектина в развитии инсулинорезистентности и артериальной гипертензии у подростков с ожирением / Г.А. Леженко, Е.В. Гладун // Georgian Medical News. — 2013. — 1(214). — 44-48.
5. Степанов Ю.М. Дыхательный водородный тест в диагностике патологии желудочно-кишечного тракта / Ю.М. Степанов, И.Я. Будзак, И.С. Коненко // Гастроэнтерология. — 2015. — № 1(55). — С. 81-85.
6. Шадрін О.Г. Проблемні питання перебігу та терапії лактазної недостатності у дітей раннього віку / О.Г. Шадрін, Т.Л. Марушко, В.П. Місник, В.М. Фисун, К.Р. Марушко // Современная педиатрия. — 2011. — № 40(6). — С. 157-163.
7. Alharbi O., El-Sohemy A. Lactose Intolerance (LCT-
13910C>T) Genotype Is Associated with Plasma 25-Hydroxyvitamin D Concentrations in Caucasians: A Mendelian Randomization Study // J. Nutr. — 2017 Jun. — 147(6). — 1063-1069. doi: 10.3945/jn.116.246108. Epub 2017 Apr 26.
8. Bayless T.M. Lactase Non-persistence and Lactose Into–lerance / T.M. Bayless, Е. Brown, D.M. Paige // Curr. Gastroenterol. Rep. — 2017 May. — 19(5). — 23. doi: 10.1007/s11894-017-0558-9.
9. Brasen C.L. Combination of real-time PCR and sequencing to detect multiple clinically relevant genetic variations in the lactase gene / C.L. Brasen, L. Frischknecht, D. Ornskov et al. // Scand. J. Clin. Lab. Invest. — 2017 Feb. — 77(1). — 60-65. doi: 10.1080/00365513.2016.1261408.
10. Enattah N.S. Identification of a variant associated with adult-type hypolactasia / N.S. Enattah, T. Sahi, E. Sa–vilahti et al. // Nat. Genet. — 2002 Feb. — 30(2). — 233-7. doi: 10.1038/ng826.
11. Fagerberg L. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics / L. Fagerberg, B.M. Hallström, P. Oksvold et al. // Mol. Cell Proteomics. — 2014 Feb. — 13(2). — 397-406. doi: 10.1074/mcp.M113.035600.
12. Fang L. The human lactase persistence-associated SNP-13910*T enables in vivo functional persistence of lactase promoter-reporter transgene expression / L. Fang, J.K. Ahn, D. Wodziak et al. // Hum. Genet. — 2012 Jul. — 131(7). — 1153-9. doi: 10.1007/s00439-012-1140-z.
13. Gasbarrini A. Methodology and indications of H2-breath testing in gastrointestinal diseases: the Rome Consensus Conference / A. Gasbarrini, G.R. Corazza, G. Gasbarrini et al. // Aliment. Pharmacol. Ther. — 2009 Mar 30. — 29, Suppl. 1. — 1-49. doi: 10.1111/j.1365-2036.2009.03951.x.
14. Heyer E. Lactase persistence in central Asia: phenotype, genotype, and evolution / E. Heyer, L. Brazier, L. Ségurel et al. // Hum. Biol. — 2011. — 83. — 379-92. doi: 10.3378/027.083.0304.
15. Hofmanova Z. Early farmers from across Europe directly descended from Neolithic Aegeans / Z. Hofmanova, S. Kreutzer, G. Hellenthal et al. // PNAS. — 2016. — 113. — 6886-91. doi: 10.1073/pnas.1523951113.
16. Liebert A. In Vitro Functional Analyses of Infrequent Nucleotide Variants in the Lactase Enhancer Reveal Diffe–rent Molecular Routes to Increased Lactase Promoter Activity and Lactase Persistence // Ann. Hum. Genet. — 2016 Nov. — 80(6). — 307-318. doi: 10.1111/ahg.12167. Epub 2016 Oct 7.
17. Lukito W. From ‘lactose intolerance’ to ‘lactose nutrition’ / W. Lukito, S. Malik, I.S. Surono, M.L. Wahlqvist // Asia Pac. J. Clin. Nutr. — 2015. — 24 Suppl 1. — S1-8. doi: 10.6133/apjcn.2015.24.s1.01.
18. Misselwitz B. What is normal and abnormal in lactose digestion? / B. Misselwitz, M. Fox // The Lancet Gastroenterology & Hepatology. — Available online 7 July 2017. doi.org/10.1016/S2468-1253(17)30180-2.
19. Paasela M. Lactose inhibits regulatory T-cell-mediated supression of effector T-cell interferon-γ and IL-17 production / М. Paasela, K.-L. Kolho, O. Vaarala et al. // British Journal of Nutrients. — 2014. — 112(11). — 1819-1825. doi:10.1017/S0007114514001998.
20. Peplies J. IDEFICS consortium. Longitudinal associations of lifestyle factors and weight status with insulin resistance (HOMA-IR) in preadolescent children: the large prospective cohort study IDEFICS / J. Peplies, C. Börnhorst, K. Günther et al. //
Int. J. Behav. Nutr. Phys. Act. — 2016 Sep 2. — № 13(1). — P. 97. doi: 10.1186 / s12966-016-0424-4.
21. Ségurel L. On the Evolution of Lactase Persistence in Humans / L. Ségurel, C. Bon // Annual Review of Genomics and Human Genetics. — 2017. — 18. — 297-319. doi: 10.1146 / annurev-genom-091416-035340.
22. Storhaug Ch.L. Country, regional, and global estimates for lactose malabsorption in adults: a systematic review and meta-analysis / Ch.L. Storhaug, S.K. Fosse, L.T. Fadnes // The Lancet Gastroenterology & Hepatology. — Available online
7 July 2017. doi.org/10.1016/S2468-1253(17)30154-1.
23. Styne D.M. Pediatric Obesity-Assessment, Treatment, and Prevention: An Endocrine Society Clinical Practice Guideline / D.M. Styne, S.A. Arslanian, E.L. Connor et al. // J. Clin. Endocrinol. Metab. — 2017 Mar 1. — 102(3). — 709-757. doi: 10.1210/jc.2016-2573.
24. Wijnhoven T.M. WHO European Childhood Obesity Surveillance Initiative 2008: weight, height and body mass index in 6–9-year-old children / T.M. Wijnhoven, J.M. van Raaij, A. Spinelli et al. // Pediatr. Obes. — 2013. — 8. — 79-97.

/34-1.jpg)
/35-1.jpg)
/36-1.jpg)
/36-2.jpg)
/37-1.jpg)