Журнал «Здоровье ребенка» Том 13, №1, 2018
Антигистаминные препараты при лечении аллергического ринита у детей
Резюме
В огляді літератури подані сучасні відомості щодо клінічної ефективності, безпеки та переносимості класичного представника другого покоління H1-антигістамінних препаратів дезлоратадину при лікуванні алергічного риніту в дітей. Для написання статті здійснювався пошук інформації з використанням баз даних Scopus, Web of Science, MedLine, PubMed, Google Scholar. Надана коротка характеристика фармакокінетики та фармакодинаміки дезлоратадину, що є потужним і селективним щодо H1-рецепторів зворотним агоністом із найтривалішим періодом напіврозпаду, який не проникає через гематоенцефалічний бар’єр і не має седативної дії. Акцентовано увагу на здатності дезлоратадину не тільки ефективно пригнічувати гістамінасоційовані клінічні прояви алергічного риніту, але й пригнічувати активність запального процесу за рахунок зниження активності фактора транскрипції NF-kB. У наукових дослідженнях показана висока ефективність дезлоратадину в купіруванні клінічних проявів алергічного риніту в дітей та вказано на хороший профіль безпеки під час його використання.
В обзоре литературы изложены современные сведения о клинической эффективности, безопасности и переносимости классического представителя второго поколения Н1-антигистаминных препаратов дезлоратадина при лечении аллергического ринита у детей. Для написания статьи осуществлялся поиск информации с использованием баз данных Scopus, Web of Science, MedLine, PubMed, Google Scholar. Дана краткая характеристика фармакокинетики и фармакодинамики дезлоратадина, являющегося мощным и селективным по отношению к H1-рецепторам обратным агонистом с самым продолжительным периодом полураспада, который не проникает через гематоэнцефалический барьер и не оказывает седативного действия. Акцентировано внимание на способности дезлоратадина не только эффективно подавлять гистаминассоциированные клинические проявления аллергического ринита, но и ингибировать активность воспалительного процесса за счет снижения активности фактора транскрипции NF-kB. В научных исследованиях продемонстрирована высокая эффективность дезлоратадина в купировании клинических проявлений аллергического ринита у детей и указан хороший профиль безопасности во время его использования.
The review of the literature provides current information about the clinical efficacy, safety and tolerability of the classic second-generation H1-antihistamine, desloratadine, in the treatment of allergic rhinitis in children. For writing the article, we used such databases, as Scopus, Web of Science, MedLine, PubMed, Google Scholar. A brief description of the pharmacokinetics and pharmacodynamics of desloratadine, which is a potent and selective inverse agonist for H1-receptors, with the longest half-life, does not penetrate the blood-brain barrier and does not have a sedative effect. Attention is focused on the ability of desloratadine not only to effectively inhibit histamine-associated clinical manifestations of allergic rhinitis, but also to inhibit the activity of the inflammatory process by decreasing the activity of transcription nuclear factor kappa B. Scientific studies demonstrate a high efficacy of desloratadine in the relief of clinical manifestations of allergic rhinitis in children and a good safety profile during its use.
Ключевые слова
H1-антигістамінні препарати; дезлоратадин; алергічний риніт; діти; огляд
H1-антигистаминные препараты; дезлоратадин; аллергический ринит; дети; обзор
H1-antihistamines; desloratadine; allergic rhinitis; children; review
Введение
Особенности современной динамики структуры заболеваемости детской популяции во всем мире характеризуются увеличением удельного веса аллергических заболеваний, которые отмечаются более чем у 50 % представителей населения Европы, из них более 30 % — у детей. Практически у 10 % детей диагностируются аллергические заболевания, среди которых 20–40 % приходится на аллергический ринит (АР), 5–10 % — на бронхиальную астму (БА), 1–3 % — на атопический дерматит (АД) [15]. У больных с БА более чем в 80 % случаев отмечаются симптомы АР, а у 10–40 % больных АР сочетается с БА [13]. В патогенезе данных форм аллергических заболеваний ключевую роль играет гистамин, действие которого предопределяет манифестацию большинства аллергоассоциированных клинических признаков, а назначение антигистаминных препаратов способствует подавлению активности их проявлений [34, 64]. Антигистаминные препараты были впервые синтезированы лауреатом Нобелевской премии итальянским фармакологом Даниэлем Боветом (Daniel Bovet) в 1937 году. Группа антигистаминных лекарственных средств подразделяется на препараты первого и второго поколения. Первое поколение антигистаминных препаратов отличается низкой селективностью взаимодействия сH1-рецепторами и высокой липофильностью, которая облегчает их проникновение через гематоэнцефалический барьер в центральную нервную систему. Второе поколение данных препаратов представляет собой соединения с высокоселективным действием, которые практически не способны преодолевать гематоэнцефалический барьер и потому не вызывают седативный эффект [36, 42, 65, 76]. Руководящие принципы, декларированные экспертами ARIA в 2016 году, преду–сматривают рекомендации по медикаментозному управлению АР, в которых наряду с интраназальными кортикостероидами, антагонистами рецепторов лейкотриенов обосновано применение и H1-антигистаминных препаратов [28].
К антигистаминным препаратам экспертами ARIA ВОЗ (Allergic Rhinitis and its Impact on Asthma Initiative) и Европейской академией аллергологии и клинической иммунологии (EAACI/ARIA, 2006) сформулированы следующие требования:
— селективная блокада H1-рецепторов;
— высокий антиаллергический эффект;
— быстрое наступление клинического эффекта;
— продолжительность действия — 24 часа (возможность приема 1 раз в сутки);
— отсутствие тахифилаксии;
— отсутствие клинически значимых взаимодействий с пищей и лекарственными препаратами;
— отсутствие седации и влияния на познавательные и психомоторные функции;
— отсутствие атропиноподобного действия;
— отсутствие эффекта увеличения массы тела;
— отсутствие кардиотоксических эффектов [1, 26, 88].
Данным требованиям в полной мере отвечают активные метаболиты Н1-антигистаминных препаратов ІІ поколения [4, 6, 7, 14, 27]. Пероральное применение Н1-антигистаминных препаратов ІІ поколения, в том числе и дезлоратадина, является настоятельной рекомендацией при лечении АР как у взрослых, так и у детей [25, 42, 67, 74, 71, 79].
Дезлоратадин — классический представитель второго поколения Н1-антигистаминных препаратов
Дезлоратадин является одним из представителей антигистаминных препаратов II поколения, применяемых у детей, показания и доступные способы введения которых представлены в табл. 1.
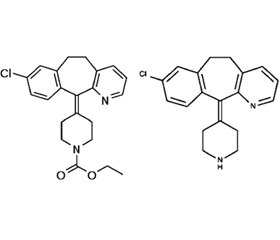
Дезлоратадин — 8-хлор-6,11-дигидро-11-(4-пиперидинилиден)-5H-бензо[5,6]циклогепта [1,2-b]пиридин (C19H19ClN2) — представляет собой активный метаболит лоратадина (рис. 1).
Краткая характеристика фармакокинетики дезлоратадина
Характеристика основных фармакокинетических свойств Н1-антигистаминных препаратов II поколения представлена в табл. 2.
Необходимо отметить, что у дезлоратадина отмечается самое продолжительное время (> 3 часов), необходимое для достижения пикового уровня в сыворотке крови (Tmax). То есть после приема дезлоратадина внутрь его концентрация в сыворотке крови достигает максимума приблизительно через три часа. Большая часть молекул дезлоратадина (83–87 %) в сыворотке крови находятся в связанном с белками сыворотки крови состоянии. Для дезлоратадина характерен и самый большой истинный объем распределения (примерно 49 л/кг). Период полувыведения (T½) дезлоратадина составляет 27 часов. Около 41 % дезлоратадина выводится с мочой, и 47 % — с калом [33, 35, 59].
Дезлоратадин подвергается практически полной метаболизации. Дезлоратадин метаболизируется в печени путем гидроксилирования с образованием 3-ОН-дезлоратадина, соединенного с глюкуронидом [20]. Установлено, что у больных с нарушением функции печени максимальная концентрация в крови и изменение концентрации во времени дезлоратадина были значительно выше, чем у здоровых людей, хотя концентрация препарата не превышала таковую при его применении в высокой дозе (45 мг/сут) в течение 10 дней. В более низкой терапевтической дозе 5 мг/сут дезлоратадин, вероятно, безопасен для больных с нарушенной функцией печени [3].
Дезлоратадин не проникает через гематоэнцефалический барьер и не оказывает центрального действия. Показано, что частота развития сонливости/седации на фоне лечения дезлоратадином аллергического ринита составляет 0,37 %, причем в течение первого месяца лечения риск развития сонливости при применении дезлоратадина в 5 раз ниже, чем при использовании левоцетиризина [44]. Таким образом, дезлоратадин по праву считают неседативным антигистаминным препаратом, который не оказывает подавляющего действия на когнитивные функции: не вызывает нарушения концентрации внимания, координации движений, снижения памяти и способности к обучению и не провоцирует психомоторные нарушения [2, 5, 9, 45].
Механизмы действия дезлоратадина
Дезлоратадин, как и большинство Н1-анти–гистаминных препаратов II поколения, вызывает антигистаминный и противовоспалительный эффекты. Учитывая, что в патофизиологической основе АР лежит ответ иммунной системы на воздействие аллергена, антигистаминные лекарственные средства, в том числе и дезлоратадин, являются препаратами выбора при лечении больных с данной патологией [6].
Ответ иммунной системы на воздействие аллергена при аллергическом рините
В основе аллергического ринита лежит локализованный аллергический ответ слизистой оболочки носовой полости, который характеризуется продукцией специфических антител иммуноглобулинового класса E (IgE), инфильтрацией слизистой оболочки Th2-клетками и секрецией провоспалительных медиаторов (гистамина, триптазы, эозинофильного катионного протеина) в ответ на воздействие аллергенов. В настоящее время различают несколько типов АР (табл. 3).
В основе всех типов АР лежит IgE-опосредо–ванное хроническое воспаление слизистой оболочки носа. Аллергический ринит представляет собой существенный фактор риска возникновения БА [68]. Ответ на воздействие специфического аллергена зависит от наличия предшествующей сенсибилизации и условно разделен на раннюю и позднюю фазы аллергического ответа [70].
Ранняя фаза аллергического ответа наблюдается на фоне предварительной сенсибилизации аллергеном и характеризуется активацией базофильных или тучных клеток за счет взаимодействия их мембранных высокоаффинных рецепторов FceRl с комплексами аллергена и предсуществующих специфических IgE-антител [43, 48]. У несенсибилизированных пациентов наблюдается локальная продукция специфических IgE-антител [53]. Представляет интерес тот факт, что назальные солютабные IgE обнаруживаются у больных как с АР, так и с ринитом неаллергического генеза [47, 69]. Активация базофильных или тучных клеток приводит к их дегрануляции и высвобождению провоспалительных медиаторов — как предварительно сформированных (гистамина, триптазы, брадикинина), так и непосредственно сгенерированных на воздействие аллергена (например, лейкотриена C4 (LTC4), простагландина D2 (PGD2), цитокинов) [17, 30]. Общее развитие ранней фазы аллергической реакции слизистой оболочки носа при АР представлено на рис. 2.
Во время ранней фазы аллергической реакции провоспалительным медиатором, определяющим манифестацию большинства патофизиологических и клинических эффектов (зуда в носовой полости, чихания, ринореи и заложенности носа) при аллергическом рините, является гистамин. Прямые аллергические эффекты гистамина опосредуются через активацию H1-рецепторов, которые преимущественно экспрессируются эндотелиоцитами, гладкомышечными клетками, кардиомиоцитами, клетками центральной нервной системы [17, 56, 68]. Возбуждение H1-рецепторов приводит к активации фактора транскрипции NF-κB, который вызывает экспрессию многочисленных генов, кодирующих провоспалительные цитокины, хемокины, молекулы адгезии (рис. 3) [19].
Клинические симптомы ранней фазы аллергического ответа проявляются через 5–15 мин после воздействия причинно-значимого аллергена; симптомы, связанные с ранней фазой аллергического ответа, обычно разрешаются спонтанно, после метаболизации провоспалительных медиаторов в слизистой оболочке носа [17].
Поздняя фаза аллергического ответа характеризуется активацией эндотелиоцитов и высвобождения провоспалительных цитокинов (например, IL-3, IL-4, IL-5, IL-6, IL-8, IL-13, TNF-α, GMCSF), хемокинов и молекул адгезии, что приводит к рекрутингу новых провоспалительных иммуноцитов (эозинофилов, нейтрофилов, Тh2-лимфоцитов) в очаг поражения (рис. 4) [70]. Для АР характерна инфильтрация слизистой оболочки носа эозинофилами, базофилами, тучными клетками, CD31+ и CD41+ T-клетками во время воздействия аэроаллергенов [68].
Антигистаминное действие дезлоратадина
Антигистаминное действие Н1-антигистаминных препаратов II поколения обусловлено их способностью взаимодействовать с Н1-рецепторами, в связи с чем антигистаминные лекарственные средства долгое время считались антагонистами рецепторов гистамина. Однако в последнее время они реклассифицированы и определены как обратные агонисты рецепторов гистамина, которые, связываясь с H1-рецепторами, стабилизируют их молекулярную структуру в неактивном состоянии и уменьшают или нивелируют сигнал гистаминассоциированного возбуждения (рис. 5). Обратные агонисты рецепторов гистамина могут снижать конститутивную рецепторную активность даже при отсутствии гистамина. В связи с этим термин «антагонисты H1-рецептора» признан ошибочным, и было предложено заменить его на «H1-антигистаминные препараты». Действие антигистаминных лекарственных средств препятствует проявлению H1-индуцированной констрикции гладких мышц сосудов, респираторного и пищеварительного трактов, гистаминзависимой активации секреции слюнных и слезных желез [36, 42].
/114-1.jpg)
У дезлоратадина значение аффинитета к H1-рецепторам достигает очень высокого уровня (Ki 0,87 нмоль/л) и превышает таковое у большинства антигистаминных препаратов (табл. 4) [31].
John C. Anthes и соавт. [18] продемонстрировали, что после формирования ассоциация дезлоратадина с H1-рецептором сохраняется достоверно дольше, чем при участии других молекул антигистаминных лекарственных средств: примерно 63 % дезлоратадина остаются связанными на протяжении 6 часов. Показатель замещения рецепторов через 4/24 часа составляет 71/43.
Противовоспалительное действие
Дезлоратадин, кроме антигистаминного, индуцирует выраженный противовоспалительный эффект, который реализуется рецепторнезависимым и рецепторзависимым способами [17].
Рецепторнезависимое противовоспалительное действие
Одним из важнейших рецепторнезависимых эффектов антигистаминных препаратов является ингибирование высвобождения биологически активных веществ базофилами и тучными клетками. Продемонстрировано, что антигистаминные препараты, в том числе и дезлоратадин, прямо ингибируют повышение внутриклеточной концентрации ионов кальция, тем самым индуцируя мембраностабилизирующий эффект [41, 51]. Ингибирование мобилизации кальция и выделение внутриклеточно расположенных ионов кальция приводит к подавлению активности мембраносвязанных ферментов, таких как PKC и NOX (NADPH oxidase) [54].
Рецепторзависимое противовоспалительное действие
В основе рецепторзависимого противовоспалительного механизма действия всех антигистаминных препаратов, в том числе и дезлоратадина, лежит их способность ингибировать Н1-рецепторзависимую активность фактора транскрипции NF-κB и, как следствие, подавлять продукцию провоспалительных цитокинов, хемокинов, молекул адгезии [32, 54, 57, 86].
По выраженности эффекта подавления активности NF-κB препараты I–II поколения располагаются в следующем порядке: дезлоратадин > цетиризин > лоратадин > фексофенадин [8].
Влияние на эпителиоциты
Дезлоратадин, оказывая влияние на эпителиальные клетки слизистой оболочки респираторного тракта, подавляет активность фактора транскрипции NF-κB и, как следствие, ингибирует продукцию хемоаттрактантов (CCL2/MCP-1, CCL3/MIP1-α, CCL4/MIP1-β, CCL5/RANTES, CXCL8/IL-8), рекрутирующих иммуноциты [29, 31, 32, 39].
Эпителиальные клетки слизистой оболочки носовой полости или полипов, стимулированные 10% фетальной бычьей сывороткой, после действия дезлоратадина резко снижают продукцию провоспалительного цитокина IL-6 [63].
Влияние на тучные клетки
Ранний период аллергического воспаления преимущественно поддерживается функциональной активностью тучных клеток, основных продуцентов гистамина. Дезлоратадин ингибирует экспрессию ассоциированного с лизосомами мембранного протеина 1 (lysosomal associated membrane protein 1 — LAMP1) — маркера дегрануляции тучных клеток и высвобождение биологически активных веществ, в том числе и гистамина, тучными клетками [46, 82]. Установлено, что дезлоратадин подавляет высвобождение предварительно сформированного гистамина из индуцированных как IgE-зависимым, так и IgE-независимым способом человеческих тучных клеток и базофилов. Вероятно, дезлоратадин пред–отвращает высвобождение гистамина из тучных клеток путем прямого ингибирования повышения внутриклеточной концентрации кальция. Также дезлоратадин in vitro ингибирует высвобождение и других предварительно сформированных медиаторов воспаления, связанных с ранней фазой аллергической реакции, таких как триптазы и PGD2, из человеческих тучных клеток [17]. Продемонстрировано, что дезлоратадин подавляет высвобождение IL-3, IL-6, TNF-α и гранулоцитарно-макрофагального колониестимулирующего фактора (granulocyte-macrophage colony-stimulating factor — GM-CSF) индуцированными тучными клетками. Причем цитокин-ингибирующее действие дезлоратадина не уступает таковому дексаметазона [55].
Влияние на базофилы
Базофилы играют решающую роль как в IgE-зависимом, так и в IgE-независимом аллергическом воспалении за счет секреции различных медиаторов, включая цитокины, хемокины и протеазы. Человеческие базофилы являются основным продуцентом IL-4, предопределяющего цитодифференцировку Т-лимфоцитов Th2-клетки. Базофильный IL-4 играет универсальную роль в аллергическом воспалении, действуя на различные типы клеток, включая макрофаги, врожденные лимфоидные клетки, фибробласты и эндотелиальные клетки [58, 85]. John T. Schroeder и соавт. [72] продемонстрировали, что дезлоратадин на 80 % подавляет IgE-индуцированную продукцию IL-4 базофилами. Также дезлоратадин ингибирует базофильную продукцию IL-13. Причем подавление интерлейкиновой продукции практически в 6–7 раз сильнее, чем ингибирование высвобождения гистамина и LTC4.
Влияние на эозинофилы
Эозинофилы являются ключевым клеточным компонентом поздней фазы аллергического воспаления слизистой оболочки респираторного тракта, который предопределяет развитие АР и БА. Ингибирование миграции эозинофилов в очаг поражения и их активации — важнейшее направление терапии аллергических заболеваний. Показано, что дезлоратадин ингибирует TNF-α-индуцированное высвобождение из эпителиоцитов носовых полипов хемокина CCL5/RANTES, который является основным хемоаттрактантом для эозинофилов, моноцитов и T-лимфоцитов. Дезлоратадинассоциированное ингибирование продукции хемокина CCL5/RANTES сопровождается уменьшением высобождения триптазы и LTC4 [51]. Дезлоратадин подавляет продукцию эотаксина, ключевого фактора, рекрутирующего эозинофилы, клетками слизистой оболочки носа. По всей вероятности, дезлоратадин блокирует миграцию эозинофилов из периферического русла крови в место аллергического воспаления слизистой носовой полости [38].
На фоне терапии дезлоратадином снижается и представительство эозинофилов, и уровень продукции солютабной молекулы 1 межклеточной адгезии (intercellular adhesion molecule 1 — ICAM-1) клетками слизистой оболочки носовой полости [37].
Отсутствие кардиотоксического эффекта
В отличие от таких антигистаминных препаратов II поколения, как терфенадин и астемизол, которые индуцируют удлинение интервала QT и развитие потенциально смертельной желудочковой аритмии, дезлоратадин у взрослых и детей не вызывает неблагоприятных сердечно-сосудистых событий [22, 52, 61, 83].
Взаимодействие дезлоратадина с лекарственными средствами и пищевыми продуктами
Дезлоратадин совместим практически с любыми лекарственными средствами, так как он не ингибирует (CYP1A2, CYP2C8, CYP2C9, CYP2C19) или слабо ингибирует (CYP2B6, CYP2D6, CYP3A4/5) изоферменты системы цитохрома P450 [49].
Прием различных продуктов питания не изменяет биодоступность дезлоратадина [21].
Также необходимо отметить, что употребление грейпфрутового сока, как известно, содержащего ингибитор цитохрома CYP3A4 (cytochrome P450 family 3 subfamily A member 4) и транспортера органических анионов SLCO1A2 (solute carrier organic anion transporter family member 1A2), не изменяет абсорбцию и биодоступность дезлоратадина [62, 66].
Эффективность применения дезлоратадина при аллергическом рините у детей
Согласно рекомендациям экспертов Американской академии оториноларингологии, хирургии головы и шеи (Guideline Otolaryngology Development Group, American Academy of Otolaryngology-Head and Neck Surgery), клиницисты обязаны рекомендовать применение пероральных антигистаминных препаратов II поколения, в том числе и дезлоратадина, взрослым и детям старше двухлетнего возраста с АР при первых жалобах на чихание и зуд в носовой полости (строгая рекомендация). Дезлоратадин разрешен для применения детям с 6 месяцев; суточная доза дезлоратадина для детей в возрасте от 6 до 11 мес. составляет 1 мг, от одного года до 5 лет — 1,25 мг, от 6 до 11 лет — 2,5 мг [74].
Проведенный метаанализ рандомизированных двойных слепых и контролируемых исследований эффективности дезлоратадина при лечении АР у взрослых показал, что применение данного антигистаминного препарата сопровождается достоверным уменьшением по сравнению с плацебо суммарного индекса симптомов заболевания, индекса назальных симптомов, улучшением назальной проходимости. Установлено преимущество эффективности (по уровню снижения количества эозинофилов в смывах со слизистой оболочки носовой полости) терапии дезлоратадином над таковой при применении плацебо. Согласно полученным данным, считают, что рекомендация о применении дезлоратадина при лечении АР соответствует уровню доказательности Ia [12]. Результаты исследования (ClinicalTrials. gov Identifier: NCT02507635) эффективности антигистаминных препаратов у больных со стойким аллергическим ринитом и риском развития бронхиальной астмы через 1,5 года показали, что четырехнедельная терапия дезлоратадином способствует угасанию всех клинических симптомов аллергического ринита и снижению концентрации IL-1β, IL-6, IL-8 и TNF-α в сыворотке крови [23]. Jean Bousquet и соавт. [24] на основании результатов проведенного 12-недельного рандомизированного плацебо-контролируемого проспективного исследования (Aerius Control: Clinical and Evaluative Profile of Treatment 2; NCT00405964) эффективности терапии дезлоратадином в суточной дозе 5 мг у больных со средней или выраженной тяжестью АР показали, что применение данного антигистаминного препарата способствует не только снижению степени проявления клинических признаков заболевания, но и повышению качества жизни пациентов.
Согласно последнему пересмотру протокола лечения АР, эксперты рекомендуют применять антигистаминные препараты внутрь совместно с интраназальными кортикостероидами в терапии сезонного (уровень доказательности Ia) и многолетнего хронического АР (уровень доказательности Ib) [28].
Несколько групп исследователей продемонстрировали, что применение дезлоратадина при лечении АР у детей характеризуется высоким уровнем эффективности и безопасности [10, 11, 16, 40].
Согласно результатам открытого наблюдательного многоцентрового исследования, проведенного Paolo Tassinari и соавт. [78], дезлоратадин хорошо переносится больными детьми и является эффективным и безопасным выбором для терапии многолетнего или сезонного АР у детей. Терапия дезлоратадином достоверно уменьшает заложенность носа, активность ринореи, носовой зуд и частоту чихания. Авторами подчеркивается, что монотерапия дезлоратадином и его сочетанием с кортикостероидами сопоставима по уровню эффективности. В то же время установлено, что комбинация дезлоратадина с преднизолоном позволяет эффективно контролировать острые периоды АР у детей и улучшать вентиляционную функцию носа [80].
Cristina Suárez-Castañón и соавт. [77] провели кросс-секционное ретроспективное исследование, посвященное анализу применения антиаллергических препаратов у детей до 14-летнего возраста. Авторы продемонстрировали, что при лечении АР практические врачи наиболее часто используют дезлоратадин и цетиризин.
Метаанализ показал, что H1-антигистаминные препараты и антагонисты лейкотриенового рецептора обладают сходными эффектами и безопасностью при лечении АР. Однако H1-антигистаминные препараты более эффективны при дневных проявлениях АР (ринорее, зуде и чихании), тогда как антилейкотриеновые лекарственные средства более эффективны при ночных симптомах (трудности засыпания, ночные пробуждения и заложенность носа во время пробуждения) [84].
Побочные эффекты терапии дезлоратадином
Vanesa González-Núñez и соавт. [45] на основании данных анализа многочисленных исследований продемонстрировали, что частота встречаемости неблагоприятных эффектов, индуцированных или связанных с применением дезлоратадина, не превышает вероятность побочных эффектов плацебо. Наиболее часто встречаются такие неблагоприятные явления, как фарингит, сухость во рту, острые респираторные инфекции, кашель, сонливость, чувство усталости, головная боль (табл. 5) [50, 75].
Как дезлоратадин, так и лоратадин не обладают канцерогенными свойствами [45].
Оценивая в целом вероятность развития неблагоприятных эффектов, можно считать, что дезлоратадин характеризуется хорошим профилем безопасности во время его использования как у взрослых, так и у детей.
Заключение
Таким образом, дезлоратадин — H1-анти–гистаминный препарат II поколения — обладает высоким профилем эффективности, безопасности и переносимости при лечении аллергического ринита у детей. Дезлоратадин является мощным и селективным по отношению к H1-рецепторам обратным агонистом с самым продолжительным периодом полураспада, который ингибирует раннюю и позднюю фазу иммунного ответа на воздействие причинно-значимого аллергена. Дезлоратадин не только эффективно подавляет гистаминассоциированные клинические проявления, но и ингибирует активность воспалительного процесса за счет снижения активности фактора транскрипции NF-kB. Терапия дезлоратадином больных с аллергическим ринитом эффективно подавляет клинические проявления (ринорею, зуд в носовой полости, чихание) аллергического ринита у детей. Применение дезлоратадина безопасно, не сопровождается кардиотоксическим, седативным эффектами, когнитивными и психомоторными нарушениями. Дезлоратадин можно считать препаратом первого выбора при лечении аллергического ринита у детей.
Список литературы
1. Абатуров А.Е., Борисова Т.П. Оптимальный выбор антигистаминного препарата при аллергических заболеваниях у детей // Здоровье ребенка. 2017; 1(12): 81-89.
2. Вишнева Е.А. Неседативные антигистаминные препараты при аллергических болезнях у детей. Дезлоратадин // Педиатрическая фармакология. 2009; 6, 1: 70-74.
3. Горячкина Л.А. Современные антигистаминные препараты в лечении аллергических заболеваний // Русский медицинский журнал. 2001; 21(9): 945-950.
4. Гущин И.С. Перспективы совершенствования противоаллергического действия Н1-антигистаминных препаратов // Леч. врач. 2009; 5: 34-40.
5. Емельянов А.В. Клиническое применение Н1-антигиста–минных препаратов // Медицинский совет. 2016; 4: 74-81.
6. Ильина Н.И., Павлова К.С. Антигистаминные, противовоспалительные и противоаллергические свойства дезлоратадина // Consilium Medicum. 2015; 3: 79-83.
7. Караулов А.В. Антигистаминные препараты в лечении аллергических заболеваний у детей: фокус на дезлоратадин при аллергическом рините // Фарматека. 2012; S3: 64-67.
8. Леонова М.В. Антигистаминные препараты в лечении хронической крапивницы: обзор современных рекомендаций / М.В. Леонова, А.С. Дворников, П.А. Скрипкина и соавт. // Медицинский совет. 2016; 19: 48-57.
9. Леонова М.В. Современные антигистаминные препараты: выбор в изобилии предложений // Фарматека. 2011; 10: 26-31.
10. Петров В.И., Малюжинская Н.В., Шишиморов И.Н. Клиническая эффективность терапии дезлоратадином у детей с персистирующей формой аллергического ринита и ее влияние на симптомы бронхиальной астмы // Саратовский научно-медицинский журнал. 2010; 6, 1: 073-076.
11. Просекова Е.В. Эффективность антигистаминных препаратов в терапии аллергического персистирующего ринита у младших школьников: клинико-иммунологические аспекты / Е.В. Просекова, А.И. Турянская, С.Ю. Нетесова, В.А. Сабыныч // Российский аллергологический журнал. 2016; 1: 57-62.
12. Сайгитов Р.Т. Дезлоратадин в лечении аллергического ринита: результаты рандомизированных, плацебо-контролируемых исследований // Вопросы современной педиатрии. 2008; 7, 1: 82-91.
13. Свистушкин В.М., Старостина С.В. Современные подходы к системной терапии аллергического ринита // РМЖ. 2016; 24, 4: 240-244.
14. Татаурщикова Н.С. Дезлоратадин — современное эффективное средство лечения аллергического ринита // Фарматека. 2013; 10(263): 66-68.
15. Уманец Т.Р. Бронхиальная астма и аллергический ринит: пути оптимизации комплайенса и эффективности лечения // Астма та алергія. 2015; 1: 61-64.
16. Файзуллина Р.М., Гусева Е.Д. Эффективность терапии дезлоратадином детей с аллергическим ринитом // Вопросы современной педиатрии. 2015; 14, 5: 597-599.
17. Agrawal D.K. Anti-inflammatory properties of desloratadine // Clin. Exp. Allergy. 2004 Sep; 34(9): 1342-8. DOI: 10.1111/j.1365-2222.2004.02026.x.
18. Anthes J.C. Biochemical characterization of desloratadine, a potent antagonist of the human histamine H(1) receptor / J.C. Anthes, H. Gilchrest, C. Richard et al. // Eur. J. Pharmacol. 2002 Aug 9; 449(3): 229-37. DOI: 10.1016/S0014-2999(02)02049-6.
19. Bakker R.A. Histamine H(1)-receptor activation of nuclear factor-kappa B: roles for G beta gamma- and G alpha(q/11)-su–bunits in constitutive and agonist-mediated signaling / R.A. Bakker, S.B. Schoonus, M.J. Smit et al. // Mol. Pharmacol. 2001 Nov; 60(5): 1133-42. DOI: 10.1124/mol.60.5.1133.
20. Barecki M.E. In vitro characterization of the inhibition profile of loratadine, desloratadine, and 3-OH-desloratadine for five human cytochrome P-450 enzymes / M.E. Barecki, C.N. Casciano, W.W. Johnson, R.P. Clement // Drug. Metab. Dispos. 2001 Sep; 29(9): 1173-5. PMID: 11502723.
21. Berger W.E. The safety and efficacy of desloratadine for the management of allergic disease // Drug Saf. 2005; 28(12): 1101-18. PMID: 16329713.
22. Bloom M., Staudinger H., Herron J. Safety of desloratadine syrup in children // Curr Med Res Opin. 2004 Dec; 20(12): 1959-65. DOI: 10.1185/030079904X14148.
23. Bocşan C.I. In Vivo Anti-Inflammatory Effect of H1 Antihistamines in Allergic Rhinitis: A Randomized Clinical Trial / C.I. Bocşan, A.I. Bujor, N. Miron et al. // Balkan Med J. 2015 Oct; 32(4): 352-8. DOI: 10.5152/balkanmedj.2015.15884.
24. Bousquet J. Randomized controlled trial of desloratadine for persistent allergic rhinitis: correlations between symptom improvement and quality of life / J. Bousquet, T. Zuberbier, G.W. Canonica et al. // Allergy Asthma Proc. 2013 May — Jun; 34(3): 274-82. DOI: 10.2500/aap.2013.34.3668.
25. Bousquet J. The ARIA/EAACI criteria for antihistamines: an assessment of the efficacy, safety and pharmacology of desloratadine / J. Bousquet, C. Bindslev-Jensen, G.W. Canonica et al. // Allergy. 2004; 59 Suppl 77: 4-16. DOI: 10.1111/j.1398-9995.2004.00577.x.
26. Bousquet J. Requirements for medications commonly used in the treatment of allergic rhinitis. European Academy of Allergy and Clinical Immunology (EAACI), Allergic Rhinitis and its Impact on Asthma (ARIA) / J. Bousquet, P. Van Cauwenberge, C. Bachert et al. // Allergy. 2003 Mar; 58(3): 192-7. DOI: 10.1034/j.1398-9995.2003.00054.x.
27. Bozek A. Pharmacological Management of Allergic Rhinitis in the Elderly // Drugs Aging. 2017 Jan; 34(1): 21-28. DOI: 10.1007/s40266-016-0425-7.
28. Brożek J.L. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines-2016 revision / J.L. Brożek, J. Bousquet, I. Agache et al. // J Allergy Clin Immunol. 2017 Oct; 140(4): 950-958. DOI: 10.1016/j.jaci.2017.03.050.
29. Camelo-Nunes I.C. New antihistamines: a critical view // J Pediatr (Rio J). 2006 Nov; 82(5 Suppl): S173-80. DOI: 10.2223/JPED.1552.
30. Campo P. Local Allergic Rhinitis / P. Campo, M. Salas, N. Blanca-López, C. Rndoón // Immunol Allergy Clin North Am. 2016 May; 36(2): 321-32. doi: 10.1016/j.iac.2015.12.008.
31. Canonica G.W., Blaiss M. Antihistaminic, anti-inflammatory, and antiallergic properties of the nonsedating second-gene–ration antihistamine desloratadine: a review of the evidence // World Allergy Organ J. 2011 Feb; 4(2): 47-53. doi: 10.1097/WOX.0b013e3182093e19.
32. Chen M. Desloratadine citrate disodium injection, a potent histamine H(1) receptor antagonist, inhibits chemokine production in ovalbumin-induced allergic rhinitis guinea pig model and histamine-induced human nasal epithelial cells via inhibiting the ERK1/2 and NF-kappa B signal cascades / M. Chen, S. Xu, P. Zhou et al. // Eur. J Pharmacol. 2015 Nov 15; 767: 98-107. doi: 10.1016/j.ejphar.2015.10.014.
33. Church D.S., Church M.K. Pharmacology of antihistamines // World Allergy Organ J. 2011 Mar; 4(3 Suppl): S22-7. doi: 10.1097/WOX.0b013e3181f385d9.;
34. Church M.K. Allergy, Histamine and Antihistamines // Handb Exp Pharmacol. 2017; 241: 321-331. DOI: 10.1007/164_2016_85.
35. Church M.K., Church D.S. Pharmacology of antihistamines// Indian J Dermatol. 2013 May; 58(3): 219-24. DOI: 10.4103/0019-5154.110832.
36. Church M.K., Maurer M. Antihistamines // Chem Immunol Allergy. 2014; 100: 302-10. DOI: 10.1159/000359963.
37. Ciebiada M., Barylski M., Gorska Ciebiada M. Nasal eosinophilia and serum soluble intercellular adhesion molecule 1 in patients with allergic rhinitis treated with montelukast alone or in combination with desloratadine or levocetirizine // Am. J. Rhinol. Allergy. 2013 Mar — Apr; 27(2): e58-62. DOI: 10.2500/ajra.2013.27.3881.
38. Cyr M.M. The effect of desloratadine on eosinophil/basophil progenitors and other inflammatory markers in seasonal allergic rhinitis: a placebo-controlled randomized study / M.M. Cyr, L.M. Hayes, L. Crawford et al. // Int Arch Allergy Immunol. 2005 Nov; 138(3): 209-16. DOI: 10.1159/000088721.
39. Di Sciascio M.B. Eosinophil recruiting chemokines are down-regulated in peripheral blood mononuclear cells of allergic patients treated with deflazacort or desloratadine / M.B. Di Sciascio, G. Vianale, N. Verna et al. // Int J Immunopathol Pharmacol. 2007 Oct — Dec; 20(4): 745-51. DOI: 10.1177/039463200702000410.
40. Dizdar E.A. The effect of regular versus on-demand desloratadine treatment in children with allergic rhinitis / E.A. Dizdar, B.E. Sekerel, O. Keskin et al. // Int. J. Pediatr. Otorhinolaryngol. 2007 Jun; 71(6): 843-9. DOI: 10.1016/j.ijporl.2007.02.003.
41. Fischer M.J. Dual effect of the anti-allergic astemizole on Ca2+ fluxes in rat basophilic leukemia(RBL-2H3) cells: release of Ca2+ from intracellular stores and inhibition of Ca2+ release-activated Ca2+ influx / M.J. Fischer, J.J. Paulussen, N.J. de Mol, L.H. Janssen // Biochem Pharmacol. 1998 Apr 15; 55(8): 1255-62. DOI: 10.1016/S0006-2952(97)00600-X.
42. Fitzsimons R. Antihistamine use in children / Fitzsimons R., van der Poel L.A., Thornhill W. et al. // Arch. Dis. Child Educ. Pract. Ed. 2015 Jun; 100(3): 122-31. DOI: 10.1136/archdischild-2013-304446.
43. Gauvreau G.M., El-Gammal A.I., O’Byrne P.M. Allergen-induced airway responses // Eur. Respir. J. 2015 Sep; 46(3): 819-31. DOI: 10.1183/13993003.00536-2015.
44. Gillman S. Концепция замещения рецепторов как предиктор клинической эффективности препарата: сравнительный анализ блокаторов Н1-рецепторов второго поколения / S. Gillman, M. Gillard, M.S. Benedetti // Современная педиатрия. 2015; 5(69): 29-35.
45. González-Núñez V., Valero A., Mullol J. Safety evaluation of desloratadine in allergic rhinitis // Expert Opin Drug Saf. 2013 May; 12(3): 445-53. DOI: 10.1517/14740338.2013.788148.
46. Grützkau A. LAMP-1 and LAMP-2, but not LAMP-3, are reliable markers for activation-induced secretion of human mast cells / A. Grützkau, A. Smorodchenko, U. Lippert et al. // Cytometry A. 2004 Sep; 61(1): 62-8. PMID: 15351990. DOI: 10.1002/cyto.a.20068.
47. Incorvaia C. Local allergic rhinitis: evolution of concepts / C. Incorvaia, N. Fuiano, I. Martignago et al. // Clin. Transl. Allergy. 2017 Nov 2; 7: 38. DOI: 10.1186/s13601-017-0174-7.
48. Kashiwakura J.I., Ando T., Kawakami T. Role of Histamine-releasing Factor in Allergic Inflammatory Reactions // Yakugaku Zasshi. 2017; 137(5): 517-521. DOI: 10.1248/yakushi.16-00239-3.
49. Kazmi F. Further Characterization of the Metabolism of Desloratadine and Its Cytochrome P450 and UDP-glucuronosyltransfe–rase Inhibition Potential: Identification of Desloratadine as a Relatively Selective UGT2B10 Inhibitor / F. Kazmi, P. Yerino, J.E. Barbara, A. Parkinson // Drug Metab Dispos. 2015 Sep; 43(9): 1294-302. DOI: 10.1124/dmd.115.065011.
50. Kim K. Desloratadine therapy for symptoms associated with perennial allergic rhinitis / K. Kim, G. Sussman, J. Hébert et al. // Ann Allergy Asthma Immunol. 2006 Mar; 96(3): 460-5. DOI: 10.1016/S1081-1206(10)60914-3.
51. Kowalski M.L. Inhibition of nasal polyp mast cell and eosinophil activation by desloratadine / M.L. Kowalski, A. Lewandowska, J. Wozniak et al. // Allergy. 2005 Jan; 60(1): 80-5. DOI: 10.1111/j.1398-9995.2005.00642.x.
52. Layton D., Wilton L., Shakir S.A. Examining the tolerability of the non-sedating antihistamine desloratadine: a prescription-event monitoring study in England // Drug Saf. 2009; 32(2): 169-79. DOI: 10.2165/00002018-200932020-00009.
53. Lee K.S. Local Immune Responses in Children and Adults with Allergic and Nonallergic Rhinitis / K.S. Lee, J. Yu, D. Shim et al. // PLoS One. 2016 Jun 9; 11(6): e0156979. DOI: 10.1371/journal.pone.0156979.
54. Leurs R., Church M.K., Taglialatela M. H1-antihistamines: inverse agonism, anti-inflammatory actions and cardiac effects // Clin. Exp. Allergy. 2002 Apr; 32(4): 489-98. DOI: 10.1046/j.0954-7894.2002.01314.x.
55. Lippert U. Inhibition of cytokine secretion from human leukemic mast cells and basophils by H1- and H2-receptor antagonists / U. Lippert, A. Möller, P. Welker et al. // Exp Dermatol. 2000 Apr; 9(2): 118-24. DOI: 10.1034/j.1600-0625.2000.009002118.x.
56. London N.R. Jr, Tharakan A., Ramanathan M. Jr. The Role of Innate Immunity and Aeroallergens in Chronic Rhinosinusitis // Adv. Otorhinolaryngol. 2016; 79: 69-77. DOI: 10.1159/000445132.
57. Matsubara M. Histamine H1 receptor antagonist blocks histamine-induced proinflammatory cytokine production through inhibition of Ca2+-dependent protein kinase C, Raf/MEK/ERK and IKK/I kappa B/NF-kappa B signal cascades / M. Matsubara, T. Tamura, K. Ohmori, K. Hasegawa // Biochem. Pharmacol. 2005 Feb 1; 69(3): 433-49. DOI: 10.1016/j.bcp.2004.10.006.
58. Miyake K., Karasuyama H. Emerging roles of basophils in allergic inflammation // Allergol. Int. 2017 Jul; 66(3): 382-391. doi: 10.1016/j.alit.2017.04.007.
59. Molimard M., Diquet B., Benedetti M.S. Comparison of pharmacokinetics and metabolism of desloratadine, fexofenadine, levocetirizine and mizolastine in humans // Fundam Clin Pharmacol. 2004 Aug; 18(4): 399-411. DOI: 10.1111/j.1472-8206.2004.00254.x.
60. Monczor F. Antihistaminergics and inverse agonism: potential therapeutic applications / F. Monczor, N. Fernandez, C.P. Fitzsimons et al. // Eur. J. Pharmacol. 2013 Sep 5; 715(1–3): 26-32. DOI: 10.1016/j.ejphar.2013.06.027.
61. Moneret-Vautrin D.A., de Chillou C., Codreanu A. Long QT syndrome in a patient with allergic rhinoconjunctivitis and auto-immune diabetes: focus on the choice of anti-H1 drugs // Eur. Ann. Allergy Clin. Immunol. 2006 Dec; 38(10): 347-50. PMID: 17274518.
62. Mouly S. Is the clinical relevance of drug-food and drug-herb interactions limited to grapefruit juice and Saint-John’s Wort? / S. Mouly, C. Lloret-Linares, P.O. Sellier et al. // Pharmacol Res. 2017 Apr; 118: 82-92. DOI: 10.1016/j.phrs.2016.09.038.
63. Mullol J. Mometasone and desloratadine additive effect on eosinophil survival and cytokine secretion from epithelial cells / J. Mullol, F. de Borja Callejas, M.A. Martínez-Antón et al. // Respir. Res. 2011 Feb 27; 12: 23. DOI: 10.1186/1465-9921-12-23.
64. Numminen J. Allergic rhinitis // Duodecim. 2017; 133(5): 473-8. PMID: 29205994.
65. Panula P. International Union of Basic and Clinical Pharmacology. XCVIII. Histamine Receptors / P. Panula, P.L. Cahzot, M. Cowart et al. // Pharmacol Rev. 2015 Jul; 67(3): 601-55. DOI: 10.1124/pr.114.010249.
66. Paśko P. Second generation H1 — antihistamines interaction with food and alcohol-A systematic review / P. Paśko, T. Rodacki, R. Domagała-Rodacka et al. // Biomed Pharmacother. 2017 Sep; 93: 27-39. DOI: 10.1016/j.biopha.2017.06.008.
67. Platt M. Pharmacotherapy for allergic rhinitis // Int Forum Allergy Rhinol. 2014 Sep; 4 Suppl 2: S35-40. DOI: 10.1002/alr.21381.
68. Rondón C. Local allergic rhinitis: concept, pathophysiology, and management / C. Rondón, P. Campo, A. Togias et al. // J. Allergy Clin. Immunol. 2012 Jun; 129(6): 1460-7. DOI: 10.1016/j.jaci.2012.02.032.
69. Rondón C. Local IgE production and positive nasal provocation test in patients with persistent nonallergic rhinitis / C. Rondón, J.J. Romero, S. López et al. // J. Allergy Clin. Immunol. 2007 Apr; 119(4): 899-905.
70. Rosenwasser L.J. Current understanding of the pathophysio–logy of allergic rhinitis // Immunol Allergy Clin North Am. 2011 Aug; 31(3): 433-9. DOI: 10.1016/j.iac.2011.05.009.
71. Sakano E. IV Brazilian Consensus on Rhinitis — an update on allergic rhinitis / E. Sakano, E.S.C. Sarinho, A.A. Cruz et al. // Braz. J. Otorhinolaryngol. 2017 Nov 2. pii: S1808-8694(17)30187-8. DOI: 10.1016/j.bjorl.2017.10.006.
72. Schroeder J.T. Inhibition of cytokine generation and mediator release by human basophils treated with desloratadine / J.T. Schroeder, R.P. Schleimer, L.M. Lichtenstein, W. Kreutner // Clin. Exp. Allergy. 2001 Sep; 31(9): 1369-77. DOI: 10.1046/j.1365-2222.2001.01130.x.
73. Seidman M.D. Clinical practice guideline: allergic rhinitis executive summary / M.D. Seidman, R.K. Gurgel, S.Y. Lin et al. // Otolaryngol Head Neck Surg. 2015 Feb; 152(2): 197-206. DOI: 10.1177/0194599814562166.
74. Seidman M.D. Clinical practice guideline: Allergic rhinitis / M.D. Seidman, R.K. Gurgel, S.Y. Lin et al. // Otola–ryngol Head Neck Surg. 2015 Feb; 152(1 Suppl): S1-43. DOI: 10.1177/0194599814561600.
75. Simons F.E., Prenner B.M., Finn A. Jr. Efficacy and safety of desloratadine in the treatment of perennial allergic rhinitis // J. Allergy Clin. Immunol. 2003 Mar; 111(3): 617-22. PMID: 12642846.
76. Simons F.E., Simons K.J. H1 antihistamines: current status and future directions // World Allergy Organ J. 2008 Sep; 1(9): 145-55. DOI: 10.1097/WOX.0b013e318186fb3a.
77. Suárez-Castañón C., Modroño-Riaño G., Solís-Sánchez G. Allergol Immunopathol (Madr). 2017 Sep — Oct; 45(5): 506-507. DOI: 10.1016/j.aller.2016.10.012.
78. Tassinari P. Desloratadine therapy improves allergic rhinitis symptoms in latin american children aged 6 to 12 years / P. Tassinari, N.R. Suárez, J. Centeno et al. // World Allergy Organ J. 2009 Apr; 2(4): 42-8. DOI: 10.1097/WOX.0b013e31819cdfdb.
79. Varshney J., Varshney H. Allergic Rhinitis: an Overview // Indian J. Otolaryngol Head Neck Surg. 2015 Jun; 67(2): 143-9. DOI: 10.1007/s12070-015-0828-5.
80. Wandalsen G.F. Association between desloratadine and prednisolone in the treatment of children with acute symptoms of allergic rhinitis: a double-blind, randomized and controlled clinical trial / G.F. Wandalsen, C. Miranda, L.F. Ensina et al. // Braz. J. Otorhinolaryngol. 2017 Nov — Dec; 83(6): 633-639. DOI: 10.1016/j.bjorl.2016.08.009.
81. Wang X.Y. Treatment of allergic rhinitis and urticaria: a review of the newest antihistamine drug bilastine / X.Y. Wang, M. Lim-Jurado, N. Prepageran et al. // Ther. Clin. Risk Manag. 2016 Apr 13; 12: 585-97. DOI: 10.2147/TCRM.S105189.
82. Weller K., Maurer M. Desloratadine inhibits human skin mast cell activation and histamine release // J. Invest Dermatol. 2009 Nov; 129(11): 2723-6. DOI: 10.1038/jid.2009.134.
83. Wilken J.A. Desloratadine for allergic rhinitis / J.A. Wilken, A.F. Daly, C.L. Sullivan, H. Kim // Expert Rev Clin Immunol. 2006 Mar; 2(2): 209-24. DOI: 10.1586/1744666X.2.2.209.
84. Xu Y., Zhang J., Wang J. The efficacy and safety of selective H1-antihistamine versus leukotriene receptor antagonist for seasonal allergic rhinitis: a meta-analysis // PLoS One. 2014 Nov 10; 9(11): e112815. DOI: 10.1371/journal.pone.0112815.
85. Yamanishi Y. Recent advances in understanding basophil-mediated Th2 immune responses / Y. Yamanishi, K. Miyake, M. Iki et al. // Immunol. Rev. 2017 Jul; 278(1): 237-245. DOI: 10.1111/imr.12548.
86. Yuan X. Effects of desloratadine citrate disodium injection on rat models of ovalbumin-induced allergic rhinitis: involvement of T-cell responses modulation / Yuan X., Ghosh A., Jie Q. et al. // Int. Forum Allergy Rhinol. 2015 Dec; 5(12): 1170-6. DOI: 10.1002/alr.21594.
87. Zuberbier T. EAACI/GA2LEN/EDF guideline: management of urticarial / T. Zuberbier, C. Bindslev-Jensen, W. Canonica et al. // Allergy. 2006 Mar; 61(3): 321-31. DOI: 10.1111/j.1398-9995.2005.00962.x.

/110-1.jpg)
/111-1.jpg)
/112-1.jpg)
/113-1.jpg)
/114-1.jpg)
/115-1.jpg)
/117-1.jpg)