Нестероїдні протизапальні препарати (НПЗП) — основний інструмент, що використовується в реальній клінічній практику для купірування гострого болю й контролю основних симптомів при хронічних захворюваннях суглобів і хребта [3]. Аж до кінця минулого століття несприятливі реакції з боку шлунково-кишкового тракту вважалися основною проблемою, що обмежує застосування НПЗП. Поява нового класу НПЗП — селективних інгібіторів циклооксигенази-2 (ЦОГ-2) — дозволила значною мірою знизити її гостроту та змістити увагу на інші аспекти безпечного застосування цих засобів. Величезний інтерес до цього класу медикаментів став потужним стимулом для проведення масштабних досліджень з вивчення дієвості й безпеки нових ліків. Аналіз отриманого при цьому клінічного матеріалу довів, що застосування селективних інгібіторів ЦОГ-2 асоціюється зі значним збільшенням частоти серцево-судинних захворювань [5]. Сучасна концепція безпечного використання НПЗП спрямована на максимальне зниження ризику ускладнень з боку шлунково-кишкового тракту, серцево-судинної системи та нирок.
За даними клінічних випробувань і популяційних досліджень, серед усіх НПЗП найменший ризик кардіоваскулярних катастроф характерний для напроксену [1, 34]. Цей препарат належить до неселективних НПЗП, широко використовується в клінічній практиці понад 40 років і завоював довіру лікарів усього світу як надійний анальгетик і потужний протизапальний засіб. Терапевтичний потенціал напроксену перевірений при найрізноманітніших захворюваннях і патологічних станах — від гострих видів болю до хронічного больового синдрому.
Велика кількість рандомізованих клінічних досліджень (РКД), що проводилися із середини 70-х рр. минулого століття, довела дієвість напроксену в усіх клінічних ситуаціях, у яких доцільно застосовувати НПЗП: від мігрені до хірургічної болю. Так, напроксен успішно пройшов порівняння з аспірином, індометацином, піроксикамом та іншими неселективними НПЗП. При цьому він не поступався препаратам контролю або ж перевершував їх за ефективністю і загалом мав істотно кращу переносимість [6, 7]. Сьогодні напроксен найчастіше використовується як препарат порівняння при випробуванні «фармацевтичних новинок», при цьому переваги напроксену залишаються незмінними [3].
Однією з гострих ситуацій, у яких з успіхом застосовується напроксен, є гострий напад подагри. Витоки вивчення його дієвості беруть початок у 70-х роках минулого століття, коли напроксен був найбільш затребуваним препаратом у лікуванні гострих і хронічних больових й запальних синдромів [13, 35]. Так, застосування напроксену у висхідних навантажувальних дозах (стартова доза 750 мг, потім по 250 мг кожні 8 год упродовж 72 год) при гострому нападі подагри дозволило досягти успіху в 75 % пацієнтів [35].
Створення нових молекул дещо обмежило його використання при гострих нападах подагри, однак унікальний фармакологічний профіль, високий ступінь безпеки при кардіоваскулярних недугах, що нерідко супроводжують подагру, швидкість настання ефекту дозволяють рекомендувати напроксен для купірування гострих нападів подагричного артриту. Зазвичай напроксен призначають у дозі 1,25–1,5 г на добу впродовж перших 2–3 днів з наступним поступовим зниженням дози [33].
Саме гострий подагричний напад є найкращою моделлю для оцінки протизапального ефекту НПЗП, оскільки його розвиток визначається гострою запальною реакцією, викликаною реакцією макрофагів і моноцитів на відкладення кристалів моноурату натрію. Напроксен проявляє потужну протизапальну активність. Це продемонстровано в дослідженні H.J. Janssens зі співавт. (2008) [18], у якому порівнювали дію напроксену 1000 мг/день і преднізолону 35 мг/добу у 120 хворих із гострим подагричним артритом. Ефект НПЗП і глюкокортикоїду суттєво не розрізнявся: через 90 год сумарна вираженість болю зменшилася на 46,0 і 44,7 % відповідно (рис. 1).
Сьогодні створений та апробований комбінований препарат для лікування подагри, що містить комбінацію напроксену й колхіцину [21], він широко використовується на американському континенті. При цьому напроксен за фармакокінетичними характеристиками являє собою субстанцію з тривалим вивільненням діючої речовини (упродовж 12 год), а колхіцин — субстанцію, що швидко вивільнюється. Таке поєднання забезпечує потужний постійний і тривалий протизапальний ефект.
У сучасних рекомендаціях саме напроксен у низьких дозах (250 мг двічі на день) рекомендується як препарат першої лінії (як і колхіцин) для тривалої (близько 6 міс.) профілактики рецидивів подагричного артриту на тлі уратзнижуючої терапії [20].
Швидкість настання ефекту та вираженість знеболюючої дії дозволили з успіхом застосовувати напроксен і в лікуванні спортивних травм. Порівняння з опіоїдними препаратами продемонструвало переваги напроксену як швидкодіючого анальгетика. Так, при вивченні порівняльної ефективності напроксену та комбінації опіоїдного препарату декспропоксифену в поєднанні з парацетамолом у 184 осіб зі спортивними травмами було встановлено, що на 7-му добу лікування напроксен продемонстрував не тільки кращий результат за знеболюванням, але й меншу частоту побічних небажаних ефектів [28]. У недавньому дослідженні M. Fathi і співавт. [15] порівнювався ефект невеликої дози напроксену (250 мг) і опіоїдного анальгетика оксикодону (5 мг) у 150 хворих із гострою травмою м’яких тканин. За дієвістю в зниженні болю напроксен не поступався опіоїдам: так, вираженість болю зменшилася з 6,21 ± 0,90 бала і 6,0 ± 1,0 бала відповідно за 10-бальною візуальною аналоговою шкалою до 4,5 ± 1,4 бала й 4,4 ± 1,2 бала через 30 хв, а потім до 2,5 ± 1,3 бала і 2,6 ± 1,3 бала через 1 год. При цьому переносимість напроксену була істотно кращою.
Порівняння ефективності німесуліду й напроксену також проведено в подвійному сліпому дослідженні, у якому взяли участь 660 пацієнтів із травматичними ушкодженнями м’яких тканин. Результати дослідження показали, що обидва препарати були дієвими в зниженні інтенсивності болю, набряку й ступеня вираженості функціональних порушень через 7 днів [11]. При цьому в більшості пацієнтів відзначено настання ремісії, що дозволило їм повернутися до занять спортом.
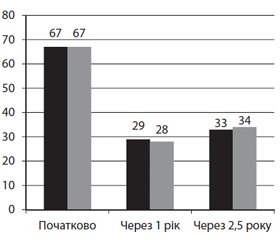
Напроксен не поступається сучасним і «модним» НПЗП у лікуванні хронічного больового синдрому. Це було вірогідно продемонстровано при остеоартриті (ОА), що, власне, й характеризується хронічним больовим синдромом, у масштабному дослідженні J. Reginster і співавт. [26]. У ньому взяли участь 997 хворих на ОА; упродовж 138 тижнів пацієнти отримували еторикоксиб 60 мг/добу або напроксен 1000 мг/добу. Лікувальний потенціал обох НПЗП не відрізнявся: так, больовий індекс за WOMAC, який початково становив 67 мм у кожній групі, через рік знизився до 29 і 28 мм, а наприкінці дослідження — до 33 і 34 мм (рис. 2). Водночас у цьому дослідженні небезпечні кардіоваскулярні події виникали суттєво рідше при застосуванні напроксену: у 6 та 13 випадках відповідно.
/66-1.jpg)
У 2010 році в провідному європейському ревматологічному журналі були опубліковані результати метааналізу 7 рандомізованих клінічних досліджень, у яких порівнювався терапевтичний потенціал целекоксибу, еторикоксибу, напроксену та ібупрофену при ОА [22]. Було продемонстровано, що целекоксиб, еторикоксиб та напроксен забезпечували значуще та приблизно однакове покращання: зменшення вираженості болю щонайменше на 50 % відзначалося в 40–50 % пацієнтів. Водночас показано, що ці три препарати перевищували за дієвістю ібупрофен у максимальній терапевтичній дозі (2400 мг/добу). Аналогічні результати були також отримані при метааналізі 8 РКД (n = 5942), що опублікований в 2016 році [32]. Цей метааналіз об’єднав порівняльні дослідження целекоксибу, еторикоксибу, напроксену та плацебо в пацієнтів з ОА. Сумарно за лікувальним ефектом всі три НПЗП істотно не розрізнялися, але значно перевершували плацебо. Так, число відмін препаратів через неефективність на тлі активного лікування було в 3–5 разів менше, ніж при використанні плацебо.
Напроксен як універсальний анальгетик з добрим профілем безпеки нерідко використовувався як препарат порівняння. Так, у мультицентровому рандомізованому подвійному сліпому контрольованому клінічному дослідженні вивчалася ефективність німесуліду порівняно з напроксеном у пацієнтів з ОА кульшового та/або колінного суглоба [16]. Тривалість дослідження становила 6 міс. (2 тижні терапії препаратами + 5,5 міс. прийому на вимогу). Німесулід застосовували в дозі 100 мг (2 рази на добу), напроксен — 500 мг (2 рази на добу). Ефективність застосування препаратів оцінювали за змінами вираженості болю при русі й ступеня ранкової скутості. Після 2 тижнів застосування відзначено порівнянне зменшення болю при рухах в обох групах (німесулід — на 41,5 %, напроксен — на 40,5 % відповідно). При цьому зменшення вираженості болю було статистично вірогідним для обох груп вже через 1 тиждень застосування препаратів. Аналогічні результати отримані й щодо ступеня ранкової скутості. Порівнянна ефективність застосування препаратів відзначалася й через 5,5 міс. Відмінності в переносимості обох препаратів не були статистично вірогідними.
Одним з механізмів знеболювального ефекту напроксену є вплив на центральну нервову систему, що переконливо доведено в дослідженні M. Gimenez із співавт. [17]. Вивчався вплив напроксену на реакцію на больову стимуляцію в пацієнтів з ОА колінних суглобів за допомогою функціональної магнітно-резонансної томографії в подвійному сліпому плацебо-контрольованому дослідженні. Дослідники виявили скорочення періоду активації мозку при застосуванні напроксену порівняно з відсутністю лікування в різних ділянках кортикального та підкоркового шарів мозку, відповідальних за реакцію болю (p ≤ 0,001). Порівняно з плацебо напроксен викликав ослаблення активації мигдалини (р = 0,001). Отже, напроксен ефективно зменшує больові реакції головного мозку, пов’язані з різними регіонами, і це ослаблення пов’язане із суб’єктивними змінами болю.
Порівняльна ефективність НПЗП та опіоїдних анальгетиків у зменшенні болю при ОА колінного суглоба підсумована в систематичному огляді, опублікованому в 2016 році [31]. Були проаналізовані РКД за період з 1982 по 2015 рік, у яких використовували целекоксиб, диклофенак, напроксен, піроксикам, трамадол та сильнодіючі опіоїди (гідроморфон, оксикодон). Результати засвідчили, що НПЗП та опіоїди приблизно однаково полегшують біль при ОА, що може допомогти при виборі раціональної протибольової терапії та уникнути численних побічних ефектів опіоїдів.
У 2014 році був уперше опублікований, а в 2016 році — був оновлений алгоритм з менеджменту остеоартриту колінного суглоба, розроблений та запропонований Європейським товариством з клінічних і економічних аспектів остеопорозу та остеоартриту (ESCEO) [9, 10]. Згідно з цим алгоритмом, застосування пероральних НПЗП рекомендується на 2-му кроці за умови недостатнього ефекту парацетамолу, повільнодіючих симптом-модифікуючих препаратів та локальних форм НПЗП. Вибір НПЗП рекомендується базувати на оцінці чинників ризику та безпеки препаратів: за наявності кардіоваскулярного ризику перевагу слід надавати напроксену. При цьому також рекомендується уникати високих доз диклофенаку й ібупрофену та ЦОГ-2 селективних НПЗП.
Ще одне дослідження вказало на переваги напроксену при ОА завдяки високому потенціалу кардіоваскулярної безпеки [25]. Серед неселективних НПЗП ібупрофен і напроксен виявляються кращими за диклофенак, з яким пов’язаний досить високий серцево-судинний ризик. Було подано рекомендацію: напроксен може бути препаратом вибору в пацієнтів із високим ризиком серцево-судинних ускладнень через менший ризик розвитку кардіоваскулярних подій.
Протягом останнього десятиріччя напроксен слугує препаратом активного контролю в численних випробуваннях нових молекул НПЗП та порівняльних дослідженнях. Так, сучасна доказова база ефективності напроксену поповнилася результатами масштабних рандомізованих клінічних досліджень VIGOR, TARGET, SUCCESS-1 [3]. У цих трьох дослідженнях 13 177 хворих отримували напроксен упродовж 3–12 міс. І в усіх цих роботах напроксен не поступався за знеболюючим ефектом новим препаратам, забезпечуючи істотне й вірогідне зниження рівня болю та покращання функціональної активності [8, 14, 30].
Отже, напроксен є препаратом вибору для тривалого лікування хронічного больового синдрому при ОА, що відрізняються за локалізацією, насамперед з огляду на низький ризик виникнення кардіоваскулярних ускладнень [1].
Проблема безпечного застосування НПЗП у пацієнтів ревматологічного профілю є наріжним каменем клінічної фармакології та ревматології. Тому значну зацікавленість викликали результати нещодавно опублікованого РКД РRECISION (PRospective Evaluation of Celecoxib Integrated Safety versus Ibuprofen Or Naproxen) — проспективної оцінки комплексної безпеки целекоксибу порівняно з напроксеном та ібупрофеном [23], що претендує на останнє слово щодо порівняльної серцево-судинної безпеки НПЗП [4]. Результати дослідження засвідчують, що целекоксиб не поступається ібупрофену та напроксену за кардіо–васкулярною безпекою. Однак у дослідження були залучені здебільшого пацієнти з ОА та низьким серцево-судинним ризиком — показник кардіоваскулярних подій не перевищував 1 % на рік. Привертає також увагу, що, згідно з протоколом дослідження, добова доза целекоксибу становила 100 мг 2 рази на добу, напроксену — 375 мг двічі на добу, ібупрофену — 600 мг тричі на добу. Під час подальших візитів лікарі могли підвищувати дозу препаратів у пацієнтів із ревматоїдним артритом (РА): целекоксибу — до 200 мг 2 рази на добу, напроксену — до 500 мг 2 рази на добу, ібупрофену — до 800 мг 3 рази на добу. У пацієнтів з ОА дозволялося збільшувати дозу напроксену та ібупрофену, але не целекоксибу. У результаті середні добові дози целекоксибу, напроксену й ібупрофену становили 209 ± 37 мг, 852 ± 103 мг і 2045 ± 246 мг відповідно. Отже, у даному протоколі спочатку була обрана найбільш безпечна доза лише для целекоксибу, але не для препаратів порівняння, і більш висока частота розвитку небажаних лікарських реакцій на тлі терапії напроксеном і ібупрофеном, можливо, пов’язана з тим, що ці препарати призначали в більш високих дозах [2]. Нарешті, протягом дослідження 69 % пацієнтів припинили прийом досліджуваного препарату, а 27 % вибули з-під спостереження (follow-up), що не дозволяє повною мірою оцінити безпеку препаратів [24]. На завершення слід зазначити, що дослідження PRECISION не змогло повною мірою відповісти на питання, наскільки безпечні коксиби порівняно з традиційними НПЗП у пацієнтів з високим ризиком розвитку ускладнень з боку серцево-судинної системи, і дане питання вимагає додаткового вивчення.
Напроксен добре зарекомендував себе при тривалому лікуванні таких тяжких ревматичних захворювань, як РА і група спондилоартритів. Відносно анкілозивного спондиліту (АС) це підтверджує найсвіжіший Кокранівський метааналіз, у якому оцінюється використання різних НПЗП і плацебо за результатами 31 РКД (n = 4356). Згідно з отриманими даними, усі НПЗП (включаючи напроксен) були ефективніші за плацебо, при цьому терапевтичний потенціал різних НПЗП істотно (статистично значущо) не вирізнявся [19].
Як відомо, при АС НПЗП відіграють роль не просто анальгетика, але й найважливішого патогенетичного засобу, здатного сповільнити необоротну деформацію хребта [3]. У цьому плані є цікавими результати недавнього дослідження INFAST, у якому 156 хворих на АС протягом 6 міс. отримували напроксен у дозі 1000 мг/добу в комбінації з інгібітором фактора некрозу пухлини a інфліксимабом або як монотерапію. Хоча комбінована терапія була значно ефективнішою за монотерапію, напроксен сам по собі забезпечував досить високий результат: так, часткова ремісія АС за критеріями ASAS була досягнута в 61,9 і 35,3 % хворих [27].
При лікуванні РА напроксен успішно витримав порівняння з усіма неселективними НПЗП та коксибами. Підтвердженням цього стали результати РКД, у якому 891 хворий на РА впродовж 12 тижнів щодня отримував 1000 мг напроксену, 90 мг еторикоксибу або плацебо [12]. Ефективність обох НПЗП виявилася однаковою: число пацієнтів, які відповіли на лікування за критерієм ACR20, становило 58 і 59 % (41 % у групі плацебо). При цьому еторикоксиб частіше викликав небажані реакції (їх загальне число становило 23,2 %), у той час як у групі напроксену небажані реакції відзначені в 19,3 % випадків, а в групі плацебо — у 15,4 %.
Напроксен також не поступався за ефективністю целекоксибу в пацієнтів із РА, що підтверджено в 12-тижневому сліпому плацебо-контрольованому дослідженні L.S. Simon і співавт. [29]. За 12 тижнів лікування в групах целекоксибу й напроксену було відзначено покращання за приблизно однаковим числом параметрів (за 5 параметрами в групі, що одержувала целекоксиб по 200 мг/добу, за 7 — у групах, що отримували целекоксиб по 400 і 800 мг/добу, і за 4 — у групі напроксену 1000 мг/добу).
Отже, у численних рандомізованих клінічних дослідженнях продемонстровано високу протибольову й протизапальну ефективність напроксену, що дозволяє рекомендувати його при різних клінічних сценаріях — від гострого болю, що потребує короткочасного прийому, і до ситуацій, що вимагають тривалого застосування НПЗП. Напроксен проявив високу клінічну дієвість при подагрі, остеоартриті, ревматоїдному артриті, анкілозивному спондиліті. Напроксен успішно пройшов порівняння з традиційними неселективними та високоселективними НПЗП (коксибами). При цьому він не поступався препаратам порівняння, а деколи перевищував їх за ефективністю та мав кращу переносимість. Напроксен має весь необхідний спектр терапевтичної активності в поєднанні з найбільш високим серед НПЗП профілем кардіоваскулярної безпеки. Таке вдале поєднання робить його ідеальним засобом для тривалого контролю основних симптомів хронічних ревматичних захворювань.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Головач І.Ю. Кардіоваскулярна безпека як важливий критерій вибору нестероїдних протизапальних препаратів // Міжнародний неврологічний журнал. — 2017. — № 6(92). — 68-74.
2. Довгань В.Е. Результаты исследования PRECISION: удалось ли ответить на вопрос, насколько безопасны коксибы в сравнении с «традиционными» нестероидными противовоспалительными препаратами у пациентов с высоким риском развития сердечно-сосудистых осложнений? // Современная ревматология. — 2017. — 11(3). — 129-131.
3. Каратеев А.Е. Напроксен: универсальный анальгетик с минимальным риском кардиоваскулярных ослонений // Современная ревматология. — 2016. — 2. — 70-77.
4. Муравьев Ю.В. Почему исследование комплексной безопасности целекоксиба при артритах, названное РRECISION, является последним по счету, а не по значимости? // Научно-практическая ревматология. — 2017. — 55(3). — 324-326.
5. Олюнин Ю.А. Применение нестероидных противовоспалительных препаратов у больных с высоким кардиоваскулярным риском // Научно-практическая ревматология. — 2017. — 55(3). — 321-323.
6. Aeidler H. Clinical results of a multicentral double-blind examination of naproxen compared to indomethacin in chronic rheumatoid arthritis, ankylosing spondylitis, and osteoarthrosis // Arzneimittelforschung. — 1975. — 25(2A). — 315-318.
7. Blechman W., Willkens R., Boncaldo G. et al. Naproxen in osteoarthrosis. Double-blind crossover trial // Ann. Rheum. Dis. — 1978. — 37(1). — 80-84.
8. Bombardier C., Laine L., Reicin A., et al. Comparison of Upper Gastrointestinal Toxicity of Rofecoxib and Naproxen in Patients with Rheumatoid Arthritis // N. Engl. J. Med. — 2000. — 343(21). — 1520-1528.
9. Bruyere O., Cooper C., Pelletier J.P. et al. An algorithm re–commendation for the management of knee osteoarthritis in Europe and internationally: A report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) // Semin. Arthritis Rheum. — 2014. — 44. — 253-263.
10. Bruyère O., Cooper C., Pelletier J.-P. et al. A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis — From evidence-based medicine to the real-life setting // Semin. Arthritis Rheum. — 2016. — 45(4). — S3-S11.
11. Calligaris A., Scaricabarozzi I., Vecchiet L. A multicentre double-blind investigation comparing nimesulide and naproxen in the treatment of minor sport injuries // Drugs. — 1993. — 46(1). — 187-190.
12. Collantes E., Curtis S.P., Lee K.W. et al. A multinational randomized, controlled, clinical trial of etoricoxib in the treatment of rheumatoid arthritis // BMC Fam. Pract. — 2002. — 3. — 10.
13. Eyman E., Brzozowska-Jurkowska A.M., Werynska-Przybylska J., Kawenoki-Minc E. Effect of naproxen on gout attacks // Reumatologia. — 1980. — 18(1). — 1-4.
14. Farkouh M., Kirshner H., Harrington R. et al. Comparison of lumiracoxib with naproxen and ibuprofen in the Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), cardiovascular outcomes: randomized controlled trial // Lancet. — 2004. — 364(9435). — 675-684.
15. Fathi M., Zare M.A., Bahmani H.R., Zehtabchi S. Comparison of oral oxycodone and naproxen in soft tissue injury pain control: a double-blind randomized clinical trial // Am. J. Emerg. Med. — 2015. — 33(9). — 1205-1208.
16. Fioravanti A., Storri L., Di Martino S. et al. A randomized, double-blind, multicenter trial of nimesulide-beta-cyclodextrin versus naproxen in patients with osteoarthritis // Clin. Тherapeutics. — 2002. — 24(4). — 504-519.
17. Gimenez M., Pujol J., Ali Z. et al. Naproxen effects on brain response to painful pressure stimulation in patients with knee osteoarthritis: a double-blind, randomized, placebo-controlled, single-dose study // J. Rheumatol. — 2014. — 41(11). — 2240-2248.
18. Janssens H.J., Janssen M., van de Lisdonk E.H. et al. Use of oral prednisolone or naproxen for the treatment of gout arthritis: a double-blind, randomised equivalence trial // Lancet. — 2008. — 371(9627). — 1854-1860.
19. Kroon F.P., van der Burg L.R., Ramiro S. et al. Nonsteroidal Antiinflammatory Drugs for Axial Spondyloarthritis: A Cochrane Review // J. Rheumatol. — 2016. — 43(3). — 607-617.
20. Latourte A., Bardin T., Richette P. Prophylaxis for acute gout flares after initiation of urate-lowering therapy // Rheumato–logy (Oxford). — 2014. — 53(11). — 1920-1926.
21. Mehmood Y., Riaz H., Yousaf H. Formulation and in vitro evaluation of colchicines and naproxen sodium sustain release tablets in combination for treatment of gout // Pak. J. Pharm. Sci. — 2016. — 29(5). — 1579-1586.
22. Moore R.A., Moore O.A., Derry S. et al. Responder analysis for pain relief and numbers needed to treat in a meta-analysis of etoricoxib osteoarthritis trials: bridging a gap between clinical trials and clinical practice // Ann. Rheum. Dis. — 2010. — 69(2). — 374-379.
23. Nissen S.E., Yeomans N.D., Solomon D.H. et al;
PRECISION Trial Investigators. Cardiovascular Safety of Celecoxib, Naproxen, or Ibuprofen for Arthritis // N. Engl. J. Med. — 2016 Dec 29. — 375(26). — 2519-2529.
24. Patrono C., Baigent C. Coxibs, Traditional NSAIDs, and Cardiovascular Safety PostPRECISION: What We Thought We Knew Then and What We Think We Know Now // Clin. Pharmacol. Ther. — 2017. — 102(2). — 238-245.
25. Pelletier J.P., Martel-Pelletier J., Rannou F., Cooper C. Efficacy and safety of oral NSAIDs and analgesics in the management of osteoarthritis: Evidence from real-life setting trials and surveys // Semin. Artritis Rheum. — 2016. — 45(4 Suppl.). — S22-27.
26. Reginster J., Malmstrom K., Mehta A. et al. Evaluation of the efficacy and safety of etoricoxib compared with naproxen in two, 138-week randomised studies of patients with osteoarthritis // Ann. Rheum. Dis. — 2007. — 66(7). — 945-951.
27. Sieper J., Lenaerts J., Wollenhaupt J. et al. Efficacy and safety of infliximab plus naproxen versus naproxen alone in patients with early, active axial spondyloarthritis: results from the double-blind, placebo-controlled INFAST study, Part 1 // Ann. Rheum. Dis. — 2014. — 73(1). — 101-107.
28. Simmons R., Owen S., Abbott C. et al. Naproxen sodium and paracetamol/dextropropoxyphene in sports injuries — a multicentre comparative study // Br. J. Sports Med. — 1982. — 16(2). — 91-95.
29. Simon L.S., Weaver A.L., Graham D.Y. et al. Anti-inflammatory and upper gastrointestinal effects of celecoxib in rheumatoid arthritis: a randomized controlled trial // JAMA. — 1999. — 282. — 1921-1928.
30. Singh G., Fort J., Goldstein J., et al. Celecoxib versus naproxen and diclofenac in osteoarthritis patients: SUCCESS-1 study // Am. J. Med. — 2006. — 119(3). — 255-266.
31. Smith S.R., Deshpsnde B.R., Collins J.E. et al. Comparative pain reduction of oral non-steroidal anti-inflammatory drugs and opioids for knee osteoarthritis: systematic analytic review // Osteoarthritis Cartilage. — 2016. — 24(6). — 962-972.
32. Song G., Seo Y., Kim J. et al. Relative efficacy and tole–rability of etoricoxib, celecoxib, and naproxen in the treatment of osteoarthritis: A Bayesian network meta-analysis of randomized controlled trials based on patient withdrawal // J. Rheumatol. — 2016. — 75(5). — 508-516.
33. Sturge R.A., Scott J.T., Hailton E.B. et al. Multicentre trial of naproxen and phenylbutazone in acute gout // Ann. Rheum. Dis. — 1977. — 36(1). — 80-82.
34. Trelle S., Reichenbach S., Wandel S. et al. Cardiovascular safety of non-steroidal antiinflammatory drugs: network meta-analysis // BMJ. — 2011. — 342. — 7086.
35. Willkens R.F., Case J.B., Huix F.J. The treatment of acute gout with naproxen // J. Clin. Pharmacol. — 1975. — 15 (4 Pt. 2). — 363-366.

/66-1.jpg)