Журнал «Боль. Суставы. Позвоночник» Том 7, №4, 2017
Вернуться к номеру
Остеоартроз: лечение с позиций доказательной медицины
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Медицинские форумы
Версия для печати
Остеоартроз:
лечение с позиций доказательной медицины
Среди многочисленных форм суставной патологии наиболее распространенной является остео–артроз (ОА) — хроническое прогрессирующее дегенеративное заболевание суставов, при котором происходит деградация суставного хряща, изменяется субхондральная кость и развиваются краевые осте–офиты.
Первые признаки дистрофических нарушений в суставах встречаются уже у 30-летних людей. С возрастом наблюдается повышение частоты заболевания. По данным по–пуляционных исследований, частота и распространенность ОА возрастают в 2–10 раз за период с 30 до 65 лет. Остеоартроз выявляется у большинства лиц старше 65 лет и практически у каждого человека после 75–80 лет.
Развитие ОА не влияет на жизненный прогноз пациентов, но является одной из основных причин преждевременной потери трудоспособности и инвалидности, сопровождается хроническим болевым синдромом, значительно снижающим качество жизни. Это диктует необходимость своевременной диагностики и применения современных методов терапии данной патологии. Однако сведения об эффективности и целесообразности различных методов лечения ОА отличаются большим разбросом, что привело к созданию рекомендаций, основанных на принципах доказательной медицины.
22 декабря в Киеве прошли научные чтения имени профессора Е.Т. Скляренко «Внедрение научных разработок в практику охраны здоровья», в рамках которых были рассмотрены актуальные вопросы травматологии и ортопедии, в том числе лечение остеоартроза с позиций доказательной медицины.
С докладом «Доказательная медицина и остео–артроз» выступил заведующий кафедрой травматологии и ортопедии Национального медицинского университета им. А.А. Богомольца доктор медицинских наук, профессор Бурьянов Александр Анатольевич.
В начале своего выступления профессор сообщил, что доказательная медицина (Evidence Based Medicine) — это раздел медицины, основанный на объективных, научно обоснованных фактах, которые предусматривают поиск, сравнение, обобщение и широкое распространение полученных доказательств для использования их в интересах больного.
Согласно правилам доказательной медицины эффективность и целесообразность применения определенной процедуры классифицируют следующим образом.
Класс I — наличие консенсуса и/или доказательств относительно эффективности, целесообразности и благоприятного действия процедуры.
Класс II — противоречивые доказательства и отсутствие консенсуса относительно эффективности и целесообразности применения процедуры:
— IIa — чаша весов доказательства/консенсус склоняется к эффективности и целесообразости применения про–цедуры;
— IIb — чаша весов доказательства/консенсус склоняется к неэффективности и нецелесообразности применения про–цедуры.
Класс III — наличие консенсуса и/или доказательств относительно неэффективности и нецелесообразности применения процедуры, а в отдельных случаях — даже ее вредности.
В свою очередь, степень доказанности эффективности и целесообразности применения процедуры подразделяют на три уровня.
Уровень А — данные, полученные хотя бы в двух рандомизированных исследованиях.
Уровень В — данные, полученные в одном рандомизированном клиническом исследовании и/или в метаанализе, или в нескольких нерандомизированных исследованиях.
Уровень С — консенсус убеждений экспертов, основанный на результатах исследований и клинической практики.
В своей повседневной практике врач должен исходить из таких принципов научных доказательств, на которых базируется доказательная медицина сегодня. Во-первых, результаты научных исследований могут подлежать сомнению и изменениям на протяжении жизни одного поколения врачей. Во-вторых, научные данные не могут полностью заменить опыт квалифицированного врача, а лишь помогают в обосновании выбранного метода лечения. В-третьих, повышение информированности врачей относительно новых данных клинических исследований, особенно результатов мегаисследований, является крайне необходимым, поскольку такая информация должна доходить к врачу как можно быстрее и в доступной форме.
Далее докладчик уделил внимание актуальности проблемы остеоартроза, подчеркнув, что данное заболевание занимает около 80 % в общей структуре патологии суставов у лиц старше 60 лет, в 10–30 % случаев приводя к нетрудо–способности разного уровня. За последние 30–40 лет зафиксирован рост заболеваемости ОА в 9 раз.
Медико-демографические показатели в Европе и США свидетельствуют о продолжении процесса старения населения и увеличении численности лиц старше 60 лет. Прогнозируется, что в 2020 году количество населения этой возрастной группы увеличится вдвое. Помимо этого, отмечается «омоложение» остео–артроза — рост заболеваемости ОА среди трудоспособного населения, а также ее увеличение в детском и подростковом возрасте.
Следует отметить, что развитие остеоартроза во многом определяется особенностью строения гиалинового хряща и его низкой регенераторной способностью, что объясняется отсутствием камбиального слоя клеток надхрящницы, низким количеством клеточных элементов, синтезирующих межклеточный матрикс (коллаген и протеогликаны): 2–5 % хондроцитов и 98–95 % хрящевого матрикса, низкой митотической активностью хондроцитов: на 600–800 хондроцитов в зрелом хряще отмечается лишь 1 реакция митоза, и отсутствием сосудов в хряще, поскольку питание хряща на 60–80 % осуществляется из синовиальной жидкости и на 20–40 % — из капиллярной сосудистой сетки суб–хондральной кости.
Считается, что развитие остеоартроза связано с прямым механическим повреждением сустава (травма) либо опосредованным повреждением вследствие нарушения соотношения процессов гипоксии/реперфузии в васкуляризированных тканях сустава (перегрузки, воспаления, гемартрозы). Они запускают типичный патологический процесс с избыточной активацией реакций свободнорадикального окисления: биосинтеза простагландинов, лейкотриенов, тромбоксанов, радикалов жирных кислот, кетонов, альдегидов, кето–кислот, что приводит к повреждению и увеличению проницаемости клеточных мембран, окислительной модификации структурных белков, ферментов, биологически активных веществ. Формируется субклинический или хронический воспалительный процесс. В дальнейшем происходит прогрессирование дистрофически-деструктивных изменений в суставах с развитием остеоартроза.
Затем Александр Анатольевич рассказал о 5-ступенчатой рентгенологической классификации остеоартроза, предложенной J.H. Kellegren и J.S. Lawrence. Сегодня эта классификация дополнена клиническими, морфологическими показателями (Mohr W., 1984, Karree H.L., 1990, Scott V.S., 1999) и является общепринятой среди ревматологов и ортопедов-травматологов. Кроме того, существует классификация степени поражения суставного хряща на основании результатов артроскопии, созданная R.E. Outerbridge. В соответствии с ней выделяют 4 степени поражения суставного хряща:
— 1-я степень — размягчение хряща;
— 2-я степень — фрагментация хряща и его эрозия до половины глубины слоя;
— 3-я степень — глубокие эрозии и большие фрагментации с образованием дефектов хряща;
— 4-я степень — образование дефектов, дном которых является субхондральная кость.
Достаточно часто рентгенологическая картина остеоартроза и данные артроскопии не соответствуют друг другу. Так, при рентгенологическом исследовании может быть определена 0-я рентгенологическая стадия по Kellegren и Lawrence, тогда как при артроскопии выявляется 3-я степень по Outerbridge. Именно поэтому А.А. Бурь–яновым и соавт. была разработана рентгенологически-артроскопическая классификация остеоартроза. В ней учитываются: рентгенологическая стадия по Kellegren и Lawrence, этиология повреждения суставного хряща, данные компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) и артроскопии с локализацией поражения хряща и его зоны, площадь поражения хряща и степень его поражения по Outerbridge. Соответственно этой классификации, в качестве примера, диагноз будет выглядеть следующим образом: посттравматический остеоартроз правого коленного сустава II степени по Kellegren и Lawrence. Хроническое повреждение суставного хряща медиального отростка бедренной кости в зоне М1, М3, М6, М7, площадь SM (до 6 см2), 4-я степень по Outerbridge. Состояние после артроскопической ревизии правого коленного сустава (2009).
Для оценки эффективности диагностического метода В.В. Власовым в 2014 году были предложены следующие показатели: чувствительность метода, специфичность, точность, прогностичность положительного результата и прогностичность негативного результата.
Чувствительность метода (Se) — это процент действительно существующих патологических изменений в отдельной группе, выявленных при данном методе исследования. Она вычисляется в процентах по формуле Se = 100PS / (PS + NS).
Специфичность метода (Sp) — это процент здоровых структур, выявленных при исследовании как неповрежденных. Вычисляется в процентах по формуле Sp = 100NH / (NH + PH).
Общая ценность метода, или точность (Ас), — процент верных решений. Вычисляется в процентах по формуле Ас = 100(PS + NH) / (PS + NH + PH + NS).
Прогностичность положительного результата (PVP) — это вероятность наличия действительных патологических изменений в структуре при их выявлении во время данного исследования. –Вычисляется в процентах по формуле PVP = 100PS / (PS + PH).
Прогностичность негативного результата (PVN) — вероятность отсутствия патологических изменений в структуре, после того как они были выявлены во время диагностического исследования. Она вычисляется по формуле PVN = 100NH / (NH + NS).
С учетом этих показателей эффективность соно–графической оценки структур сустава не имеет достаточной точности и чувствительности к повреждениям суставного хряща (25,3 и 25,5 % соответственно), но имеет достаточную информативность при повреждениях синовиального хряща и капсульно-связочных структур.
Магнитно-резонансная томография суставов более информативна в отношении выявления патологии менисков, синовита, синовиальных и капсульно-связочных структур, однако в отношении суставного хряща имеет низкую чувствительность и специфичность на уровне 35 %, что недостаточно для рекомендации МРТ как точного метода.
МРТ с артрографией обладает несом–ненно большими преимуществами, поскольку обеспечивает точную визуализацию хряща и его повреждений, особенно на ранних стадиях дегенеративного процесса. На 1-м этапе предусмотрено использование общепринятого протокола МРТ-исследования сустава. На 2-м этапе применяют внутрисуставное введение контраста (гадолиний 0,1 мл и 20 мл физиологического раствора) + внутривенно гадолиний 1 мл на 3 кг массы тела; на 3-м этапе — использование общепринятого протокола МРТ-исследования сустава. Данный метод исследования обладает наилучшими показателями чувствительности (99,3 %), специфичности (98,6 %), точности (98,8 %), прогностически позитивного (99,5 %) и прогностически негативного (98,7 %) результатов для суставного хряща.
Таким образом, в качестве стандарта диагностики остеоартроза основное место в алгоритме занимают рентгенография, сонография, МРТ и артроскопия. Однако необходимо помнить, что рентгенография на ранних стадиях заболевания малоинформативна. При сонографии сустава его визуализация ограничена и колеблется в диапазоне от 25 до 50 %. Высокой чувствительностью и специфичностью обладает МРТ сустава, но этот метод также малоинформативен на ранних стадиях ОА. Артроскопия сустава — золотой стандарт диагностики, однако ее отрицательной стороной является инвазивность метода и зависимость его проведения от анестезиолога.
Далее профессор сообщил об основных рекомендациях EULAR, OARSI, NICE относительно лечения остеоартроза. Согласно рекомендациям EULAR терапия остеоартроза должна начинаться с нефармакологического лечения, направленного на образование пациента, уменьшение избыточной массы тела и коррекцию питания. Также оно включает ортопедический режим, физические упражнения, витамино- и фитотерапию и такие физиотерапевтические методы лечения, как бальнеотерапия, электромагнитная и ультразвуковая терапия, электростимуляция, акупунктура, лазерная терапия, электрофорез и гидро–терапия.
В качестве фармакологического лечения рекомендуются противоартрозные препараты, которые подразделяются на препараты симптоматического действия (SMOADs): быстрого действия (нестероидные противовоспалительные препараты (НПВП), парацетамол, опиоидные анальгетики, глюкокортикостероидные препараты) и замедленного действия (SYSADOA: хондроитина сульфат, гиалуроновая кислота, неомыляемые соединения авокадо и сои, глюкозамин). Кроме того, целесообразно назначение препаратов патогенетического действия, структурно модифицирующих хрящ (DMADS). Показана антиоксидантная терапия, препараты, улучшающие микроциркуляцию, ингибиторы протеолитических ферментов и метаболическая терапия.
Интраартикулярное лечение включает хондропротекторы для внутрисуставного применения, противовоспалительную и антигомотоксическую терапию, глюкокортикостероидные препараты и лаваж. Хирургическое лечение — диагностически-лечебную артроскопию, лаваж, коррекционные остеотомии, эндопротезирование и артропластику суставов, артродез.
Артроскопия — золотой стандарт в диагностике и лечении ранних стадий остеоартроза крупных суставов и внутрисуставных повреждений. Благодаря артроскопии возможно осуществление таких методов лечения:
— лаваж сустава: при I cтепени повреждения сустава;
— удаление свободных хрящевых и костно-хрящевых суставных тел;
— парциальная менискэктомия при 2–3-й степени с использованием температурной модификации мягких тканей, в том числе разрушенного хряща;
— шейвирование: при 2-й степени повреждения сустава;
— дебридмент: при 2–3-й степени повреждения сустава;
— селективное удаление остеофитов;
— парциальная синовэктомия;
— артроскопическая ассистенция при остеосинтезе внутрисуставных переломов крупных суставов (коленного, голеностопного, плечевого);
— лечение внутрисуставной патологии, осложненной кистами;
— микрофрактуирование (костно-мозговая стимуляция репарации хряща).
При 3–4-й степени повреждения хряща у больных до 60 лет на участках, где упругость хряща составляет более 50 единиц Шора, используются операции костно-мозговой стимуляции репарации хрящевой ткани. При наличии полных дефектов хряща до 6–8 см2 у больных до 60 лет с индексом массы тела до 30 кг/м2 используют микропереломы склерозированной субхондральной кости. В других случаях рекомендуется выполнять аутогенную костно-хрящевую трансплантацию, ауто–генную имплантацию хондроцитов или гемиэндопротезирование.
Исходя из рекомендаций OARSI 2014 года, при остеоартрозе коленных суставов без коморбидной патологии рекомендуются биомеханические вмешательства, интраартикулярное введение кортикостероидов, топические НПВП, пероральное назначение селективных и неселективных НПВП, капсаицин, дулоксетин и ацетаминофен. При ОА коленных суставов у пациентов с коморбидной патологией применяют биомеханические вмешательства, интраартикулярное введение кортикостероидов, топические НПВП. При распространенном остеоартрозе без коморбидной патологии рекомендуется назначать пероральные селективные и неселективные НПВП, парацетамол, дулоксетин, интраартикулярное введение кортикостероидов и биомеханические вмешательства. Распространенный ОА у пациентов с коморбидной патологией подразумевает назначение биомеханических вмешательств, интраартикулярное введение кортикостероидов, пероральных селективных НПВП и дулоксетина.
Для лечения остеоартроза на ранних стадиях назначают патогенетически обоснованную базовую схему медикаментозного лечения, включающую противовоспалительную и обезболивающую терапию: селективные ЦОГ-2 НПВП (нимесил) и адъювантный анальгетик (инфлуган, дексалгин) курсом 10–14 дней. Также применяют хондрометаболическую и регенераторную терапию: Пиаскледин на протяжении 2–3 месяцев. Кроме того, возможно локальное применение плазмы крови, обогащенной тромбоцитами (PRP) — № 3; комплекс гиалуронат-сукцинат внутрисуставно 1–2% 3–5 раз с интервалом 7–10 дней, при отсутствии проявлений синовита; местно — по необходимости НПВП.
Согласно рекомендациям OARSI (2014, 2017) к препаратам, которые обладают симптоммодифицирующим и, возможно, структурно-модифицирующим действием, относится Пиаскледин 300, имеющий уникальный двойной механизм действия и оказывающий следующие эффекты:
— повышает экспрессию трансформирующего фактора роста 1 и 2 (TGFb1 и ТGFb2);
— повышает экспрессию ингибитора активатора плазминогена (РАI-1);
— стимулирует синтез протеогликанов и коллагеновых волокон;
— подавляет и блокирует IL-1, оказывая опосредованный коллагенолитический эффект на хондроциты и синовиоциты;
— угнетает IL-1b-стимулированный синтез металлопротеиназ хондроцитами;
— тормозит стимулирующее влияние IL-1b на экспрессию IL-6, IL-8 и простагландины Е2 (Pg E2);
— стимулирует синтез коллагеновых волокон в культуре хондроцитов;
— обладает превентивным действием в отношении развития остеоартрита в эксперименте.
Влияние Пиаскледина на продукцию металлопротеиназ, цитокинов и простагландина Е2 было продемонстрировано в исследовании Y. Henrotin et al. (1998): произошло ее уменьшение при приеме Пиаскледина в сравнении с плацебо.
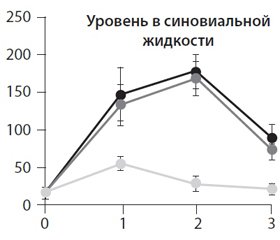
В работе L. Altinel (2007) обнаружено, что Пиаскледин обусловливает значительное повышение уровня TGF-b в синовиальной жидкости коленных суставов при разных режимах дозирования.
Структурно-модифицирующее действие Пиаскледина при коксартрозе, проявляющееся в замедлении деструкции хряща и прогрессирования сужения суставной щели, было доказано в крупномасштабных исследованиях Lequence et al. в 2002 году и E. Maheu et al. в 2009 году. По результатам этих работ после двух лет терапии Пиаскледином у пациентов с выраженным коксартрозом отмечалось в 2 раза меньшее сужение суставной щели, чем в группе плацебо. После трех лет терапии в исследовании ERADIAS уменьшение количества пациентов с сужением суставной щели в группе ASU в сравнении с группой плацебо составило 50 %. Данные исследований, подтверждающих эффективность Пиаскледина, позволили рекомендовать его как структурно-модифицирующий препарат для лечения ОА.
Также патогенетически обоснованным является назначение комбинации гиалуроната и сукцината — гиалуаль-артро (диарт). Действие антиоксиданта сукцината натрия направлено на подавление катаболических процессов и активацию анаболических процессов в клеточных элементах суставного хряща. Действие хондропротектора гиалуроната — на замещение поврежденных участков матрикса хряща.
При анализе влияния отдельных клинических параметров на прогрессирование остеоартроза коленного сустава было установлено, что возраст больных, индекс массы тела, длительность заболевания, площадь и стадия поражения хряща, повреждение менисков и связок, выраженность синовита — прогностически важные параметры, оказывающие достоверное влияние на дальнейшее прогрессирование заболевания. Их сумма позволяет прогнозировать получение положительного результата после лечения пациента с ранними стадиями ОА коленного сустава и может быть рассчитана по формуле
ПК = ПК1 + ПК2 + ПК3 + … + ПКn.
На основании этого выделяют 3 группы пациентов:
1. Группа низкой вероятности позитивного прогноза после оперативного лечения (–100 < ПК < –70).
2. Группа средней вероятности позитивного прогноза (–69,9 < ПК < +40).
3. Группа высокой вероятности позитивного прогноза (+40,1 < ПК < +120).
В заключение своего выступления докладчик сообщил о программе после–операционного функционально-восстановительного лечения больных с повреждением хряща, включающей 3 периода. Первый период — ранний восстановительный (до 3 месяцев), предусматривает разгрузку суставных поверхностей, восстановление движений в суставах и нормализацию тонуса мышц. Второй — поздний восстановительный (3–6 месяцев), направлен на восстановление функции суставов, нормализацию тонуса мышц и мышечной координации. Третий период — период профессиональной (спортивной) адаптации (6–12 месяцев).
Лечение таких пациентов осуществляется в ортопедо-травматологических отделениях, где проводится хирургическая, консервативная терапия и реабилитация. Медико-социальной экспертной комиссией определяется степень утраты здоровья и трудоспособности. Кроме того, немаловажная роль в оказании помощи больным с остеоартрозом отводится поликлиникам, где проводится диспансеризация пациентов, реабилитационным отделениям и медсанчастям, осуще–ствляющим восстановительное лечение, профессиональную и трудовую реабилитацию, протезно-ортопедическим объединениям, обеспечивающим протезирование и ортезирование, отделениям социального обеспечения, трудовым организациям, санаториям и профилакториям.
Подготовила Татьяна Чистик

/76-1.jpg)
/77-1.jpg)