Введение
Лечение и профилактика заболеваний щитовидной железы (ЩЖ) являются важными медико-социальными проблемами здравоохранения. Несмотря на значительные достижения в области тиреоидологии, число пациентов с заболеваниями ЩЖ ежегодно увеличивается. На сегодняшний день эта эндокринная патология признана самой распространенной в мире [1, 2]. Дисфункция ЩЖ приводит к тяжелым патологическим нарушениям работы других органов и систем организма человека. Наиболее частыми осложнениями тиреоидной патологии являются заболевания сердечно-сосудистой и нервной системы, а также изменения структуры ЩЖ, которые ведут к образованию различных форм зоба. Указанные изменения приводят к снижению качества жизни пациентов и, как правило, требуют длительного и комплексного лечения [3].
Причинами всплеска заболеваний ЩЖ в Украине и их лидерства в структуре обращений к врачу-эндокринологу стали произошедшая более 30 лет тому назад катастрофа на Чернобыльской АЭС и ухудшение экологической ситуации [4]. В 2013 году на диспансерном учете состояло около 2 млн человек с различной патологией ЩЖ, это почти 50 % больных с эндокринной патологией. Чрезвычайно печальным является и тот факт, что в Украине заболевания ЩЖ среди пациентов детского возраста занимают первое место в структуре всей детской эндокринной патологии (56–58 %); ее распространенность находится в пределах 56,6–61,8 на 1 тыс. детского населения [5, 6]. Такие масштабы заставляют, по сути дела, говорить об эпидемии заболеваний ЩЖ в стране.
Наиболее частыми заболеваниями ЩЖ как среди взрослых, так и среди детей являются узловой зоб (УЗ), диффузный нетоксический зоб (ДНЗ), аутоиммунный тиреоидит (АИТ).
В широком спектре причин многих заболеваний ЩЖ одной из основных является дефицит йода. Это нашло свое подтверждение в том, что заболеваемость АИТ, ДНЗ, УЗ существенно выше в йододефицитных регионах Европы, Азии, Южной Америки [7].
Дефицит йода как один из этиологических факторов многих заболеваний ЩЖ установлен давно. Приблизительно столько же насчитывает и история йодозаместительной терапии при данных заболеваниях. Известно, что йод необходим как строительный материал, из которого образуются два основных гормона ЩЖ — трийодотиронин (Т3) и тетрайодотиронин (Т4). Однако достаточно ли проводить только йодозаместительную терапию? Исследования последних лет демонстрируют, что йододефицитная патология ЩЖ в значительной степени усугубляется дефицитом других эссенциальных микроэлементов, в первую очередь дефицитом селена, железа, цинка как основных молекулярных синергистов йода, необходимых для реализации биологических эффектов на пути метаболизма тиреоидных гормонов [8–13].
В последнее время для профилактики и комплексного лечения заболеваний ЩЖ все большее внимание уделяется применению фитотерапии. Лекарственные растения являются наиболее перспективным источником биологически активных веществ с тиреотропным действием. Как известно, последние безопаснее и при правильной комбинации не дают побочных эффектов, что позволяет широко применять их. Также следует подчеркнуть, что одно лекарственное растение может обладать комплексом фармакологических эффектов (противовоспалительным, анальгезирующим, тонизирующим и др.), что позволяет оказывать позитивное влияние на весь организм в целом [14].
Столь высокая распространенность заболеваний ЩЖ диктует необходимость наличия в арсенале врача-эндокринолога эффективных и безопасных препаратов, предназначенных для лечения таких больных. В этом плане бесспорный интерес представляет Альба®, первый стандартизированный фитопрепарат экстракта корня лапчатки белой.
Альба® имеет ряд преимуществ по сравнению с препаратами данной терапевтической направленности, присущих только ей. Это связано с тем, что в составе экстрактов, приготовленных на основе корней лапчатки белой, установлено наличие сапонинов (обладают адаптогенным и гиполипидемическим действием), флавоноидов (рутин стабилизирует эластичность и проницаемость сосудистой стенки; кверцетин демонстрирует антиоксидантные свойства), танинов (оказывают детоксицирующее действие). Важно также отметить, что экстракт корня лапчатки белой, который входит в состав препарата Альба®, содержит макро- (магний, калий, кальций, фосфор) и микроэлементы (селен, цинк, железо, йод, марганец). Макро- и микроэлементы чрезвычайно важны для жизнедеятельности организма. Так, например, селен играет существенную роль в функционировании ЩЖ. Селеноцистеин входит в состав активного центра ферментов глутатионпероксидазы, ответственных за антиоксидантную защиту ЩЖ, а также фермента йодтиронин-5’-дейодиназы, обеспечивающего периферическую активацию тиреоидных гормонов. Дефицит цинка значительно снижает эффективность лечения эндемического зоба монопрепаратами йода [15]. Фермент супероксиддисмутаза, который содержит в себе медь и цинк, обеспечивает антиоксидант–ную защиту ЩЖ, при снижении активности этого фермента повышается риск увеличения ЩЖ [16]. Дефицит железа, в частности, снижает синтез тиреоидных гормонов путем уменьшения активности гемзависимой тиреопероксидазы. Также дефицит железа негативно влияет на гипоталамо-гипофизарно-тиреоидную ось гормональной регуляции. При дефиците железа наблюдается снижение общего уровня T3 на 43 %, а общего уровня T4 — на 67 % [10]. Положительные клинические эффекты применения стандартизированного экстракта корня лапчатки белой исчерпывающе описаны в работах отечественных ученых-эндокринологов [17–19].
Опыт применения препарата Альба® при различных заболеваниях ЩЖ достаточно успешный, препарат более 6 лет присутствует на рынке Украины. Во многих работах [17–20] продемонстрирована способность препарата влиять как на субъективные проявления, так и на объективные показатели больных с патологией ЩЖ. Убедительно доказано, что прием Альбы® у пациентов с гипотиреозом по мере восстановления тиреоидного статуса способствует уменьшению вялости, быстрой утомляемости, сонливости, улучшению состояния ногтей и кожи, исчезновению отечности лица, уменьшению выпадения волос. Такие больные отмечали улучшение памяти, уменьшение веса, восстановление регулярного менструального цикла. У пациентов с тиреотоксикозом уменьшался тремор, тахикардия, потливость, улучшалось эмоциональное состояние. Ряд пациентов отмечали облегчение чувства давления на шею, что сопровождалось уменьшением объема зоба; это подтверждалось результатами ультразвукового исследования (УЗИ) ЩЖ.
В то же время дальнейшие клинические исследования Альбы® позволят получить новые данные, основанные на результатах больших выборок больных, обеспечивающих базу для доказательной медицины.
Целью работы была оценка динамики размеров зоба у больных АИТ, ДНЗ, УЗ при проведении монотерапии препаратом Альба® в различных регионах Украины.
Материалы и методы
Исследование проводилось врачами-эндокринологами в 56 медицинских учреждениях Украины. В исследование приглашались больные, состоящие на диспансерном учете по поводу АИТ, ДНЗ или УЗ. Пациентам предлагалось проведение монотерапии препаратом Альба® на протяжении шести месяцев в режиме дозирования по одной капсуле 2 раза в день. До начала лечения, через 3 и 6 месяцев лечения оценивался объем ЩЖ (в см3), а также уровень тиреотропного гормона (ТТГ) в крови.
Перед началом исследования все больные подписали информированное согласие, в котором изложены возможная польза лечения препаратом Альба®, альтернативные методы терапии, права пациента, контактные данные исследователя.
При проведении анализа результатов исследования использовался статистический пакет MedCalc v.15.11.0 (MedCalc Software bvba 1993–2015).
При проведении анализа количественные признаки представлены значением медианы (Me) первого (QI) и третьего (QIII) квартилей [15]. Для качественных признаков приведена частота (%) и 95% доверительный интервал (95% ДИ).
При проведении анализа динамики изменения показателей использован ANOVA для повторных измерений [21]. При проведении парных сравнений использовалась поправка Бонферрони [21]. Критический уровень значимости принят равным 0,05.
Для выявления факторов, связанных с эффективностью снижения размеров ЩЖ, были использованы методы построения и анализа многофакторных логистических моделей регрессии [22, 23]. Для оценки связи факторного признака с результирующим рассчитывался показатель отношения шансов (ОШ) и 95% ДИ [21–23]. Для оценки адекватности модели использован метод анализа кривых операционных характеристик (ROC — Receiver Operating Characteristic curve analysis) [22], при этом рассчитывалась площадь под ROC-кривой (AUC — Area under the ROC curve) и ее 95% ДИ [15, 16]. Оптимизация порога принятия/отвержения проводилась методом максимизации показателя теста Youden индекс (J) [23]:
J = max {sensitivityc + specificityc – 1},
где sensitivityc — чувствительность теста при выбранном критическом значении порога, specificityc — специфичность при выбранном критическом значении порога.
Результаты
Всего в исследовании приняли участие 1107 больных: с диагнозом АИТ — 252 пациента; ДНЗ — 333 и УЗ — 522 пациента. Распределение больных по возрасту представлено в табл. 1.
В группе больных с АИТ было 6,6 ± 1,7 % мужчин и 93,4 ± 1,7 % женщин, в группе больных с ДНЗ — 11,8 ± 1,9 % мужчин и 88,2 ± 1,9 % женщин, в группе больных с УЗ — 7,2 ± 1,2 % мужчин и 92,8 ± 1,2 % женщин (статистически значимого различия распределения больных по возрасту между группами не выявлено, p = 0,06 по критерию хи-квадрат).
Уровень ТТГ у больных АИТ, ДНЗ и УЗ находился в пределах референсных значений. Однако при проведении анализа в группе пациентов с АИТ было обнаружено снижение (p < 0,001) уровня ТТГ в процессе лечения. При этом выявлено снижение (p < 0,05) уровня ТТГ через 3 месяца лечения до 2,62 мМЕ/л (1,5–4,0 мМЕ/л) и через 6 месяцев лечения до 2,1 мМЕ/л (1,4–2,65 мМЕ/л) по сравнению с началом лечения — 3,43 мМЕ/л (1,6–6,4 мМЕ/л). Также выявлено снижение уровня ТТГ через 6 месяцев лечения по сравнению с показателями за 3 месяца лечения (p < 0,05).
При проведении анализа в группе пациентов с ДНЗ выявлено снижение (p < 0,001) уровня ТТГ в процессе лечения (табл. 2). Наблюдалось достоверное снижение (p < 0,05) уровня ТТГ через 3 месяца лечения до 1,81 мМЕ/л (1,3–2,5 мМЕ/л) и через 6 месяцев лечения до 1,79 мМЕ/л (1,3–2,2 мМЕ/л) по сравнению с началом лечения — 2,0 мМЕ/л (1,2–2,9 мМЕ/л). Выявлено снижение уровня ТТГ через 6 месяцев лечения по сравнению с показателями за 3 месяца лечения (p < 0,05).
При проведении анализа в группе пациентов с диагнозом УЗ аналогично выявлено снижение (p < 0,001) уровня ТТГ в процессе лечения (табл. 2). Так, наблюдалось достоверное снижение (p < 0,05) уровня ТТГ через 3 месяца лечения до 1,9 мМЕ/л (1,3–2,6 мМЕ/л) и через 6 месяцев лечения до 1,8 мМЕ/л (1,22–2,23 мМЕ/л) по сравнению с началом лечения — 2,1 мМЕ/л (1,28–3,1 мМЕ/л). Выявлено снижение уровня ТТГ через 6 месяцев лечения по сравнению с показателями за 3 месяца лечения (p < 0,05).
При анализе показателей пациентов с АИТ выявлено достоверное уменьшение (p < 0,001) объема ЩЖ под влиянием проведенного лечения. При этом наблюдалось уменьшение (p < 0,05) объема ЩЖ через 3 месяца лечения до 12,6 см3 (9,4–18,0 см3) и через 6 месяцев лечения — до 12,0 см3 (9,0 –16,0 см3) по сравнению с исходным размером — 14,1 см3 (9,9–19 см3). Установлено также уменьшение –объема ЩЖ через 6 месяцев лечения по сравнению с показателями через 3 месяца лечения (p < 0,05).
При проведении анализа для пациентов с ДНЗ также выявлено уменьшение (p < 0,001) объема ЩЖ (табл. 3). Наблюдалось достоверное уменьшение (p < 0,05) объема ЩЖ через 3 месяца лечения до 18,0 см3 (14,2–21,3 см3) и через 6 месяцев лечения — до 16,0 см3 (13,2–18,8 см3) по сравнению с исходным размером — 19,0 см3 (16,0–23,7 см3). Выявлено также уменьшение объема ЩЖ через 6 месяцев лечения относительно показателей через 3 месяца лечения (p < 0,05).
Для пациентов с УЗ аналогично выявлено уменьшение (p < 0,001) объема ЩЖ в процессе лечения (табл. 3; рис. 2). Обнаружено уменьшение (p < 0,05) объема ЩЖ через 3 месяца лечения до 13,6 см3 (10,2–18,7 см3) и через 6 месяцев лечения — до 12,3 см3 (9,6–17,0 см3) по сравнению с началом лечения — 14,2 см3 (10,6–19,9 см3). Выявлено также уменьшение объема ЩЖ через 6 месяцев лечения по сравнению с показателями через 3 месяца лечения (p < 0,05).
На рис. 2 представлена динамика объема ЩЖ в процентах к исходному размеру для трех групп пациентов, проходивших лечение.
Проведенный анализ показал (рис. 2), что через 6 месяцев лечения:
— в группе пациентов с АИТ у половины обследованных объем ЩЖ уменьшился на 11,3 % (95% ДИ 9,6–13,7 %) и более;
— в группе пациентов с диагнозом ДНЗ у половины обследованных объем ЩЖ уменьшился на 16,8 % (95% ДИ 14,2–18,3 %) и более;
— в группе пациентов с диагнозом УЗ у половины обследованных объем ЩЖ уменьшился на 16,7 % (95% ДИ 16,7–20,0 %) и более.
Факторы, связанные со снижением объема ЩЖ в процессе лечения
Для выявления факторных признаков, связанных со снижением объема ЩЖ в процессе лечения, были использованы методы построения и анализа многофакторных логистических моделей регрессии. При проведении анализа в качестве результирующего признака рассматривался размер ЩЖ через 6 месяцев от начала лечения (переменная Y). Считали, что размер ЩЖ эффективно уменьшается (Y = 1), если через 6 месяцев от начала лечения ее размер составлял не более 85 % (т.е. произо–шло уменьшение на 15 %) от исходного размера, в противном случае изменение не считалось эффективным (Y = 0). В качестве факторных признаков исследовалось влияние возраста (X1), исходного размера ЩЖ (X2), начального уровня ТТГ (X3).
Среди больных с диагнозом АИТ уменьшение размеров ЩЖ оказалось эффективным для 35,2 ± 3,0 % пациентов. Для проведения анализа на трех факторных признаках была построена модель прогнозирования эффективности уменьшения размеров ЩЖ. Модель адекватна (p = 0,008 по критерию хи-квадрат), что свидетельствует о наличии связи эффективности с факторными признаками.
В табл. 4 приведены значения коэффициентов модели.
При проведении анализа (табл. 4) выявлено увеличение (p = 0,002) вероятности эффективного снижения размеров ЩЖ при ее больших исходных размерах, ОШ = 1,06 (95% ДИ 1,02–1,11) на каждый кубический сантиметр увеличения исходного размера. Значимого влияния других факторных признаков не выявлено (p > 0,05).
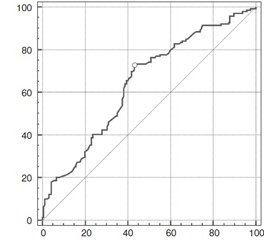
Для выявления критического исходного размера ЩЖ, при котором прогнозируется ее уменьшение на 15 % и более от исходных размеров, был использован метод анализа ROC-кривой однофакторной логистической модели (рис. 3). Модель адекватна, площадь под кривой операционных характеристик, AUC = 0,67 ± 0,04, статистически значимо (p < 0,001) превышает 0,5. Оптимальный порог принятия решения в рамках модели был выбран с использованием метода максимизации Youden index. Получено X2crit = 13,7 см3, при выбранном пороге чувствительность теста равна 62,2 % (95% ДИ 53,5–70,4 %), специфичность теста составила 68,6 % (95% ДИ 57,7–78,2 %).
Среди больных с ДНЗ снижение размеров ЩЖ на фоне лечения оказалось эффективным для 52,4 ± 2,8 % пациентов. Модель прогнозирования адекватна (p < 0,001 по критерию хи-квадрат), что свидетельствует о наличии связи эффективности уменьшения размеров ЩЖ с факторными признаками.
В табл. 5 приведено значение коэффициентов модели.
При проведении анализа (табл. 5) выявлено увеличение (p < 0,001) вероятности эффективного снижения размеров ЩЖ при ее больших исходных размерах, ОШ = 1,09 (95% ДИ 1,04–1,14) на каждый кубический сантиметр увеличения исходного размера. Значимого влияния других факторных признаков не выявлено (p > 0,05).
Для выявления критического исходного размера ЩЖ, при котором прогнозируется ее уменьшение на 15 % и более от исходных размеров, был использован метод анализа ROC-кривой однофакторной логистической модели (рис. 4). Модель адекватна, площадь под кривой операционных характеристик, AUC = 0,64 ± 0,03, статистически значимо (p < 0,001) превышает 0,5. Получен оптимальный порог принятия решения в рамках модели, X2crit = 20,2 см3, при выбранном пороге чувствительность теста равна 72,7 % (95% ДИ 64,5–79,9 %), специфичность теста составила 57,0 % (95% ДИ 49,0–64,6 %).
Среди больных с УЗ снижение размеров ЩЖ оказалось эффективным для 54,1 ± 1,8 % пациентов. Для проведения анализа на трех факторных признаках была построена модель прогнозирования эффективности уменьшения размеров ЩЖ. Модель неадекватна (p = 0,57 по критерию хи-квадрат), что свидетельствует об отсутствии связи наличия эффекта с факторными признаками.
Обсуждение
Важным фактором, который определяет распространенность и нозологическую структуру заболеваний ЩЖ в популяции, является уровень потребления йода. Йод — неотъемлемый субстрат для синтеза гормонов ЩЖ. Недостаточность йода приводит к снижению продукции тиреоидных гормонов и развитию йододефицитных заболеваний (ЙДЗ). Для Украины проблема йодного дефицита остается актуальной, поскольку не существует территорий, где население не испытывает риска развития ЙДЗ. Эти нарушения изменяются с возрастом и физиологическим состоянием. В любом возрасте может развиться зоб (диффузное увеличение ЩЖ или появление узлов) и нарушение функции ЩЖ. Также не следует упускать из виду неразрывную связь метаболизма йода с метаболизмом других микронутриентов. Без этих микронутриентов монопрепараты йода значительно менее эффективны. При этом тактика лечения заболеваний ЩЖ за последние десятилетия заметно не изменилась, а арсенал эффективных лекарственных средств, предназначенных для терапии и профилактики этой патологии, явно недостаточный.
В связи с этим появляются новые взгляды на применение фитотерапии у больных с патологией ЩЖ в аспекте общеметаболических неспецифических нарушений на уровне тканей, органов и организма в целом. На сегодня акцент делается на готовых фитотерапевтических препаратах, поскольку значительное антропогенное загрязнение большей части территории Украины делает вчерашние весомые приобретения народной медицины рискованными к применению и мало отвечающими темпам жизни современного человека [14].
Фитопрепараты, которые содержат биологически активные вещества, лучше переносятся больными, практически не приводят к возникновению побочных явлений и имеют меньшую токсичность по сравнению с синтетическими лекарственными средствами. Низкая токсичность подавляющего большинства лекарственных растений позволяет назначать их длительными курсами для противорецидивного или реабилитационного лечения.
По данным независимых исследований, фитопрепарат Альба® (стандартизированный монопрепарат экстракта корня лапчатки белой 300 мг) зарекомендовал себя как перспективное направление лечения заболеваний ЩЖ с широкими терапевтическими возможностями. Отмечена высокая –безопасность терапии при продолжительном приеме, не было зарегистрировано случаев непереносимости, побочных эффектов или фактов отказа от лечения [24, 25].
Благодаря сбалансированному содержанию йода и ряда других микроэлементов, необходимых для функционирования ЩЖ, а также патогенетически обоснованному мембраностабилизирующему действию биологически активных веществ фитопрепарат Альба® может быть использован как для профилактики заболеваний ЩЖ (ДНЗ, УЗ), так и для лечения пациентов с гипер- и гипотиреозом различной этиологии, узловым, многоузловым и диффузным нетоксическим зобом, хроническим АИТ.
Известно, что в условиях снижения поступления йода в организм уменьшается биосинтез и секреция тиреоидных гормонов, поэтому активизируются процессы образования и высвобождения ТТГ и, как следствие, увеличиваются размеры ЩЖ [2].
На фоне лечения Альбой® в течение шести месяцев при наблюдении с использованием УЗИ важным является постепенное уменьшение размеров ЩЖ. В данном случае терапия Альбой® является этиотропной. Работы последних 10–15 лет показали, что повышение продукции ТТГ или чувствительности к нему тиреоцитов имеет второстепенное значение в патогенезе йододефицитного зоба [3, 8]. При недостаточном поступлении йода в железу снижается количество йодированных липидов (основных ингибиторов факторов роста), что оказывает мощное стимулирующее воздействие на рост тиреоцитов.
Важным результатом исследования для практикующего врача-эндокринолога является улучшение функционального состояния ЩЖ, что проявилось в достоверном снижении уровня ТТГ до среднепопуляционного под влиянием Альбы®. Известно, что при исключении из выборки носителей антител к ЩЖ и лиц, имеющих зоб или ближайших родственников с тиреоидной патологией, лишь в 8 % случаев уровень ТТГ превышает 2,5 мМЕ/л [26].
Хотя уровень ТТГ у обследованных нами больных не превышал референсные значения, его снижение до средних показателей в популяции свидетельствует об улучшении функционального состояния ЩЖ и уменьшении риска дальнейшего прогрессирования заболевания.
Проведенный анализ свидетельствует, что существует вероятность уменьшения размеров ЩЖ на фоне лечения препаратом Альба® у пациентов с АИТ, ДНЗ и УЗ (p < 0,001). В случае с ДНЗ и АИТ эффективность уменьшения связана с исходным размером ЩЖ: эффективное уменьшение через 6 месяцев прогнозируется при исходном размере ЩЖ ≥ 13,7 см3 и ≥ 20,2 см3 соответственно. У пациентов с УЗ не выявлено связи эффективности уменьшения размеров ЩЖ с возрастом пациента, исходным размером ЩЖ, начальным уровнем ТТГ.
Выводы
1. При проведении анализа в группе пациентов с диагнозом АИТ было выявлено эффективное уменьшение (p < 0,001) объема ЩЖ при проведении лечения через 3 и 6 месяцев. Вероятность уменьшения размеров щитовидной железы (на 15 % за 6 месяцев и более) для пациентов с АИТ на фоне лечения Альбой® связана с исходным размером щитовидной железы. Вероятность достижения эффекта возрастает (p = 0,001; ОШ = 1,07; 95% ДИ 1,03–1,11) на каждый кубический сантиметр увеличения исходного размера.
2. При проведении анализа в группе пациентов с диагнозом ДНЗ было выявлено эффективное уменьшение (p < 0,001) объема ЩЖ при проведении лечения через 3 и 6 месяцев. Вероятность уменьшения размеров ЩЖ (на 15 % за 6 месяцев и более) для пациентов с диагнозом ДНЗ после применения Альбы® связана с исходным размером ЩЖ. Вероятность достижения эффекта возрастает (p < 0,001; ОШ = 1,09; 95% ДИ 1,04–1,14) на каждый кубический сантиметр увеличения исходного размера.
3. При проведении анализа в группе пациентов с диагнозом АИТ было выявлено эффективное уменьшение (p < 0,001) объема ЩЖ при проведении лечения через 3 и 6 месяцев. Не выявлено связи (p > 0,05) эффективности уменьшения размеров ЩЖ (на 15 % за 6 месяцев и более) с возрастом пациента, исходным размером ЩЖ, начальным уровнем ТТГ для пациентов с УЗ на фоне применения Альбы®.
4. Применение препарата Альба® способствовало улучшению функционального состояния ЩЖ, что проявилось в достоверном снижении уровня ТТГ до среднепопуляционного у пациентов с АИТ, ДНЗ и УЗ на фоне уменьшения общего –объема ЩЖ.
5. Применение препарата Альба® у пациентов с АИТ, ДНЗ, УЗ позволяет снизить риск дальнейшего прогрессирования заболевания.
Конфликт интересов. Не заявлен.
Список литературы
1. Vanderpump M.P. The epidemiology of thyroid disease // Br. Med. Bull. — 2011. — Vol. 99. — P. 39-51. doi: 10.1093/bmb/ldr030.
2. Eastman C.J. Screening for thyroid disease and iodine deficiency // Pathology. — 2012. — Vol. 44 (2). — P. 153-9. doi: 10.1097/PAT.0b013e32834e8e83.
3. Балаболкин М.И. Фундаментальная и клиническая тиреоидология / М.И. Балаболкин, Е.М. Клебанова, В.М. Креминская. — М.: Медицина, 2007. — 816 с.
4. Паньків В.І. Практична тиреоїдологія / В.І. Паньків. — Донецьк: Видавець Заславський О.Ю., 2011. — 224 с.
5. Тронько М.Д. Сучасний стан і перспективи розвитку фундаментальної та клінічної ендокринології на 2015–2020 роки // Ендокринологія. — 2015. — Т. 20, № 1. — C. 373-381. (Contemporary state and prospects of development of fundamental and clinical endocrinology in 2015 // Endokrynolohiya. — 2015. — Vol. 20, № 1. — P. 373-381.
6. Кравченко В.І. Динаміка захворюваності на патологію щитоподібної залози в Україні / В.І. Кравченко, С.В. Постол // Международный эндокринологический журнал. — 2011. — № 3 (35). — С. 26-31.
7. Laurberg P., Bulow P., Knudsen N. et al. Environmental iodine intake affects the type of nonmalignant thyroid disease // Thyroid. — 2001. — Vol. 11. — P. 457-469.
8. Громова О.А., Торшин И.Ю., Кошелева Н.Г. Молекулярные синергисты йода: новые подходы к эффективной профилактике и терапии йододефицитных заболеваний у беременных // РМЖ. — 2011. — № 1. — С. 51-59.
9. Стандарти надання медичної допомоги хворим з патологічними станами щитоподібної залози в умовах дії негативних чинників довкілля: Медичний посібник / Камінський О.В., Афанасьєв Д.Є., Коваленко О.М. — К., 2012. — 164 с.
10. Маменко М.Є., Єрохіна О.І., Головченко Н.М. Профілактика та лікування ендемічного зоба в регіонах із високою поширеністю поєднаного дефіциту йоду та заліза // Український медичний альманах. — 2008. — Т. 11, № 5. — С. 101-104.
11. Ляхнович Н.А., Гутикова Л.В. Роль йода и селена в гормональной регуляции функции щитовидной железы при беременности // Медико-биологические проблемы жизнедеятельности. — 2013. — № 2 (10). — С. 13-23.
12. Guastamacchia E., Giagulli V.A., Licchelli B., Triggiani V. Selenium and Iodine in Autoimmune Thyroiditis // Endocr. Metab. Immune Disord. Drug. Targets. — 2015. — Vol. 15 (4). — P. 288-92.
13. Duntas L.H. The Role of Iodine and Selenium in Autoimmune Thyroiditis // Horm. Metab. Res. — 2015. — Vol. 47 (10). — P. 721-6. doi: 10.1055/s-0035-1559631.
14. Волошин О.І., Васюк В.Л., Малкович Н.М., Сенюк Б.П. Основи фітотерапії та гомеопатії. — Вижниця: Черемош, 2011. — 628 с.
15. Betsy A., Binitha M., Sarita S. Zinc Deficiency Associated with Hypothyroidism: An Overlooked Cause of Severe Alopecia // International Journal of Trichology. — 2013. — Vol. 5 (1). — P. 40-42. doi:10.4103/0974-7753.114714.
16. Case A.J. On the Origin of Superoxide Dismutase: An Evolutionary Perspective of Superoxide-Mediated Redox Signa–ling // Antioxidants (Basel). — 2017. — Vol. 30, № 6 (4). pii: E82. doi: 10.3390/antiox6040082.
17. Киселева И.А., Теплая Е.В., Каминский А.В. Применение растительного препарата Альба® в лечении больных с патологией щитовидной железы // Врачебное дело. — 2012. — № 8. — С. 116-119.
18. Кваченюк А.Н., Кваченюк Е.Л. Использование фитотерапии при лечении заболеваний щитовидной железы // Врачебное дело. — 2012. — № 3–4. — С. 108-115.
19. Паньків В.І. Використання фітотерапії в комплекс–ному лікуванні хворих на дифузний токсичний зоб // Міжнародний ендокринологічний журнал. — 2012. — № 2 (42). — С. 114-117.
20. Семенова Е.Ф., Преснякова Е.В. Химический состав лапчатки белой и применение ее с лечебной целью // Химия и компьютерное моделирование. Бутлеровские сообщения. — 2001. — № 5.
21. Петри А., Сэбин К. Наглядная статистика в медицине: Пер. с англ. В.П. Леонова. — М.: ГЭОТАР-МЕД, 2003. — 144 с.
22. Лях Ю.Е., Гурьянов В.Г. Математическое моделирование при решении задач классификации в биомедицине // Український журнал телемедицини та медичної телематики. — 2012. — Т. 10, № 2. — С. 69-76.
23. Лях Ю.Е., Гурьянов В.Г., Хоменко В.Н., Панченко О.А. Основы компьютерной биостатистики: анализ информации в биологии, медицине и фармации статистическим пакетом Medstat. — Д.: Папакица Е.К., 2006. — 214 с.
24. Каминский А.В., Киселева И.А., Теплая Е.В. Клинические возможности применения лапчатки белой в профилактике и лечении больных с патологией щитовидной железы // Врачебное дело. — 2013. — № 8. — С. 99-108.
25. Турчанинова Л.И. Опыт применения фитопрепарата Альба в лечении заболеваний щитовидной железы у детей и подростков // Врачебное дело. — 2014. — № 3–4. — С. 125-129.
26. Свиридонова М.А., Фадеев В.В. Значение вариабельности уровня ТТГ в клинической практике // Клиническая и экспериментальная тиреоидология. — 2008. — Т. 4 (4). — С. 16-22.

/37-1.jpg)
/38-1.jpg)
/39-1.jpg)
/40-1.jpg)
/43-1.jpg)
/44-1.jpg)