Введение
Бактерии с мультилекарственной резистентностью (multidrug-resistant — MDR), экстенсивной лекарственной резистентностью (extensively drug-resistant — XDR) представляют реальную угрозу человечеству практически во всех странах мира [17, 28]. Ускорение прироста уровня распространенности антибиотикорезистентности клинически значимых бактериальных штаммов привело к интенсификации исследований, направленных на поиск и разработку новых антимикробных лекарственных средств, в том числе основанных на молекулярных структурах эндолизинов, бактериоцинов, антимикробных пептидов (АМП); созданию препаратов моноклональных антител, направленных против бактериальных факторов вирулентности, пробио–тиков и вакцин [10]. Натуральные АМП впервые были открыты в 1939 году René J. Dubos [12], который экстрагировал из бактерии Bacillus brevi грамицидин, обладающий высокой бактерицидной активностью против широкого спектра грамположительных бактерий. Однако понимание функционирования АМП как универсального оружия иммунной системы против патогенных микроорганизмов привнесли Hans G. Boman и соавторы в 70-х годах прошлого века [47]. Hans G. Boman задал простой вопрос: при помощи каких механизмов защиты мы остаемся здоровыми, если подготовка к продукции специфических антител занимает недели, в то время как микроорганизмы делятся ежечасно? В 1972 году была идентифицирована индуцибельная продукция антимикробного пептида у дрозофилы, который в 1981 году был охарактеризован и получил название цикропина. Несмотря на то, что вначале продукцию АМП считали ответом, специфическим для насекомых, в последующем была показана глобальная роль АПМ в противоинфекционной защите практически всех существующих организмов [14]. Антимикробные пептиды представляют собой древнейший неспецифический механизм защиты организма от разнообразных инфекционных патогенов, в том числе бактерий, вирусов, грибов [37, 46]. С момента открытия первого антимикробного пептида до настоящего времени присутствие АМП обнаружено у всех организмов: гены АМП идентифицированы в геномах как у прокариот, так и у млекопитающих [41]. Антимикробные пептиды обладают чрезвычайным структурным и функциональным разнообразием: они проявляют не только антибактерицидное, но и иммуномодулирующее действие, а также оказывают влияние на ангиогенез, репарацию тканей, развитие воспалительной реакции и др. [15, 42, 44, 46]. Установлено, что некоторые АМП благодаря быстрой реакции механизмов их синтеза на внедрение патогена и широкому спектру бактерицидности пептидов обладают более высоким уровнем противомикробной активности, чем обычные антибиотики [26]. На основании молекул АМП уже созданы и разрабатываются новые антибактериальные средства, которые вызывают гибель бактерии гораздо эффективнее, чем обычные антибиотики (табл. 1) [27, 30, 43, 56, 57]. Первое терапевтическое использование АМП было проведено в 2009 году [27].
/103-1.jpg)
/104-1.jpg)
/105-1.jpg)
Антимикробные пептиды
Большинство молекул АМП представляют собой относительно короткие, состоящие из 10–50 аминокислотных остатков, амфифильные пептиды с общим положительным зарядом от +2 до +11. В зависимости от особенностей вторичной структуры молекул АМП классифицируются: на α-спирали, β-листы, пептиды со случайной структурой спирали, цистеинстабилизированные α-β мотивы (рис. 1) [29, 32].
Большинство АМП представляют α-спирали, β-листы. Антимикробные пептиды с α-спиральной структурой у человека представлены: LL-37, неактивным предшественником которого является кателицидин (hCAP18), продуцируемый нейтрофилами и эпителиальными клетками [62], и лактоферрицином, предшественником которого является гликопротеин лактоферрин, присутствующий в экскретах экзокринных желез [63]. Антимикробные пептиды с β-листовой структурой стабилизированы дисульфидными связями и при взаимодействии с мембраной не испытывают резкое конформационное изменение, как α-спиральные пептиды. Наиболее изученными пептидами данного класса АМП являются дефензины, продуцируемые как неактивные предшественники нейтрофилами, макрофагами и эпителиальными клетками [58].
Общая база данных АМП представляет собой коллекцию 19 062 аминокислотных последовательностей, обладающих бактерицидной активностью против различных микроорганизмов. Электронные адреса баз данных АМП представлены в табл. 2 [33].
Антимикробные пептиды продуцируются при помощи рибосомной трансляции мРНК или нерибосомного пептидного синтеза. Рибосомно-синтезируемые АМП продуцируются всеми видами организмов, включая бактерии, а нерибосомный синтез АМП преимущественно характерен для бактерий. По сравнению с пептидами нерибосомного происхождения, многие из которых уже продолжительное время используются в клинической практике в качестве антибиотиков (например, полимиксины и грамицидин S), терапевтический потенциал рибосомно-синтезируемых АМП признан только в последнее время. У млекопитающих АМП в основном продуцируются нейтрофилами и эпителиальными клетками слизистых оболочек и кожи. В разных компартментах человеческого организма продуцируется своеобразный спектр АМП (рис. 2) [36].
Характеристика антимикробных пептидов ткани легкого человека представлена в табл. 3.
Гены некоторых АМП в геноме человека располагаются кластерами и коэкспрессируются, что приводит к накоплению разнообразных AMP на территории одного сайта. Большинство АМП продуцируются как неактивные молекулярные предшественники пептида, которые для своей активации требуют протеолитического расщепления. У многоклеточных организмов некоторые AMP конститутивно экспрессируются в виде неактивных предшественников и сохраняются в гранулах, высвобождаясь исключительно в местах инфицирования; другие же AMP продуцируются в ответ на стимуляцию цитокинами или сигналами, ассоциированными с образраспознающими рецепторами [36].
Механизм действия антимикробных пептидов
Положительный заряд АМП обеспечивает более высокую вероятность их взаимодействия с отрицательно заряженными клеточными стенками бактерий, чем с нейтральными клеточными мембранами клеток макроорганизма. Важно отметить, что АМП остаются бактерицидно активными по отношению к антибиотикорезистентным микробам [38, 64]. Антимикробные пептиды, взаимодействуя с бактериями, приводят к деструкции бактериальной стенки за счет трех основных способов нарушения целостности: образуя цилиндрические или торо–идальные поры или разрывая внутреннюю мембрану бактериальной стенки («ковровая» модель) (рис. 3, табл. 4).
Необходимо отметить, что АМП взаимодействуют с бактериальными мембранами при относительно низких своих концентрациях, в то время как при высокой концентрации они могут взаимодействовать с эритроцитами, гликопротеины мембран которых содержат сиаловую кислоту, и вызывать гемолиз [59].
Антимикробные пептиды человека и их аналоги
Большинство антимикробных пептидов человека представлены двумя классами: кателицидином и дефензинами.
Протеин hCAP18 является единственным кателицидином человека, С-терминальный регион молекулы которого, состоящий из 37-аминокислотных остатков (LL-37), обладает противомикробной и иммунотропной активностью, модулируя экспрессию сотен генов в моноцитах, эпителиальных и других клетках. Пептид может индуцировать (табл. 5) и подавлять провоспалительные эффекты, ингибируя активацию MAPK- и Akt-ассоциированных сигнальных путей. Отщепленный регион LL-37 представляет собой линейный, катионный, амфипатический, α-спиральный пептид. Он связывается с отрицательно заряженными клеточными мембранами бактерий. После проникновения в мембрану LL-37 вызывает порообразование, которое приводит к гибели бактерии [13, 24, 48, 60].
Кателицидин и его дериваты
Пептид LL-37 нейтрализует патогенассоциированные молекулярные паттерны (например, липотейхоевые кислоты, пептидогликан), тем самым подавляя провоспалительный ответ [9]. Пептид LL-37 и его производные обладают достаточно выраженным терапевтическим потенциалом, как бактерицидным, так и репарационным. Пептид LL-37 индуцирует пролиферацию эпителиальных и стромальных клеток, способствуя заживлению ран [16]. Показано, что некоторые дериваты LL-37 обладают более выраженной антибактериальной активностью, чем непосредственно пептид LL-37 [19]. Так, Elisabeth M. Haisma и соавт. [18], модифицировав пептид –LL-37, получили пептид α-спиральный амфипатический P10 (LAREYKKIVEKLKRWLRQVLRTLR), который обладает более выраженным антимикробным эффектом против грамотрицательных и –грамположительных бактерий и грибов (Candida albicans и Aspergillus niger), чем LL-37. Авторами было продемонстрировано, что P10 может эффективно контролировать инфекции, ассоциированные с атопическим дерматитом.
Man Hou и соавт. [23] на экспериментальных животных продемонстрировали, что пептид LL-37 способствует саногенезу пневмонии, вызванной метициллинрезистентными бактериями Staphylococcus aureus (methicillin-resistant Staphylococcus aureus — MRSA). В экспериментальной работе Brandon J.H. Banaschewski и соавт. [3] показали возможность использования кателицидиновых пептидов LL-37, CATH-1, CATH-2, CRAMP, обладающих антибактериальной активностью против MRSA и Pseudomonas aeruginosa, при лечении бактериальной пневмонии. Авторы решили вопрос доставки АПМ в респираторный тракт: они разработали интратрахеальный метод введения АМП в сочетании с сурфактантом.
В настоящее время исследуется бактерицидная активность различных дериватов кателицидина и возможность их терапевтического использования (табл. 6) [24, 34, 49, 50].
Согласно результатам исследований Stephanie M. Barksdale [5], самым эффективным бактерицидным действием против MDR Acinetobacter baumanii и Klebsiella pneumoniae и минимальным токсическим влиянием обладает AM-CATH36 дериват кателицидина американского аллигатора.
Дефензины и их дериваты
Дефензиновые пептиды образуют три семейства α-, β- и θ-дефензинов.
Впервые дефензины млекопитающих были описаны в 1956 году Robert C. Skarnes и Dennis W. Watson [53] как лейкины и James G. Hirsch [22] — как фагоцитины полиморфноядерных лейкоцитов кролика. В серии работ H.I. Zeya и John K. Spitznagel [65] показали, что данные протеины относятся к одному молекулярному семейству, которое они определили как семейство катионных антимикробных протеинов, и только в 1985 году Michael E. Selsted и соавт. [51] дали им современное название — дефензины.
Человеческие дефензины представляют собой семейство амфифильных, катионных, богатых цистеиновыми остатками пептидов с молекулярной массой 3–4 kDa, молекула которых состоит из 29–47 аминокислотных остатков [2].
Молекулы дефензинов отличаются высоким содержанием положительно заряженных аргининовых, лизиновых остатков, аминокислот с гидрофобными боковыми группами и обязательным наличием шести цистеиновых остатков, образующих три внутримолекулярных дисульфидных мостика, которые функционально стабилизируют молекулу от деградации протеазами. В настоящее время идентифицировано три типа дефензинов: α-дефензины, b-дефензины и θ-дефензины. У человека обнаружены α-дефензины и b-дефензины. Циклические θ-дефензины обнаружены только у макаки-резус (Macaca mulatta). Из-за короткой аминокислотной последовательности (18 аминокислотных остатков) θ-дефензины получили альтернативное название — мини-дефензины. Показано, что у человека экспрессируются мРНК θ-дефензинов, но так как человеческие гены (DEFT) θ-дефензинов содержат в сигнальном регионе гена стоп-кодон, который прерывает трансляцию, соответствующие пептиды в человеческом организме не синтезируются [1].
Молекулы различных классов дефензинов отличаются длиной аминокислотных последовательностей и аранжировкой дисульфидных связей. Аминокислотная последовательность молекул дефензинов характеризуется двумя формулами, характерными для α- и β-дефензинов. Молекулы α-дефензинов характеризуются последовательностью xxCxCxxxxxCxxxxxxxGxCxxxxxxxxxCCxx, где х представляет разные аминокислотные остатки, а C — цистеиновые остатки, которые в данной аминокислотной последовательности связаны в позициях Cys1-Cys6, Cys2-Cys4, Cys3-Cys5; молекулы β-дефензинов — CxxxxxxCxxxxCPxxxxxxxxCxxxxx(х)CCxx, у которой цистеиновые остатки связаны в позициях Cys1-Cys5, Cys2-Cys4, Cys3-Cys6 (рис. 4) [1].
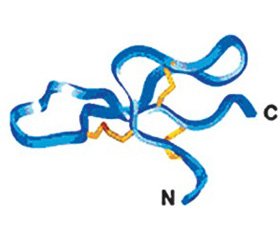
Согласно данным рентгеновской кристаллографии, несмотря на разницу в аминокислотной последовательности, вторичная структура различных дефензинов удивительно похожа. Она представляет антипараллельный β-складчатый лист, который стабилизирован тремя внутримолекулярными ди–сульфидными связями (рис. 5) [2].
В 1980 году α-дефензины впервые были выделены в отдельную структурно-функциональную группу, которая в настоящее время представлена нейтрофильными или миелоидными (human neutrophils peptides — HNP) α-дефензинами (HNP-1, HNP-2, HNP-3, HNP-4) и кишечными α-дефензинами клеток Панета (HD5, HD6). Нейтрофильные α-дефензины участвуют в антибактериальной защите, а α-дефензины, секретируемые клетками Панета, преимущественно управляют жизнедеятельностью микрофлоры кишечника [1].
В 1991 году Gill Diamond и соавт. [11] в ткани языка коровы идентифицировали первый представитель β-дефензинов млекопитающих, который получил название трахеального антимикробного пептида TAP (tracheal antimicrobial peptide). В 1995 году Klaus W. Bensch и соавт. [6] из диализата гемофильтрата выделили первый человеческий β-дефензин (HBD-1), молекула которого состояла из 36 аминокислотных остатков. В настоящее время субкласс β-дефензинов объединяет более 40 пептидов, которые являются ключевыми компонентами системы неспецифической противоинфекционной защиты слизистых оболочек респираторного, пищеварительного, урогенитального трактов и кожных покровов. Наиболее изучены 4 представителя β-дефензинов — HBD-1, HBD-2, HBD-3, HBD-4. Пептидные представители субкласса β-дефензинов отличаются по молекулярному строению и уровню положительного заряда. Так, пептид HBD-1 состоит из 36 аминокислотных остатков и характеризуется уровнем заряда +5, HBD-2 состоит из 41 аминокислотного остатка и поддерживает уровень заряда +7, HBD-3 содержит 45 аминокислотных остатков, поддерживает уровень заряда +11. Представляет интерес, что высокие уровни экспрессии мРНК –HBD-3 регистрируются, как правило, в здоровых тканях макроорганизма [1].
Дефензины, как и LL-37, обладают выраженным иммуномодулирующим действием [66].
β-дефензины
Новые АМП, полученные из C-терминального региона молекулы человеческого бета-1-дефензина (HBD-1), октапептид (RGKAKCCK) и АТСС –НТВ-37 обладают более выраженной бактерицидной активностью и не токсичны по отношению к Caco-клеточной линии человека 2 даже при высоких концентрациях (до 60 мкг/мл) [54].
θ-дефензины
Синтетические θ-дефензины представлены ретроциклинами 1, 2 и 3 (табл. 7) [8, 55].
Ретроциклины 1 и 2 обладают выраженной активностью против ВИЧ-1 [45].
В настоящее время еще не созданы дериваты или аналоги человеческих дефензинов, которые можно было бы использовать в качестве лекарственных средств при лечении инфекционных заболеваний респираторного тракта.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Абатуров А.Е. Дефензины и дефензин-зависимые заболевания / А.Е. Абатуров, О.Н. Герасименко, И.Л. Высочина, Н.Ю. Зав–городняя. — Одесса: Издательство ВМВ, 2011. — 265 с.
2. Будихина А.С., Пинегин Б.В. β-дефензины: свойства и функции // Российский аллергологический журнал. — 2008. — № 3. — С. 15-21.
3. Banaschewski B.J. Antimicrobial and biophysical properties of surfactant supplemented with an antimicrobial peptide for treatment of bacterial pneumonia / B.J. Banaschewski, E.J. Veldhuizen, E. Keating et al. // Antimicrob. Agents Chemother. — 2015. — 59(6). — 3075-83. — doi: 10.1128/AAC.04937-14.
4. Bandurska K. Unique features of human cathelicidin LL-37 / K. Bandurska, A. Berdowska, R. Barczyńska-Felusiak, P. Krupa // Biofactors. — 2015 Sep-Oct. — 41(5). — 289-300. — doi: 10.1002/biof.1225.
5. Barksdale S.M. Cathelicidin antimicrobial peptide from Alligator mississippiensis has antibacterial activity against multi-drug resistant Acinetobacter baumanii and Klebsiella pneumoniae / S.M. Barksdale, E.J. Hrifko, M.L. van Hoek et al. // Dev. & Comp. Immunol. — 2017 May. — 70. — 135-144. — doi: 10.1016/j.dci.2017.01.011.
6. Bensch K.W. hBD-1: a novel beta-defensin from human plasma / K.W. Bensch, M. Raida, H.J. Mägert et al. // FEBS Lett. — 1995 Jul 17. — 368(2). — 331-5. — PMID: 7628632.
7. Brinch K.S. Plectasin shows intracellular activity against Staphylococcus aureus in human THP-1 monocytes and in a mouse peritonitis model // Brinch K.S., Sandberg A., Baudoux P. et al. // Antimicrob. Agents Chemother. — 2009 Nov. — 53(11). — 4801-8. — doi: 10.1128/AAC.00685-09.
8. Conibear A.C., Craik D.J. The chemistry and biology of theta defensins // Angew. Chem. Int. Ed Engl. — 2014 Sep 26. — 53(40). — 10612-23. — doi: 10.1002/anie.201402167.
9. Coorens M. Interspecies cathelicidin comparison reveals divergence in antimicrobial activity, TLR modulation, chemokine induction and regulation of phagocytosis / M. Coorens, M.R. Scheenstra, E.J. Veldhuizen, H.P. Haagsman // Sci. Rep. — 2017 Jan 19. — 7. — 40874. — doi: 10.1038/srep40874.
10. Czaplewski L. Alternatives to antibiotics-a pipeline portfolio review / L. Czaplewski, R. Bax, M. Clokie et al. // Lancet Infect. Dis. — 2016 Feb. — 16(2). — 239-51. — doi: 10.1016/S1473-3099(15)00466-1.
11. Diamond G. Tracheal antimicrobial peptide, a cysteine-rich peptide from mammalian tracheal mucosa: peptide isolation and cloning of a cDNA / G. Diamond, M. Zasloff, H. Eck et al. // Proc. Natl. Acad. Sci USA. — 1991 May 1. — 88(9). — 3952-6. — PMID: 2023943.
12. Dubos R.J. Studies on a bactericidal agent extracted from a soil bacillus: I. Preparation of the agent. Its activity in vitro // J. Exp. Med. — 1939 Jun 30. — 70(1). — 1-10. — PMID: 19870884.
13. Fabisiak A., Murawska N., Fichna J. LL-37: Cathelicidin-related antimicrobial peptide with pleiotropic activity // Pharmacol. Rep. — 2016 Aug. — 68(4). — 802-8. — doi: 10.1016/j.pharep.2016.03.015.
14. Faye I., Lindberg B.G. Towards a paradigm shift in innate immunity-seminal work by Hans G. Boman and co-workers // Philos. Trans. R. Soc. Lond. B. Biol. Sci. — 2016 May 26. — 371(1695). — pii: 20150303. — doi: 10.1098/rstb.2015.0303.
15. Fjell C.D. Designing antimicrobial peptides: form follows function / C.D. Fjell, J.A. Hiss, R.E. Hancock, G. Schneider // Nat. Rev. Drug. Discov. — 2011 Dec 16. — 11(1). — 37-51. — doi: 10.1038/nrd3591.
16. Grönberg A. Treatment with LL-37 is safe and effective in enhancing healing of hard-to-heal venous leg ulcers: a randomized, placebo-controlled clinical trial / Grönberg A., Mahlapuu M., Ståhle M. et al. // Wound Repair Regen. — 2014 Sep-Oct. — 22(5). — 613-21. — doi: 10.1111/wrr.12211.
17. Gupta R. Epidemiology of multidrug-resistant Gram-nega–tive pathogens isolated from ventilator-associated pneumonia in ICU patients / R. Gupta, A. Malik, M. Rizvi et al. // J. Glob. Antimicrob. Resist. — 2017 Apr 10. — 9. — 47-50. — doi: 10.1016/j.jgar.2016.12.016.
18. Haisma E.M. Antimicrobial Peptide P60.4Ac-Containing Creams and Gel for Eradication of Methicillin-Resistant Staphylococcus aureus from Cultured Skin and Airway Epithelial Surfaces / E.M. Haisma, A. Göblyös, B. Ravensbergen et al. // Antimicrob. Agents Chemother. — 2016 Jun 20. — 60(7). — 4063-72. — doi: 10.1128/AAC.03001-15.
19. Haisma E.M. LL-37-derived peptides eradicate multidrug-resistant Staphylococcus aureus from thermally wounded human skin equivalents / E.M. Haisma, A. de Breij, H. Chan et al. // Antimicrob. Agents Chemother. — 2014 Aug. — 58(8). — 4411-9. — doi: 10.1128/AAC.02554-14.
20. Hazlett L., Wu M. Defensins in innate immunity // Cell. Tissue Res. — 2011 Jan. — 343(1). — 175-88. — doi: 10.1007/s00441-010-1022-4.
21. Heimlich D.R., Harrison A., Mason K.M. Host Antimicrobial Peptides in Bacterial Homeostasis and Pathogenesis of Disease // Antibiotics (Basel). — 2014 Dec 1. — 3(4). — 645-76. — doi: 10.3390/antibiotics3040645.
22. Hirsch J.G. Phagocytin: a bactericidal substance from polymorphonuclear leucocytes // J. Exp. Med. — 1956 May 1. — 103(5). — 589-611. — PMID: 13319580.
23. Hou M. Antimicrobial peptide LL-37 and IDR-1 ameliorate MRSA pneumonia in vivo / M. Hou, N. Zhang, J. Yang et al. // Cell. Physiol. Biochem. — 2013. — 32(3). — 614-23. — doi: 10.1159/000354465.
24. Iacob S.A., Iacob D.G. Antibacterial function of the human cathelicidin-18 peptide (LL-37) between theory and practice // Protein Pept. Lett. — 2014. — 21(12). — 1247-56. — doi: 10.2174/0929866521666140805124855.
25. Isaksson J. A synthetic antimicrobial peptidomimetic (LTX 109): stereochemical impact on membrane disruption / Isaksson J., Brandsdal B.O., Engqvist M. et al. // J. Med. Chem. — 2011 Aug 25. — 54(16). — 5786-95. — doi: 10.1021/jm200450h.
26. Jorge P., Lourenço A., Pereira M.O. New trends in peptide-based anti-biofilm strategies: a review of recent achievements and bioinformatic approaches // Biofouling. — 2012. — 28(10). — 1033-61. — doi: 10.1080/08927014.2012.728210.
27. Kang H.K. The therapeutic applications of antimicrobial peptides (AMPs): a patent review / H.K. Kang, C. Kim, C.H. Seo, Y. Park // J. Microbiol. — 2017 Jan. — 55(1). — 1-12. — doi: 10.1007/s12275-017-6452-1.
28. Karaiskos I., Giamarellou H. Multidrug-resistant and extensively drug-resistant Gram-negative pathogens: current and emerging therapeutic approaches // Expert Opin. Pharmacother. — 2014 Jul. — 15(10). — 1351-70. — doi: 10.1517/14656566.2014.914172.
29. Kindrachuk J., Napper S. Structure-activity relationships of multifunctional host defence peptides // Mini Rev. Med. Chem. — 2010 Jun. — 10(7). — 596-614. — doi: 10.2174/138955710791383983.
30. Kosikowska P., Lesner A. Antimicrobial peptides (AMPs) as drug candidates: a patent review (2003-2015) // Expert Opin. Ther. Pat. — 2016 Jun. — 26(6). — 689-702. — doi: 10.1080/13543776.2016.1176149.
31. Lecaille F., Lalmanach G., Andrault P.M. Antimicrobial proteins and peptides in human lung diseases: A friend and foe partnership with host proteases // Biochimie. — 2016 Mar. — 122. — 151-68. — doi: 10.1016/j.biochi.2015.08.014.
32. Li J. Membrane Active Antimicrobial Peptides: Translating Mechanistic Insights to Design / J. Li, J.J. Koh, S. Liu, R. Lakshminarayanan // Front. Neurosci. — 2017 Feb 14. — 11. — 73. — doi: 10.3389/fnins.2017.00073.
33. Liu S. Computational resources and tools for antimicrobial peptides / S. Liu, L. Fan, J. Sun et al. // J. Pept. Sci. — 2017 Jan. — 23(1). — 4-12. — doi: 10.1002/psc.2947.
34. Luo Y. The Naturally Occurring Host Defense Peptide, –LL-37, and Its Truncated Mimetics KE-18 and KR-12 Have Selected Biocidal and Antibiofilm Activities Against Candida albicans, Staphylococcus aureus, and Escherichia coli In vitro / Y. Luo, D.T. McLean, G.J. Linden et al. // Front. Microbiol. — 2017 Mar 31. — 8. — 544. — doi: 10.3389/fmicb.2017.00544.
35. Mackin W.M. Neuprex XOMA Corp // IDrugs. — 1998 Oct. — 1(6). — 715-23. — PMID: 18465627.
36. Mahlapuu M. Antimicrobial Peptides: An Emerging Category of Therapeutic Agents / M. Mahlapuu, J. Håkansson, L. Ringstad, C. Björn // Front. Cell. Infect. Microbiol. — 2016 Dec 27. — 6. — 194. — doi: 10.3389/fcimb.2016.00194.
37. Malanovic N., Lohner K. Antimicrobial Peptides Targeting Gram-Positive Bacteria // Pharmaceuticals (Basel). — 2016 Sep 20. — 9(3). — pii: E59. — doi: 10.3390/ph9030059.
38. Mangoni M.L., McDermott A.M., Zasloff M. Antimicrobial peptides and wound healing: biological and therapeutic conside–rations // Exp. Dermatol. — 2016 Mar. — 25(3). — 167-73. — doi: 10.1111/exd.12929.
39. Morici P. Inhibition of Candida albicans Biofilm Formation by the Synthetic Lactoferricin Derived Peptide hLF1-11 / P. Morici, R. Fais, C. Rizzato et al. // PLoS One. — 2016 Nov 30. — 11(11). — e0167470. — doi: 10.1371/journal.pone.0167470.
40. Morrisey I. The activity of PMX-30063 against staphylococci and streptococci / I. Morrisey, J., Dallow E., Smith A. et al. // 22nd European Congress of Clinical Microbiology and Infectious Diseases (ECCMID). — London, 2012. — 1458.
41. Mylonakis E. Diversity, evolution and medical applications of insect antimicrobial peptides / E. Mylonakis, L. Podsiadlowski, M. Muhammed, A. Vilcinskas // Philos. Trans. R. Soc. Lond. B. Biol. Sci. — 2016 May 26. — 371(1695). — рii: 20150290. — doi: 10.1098/rstb.2015.0290.
42. Niyonsaba F. Multifunctional antimicrobial proteins and peptides: natural activators of immune systems / F. Niyonsaba, I. Nagaoka, H. Ogawa, K. Okumura // Curr. Pharm. Des. — 2009. — 15(21). — 2393-413. — doi: 10.2174/138161209788682271.
43. Ong Z.Y. Strategies employed in the design and optimization of synthetic antimicrobial peptide amphiphiles with enhanced therapeutic potentials / Z.Y. Ong, N. Wiradharma, Y.Y. Yang // Adv. Drug. Deliv. Rev. — 2014 Nov 30. — 78. — 28-45. — doi: 10.1016/j.addr.2014.10.013.
44. Pasupuleti M., Schmidtchen A., Malmsten M. Antimicrobial peptides: key components of the innate immune system // Crit. Rev. Biotechnol. — 2012 Jun. — 32(2). — 143-71. — doi: 10.3109/07388551.2011.594423.
45. Penberthy W.T. Retrocyclins and their activity against –HIV-1 / W.T. Penberthy, S. Chari, A.L. Cole, A.M. Cole // Cell. Mol. Life Sci. — 2011 Jul. — 68(13). — 2231-42. — doi: 10.1007/s00018-011-0715-5.
46. Phoenix D.A. Antimicrobial Peptides / D.A. Phoenix, S.R. Dennison, F. Harris. — Singapore: Wiley-VCH, 2013. — 231 p.
47. Pütsep K., Faye I. Hans G Boman (1924–2008): pioneer in peptide-mediated innate immune defence // Scand. J. Immunol. — 2009 Sep. — 70(3). — 317-9. — doi: 10.1111/j.1365-3083.2009.02293.x.
48. Ruan Y. Antimicrobial peptide LL-37 attenuates LTA induced inflammatory effect in macrophages / Y. Ruan, T. Shen, Y. Wang et al. // Int. Immunopharmacol. — 2013 Mar. — 15(3). — 575-80. — doi: 10.1016/j.intimp.2013.01.012.
49. Sahoo B.R. Mechanistic and structural basis of bioengineered bovine Cathelicidin-5 with optimized therapeutic activity / B.R. Sahoo, K. Maruyama, J.R. Edula et al. // Sci. Rep. — 2017 Mar 21. — 7. — 44781. — doi: 10.1038/srep44781.
50. Sahoo B.R., Fujiwara T. Membrane Mediated Antimicrobial and Antitumor Activity of Cathelicidin 6: Structural Insights from Molecular Dynamics Simulation on Multi-Microsecond Scale // PLoS One. — 2016 Jul 8. — 11(7). — e0158702. — doi: 10.1371/journal.pone.0158702.
51. Selsted M.E. Primary structures of three human neutrophil defensins / M.E. Selsted, S.S. Harwig, T. Ganz et al. // J. Clin. Invest. — 1985 Oct. — 76(4). — 1436-9. — PMID: 4056036.
52. Simonetti O. In vitro activity of the protegrin IB-367 alone and in combination compared with conventional antifungal agents against dermatophytes / O. Simonetti, C. Silvestri, D. Arzeni et al. // Mycoses. — 2014 Apr. — 57(4). — 233-9. — doi: 10.1111/myc.12148.
53. Skarnes R.C., Watson D.W. Characterization of leukin: an antibacterial factor from leucocytes active against gram-positive pathogens // J. Exp. Med. — 1956 Dec 1. — 104(6). — 829-45. — PMID: 13376807.
54. Stange E., Schroeder B., Wehkamp, J. 2015. Antimicrobial peptides. WO2013132005 A1.
55. Strzelecka P. Simplified, serine-rich theta-defensin analogues as antitumour peptides / P. Strzelecka, D. Czaplinska, R. Sadej et al. // Chem. Biol. Drug. Des. — 2016 Dec 22. — doi: 10.1111/cbdd.12927.
56. Teng P. Small Antimicrobial Agents Based on Acylated Reduced Amide Scaffold / P. Teng, D. Huo, A. Nimmagadda et al. // J. Med. Chem. — 2016 Sep 8. — 59(17). — 7877-87. — doi: 10.1021/acs.jmedchem.6b00640.
57. Tonk M., Vilcinskas A. The Medical Potential of Antimicrobial Peptides from Insects // Curr. Top. Med. Chem. — 2017. — 17(5). — 554-575. — doi: 10.2174/1568026616666160713123654.
58. Torres A.M., Kuchel P.W. The beta-defensin-fold family of polypeptides // Toxicon. — 2004 Nov. — 44(6). — 581-8. — PMID: 15501283.
59. Vandamme D. A comprehensive summary of LL-37, the factotum human cathelicidin peptide / D. Vandamme, B. Landuyt, W. Luyten, L. Schoofs // Cell. Immunol. — 2012 Nov. — 280(1). — 22-35. — doi: 10.1016/j.cellimm.2012.11.009.
60. Verjans E.T. Molecular mechanisms of LL-37-induced receptor activation: An overview / E.T. Verjans, S. Zels, W. Luyten, B. Landuyt, L. Schoofs // Peptides. — 2016 Nov. — 85. — 16-26. — doi: 10.1016/j.peptides.2016.09.002.
61. Wiesner J., Vilcinskas A. Antimicrobial peptides: the ancient arm of the human immune system // Virulence. — 2010 Sep-Oct. — 1(5). — 440-64. — doi: 10.4161/viru.1.5.12983.
62. Xhindoli D. The human cathelicidin LL-37-A pore-forming antibacterial peptide and host-cell modulator / D. Xhindoli, S. Pacor, M. Benincasa et al. // Biochim. Biophys. Acta. — 2016 Mar. — 1858(3). — 546-66. — doi: 10.1016/j.bbamem.2015.11.003.
63. Yin C., Wong J.H., Ng T.B. Recent studies on the antimicrobial peptides lactoferricin and lactoferrampin // Curr. Mol. Med. — 2014. — 14(9). — 1139-54. — PMID: 25324002.
64. Zasloff M. Antimicrobial peptides of multicellular orga–nisms // Nature. — 2002 Jan 24. — 415(6870). — 389-95. — doi: 10.1038/415389a.
65. Zeya H.I., Spitznagel J.K. Characterization of cationic protein-bearing granules of polymorphonuclear leukocytes // Lab. Invest. — 1971 Mar. — 24(3). — 229-36. — PMID: 4251552.
66. Zhao L., Lu W. Defensins in innate immunity // Curr. Opin. Hematol. — 2014 Jan. — 21(1). — 37-42. — doi: 10.1097/MOH.0000000000000005.

/103-1.jpg)
/104-1.jpg)
/105-1.jpg)
/106-1.jpg)
/107-1.jpg)
/108-1.jpg)
/109-1.jpg)
/111-1.jpg)
/110-1.jpg)
/110-2.jpg)
/112-1.jpg)