У світі є три речі, які неможливо приховати — любов, бідність і кашель…
Іво Андрич
Кашель у дітей є однією з найбільш частих причин звернення до педіатрів та сімейних лікарів. Кашель супроводжує понад 100 різних захворювань, перш за все респіраторні (інфекційної або алергічної етіології), отит, гастроезофагеальний рефлюкс, пухлини середостіння, вади розвитку бронхів або легенів, сторонній предмет у дихальних шляхах (ДШ), спадкові захворювання (муковісцидоз, дефіцит α-1-антитрипсину), а також може мати психогений характер. У дітей, особливо молодшого віку, кашель супроводжує синдром постназального затікання (PNDS — post nasal drip syndrome), що виникає при риносинуситі і/або аденоїдиті [4, 11, 23].
Кашель є фізіологічним синдромом, направленим на звільнення ДШ від патологічно зміненого бронхіального секрету (мокротиння) або сторонніх предметів. У фізіологічних умовах захисну функцію ДШ забезпечує мукоциліарний кліренс, основними компонентами якого є бронхіальний секрет та ефективна робота високоспеціалізованого миготливого епітелію (рис. 1).
/90-2.jpg )
Бронхіальний секрет утворюється завдяки секреторній функції келихоподібних клітин (клітини Гоблета), бронхіальних залоз, а також епітелію альвеол та термінальних бронхіол. Келихоподібні клітини розташовані в слизовій оболонці (СО) ДШ, і їх співвідношення з війчастими клітинами становить від 1 : 4 до 1 : 7. Війчасті клітини мають на своїй поверхні війки (цилії), що постійно рухаються (12–15 коливань за секунду) та забезпечують евакуацію бронхіального секрету в напрямку до ротової порожнини. Цилії — це органели діаметром 0,1–0,6 мкм та довжиною від 3–15 мкм до 2 мм, що мають складну будову (рис. 2) [6], і їх активність залежить від фізіо–логічних реологічних властивостей бронхіального секрету (нейтральний рН, ізотонічна осмолярність) та достатньої кількості енергії з аденозинтрифосфату (АТФ), який розщеплює фермент динеїн
(Са/Mg-залежна АТФаза).
Бронхіальні залози розташовані в підслизовому шарі СО бронхів і складаються із серозних (продукують рідкий секрет) та слизових (продукують в’язкий секрет) клітин. Важливо, що подразнення СО ДШ призводить до стимуляції як келихоподібних, так і бронхіальних залоз, на той час як вагусна стимуляція підвищує секреторну функцію лише бронхіальних залоз. При цьому надлишкова секреція келихоподібних клітин підвищує в’язкість мокротиння, а бронхіальних залоз — навпаки, зменшує його в’язкість [6].
На сьогодні з’ясовано, що бронхіальний секрет складається з двох фаз — поверхневої щільної, нерозчинної у воді (гель-фаза) та більш рідкої, розчинної у воді й розташованої перициліарно (золь-фаза).
Гель-фаза містить лізоцим, α-1-антитрипсин, сурфактант, ліпіди, імуноглобулін А та муцини — складні білки (глікопротеїни), що мають велику молекулярну масу (тисячі кДа), високий вміст вуглеводів (50–80 % від маси молекули), розгалужені олігосахаридні ланцюжки та О-глікозидний зв’язок з білком. На сьогодні відомо близько двох десятків генів, що відповідають за синтез муцинів у людини (MUC1, MUC2, MUC3A, MUC3B, MUC4, MUC5AC, MUC5B, MUC6, MUC7, MUC8, MUC12, MUC13, MUC15, MUC16, MUC17, MUC19 і MUC20) [6, 25].
Золь-фаза містить міжклітинну рідину, електроліти, ферменти, секрет бронхіальних залоз та келихоподібних клітин. Саме у золь-фазі рухаються війки миготливого епітелію. Їх ефективність залежить від еластичності та в’язкості золю [6], що визначається співвідношенням муцинів і води в ньому.
Велике значення для підтримання нормальних реологічних властивостей бронхіального секрету має фізіологічний рівень рН, осмолярності, сурфактанту й співвідношення гідрофільних (сіаломуцинів) та гідрофобних (фукомуцинів) глікопротеїнів. У здорової людини співвідношення останніх приблизно однакове (1 : 1) [6, 17].
При респіраторній патології на тлі запалення інфекційного чи алергічного генезу змінюється співвідношення глікопротеїнів (зменшується вміст сіаломуцинів і збільшується рівень фукомуцинів), рН, осмолярність, знижується кількість сурфактанту, формуються дисульфідні містки та порушуються фізико-хімічні властивості бронхіального секрету, що призводить до зниження його еластичності, підвищення в’язкості та адгезивності (здатності приклеюватися до СО ДШ). Вказане лежить в основі порушення рухливості війок миготливого епітелію і, як наслідок, дренажної функції бронхів, що створює сприятливий фон для патогенізації власної флори (автофлори) та виникнення бактеріальних ускладнень. У свою чергу, дія бактеріальних ферментів і лізосомальних протеаз викликає пошкодження клітин СО ДШ та посилює зміни еластичності секрету (рис. 3) [3, 6].
/91-1.jpg )
Зміни співвідношення «золь/гель» призводять до формування патологічно зміненого бронхіального секрету (мокротиння), порушення мукоциліарного транспорту, а згодом і мукоциліарного кліренсу та формують передумови для розвитку мукостазу з патогенізацією автофлори (рис. 4).
В таких умовах єдиним фізіологічним механізмом очищення ДШ стає ефективний кашель. Однак цей механізм зберігає свою фізіологічність нетривалий час. У подальшому він набуває патологічних ознак, порушує якість життя дитини та потребує корекції.
Для лікування кашлю в дітей використовують мукоактивні препарати. Класифікація мукоактивних лікарських засобів за їх впливом на бронхіальну секрецію наведена на рис. 5.
Відхаркувальний ефект засобів рефлекторної дії пов’язаний з подразненням слизової СО шлунка, що завдяки вагусній стимуляції приводить до посилення секреції бронхіальних залоз, покращення рухової активності миготливого епітелію та перистальтики бронхіол. У результаті бронхіальний секрет розріджується і прискорюється його виділення.
До мукосекреторних засобів рефлекторної дії належить трава термопсису, корінь алтеї лікарської, кореневище й корінь синюхи, трава фіалки триколірної, терпінгідрат, ефірні олії деяких рослин (плодів анісу, трави чебрецю, материнки звичайної, кореня оману, листя підбілу звичайного).
Калію йодид, амонію хлорид та натрію гідрокарбонат, виділяючись бронхіальними залозами, стимулюють їх секреторну активність, рухову здатність миготливого епітелію. Крім того, натрію гідрокарбонат, олужнюючи мокротиння, полегшує його виділення з ДШ.
Відхаркувальні засоби прямої дії (муколітики) розріджують мокротиння, змінюючи його реологічні властивості. Ферментні муколітики, до яких належать протеолітичні ферменти (трипсин кристалічний, хімотрипсин, дезоксирибонуклеаза), розривають пептидні зв’язки білкових молекул мокротиння.
До неферментних муколітиків прямої дії належать тіолітики — похідні цистеїну з вільною тіоловою групою (ацетилцистеїн). Механізм дії тіолітиків полягає в розриві дисульфідних зв’язків білків мокротиння за рахунок вільної SH-групи, що призводить до зниження в’язкості секрету. Але недоліком цих засобів є ймовірність надмірного розрідження мокротиння з порушенням мукоциліарного кліренсу та виникнення бронхореї.
До секретолітиків непрямої дії належать бромгексин та його активний компонент амброксол. Бромгексин є штучним похідним алкалоїду вазицину — активного екстракту рослини Adhatoda vasica, що має теофіліноподібну дію.
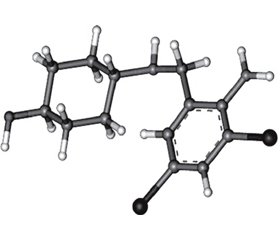
Амброксол є одним із дванадцяти метаболітів бромгексину (метаболіт VIII) — транс-4-(2-аміно-3,5-дибромбензил)амінциклогексанол (рис. 6).
Основними ефектами амброксолу є муколітичний, мукокінетичний та мукорегуляторний. Муколітичний ефект обумовлений розщепленням кислих мукополісахаридів та дезоксирибонуклеїнової кислоти, нормалізацією співвідношення серозного та слизового компонентів бронхіального секрету зі зниженням в’язкості мокротиння за рахунок активації гідролаз та вивільнення лізосом із клітин Клара. Мукокінетичний ефект амброксолу обумовлений посиленням рухової активності війчастого епітелію з підвищенням мукоциліарного кліренсу. Мукорегуляторна дія амброксолу реалізується внаслідок нормалізації співвідношення серозного та слизового компонентів секрету завдяки підвищенню секреції серозних клітин бронхіальних залоз та стимуляції виділення сурфактанту в альвеолах [11, 16, 25].
Крім того, амброксол має протизапальні властивості, що реалізуються шляхом інгібування прозапальних цитокінів (IL-1β, IL-4, IL-6, IL-13, TNF), а також підвищення активності макрофагів [17, 22]. Завдяки блокуванню виділення серотоніну та гістаміну амброксол демонструє протинабрякову та помірну знеболюючу й антиоксидантну дію, що пов’язана з блокуванням вільних радикалів (H2O2, NOS, ROS).
Амброксол також проявляє імуномодулюючий ефект завдяки здатності активізувати макрофаги та підвищувати синтез секреторних IgA та IgG. Важливими ефектами амброксолу також є його противірусні властивості. Відомо, що він знижує реплікацію вірусів грипу, парагрипу, риновірусу шляхом стимуляції синтезу ендогенного сурфактанту та блокування протеаз верхніх і нижніх ДШ [22, 29].
Практично значущою властивістю амброксолу є його здатність підвищувати концентрацію антибіотиків у альвеолах та СО бронхів. Цей ефект реалізується завдяки підвищенню швидкості пасивної дифузії антибіотиків із кровоносних судин у легеневу тканину без зміни їх концентрації в плазмі крові [9, 11].
Також амброксол чинить помірний опосередкований вплив на процеси формування біоплівок патогенів, порушуючи їх структурну цілісність та впливаючи на деякі етапи розвитку — оборотну й необоротну адгезію, колонізацію та дозрівання [7, 21, 24]. Вплив амброксолу на біоплівки реалізується завдяки покращанню мукоциліарного кліренсу, помірним антиоксидантним та протизапальним властивостям, здатності підвищувати концентрацію антибіотиків в СО ДШ (рис. 7).
/93-1.jpg )
До мукорегуляторних муколітиків непрямої дії належить карбоцистеїн, дія якого полягає в стимуляції активності сіалової трансферази, що призводить до підвищення синтезу сіаломуцинів та оптимізації балансу сіало- й фукомуцинів із виникненням нового шару слизу з нормальними реологічними властивостями, у якому рух війок миготливого епітелію покращується й забезпечує нормалізацію мукоциліарного кліренсу та видалення в’язкого секрету. На відміну від муколітиків прямої дії карбоцистеїн не впливає безпосередньо на структуру секрету. Він відновлює рух війчастих клітин СО не тільки бронхів, а й носа, приносових пазух та середнього вуха, що має прикладне значення, оскільки саме ефективне їх очищення є запорукою ефективного лікування риносинуситів та отитів [1, 5].
Муколітичний та мукорегуляторний ефект карбоцистеїну також пов’язаний з підвищенням транспорту іонів Cl в епітеліальних клітинах ДШ, що впливає на вміст води в бронхіальному секреті та відновлює мукоциліарний транспорт, а в подальшому й кліренс [10, 12].
Крім того, карбоцистеїн має помірну протизапальну дію завдяки кінін-інгібуючій дії сіаломуцинів, зменшенню інфільтрації СО ДШ нейтрофільними гранулоцитами та зниженню продукції прозапальних цитокінів (IL-6, IL-8). Він також зменшує ендосомне окислення в епітеліальних клітинах ДШ та забезпечує помірний антиоксидантний ефект. Карбоцистеїн підвищує синтез секреторного IgA, що запобігає патогенізації автофлори й чинить профілактичну дію стосовно рекурентних захворювань ДШ [17, 19].
Важливою особливістю дії карбоцистеїну є блокування адгезії та проникнення вірусів (грипу, парагрипу, риновірусу, респіраторно-синцитіального вірусу) в ендосоми, що реалізується завдяки зниженню експресії молекул міжклітинної адгезії –ICAM-1 [20, 28]. На сьогодні доведено, що карбоцистеїн також блокує адгезію Streptococcus pneumoniae до клітин дихального епітелію внаслідок зменшення активності рецепторів до тромбоцитоактивуючого фактора на поверхні альвеолоцитів [10, 26].
При одночасному призначенні карбоцистеїну з антибактеріальними препаратами спостерігається підвищення ефективності лікування завдяки покращенню проникнення антибіотиків у СО бронхів та альвеол [9, 27].
Перспективним напрямком терапії кашлю є використання комбінованих лікарських засобів, що містять мукоактивні компоненти різнонаправленої дії. До таких препаратів належить Мілістан сироп від кашлю та таблетки від кашлю (XL Laboratories Private Limited для Mili Healthcare Limited, Індія/Великобританія). Мілістан сироп від кашлю містить 15 мг амброксолу гідрохлориду та 100 мг карбоцистеїну в 5 мл, а 1 таблетка — амброксолу гідрохлориду 30 мг і карбоцистеїну 200 мг.
Позитивний ефект при використанні Мілістану сиропу від кашлю отримано при лікуванні дітей із гострими бронхітами порівняно з амброксолом. У результаті дослідження в групі дітей, які отримували комбінований мукоактивний препарат, зменшення кашлю спостерігалось на 2–4 дні раніше, а період в’язкого мокротиння та фізикальних змін у бронхах був менш тривалим [12, 13].
Продемонстровано також високу ефективність Мілістану від кашлю в комплексній терапії дітей з пневмонією зі зниженням тривалості лікування в 1,4 раза, нормалізацією імунологічних показників (зростання кількості зрілих Т-лімфоцитів та імунорегуляторного індексу CD4/CD8 на тлі зниження вмісту прозапальних цитокінів (фактор некрозу пухлини та інтерлейкін-8)) [4, 15, 26].
Комплексна мукоактивна терапія препаратом Мілістан сироп та таблетки від кашлю розширює можливості лікування бронхообструктивного синдрому в дітей, покращуючи евакуацію секрету з ДШ та усуваючи запалення [4, 14].
Завдяки збалансованій комбінації муколітиків непрямої дії Мілістан сироп та таблетки від кашлю забезпечують секретолітичну, секретомоторну та секреторегуляторну дію. Особливості фармакокінетики амброксолу забезпечують реалізацію його впливу протягом доби, на той час як карбоцистеїн починає діяти вже через 2 години з максимальним ефектом у перші 4 години. Отже, Мілістан від кашлю забезпечує не тільки швидку, а й більш тривалу мукоактивну дію [2, 8, 12, 18].
Показаннями до застосування Мілістану сиропу та таблеток від кашлю є гострі та хронічні захворювання ДШ, що супроводжуються утворенням мокротиння, яке важко виділяється, хронічний бронхіт з обструктивним синдромом, пневмонія, бронхіальна астма з важким відходженням мокротиння, бронхоектатична хвороба, респіраторний дистрес-синдром у дітей молодшого віку (для стимуляції синтезу сурфактанту), муковісцидоз, профілактика та лікування ускладнень після оперативних втручань на легенях, догляд за трахеостомою, період до й після бронхоскопії, а також запальні захворювання середнього вуха та придаткових пазух носа.
Препарат застосовується залежно від віку: у дітей 7–12 років — по 5 мл (1 мірна ложечка) 2–3 рази на день; 2–6 років — по 2,5 мл (1/2 мірної ложечки) 2– 3 рази на день; 0–2 роки — по 2,5 мл (1/2 мірної ложечки) 2 рази на день; дорослі та діти віком від 12 років — по 1 таблетці 3 рази на добу.
Мілістан сироп та таблетки від кашлю підвищують ефективність глюкокортикоїдної та антибактеріальної терапії при лікуванні запальних захворювань верхніх і нижніх ДШ. Однак препарат не рекомендується застосовувати одночасно з антибіотиками тетрациклінового ряду (за винятком доксицикліну). Інтервал між їх прийомом повинен становити не менше від 2 годин. Протипоказане одночасне застосування амброксолу та карбоцистеїну з протикашльовими лікарськими препаратами у зв’язку з утрудненням відходження мокротиння при пригніченні кашльового рефлексу та накопиченні секрету в ДШ. Окрім цього, одночасний прийом Мілістану від кашлю та теофіліну підвищує дію останнього.
Отже, використання препарату Мілістан сироп від кашлю та Мілістан таблетки від кашлю підвищує ефективність лікування респіраторних захворювань у дітей завдяки вираженій муколітичній, секретомоторній, мукорегуляторній дії препарату, а також наявності помірного протизапального, антиоксидантного та імунорегуляторного ефектів і підвищенню синтезу й збереження сурфактанту.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Балясинская Г.Л. Опыт применения карбоцистенна в терапии детей раннего возраста с острым обструктивным бронхитом // Пульмонол. детского возраста: проблемы и решения. — 2010. — № 10. — С. 102-104.
2. Батожаргалова Б.Ц., Мельникова И.М., Козлова Л.А., Мизерницкий Ю.Л., Логиневская Я.В. Клиническая эффективность комбинированной мукоактивной отхаркивающей терапии у детей с острыми респираторными инфекциями нижних дыхательных путей // Лечащий врач. — 2011. — № 11. — С. 1-5.
3. Бекетова Г.В., Горячева И.П. Муколитики в педиатрии — новые грани известного // Педиатрия. Восточная Европа. — 2017. — Т. 5, № 4. — С. 83-97.
4. Дука Е.Д. Современные подходы к симптоматической терапии острых заболеваний органов дыхания у детей / Е.Д. Дука, А.А. Ефанова // Новости медицины и фармации. — 2007. — № 4(208). — Режим доступа: http://www.mif-ua.com/ archive/article/32666.
5. Ермакова И.Н. Карбоцистеин (Флюдитек) в комплексной терапии рецидивирующих респираторных инфекций нижних дыхательных путей у детей / И.Н. Ермакова, Ю.Л. Мизерницкий // Земский врач. — 2012. — № 5. — С. 12-16.
6. Ерохин В.В., Романова Л.К. (ред.) Клеточная биология в норме и патологии. — М.: Медицина, 2000. — 79 с.
7. Зыков К.А., Агапова О.Ю., Соколов Е.И. Новые возможности применения амброксола в пульмонологии: влияние на биопленки // Болезни органов дыхания. — 2014. — № 1. —
С. 27-32.
8. Кочуева М.Н. Полимодальность эффектов Милистана в лечении острых респираторных заболеваний // Новини медицини та фармации. — 2017. — № 11(623). — Режим доступа: http://www.mif-ua.com/archive/article/45164
9. Кривопустов С.П. Комбінована мукоактивна терапія у дітей із захворюваннями дихальних шляхів, що супроводжуються утворенням в’язкого секрету // Здоров’я дитини. — 2017. — Т. 12, № 2. — С. 30-31.
10. Марушко Ю.В. Применение карбоцистеина в терапии респираторной патологии у детей // Современная педиатрия. — 2012. — № 4(44). — С. 1-6.
11. Марушко Ю.В., Московенко О.Д. Сухий кашель у дітей: причини, особливості перебігу респіраторних захворювань та лікування // Здоров’я дитини. — 2017. — Т. 12, № 1. — С. 49-54.
12. Майданник В.Г. Эффективность применения препарата «Милистан от кашля» при острых бронхитах у детей // Современная педиатрия. — 2006. — № 3. — С. 55-57.
13. Овчаренко Л.С., Вергегел А.А., Андрієнко Т.Г. та ін. Раціональна мукотропна терапія гострого бронхіту в дітей // Украинская медицинская газета. — 2007. — № 1. — С. 8.
14. Охотникова Е.Н. Бронхообструктивный синдром инфекционного и аллергического генеза у детей: сложности дифференциальной диагностики и выбора муколитической терапии // Современная педиатрия. — 2012. — № 2(42). — С. 76-80.
15. Прохоров Е.В., Островский И.М., Акимочкина Н.А. Опыт использования и оценка эффективности препарата Милистан от кашля при острой бронхопневмонии у детей // Здоров’я дитини. — 2007. — № 4(7). — С. 14-17.
16. Соловьева Н.А., Кулакова Г.А., Курмаева Е.А. Мукоактивная терапия при лечении острых респираторных инфекций у детей // Практическая медицина. — 2013. — № 6(75). —
С. 191-198.
17. Юлиш Е.И. Патогенетические обоснования назначения муколитических средств при респираторных заболеваниях у детей // Здоровье ребенка. — 2015. — № 1(60). — С. 12-15.
18. Юрочко Ф. Клінічне дослідження препарату Мілістан від кашлю при гострих синуситах у дітей // Новости медицины и фармации. — 2007. — № 8. — Режим доступа: http://www.mif-ua.com/archive/article/630.
19. Ясуда Х. Карбоцистеин ингибирует развитие риновирусной инфекции в эпителиальных клетках трахеи человека / Х. Ясуда, M. Ямая, T. Сасаки // Современная педиатрия. — 2010. — № 3(31). — С. 10-17.
20. Asada M. l-carbocisteine inhibits respiratory syncytial virus infection in human tracheal epithelial cells / M. Asada, M. Yoshida, Y. Hatachi // Respiratory Physiology and Neurobiology. — 2012. — Vol. 180(1). — P. 112-118.
21. Cataldi M et al. Biofilm-dependent airway infections: a role for ambroxol? // Pulmonary Pharmacology and Therapeutics. — 2014. — 28(2). — 98-108.
22. Chenot J.F., Weber P., Friede T. Efficacy of Ambroxol lo–zenges for pharyngitis: a meta-analysis // BMC Fam. Pract. — 2014. — 15. — 45.
23. Duncan F. Rogers // Respir. Care. — 2007. — 52(9). — 1193-117.
24. Flemming H.C., Wingender J. The biofilm matrix // Nat. Rev. Microbiol. — 2010. — 8. — 623-33.
25. Seagrave J., Albrecht H.H., Hill D.B., Rogers D.F., Solomon G. Effects of guaifenesin, N-acetylcysteine, and ambroxol on MUC5AC and mucociliary transport in primary differentiated human tracheal-bronchial cells // Respir. Res. — 2012 Oct 31.
26. Sumitomo T., Nakata M., Yamaguchi M. et al. S-carboxymethylcysteine inhibits adherence of Streptococcus pneumoniae to human alveolar epithelial cells // Journal of Medical Microbiology. — 2012. — 61. — 101-108.
27. S-carboxymethylcysteine inhibits adherence of Streptococcus pneumoniae to human alveolar epithelial cells / Sumitomo T., Nakata M., Yamaguchi M. [et al.] // Journal of Medical Microbiology. — 2012. — Vol. 61. — P. 101-108.
28. Yamaya M. Inhibitory effects of carbocisteine on type A seasonal influenza virus infection in human airway epithelial cells / M. Yamaya, H. Nishimura, K. Shinya // Am. J. Physiol. Lung. Cell. Mol. Physiol. — 2010. — Vol. 299(2). — P. 160-168.
29. Yamaya M., Nishimura H., Nadine L.K. et al. Ambroxol inhibits rhinovirus infection in primary cultures of human tracheal epithelial cells // Arch. Pharm. Res. — 2013, Jul. 16.

/90-2.jpg )
/90-1.jpg )
/91-1.jpg )
/92-1.jpg )
/93-1.jpg )