Резюме
Актуальність. Захворювання органів дихання, і в тому числі бронхообструктивний синдром (БОС), є досить частою патологією дитячого віку. Відомо, що частота і тяжкість респіраторних захворювань корелюють із рівнем забезпеченості вітаміном D (VD), дефіцит якого може сприяти розвитку повторних епізодів БОС у дітей раннього віку поряд з іншими факторами ризику, такими як еозинофілія, обтяжений сімейний та індивідуальний алергоанамнез. Мета. Вивчення рівня забезпеченості VD і прогностичних критеріїв розвитку повторних епізодів БОС у дітей раннього віку. Матеріали та методи. Обстежено 120 дітей віком від 6 місяців до 3 років зі встановленим діагнозом «гострий обструктивний бронхіт» (1-ша група — 60 дітей з епізодичним БОС, 2-га група — 60 дітей із повторним БОС). Усім дітям проводили оцінку анамнестичних даних, загальне клінічне обстеження з визначенням ступеня тяжкості БОС за шкалою The Seattle Children’s respiratory scoring tool. Лабораторні дослідження включали визначення концентрації 25-гідроксивітаміну D (25(OH)D) в сироватці крові електрохемілюмінесцентним методом на аналізаторі Cobas e411 (серійний номер 1041-24, виробник Roche Diagnostics GmbH, Німеччина) та сироваткової концентрації загального кальцію (Са) за загальноприйнятою методикою. При аналізі отриманих даних використовували непараметричні статистичні критерії. Різниця між показниками, що порівнювались, вважалась вірогідною при р < 0,05. Результати. У дітей із повторним БОС на відміну від дітей з епізодичним БОС був значно нижчий рівень саплементації VD (р < 0,01). Перебіг БОС у дітей 2-ї групи вірогідно частіше супроводжувався розвитком синдрому дихальної недостатності порівняно з 1-ю групою (p < 0,01). За наявності повторних епізодів БОС в анамнезі захворювання характеризувалось більш тяжким перебігом. Середній показник 25(OH)D в сироватці крові у дітей 1-ї групи становив 33 (28,1; 41,9) нг/мл, 2-ї групи — 13,68 (7,96; 19,51) нг/мл (U = 152,0; p < 0,01). Достатній рівень забезпеченості VD частіше реєструвався у дітей 1-ї групи, тоді як у 2-й групі переважали діти, які мали дефіцит VD. Виявлено зворотну залежність між рівнем VD і частотою БОС. Рівень Са в сироватці крові в обох групах знаходився в межах нормальних величин. Висновки. Розвиток повторних епізодів БОС асоційований із більш низькими показники 25(OH)D у сироватці крові. Тяжкий перебіг БОС частіше зустрічається у дітей із повторними епізодами та на тлі дефіциту VD, який, однак, не супроводжується порушеннями кальцієвого обміну. Адекватний рівень забезпеченості VD найбільшою мірою забезпечується за рахунок достатнього рівня його саплементації, особливо на першому році життя. Таким чином, перебіг та частота епізодів БОС у дітей раннього віку залежать від рівня забезпеченості VD.
Актуальность. Заболевания органов дыхания, и в том числе бронхообструктивный синдром (БОС), являются довольно частой патологией детского возраста. Известно, что частота и тяжесть респираторных заболеваний коррелируют с уровнем обеспеченности витамином D (VD), дефицит которого может способствовать развитию повторных эпизодов БОС у детей раннего возраста наряду с другими факторами риска, такими как эозинофилия, отягощенный семейный и индивидуальный аллергоанамнез. Цель. Изучение уровня обеспеченности VD и прогностических критериев развития повторных эпизодов БОС у детей раннего возраста. Материалы и методы. Обследованы 120 детей в возрасте от 6 месяцев до 3 лет с установленным диагнозом «острый обструктивный бронхит» (1-я группа — 60 детей с эпизодическим БОС, 2-я группа — 60 детей с повторным БОС). Всем детям проводили оценку анамнестических данных, общее клиническое обследование с определением степени тяжести БОС по шкале The Seattle Children’s respiratory scoring tool. Лабораторные исследования включали определение концентрации 25-гидроксивитамина D (25(OH)D) в сыворотке крови электрохемилюминесцентным методом на анализаторе Cobas e411 (серийный номер 1041-24, производитель Roche Diagnostics GmbH, Германия) и сывороточной концентрации общего кальция (Са) по общепринятой методике. При анализе полученных данных использовали непараметрические статистические критерии. Разница между сравниваемыми показателями считалась достоверной при р < 0,05. Результаты. У детей с повторным БОС в отличие от детей с эпизодическим БОС был значительно ниже уровень саплементации VD (р < 0,01). Течение БОС у детей 2-й группы достоверно чаще сопровождалось развитием синдрома дыхательной недостаточности по сравнению с 1-й группой (p < 0,01). При наличии повторных эпизодов БОС в анамнезе заболевание характеризовалось более тяжелым течением. Средний показатель 25(OH)D в сыворотке крови у детей 1-й группы составил 33 (28,1; 41,9) нг/мл, 2-й группы — 13,68 (7,96; 19,51) нг/мл (U = 152,0; p < 0,01). Достаточный уровень обеспеченности VD чаще регистрировался у детей 1-й группы, тогда как во 2-й группе преобладали дети, имевшие дефицит VD. Выявлена обратная зависимость между уровнем VD и частотой БОС. Уровень Са в сыворотке крови в обеих группах находился в пределах нормальных величин. Выводы. Развитие повторных эпизодов БОС ассоциировано с более низкими показателями 25(OH)D в сыворотке крови. Тяжелое течение БОС чаще встречается у детей с повторными эпизодами и на фоне дефицита VD, который, однако, не сопровождается нарушениями кальциевого обмена. Адекватный уровень обеспеченности VD в наибольшей степени обеспечивается за счет достаточного уровня его саплементации, особенно на первом году жизни. Таким образом, течение и частота эпизодов БОС у детей раннего возраста зависят от уровня обеспеченности VD.
Background. Diseases of the respiratory tract, including broncho-obstructive syndrome (BOS), are common pathology in childhood. It is known that the incidence and severity of respiratory diseases correlates with the level of vitamin D (VD), which deficiency may contribute to the development of recurrent episodes of BOS in young children along with other risk factors, such as eosinophilia, family and individual allergy history. Materials and methods. 120 children aged 6 months to 3 years with the diagnosis of acute obstructive bronchitis were examined (I group — 60 children with episodic BOS, group II — 60 children with recurrent BOS). All children were evaluated for anamnesis, general clinical examination with assessment of severity of BOS according to the Seattle Children’s respiratory scoring tool. Laboratory studies included estimation of 25-hydroxyvitamin-D (25(OH)D) concentration in the blood serum using an electrochemiluminescence method on the Cobas e411 analyzer (serial number 1041-24, manufacturer Roche Diagnostics GmbH, Germany) and total calcium concentration in the blood serum according to the generally accepted methodology. Non-parametric statistical criteria were used for the analysis of the obtained data. The difference between compared indicators was considered as statistically significant at a rate of p < 0.05. Results. In children with recurrent BOS, unlike children with episodic one, the level of VD supplementation was significantly lower (p < 0.01). The course of BOS in children of group II was significantly more often associated with the development of respiratory failure syndrome in comparison to group I (p < 0.01). The disease was characterized by a more severe course in the presence of recurrent episodes of BOC in past. The mean serum 25(OH)D level in children of group I was 33 (28.1; 41.9) ng/ml and in group II — 13.68 (7.96; 19.51) ng/ml (U = 152.0; p < 0.01). Sufficient level of VD was more often noted in children of group I, while in the group II, children with VD deficiency prevailed. The inverse relationship between the level of VD and the incidence of BOS was found. The level of calcium in the blood serum in both groups was within the normal range. Conclusions. The development of recurrent episodes of BOS is associated with lower levels of 25(OH)D in the blood serum. The severe course of BOS is more common in children with recurrent episodes on the background of VD deficiency, which, however, is not accompanied by disturbances of calcium metabolism. An adequate level of VD is mostly provided by the sufficient level of its supplementation, especially in the first year of life. Thus, the course and frequency of episodes of BOS in young children depends on level VD.
Вступ
Патологія органів дихання, і в тому числі бронхообструктивний синдром (БОС), у дітей раннього віку є однією з актуальних проблем сучасної педіатрії. Відомо, що гострі респіраторні вірусні інфекції (ГРВІ) є найбільш частою причиною розвитку БОС у цій віковій категорії. Дані епідеміологічних досліджень показують, що частота БОС при ГРВІ на першому році життя становить понад 50 %. До досягнення шкільного віку 40 % дітей переносять хоча б один епізод БОС, із них понад 50 % мають повторні епізоди обструктивного бронхіту, що не супроводжується розвитком у подальшому бронхіальної астми [1, 2]. Згідно з іншими даними, в Європі повторні епізоди БОС реєструються у 15 % дітей раннього віку, а в Латинській Америці — у 25 % [3].
Відомо, що сімейний алергоанамнез, прояви атопії, еозинофілія є факторами ризику повторних епізодів БОС. Разом із цим на сьогодні активно вивчається роль вітаміну D (VD), а також значення його дефіциту у схильності до частих респіраторних захворювань. Згідно з результатами останніх популяційних досліджень, поширеність гіповітамінозу D серед дитячого населення варіює від 29 до 100 % залежно від географічного місцезнаходження, сезонності, етнічної приналежності [4, 5].
Дослідження останніх років демонструють певний зв’язок між споживанням VD та ГРВІ, гострим середнім отитом, фаринготонзилітом, бронхіолітом, пневмонією [6]. Встановлено, що протиінфекційна дія VD забезпечується шляхом активації системи вродженого та адаптивного імунітету [7].
На сьогодні зв’язок між рівнем забезпеченості VD та особливостями перебігу і факторами ризику повторних епізодів БОС у дітей раннього віку вивчений недостатньо.
Метою даного дослідження стало вивчення рівня забезпеченості VD і прогностичних критеріїв розвитку повторних епізодів БОС у дітей раннього віку.
Матеріали та методи
Дослідження проводилося на базі інфекційного відділення дітей раннього віку КЗ «Дніпропетровська дитяча міська клінічна лікарня № 6 ДОР» із січня 2016 по квітень 2017 року. Було обстежено 120 дітей віком від 6 місяців до 3 років зі встановленим діагнозом «гострий обструктивний бронхіт». Пацієнти були розподілені на дві групи. Першу (1-шу) групу становили 60 дітей з епізодичним БОС (менше трьох епізодів за рік протягом попереднього року), другу (2-гу) групу — 60 дітей із повторним БОС (3 і більше епізодів за рік протягом попереднього року).
Критерії включення дітей у дослідження:
— верифікований діагноз «гострий обструктивний бронхіт»;
— вік від 6 місяців до 3 років;
— інформована згода на участь у дослідженні;
— належність до кавказької етнічної групи.
Критеріями виключення були: недоношеність, затримка фізичного розвитку, хронічні захворювання дихальних шляхів (муковісцидоз, бронхолегенева дисплазія, вроджені аномалії), клінічні прояви рахіту, імунодефіцитні стани, попередній прийом системних глюкокортикостероїдів або антиконвульсантів.
Обстеження та лікування хворих проводили згідно з наказом МОЗ України від 13.01.2005 р. № 18 «Про затвердження протоколів надання медичної допомоги дітям за спеціальністю «дитяча пульмонологія»».
Усім дітям проводили оцінку анамнестичних даних, ступеня тяжкості БОС за 12-бальною оцінною шкалою (Respiratory Score), загальне клінічне обстеження та пульсоксиметрію. Як критерій рівня інсоляції використовували час перебування на сонці з 10-ї до 15-ї години мінімальною тривалістю 15 хвилин [8]. Якщо цей показник становив менше 15 діб на місяць, рівень інсоляції вважали низьким, від 15 до 30 діб на місяць — помірним, а показник 30 діб і більше оцінювався як високий рівень інсоляції [9]. Для визначення наявності тахіпное використовували рекомендації Всесвітньої організації охорони здоров’я (2013) шляхом підрахунку частоти дихання за 1 хвилину у спокої.
Для визначення ступеня тяжкості БОС використовували шкалу The Seattle Children’s respiratory scoring tool, яка враховує такі критерії, як:
— частота дихання (1–3 бали);
— ретракція піддатливих місць грудної клітки та роздування крил носа (0–3 бали);
— диспное (0–3 бали);
— wheezing при аускультації (0–3 бали).
Ступінь тяжкості БОС оцінювався як легкий при 1–3 балах, середньотяжкий — 4–7 балах, тяжкий — 8–12 балах [10].
Лабораторні дослідження проводились у лікувально-діагностичному центрі ТОВ «Аптека медичної академії» та включали визначення концентрації 25-гідроксивітаміну D (25(OH)D) в сироватці крові електрохемілюмінесцентним методом на аналізаторі Cobas e411 (серійний номер 1041-24, виробник Roche Diagnostics GmbH, Німеччина) та сироваткової концентрації загального кальцію (Са) за загальноприйнятою методикою. На сьогодні саме 25(OH)D є найкращим показником для оцінки рівня забезпеченості VD, оскільки відображає сумарну кількість вітаміну D, який виробляється в шкірі та отримується з їжею або харчовими добавками [11]. Згідно з рекомендаціями Endocrine Practice Guidelines Committee (Holick M.F., 2011), достатнім рівнем VD вважали показник 25(OH)D в сироватці крові 30 нг/мл, недостатність VD — при рівні 21–29 нг/мл і дефіцит, якщо показник 25(OH)D в сироватці крові був нижчим від 20 нг/мл [12]. Дослідження проводилися в гострий період, переважно на третю добу від початку захворювання.
Статистична обробка отриманих результатів проводилась за допомогою програмного забезпечення Statistica 6.1 (серійний номер AGAR909 E415822FA) та Excel-2010. Перевірка нормальності розподілу кількісних показників здійснювалась за допомогою критерію Шапіро — Уїлка з виправленням Ліллієфорса. Якісні показники наведені у вигляді абсолютних величин та відсотків (%). Оскільки переважна більшість кількісних показників характеризувалась типом розподілу, що відрізняється від нормального, при статистичному аналізі результатів дослідження використовували непараметричні показники: медіана (Ме), нижній і верхній квартилі (Q1 та Q3). Вірогідність відмінностей відносних показників оцінювалась з використанням критерію χ2 Пірсона та для кількісних ознак використовувався критерій Манна — Уїтні (U). Для визначення зв’язку між досліджуваними параметрами розраховували показники рангової кореляції Спірмена. Різниця між показниками, що порівнювалися, вважалась вірогідною при р < 0,05.
Проведення дослідження дозволено комісією з питань біомедичної етики ДЗ «Дніпропетровська медична академія МОЗ України».
Результати
Проведене порівняння досліджуваних груп за віком та гендерними співвідношеннями показало, що вони істотно не відрізнялись між собою. Середній вік пацієнтів 1-ї групи становив 18,16 ± 7,60 міс., 2-ї групи — 22,86 ± 7,75 міс. (р > 0,05). За гендерною ознакою в обох групах переважали хлопчики, їх було приблизно по 70 % від загальної кількості обстежених (р > 0,05).
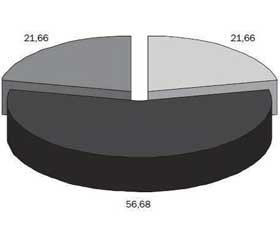
Проведений аналіз частоти виникнення БОС показав, що більшість пацієнтів 2-ї групи (56,6 %) мали 4 епізоди за останні 12 місяців (рис. 1).
Анамнестичні та демографічні показники, що можуть впливати на рівень забезпеченості вітаміном D, наведені в табл. 1.
При вивченні анамнезу життя вірогідної різниці між показниками щодо тривалості грудного вигодовування на першому році життя та щоденних прогулянок на свіжому повітрі серед пацієнтів 1-ї та 2-ї груп за критерієм χ2 Пірсона не виявлено (р > 0,05). Рівень інсоляції в обох групах був низьким, і за цим показником вони суттєво не відрізнялись.
Вітамін D3 у профілактичній дозі 500 МО на першому році життя отримували 80 % пацієнтів 1-ї групи, що практично у два рази вище порівняно з пацієнтами 2-ї групи, в яких даний показник становив 43,3 % (р < 0,01 за критерієм χ2 Пірсона). Встановлено, що на момент дослідження більша частина дітей 1-ї групи (60 %) приймала вітамін D3 на відміну від пацієнтів 2-ї групи, серед яких цей показник був дуже низьким, а саме 5 % (p < 0,01 за критерієм χ2 Пірсона).
Суттєвої різниці між групами щодо частоти виявлення обтяженого алергологічного анамнезу (сімейного та індивідуального) не відзначалось.
При аналізі наявності куріння матері під час вагітності або після пологів серед обстежених пацієнтів відмічено, що у групі дітей з повторним БОС даний показник перевищував такий у дітей з епізодичним БОС (21,7 проти 10 % відповідно), але різниця не виявилась вірогідною (р > 0,05).
Проведений нами аналіз параметрів фізичного розвитку обстежених дітей, зокрема індексу маси тіла (ІМТ), не виявив вірогідних відмінностей між пацієнтами 1-ї та 2-ї груп: середній показник ІМТ знаходився в межах нормальних величин (17,75 ± 2,21 кг/м2 і 17,44 ± 2,39 кг/м2 відповідно, р > 0,05).
Усі пацієнти були обстежені після госпіталізації до стаціонару, зазвичай на другу або третю добу від початку захворювання. Основні клінічні симптоми захворювання та дані об’єктивного обстеження наведені у табл. 2. Початок захворювання в обох досліджуваних групах характеризувався появою сухого або продуктивного кашлю та підвищенням температури тіла, що свідчило про вірусну етіологію БОС. Більше ніж 90 % дітей обох груп мали скарги на кашель. У 52 пацієнтів 1-ї групи (86,6 %) та у 56 пацієнтів 2-ї групи (93,2 %) відзначалися скарги на задишку під час незначного фізичного навантаження або в стані спокою. В перші дні захворювання підвищення температури тіла відмічалось у більшої частини хворих 1-ї та 2-ї груп (76,6 і 68,3 % відповідно, р > 0,05), при цьому фебрильні значення зареєстровані у 50 % дітей 1-ї групи та у 55 % дітей 2-ї групи.
/691-2.jpg)
Під час фізикального обстеження тахіпное виявлено у 83,3 % дітей 1-ї групи та 93,3 % дітей 2-ї групи (p > 0,05), що свідчило про розвиток синдрому дихальної недостатності. У 96,7 % усіх обстежених хворих рівень сатурації кисню крові (SpO2) знаходився в межах 93–100 % та лише у 3,3 % пацієнтів обох груп виявлено SpO2 ≤ 92 %. Подовжений свистячий видих (wheezing) вірогідно частіше спостерігався у пацієнтів із повторними епізодами БОС в анамнезі (65 %) (р < 0,01 за критерієм χ2 Пірсона). Статистично значуща різниця встановлена між досліджуваними групами щодо частоти виникнення ретракції піддатливих місць грудної клітки, яка також у два рази частіше спостерігалась у 2-й групі, ніж у 1-й (46,6 і 20 % відповідно, χ2 = 15,29; p = 0,0007).
У всіх (100 %) обстежених пацієнтів під час аускультації легень були виявленні хрипи, в структурі яких у більшості випадків (60 %) переважали сухі свистячі. На момент обстеження всі пацієнти не мали проявів рахіту.
Отримані дані свідчать, що за наявності повторних епізодів БОС в анамнезі захворювання характеризувалось більш тяжким перебігом (рис. 2), про що також свідчить прямий кореляційний зв’язок слабкої сили між кількістю епізодів БОС і тяжкістю його перебігу (R = 0,20; р < 0,05).
БОС середньотяжкого та тяжкого ступеня відзначався у 60 % дітей 1-ї групи, тоді як серед дітей 2-ї групи — у 88,3 % (χ2 = 4,37; р = 0,036). Слід також зазначити, що тяжкий БОС серед дітей 2-ї групи зустрічався у два рази частіше порівняно з 1-ю групою (23,3 і 10,0 % відповідно, p < 0,05).
За нашими даними, середній показник 25(OH)D в сироватці крові у дітей 1-ї групи становив 33 нг/мл (Me = 33,0; Q1 = 28,1; Q3 = 41,9) та 2-ї групи — 13,68 нг/мл (Me = 13,68; Q1 = 7,96; Q3 = 19,51), тобто різниця між групами була статистично вірогідною за критерієм Манна — Уїтні (U = 152,0; p < 0,01). Достатній рівень забезпеченості VD частіше реєструвався у дітей 1-ї групи, тоді як у 2-й групі переважали діти, які мали дефіцит VD. Дані щодо статусу забезпеченості VD наведені в табл. 3.
/692-2.jpg)
Згідно з табл. 3, недостатній рівень VD майже з однаковою частотою зустрічався в обох досліджуваних групах (р > 0,05), тоді як дефіцит VD частіше мали пацієнти з повторним БОС (75 %) на відміну від дітей з епізодичним БОС, в яких даний показник не перевищував 6,6 % (p < 0,05). Виявлено прямий кореляційний зв’язок середньої сили між частотою прийому VD на момент дослідження хворих і його рівнем у сироватці крові (R = 0,59; р < 0,05). Як згадувалось вище, лише 5 % хворих із повторним БОС приймали профілактичну дозу вітаміну D3 на момент включення, що, ймовірно, може пояснити високий рівень дефіциту саме в цій групі, адже всі обстежені діти не мали інших захворювань, які могли б порушувати метаболізм VD.
Під час дослідження ми виявили, що зниження рівня 25(OH)D у сироватці крові не просто притаманне дітям із повторними епізодами БОС, але й залежить від частоти епізодів, про що свідчить наявність зворотного кореляційного зв’язку слабкої сили між цими показниками (R = –0,27; р < 0,05). Дані відображені на рис. 3.
Дослідження показників мінерального обміну показало, що за показником вмісту Ca в сироватці крові досліджувані групи не відрізнялись. У дітей з епізодичним БОС він становив 2,54 ммоль/л (Me = 2,54; Q1 = 2,45; Q3 = 2,66) та у пацієнтів із повторним БОС — 2,49 ммоль/л (Me = 2,49; Q1 = 2,37; Q3 = 2,65) (р > 0,05), що відповідає межам нормальних величин для даного віку.
Обговорення
Отримані результати дослідження свідчать, що БОС у дітей перших трьох років життя частіше зустрічається у хлопчиків, ніж у дівчаток. У всіх 120 дітей епізоди бронхообструкції були спричинені ГРВІ. Відомо, що практично в кожної другої дитини раннього віку з ГРВІ у клініці присутня бронхіальна обструкція різного ступеня [13].
Останніми роками активно вивчаються позаскелетні ефекти VD, зокрема вплив його дефіциту на частоту, перебіг і тяжкість гострої респіраторної патології у дітей різних вікових груп [14, 15]. Згідно з результатами поодиноких зарубіжних досліджень, які досі залишаються неоднозначними, дефіцит VD у дітей раннього віку з БОС коливається в ме–жах від 12 до 73 % [16, 17]. Така варіабельність рівня гіповітамінозу D пояснюється багатьма факторами, серед яких найбільш значущими є географічне місцезнаходження, сезонність, етнічна приналежність та нутритивний статус. За даними нашого дослідження, дефіцит VD реєструвався у 40,8 % обстежених хворих, недостатність — у 25 % та оптимальний рівень визначався у 34,2 % дітей. Слід зазначити, що у більшої частини пацієнтів (75 %) із повторним БОС показник 25(OH)D у сироватці крові відповідав критеріям дефіциту, в той час як у більшості дітей (66,7 %) з епізодичним БОС рівень VD був достатнім. Недостатність VD зустрічається з однаковою частотою як у дітей з одиничними, так і з повторними епізодами бронхообструкції. Відмінності між дітьми з різною частотою БОС в анамнезі також проявляються у тому, що середня концентрація 25(OH)D в сироватці крові має тенденцію до більш низьких показників при зростанні кількості епізодів, що свідчить про певну роль дефіциту VD у розвитку повторного БОС. Так, Uysalol et al. (2014) продемонстрували, що рівень 25(OH)D в сироватці крові був значно нижчим у дітей віком від 15 до 18 місяців із повторним БОС та позитивним прогностичним індексом розвитку астми (API) порівняно з дітьми, які не мали повторних епізодів БОС і з негативним API [18]. Згідно з іншими даними, низький рівень 25(OH)D у сироватці крові був асоційований із підвищеним ризиком вірусної коінфекції у дітей з БОС [19].
Синтез VD у шкірі під впливом ультрафіолетових променів сонячного світла забезпечує 80–90 % добової потреби у вітаміні D [6, 12]. Однак серед обстежених хворих основним джерелом VD слід розглядати саме профілактичний прийом вітаміну D3, оскільки дослідження проводилось переважно в зимовий період, коли синтез VD під впливом сонячних променів природно знижений, що і пояснює низький рівень інсоляції у всіх пацієнтів. Рівень саплементації VD виявився найбільш значущим фактором ризику його дефіциту, зокрема в зимово-весняний період, адже саме у дітей із повторним БОС, в яких переважав дефіцит VD, рівень саплементаціїї був дуже низьким на відміну від пацієнтів з одним або двома епізодами БОС протягом останнього року. Згідно з результатами нашого дослідження, тривалість грудного вигодовування, щоденних прогулянок на свіжому повітрі, рівень інсоляції, обтяжений сімейний або індивідуальний алергічний анамнез, пасивне куріння не мають суттєвого впливу на рівень забезпеченості VD у дітей з БОС, ці показники не відрізнялися між групами. Проте деякі дослідники вказують на те, що тривале грудне вигодовування та пізнє введення прикорму є предикторами дефіциту VD [17].
Згідно з літературними даними, збільшення кількості осіб з надмірною масою тіла призводить до підвищення поширеності дефіциту VD, що пов’язують з його депонуванням у підшкірно-жировій клітковині та недоступністю для центрального кровотоку [20]. Однак в нашому дослідженні всі обстежені діти мали нормальний ІМТ, що також не пояснювало високий рівень недостатності або дефіциту VD у дітей із повторним БОС. Усі діти не мали клінічних проявів рахіту та порушень кальцієвого обміну, що, ймовірно, свідчить про те, що порушення протиінфекційного імунітету виникають раніше від кальцієвого дисбалансу.
Висновки
1. Для пацієнтів із повторним БОС характерні більш низькі показники 25(OH)D у сироватці крові.
2. На забезпеченість вітаміном D найбільшою мірою впливає рівень його саплементації, особливо на першому році життя.
3. Тяжкий перебіг БОС частіше зустрічається на тлі дефіциту вітаміну D, а саме зменшення його рівня в сироватці крові нижче від 20 нг/мл.
4. Встановлений зворотний кореляційний зв’язок між рівнем вітаміну D у сироватці крові та частотою БОС, тобто при зниженні сироваткової концентрації 25(OH)D кількість епізодів БОС зростає.
5. Недостатність або дефіцит вітаміну D не супроводжується порушеннями кальцієвого обміну у дітей із БОС.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про внесок кожного автора:
Больбот Ю.К. — концепція дослідження.
Бордій Т.А. — дизайн дослідження, написання тексту.
Годяцька К.К. — збір та обробка матеріалів, написання тексту.
Петрик Н.М. — лабораторні дослідження.
Литовченко О.А. — лабораторні дослідження.
Список литературы
1. Yulish EI, Soroka YA, Chernyisheva OE. About risk factors of bronchial obstructive syndrome in children of early age. Zdorov’ye Rebenka. 2012;41(6):85- 88. (In Russian).
2. Oo S, Le Souëf P. The wheezing child: an algorithm. Australian Family Physician. 2015 June;44(6):360-4. PMID: 26209984.
3. Lasso-Pirot A, Delgado-Villalta S, Spanier AJ. Early childhood wheezers: identifying asthma in later life. J Asthma Allergy. 2015;44(8):63-73. doi: 10.2147/JAA.S70066.
4. Al-Shoumer KA, Al-Essa TM. Is there a relationship between vitamin D with insulin resistance and diabetes mellitus? World Journal of Diabetes. 2015;6(8):1057-64. doi: 10.4239/wjd.v6.i8.1057.
5. Shin YH, Shin HJ, Lee YJ. Vitamin D status and childhood health. Korean J Pediatr. 2013;56(10):417-23. doi: 10.3345/kjp.2013.56.10.417.
6. Esposito S, Lelii M. Vitamin D and respiratory tract infections in childhood. BMC Infect Dis. 2015 Oct 28;15:487. doi: 10.1186/s12879-015-1196-1.
7. Cantorna MT, Snyder L, Lin YD, Yang L. Vitamin D and 1,25(OH)2D Regulation of T cells. Nutrients. 2015 Apr;7(4):3011-21. doi: 10.3390/nu7043011.
8. Holick MF. The D-lightful vitamin D for child health. JPEN J Parenter Enteral Nutr. 2012 Jan;36(1 Suppl):9S-19S. doi: 10.1177/0148607111430189.
9. Niruban SJ, Alagiakrishnan K, Beach J, Senthilselvan A. Association of vitamin D with respiratory outcomes in Canadian children. Eur J Clin Nutr. 2014 Dec;68(12):1334-40. doi: 10.1038/ejcn.2014.121.
10. Ralston SL, Lieberthal AS, Meissner HC, et al. Clinical practice guideline: the diagnosis, management, and prevention of bronchiolitis. Pediatrics. 2014 Nov;134(5):e1474-502. doi: 10.1542/peds.2014-2742.
11. Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol. 2014 Mar 20;21(3):319-29. doi: 10.1016/j.chembiol.2013.12.016.
12. Lee JY, So TY, Thackray J. A review on vitamin d deficiency treatment in pediatric patients. J Pediatr Pharmacol Ther. 2013 Oct;18(4):277-91. doi: 10.5863/1551-6776-18.4.277.
13. Bielykh NA, Zalyvna LA. Current approaches to the diagnosis and treatment for bronchial obstruction syndrome of infectious origin in children. Aktual'naya Infektologiya. 2015;1:88-93. (In Ukrainian).
14. de Sa Del Fiol F, Barberato-Filho S, Lopes LC, de Cassia Bergamaschi C. Vitamin D and respiratory infections. J Infect Dev Ctries. 2015 Apr 15;9(4):355-61. doi: 10.3855/jidc.5711.
15. Wranicz J, Szostak-Wegierek D. Нealth outcomes of vitamin D. Part I. Characteristics and classic role. Roczniki Państwowego Zakładu Higieny. 2015;65(3):179-184.
16. El-Asheer OM, Tawfeek MSK, Abd Aziz NH, et al. Serum vitamin D and IgE levels in infants and children under 2 years of age with recurrent chest wheeze. Egypt J Pediatr Allergy Immunol. 2016;14(1):15-21.
17. Prasad S, Rana RK, Sheth R Mauskar AV. A Hospital Based Study to Establish the Correlation between Recurrent Wheeze and Vitamin D Deficiency Among Children of Age Group Less than 3 Years in Indian Scenario. J Clin Diagn Res. 2016 Feb;10(2):18-21. doi: 10.7860/JCDR/2016/17318.7287.
18. Uysalol M, Uysalol EP, Yilmaz Y, et al. Serum level of vitamin D and trace elements in children with recurrent wheezing: a cross-sectional study. BMC Pediatr. 2014 Oct 16;14:270. doi: 10.1186/1471-2431-14-270.
19. Durmaz C, Asilsoy S, Usta Güç B. Serum Vitamin D Levels Among Recurrently Wheezy Infants. Turkiye Klinikleri J Med Sci. 2013;33(6):1337-43. doi: 10.5336/medsci.2012-30610.
20. Pyrżak B, Witkowska-Sędek E, Krajewska M, Demkow U, Kucharska AM. Metabolic and immunological consequences of vitamin D deficiency in obese children. Adv Exp Med Biol. 2015;840:13-9. doi: 10.1007/5584_2014_81.

/690-1.jpg)
/690-2.jpg)
/691-2.jpg)
/691-1.jpg)
/692-2.jpg)
/692-1.jpg)