Вступ
Проблема сучасної діагностики інфекційних ускладнень у постраждалих із політравмою і ефективного контролю за перебігом захворювання в даний час є досить актуальною [1]. У клінічній практиці наявні дві основні проблеми при діагностиці тяжкої інфекції. Першою є проблема диференціації між локальною та генералізованою інфекцією, що супроводжується відповідними системними реакціями. Якщо патофізіологічні ефекти синдрому системної запальної відповіді можливо визначити за наявності клінічних ознак, то тяжкість синдрому й прогноз клінічно оцінити значно важче [5]. Другою проблемою при діагностуванні інфекційних ускладнень у постраждалих із політравмою є диференціація між інфекцією та імунокомпетентними захворюваннями [2]. Діагностика інфекційних ускладнень у постраждалих із політравмою ускладнена ще й тим, що важко визначити, чим викликана інфекція, екзогенним чи ендогенним чинником, та чи присутній імунодефіцитний стан, обумовлений тяжкою травмою чи наявним соматичним станом, що спостерігався в постраждалого до травми. Ще одним фактором, що ускладнює діагностичний процес, є негативна гемокультура та неясна мікробіологічна картина інфекційного ускладнення [2]. Запалення, що виникає після пошкодження тканин у травмованих, супроводжується продукцією цитокінів та білків гострої фази, визначення рівня яких може свідчити про наявність запалення та ступінь його тяжкості. У зв’язку з цим зрозумілий інте–рес дослідників та клініцистів до інтерлейкіну-6 (ІЛ-6), який багато авторів вважають специфічним маркером інфекції.
Інтерлейкін-6 (ІЛ-6) — один із білків міжклітинної взаємодії, що декретується при запаленні. Він є досить потужним активатором гіпоталамо-гіпофізарної системи, а глюкокортикоїди стимулюють його секрецію по шляху негативного зворотного зв’язку [3]. Інтерлейкін-6 відносять до прозапальних цитокінів. Він продукується багатьма клітинами: моноцитами, макрофагами, ендотеліальними клітинами, і це відбувається під дією різних факторів, що включають прозапальні медіатори й ендотоксин [6]. У багатьох дослідженнях виявлений зв’язок між концентрацією ІЛ-6 та септичним процесом, а також летальністю пацієнтів. Однак роль ІЛ-6 у діагностиці інфекційних ускладнень у постраждалих із політравмою, на нашу думку, вивчена недостатньо, що й визначило завдання нашої роботи.
Матеріали та методи
Для вирішення завдань дослідження, пов’язаних із вивченням імунологічної складової діагностики інфекційних ускладнень у постраждалих із політравмою, проведений аналіз лікування постраждалих контрольної групи (116) відповідно до критеріїв Погоджувальної конференції АССР/SССМ 1992 року. Середній вік постраждалих становив 35,0 ± 0,7 року. Для включення в дослідження постраждалі мали тяжку політравму (≥ 20 балів за шкалою Lyndzau в модифікації Можаєва та Малиша). Чоловіків було 79 (68,1 %), жінок — 37 (31,9 %). З огляду на вищевикладене масив контрольної групи було розподілено за клініко-нозологічною ознакою інфекційного ускладнення: SIRS (systemic inflammatory response syndrome — синдром системної запальної відповіді) (n = 28), локальна інфекція (n = 42), сепсис (n = 31), тяжкий сепсис (n = 9), септичний шок (n = 6). Усі постраждалі відповідно до прийнятої в нашій клініці доктрини профілактики інфекційних ускладнень політравми лікувалися за розробленою та впровадженою схемою сучасної антибіотикотерапії в поєднанні з етапним хірургічним лікуванням. Після надходження в клініку всім постраждалим виконувались первинні оперативні втручання, направлені на збереження життя хворих.
Результати та обговорення
Концентрація ІЛ-6, однією з основних функцій якого є регуляція процесів визрівання антитіло-
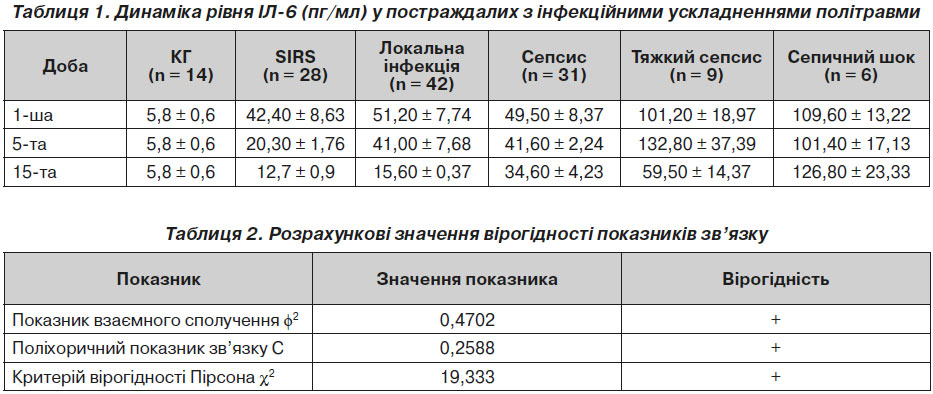
утворючих клітин і продукції імуноглобулінів, є досить показовою, оскільки відбиває активацію синтезу антитіл, що часто страждає в постраждалих із політравмою. У деяких повідомленнях демонструється залежність між підвищеним рівнем ІЛ-6 та результатом захворювання: чим більший рівень ІЛ-6, тим більша вірогідність летального випадку. Серед проспективної групи жоден з постраждалих не помер, тому підтвердити або заперечити дане твердження ми не можемо. Динаміка рівня ІЛ-6 наведена в табл. 1.
Розрахункові показники вірогідності подані в табл. 2.
Аналізуючи дані, наведені в табл. 1, ми дійшли висновку, що в першу добу спостереження в усіх клінічних групах було виявлено значне підвищення рівня ІЛ-6. Навіть в групі SIRS рівень ІЛ-6 був підвищений у 8 разів. Ще більшим цей показник був у групі локальної інфекції. Дещо нижчим виявився рівень ІЛ-6 у постраждалих із генералізованою інфекцією, що можна пояснити початком розвитку сепсису й більш вираженим підключенням протизапальних цитокінів. Однак підвищення рівня ІЛ-6 майже в 9 разів порівняно з нормальним рівнем повинно спонукати до пошуку вогнища інфекції. У групах тяжкого сепсису та септичного шоку підвищення рівня ІЛ-6 було дуже великим, показники перевищували норму у 20 і більше разів.
На 5-ту добу в постраждалих із політравмою та SIRS рівень ІЛ-6 знизився на 52,12 %, однак все одно перевищував норму майже в 4 рази. У групі локальної інфекції рівень ІЛ-6 також знизився, але тільки на 20 %, він у 8 разів перевищував норму. У групі сепсису також відмічалось зниження рівня ІЛ-6, однак лише на 16 %, він також перевищував норму у 8 разів. Серед постраждалих із тяжким сепсисом відмічалось зворотна тенденція: рівень ІЛ-6 порівняно з 1-ю добою зріс на 21,8 %. Така динаміка пояснюється каскадним збільшенням запалення, посиленням виділення групи прозапальних цитокінів, одним з яких є ІЛ-6. У групі септичного шоку спостерігалось зменшення рівня ІЛ-6, однак ми розцінили таку динаміку скоріше як стабілізацію стану постраждалих.
На 15-ту добу в усіх групах, крім групи септичного шоку, відмічалась тенденція до зниження рівня ІЛ-6 у крові постраждалих. Потрібно відмітити, що в групі SIRS його рівень впав на 70 % і був збільшений лише у 2 рази порівняно з нормою. У групі локальної інфекції рівень ІЛ-6 також впав на 70 % і був збільшений у 2,5 раза порівняно з нормою. Серед постраждалих із сепсисом досліджуваний показник також знизився, але лише на 30 %, він був у 6 разів вище від норми. Серед постраждалих із сепсисом рівень ІЛ-6 впав на 43 %, однак був збільшений у 10 разів порівняно з нормою. Лише серед постраждалих із септичним шоком показник ІЛ-6 на 15-ту добу збільшився на майже 9 % і був підвищений порівняно з нормою у 24 рази.
Підсумовуючи все вищенаведене, потрібно вказати, що рівень ІЛ-6 є досить чутливим маркером розвитку інфекційних ускладнень у постраждалих із політравмою. Висока чутливість навіть у найбільш ранні строки розвитку травми дозволяє діагностувати розвиток інфекції тоді, коли явних проявів інфекційних ускладнень ще немає. Навіть початкові явища у вигляді SIRS дають різке підвищення рівня цього прозапального інтерлейкіну. У період розпалу інфекційних ускладнень, що зазвичай збігається з 5–10-ю добою травматичного процесу, рівні ІЛ-6 є піковими, що вказує на досить значну його роль у розвитку септичного запалення. Саме в цей час, коли рівень прозапальних цитокінів є досить високим, а рівень протизапальних цитокінів ще тільки починає підвищуватись, відбувається процес обмеження або генералізації процесу інфекції, і саме опираючись на показники ІЛ-6, можна прогнозувати розвиток інфекційного ускладнення, а також ефективність проведеної терапії.
Безперечно, визначення рівня ІЛ-6 не може бути золотим стандартом у діагностиці інфекційних ускладнень у постраждалих із політравмою, однак у комплексі з іншими маркерами запального процесу, такими як С-реактивний білок, прокальцитонін тощо, є досить цінним діагностичним тестом та може використовуватись у клінічній практиці.
Висновки
1. Рання діагностика інфекційних ускладнень у постраждалих із політравмою є досить актуальною проблемою.
2. Визначення рівня ІЛ-6 у постраждалих із політравмою дозволяє визначати наявність розвитку інфекційних ускладнень без їх клінічних проявів.
3. Рівень ІЛ-6 дозволяє диференціювати розвиток локальної та генералізованої інфекції, що дає можливість призначати лікування та визначати прогноз у постраждалих із політравмою.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Абу Салех Аммар Ибрахим. Роль цитокинов в патогенезе острого периода черепно-мозговой травмы: Автореф. дис… на соискание уч. степени канд. мед. наук: спец. 14.00.13 «Нервные болезни» / Абу Салех Аммар Ибрахим. — М., 2007. — 22 с.
2. Иммунологические маркеры воспаления и сепсиса при сочетанной механической травме / С.Ф. Багненко, Л.П. Пивоварова, М.Е. Малышев [и др.] // Инфекции в хирургии. — 2012. — № 1. — С. 22-27.
3. Кетлинский С.А. Цитокины / С.А. Кетлинский, А.С. Симбирцев. — СПб.: Фолиант, 2008. — 549 с.
4. Donelly T.G. Cytokine, complement and endotoxine profiles associated with the development of the adult respiratory syndrome after severe injury / T.G. Donelly, P. Meade, M. Jag-les // Crit. Care Med. — 2004. — Vol. 22. — P. 768-776.
5. Immunomodulation in polytrauma and polymicrobial sepsis — where do we stand? / C. Neunaber, C. Zeckey, H. Andruszkow et al. // Recent Pat Inflamm Allergy Drug Discov. — 2011. — Vol. 5, № 1. — P.17-25.
6. Menges P. Surgical trauma and postoperative immune dysfunction / P. Menges, W. Kessler, C. Kloecker // Eur. Surg. Res. — 2012. — 48(4). — 180-6.
7. Mira J.-P. Sepsis. Mechanismes immunitaires / J.-P. Mira, B. Vallet. — Paris, 2004. — P. 334.