Боль является неотъемлемой спутницей остеоартрита (ОА). Она отрицательно влияет на качество жизни, приводит к снижению или потере трудоспособности, связана со значительными затратами для системы здравоохранения [9]. Боль — первый симптом, побуждающий пациента обратиться к врачу. Важно подчеркнуть, что боль — не только неприятный для пациента симптом и клинический ориентир для оценки эффективности лечения, но и фактор, в значительной мере определяющий отдаленные результаты патологического процесса [20]. Болевой синдром при ОА характеризуется гетерогенностью и мультимодальностью, поскольку источником болевых ощущений могут быть различные околосуставные структуры — субхондральная кость, синовиальная оболочка, сухожилия, связки, мышцы, а также сочетанием боли механического, воспалительного и нейропатического характера, что вызывает упорное хроническое ее течение [7]. Боль приводит к формированию порочного круга, так как способствует появлению мышечного спазма, обострения ощущения боли, что, в свою очередь, усиливает мышечное сокращение. С другой стороны, боль обусловливает снижение двигательной активности, способствует обездвиженности пациента, мышечной слабости, в дальнейшем приводит к атрофии мышц. Третья составляющая этого порочного круга — депрессия, возникающая и прогрессирующая вследствие снижения социальной и личной активности пациентов.
Выраженность болевого синдрома при ОА зависит: от рентгенологической стадии, пола (у женщин болевые ощущения, как правило, выражены более сильно), возраста, локализации (боль более выражена при поражении суставов нижних конечностей — тазобедренных и коленных), психологических факторов (депрессия, тревога) [17]. Структурные изменения суставов не всегда ассоциируются с болью. Это подтверждается исследованиями, в которых проводилось сравнение рентгенологических и клинических проявлений при ОА. В то же время достоверно установлено, что боль является одним из факторов риска и прогрессирования ОА [7, 14].
Поэтому купирование боли — важнейший компонент комплексной терапии ОА. Признание значительной роли воспаления в развитии и прогрессировании ОА постулирует необходимость активного применения противовоспалительных препаратов (НПВП) как основного метода патогенетического воздействия [3], значение которых в купировании болевого синдрома при ОА трудно переоценить [5].
В последние годы прослеживается четкая тенденция рассматривать НПВП как достаточно эффективное, но весьма небезопасное симптоматическое обез-боливающее средство. Такая позиция определялась в первую очередь опасениями развития гастроинтестинальных и кардиоваскулярных осложнений. Ведь большинство пациентов с ОА — это люди пожилого возраста с весомой коморбидной патологией. Поэтому использование НПВП при ОА базировалось на принципе «минимальные дозы в течение минимального периода времени». Предлагался прием НПВП по требованию, но только в периоды усиления болевого синдрома. А в качестве анальгетического препарата первой линии многочисленными рекомендациями предлагалось назначение парацетамола.
В новой редакции (2016) рекомендаций по лечению ОА коленных суставов, разработанных группой ведущих международных экспертов ESCEO (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis), изменены подходы к назначению НПВП. Так, второй шаг алгоритма терапии ОА при неэффективности медленно действующих симптоммодифицирующих средств (SYSADOAs), парацетамола и средств локальной терапии предполагает назначение НПВП, причем не короткими курсами, а прерывисто или постоянно длительными циклами (Intermittent or continuous (longercycles) oral NSAID) [16].
Это ключевое положение, которое указывает на осознание роли НПВП в качестве принципиально важного средства для фармакотерапии ОА [5], подчеркивается в недавнем обзоре J.P. Pelletier с соавт. (2016) [25], посвященном использованию НПВП, где идет речь о том, что НПВП являются краеугольным камнем в лечении ОА.
Во многих рекомендациях при незначительно выраженном болевом синдроме как препарат первой линии рассматривают парацетамол (ацетаминофен) в дозе до 3 г/сут, несмотря на минимальное влияние на симптомы (ES < 0,2), впрочем, основываясь на приемлемой безопасности и доступной цене. Однако последние исследования пошатнули позиции парацетамола как эффективного обезболивающего средства при ОА [12]: возникли сомнения в его долгосрочной эффективности. В то же время накоплены данные по возрастанию гастроинтестинального риска и повышению активности печеночных ферментов при использовании парацетамола. Доказано, что пероральные неселективные или ЦОГ (циклооксигеназа)-2-селективные НПВП обеспечивают более выраженное и стойкое облегчение болевых симптомов, чем парацетамол [31], при этом выраженность эффекта по отношению к боли составляет 0,29 (0,22–0,35) [15], что в 2 раза выше влияния парацетамола [31]. Одновременно сами пациенты отдают большее предпочтение применению НПВП по сравнению с парацетамолом.
Еще одним доказательством преимуществ НПВП стала работа S.R. Smith и соавт. [29], которые сопоставили эффективность НПВП, трамадола и более сильных опиоидных анальгетиков (гидроксиморфон, оксикодон) при ОА. Метаанализ 17 рандомизированных контролируемых исследований продемонстрировал, что НПВП нисколько не уступали опиоидам по обезболивающему действию: среднее снижение интенсивности боли по визуально-аналоговой шкале 100 мм составило 18, 18 и 19 мм соответственно.
Выбор лекарственного средства среди доступных НПВП диктуется прежде всего профилем безопасности с учетом различных факторов риска, сопутствующих заболеваний пациента и медицинских условий. С этой точки зрения возникает вопрос индивидуальной оценки риска развития побочных эффектов у пациентов, которым назначаются НПВП, а также выбора препарата с наименьшим индексом кардио-, гастро- и нефротоксичности. Широкий спектр представителей этой лекарственной группы на фармакологическом рынке позволяет практикующему врачу принять правильное решение.
Лорноксикам отличается выраженным анальгезирующим и противовоспалительным эффектами, что позволило препарату занять центральное место в лечении болевых синдромов при различных нозологических формах, патологических состояниях, а также в лечении послеоперационной боли [1, 5]. По обезболивающей активности 8 мг лорноксикама (Ксефокам) можно сравнить с 40 мг кеторолака, 100 мг трамадола и 20 мг морфина [23, 28, 30]. При этом он не имеет опиатоподобного действия на центральную нервную систему и не вызывает лекарственную зависимость [11]. Эти свойства препарата связаны с уникальным механизмом действия: кроме ингибирования синтеза простагландинов за счет угнетения ЦОГ, лорноксикам тормозит высвобождение свободных радикалов кислорода из активированных лейкоцитов, что усиливает его противовоспалительную и анальгезирующую активность [14]. Существуют убедительные доказательства того, что лорноксикам ингибирует цитокининдуцибельную синтетазу оксида азота, при этом уровень ингибирования является дозозависимым. В то же время пироксикам, диклофенак, ибупрофен, кеторолак и напроксен в значительно меньшей степени влияют на образование NO-соединений. Кроме того, на стимулированных моноцитарных клетках лорноксикам демонстрирует сильное угнетение образования интерлейкина (ИЛ)-6 и умеренное — фактора некроза опухоли α, ИЛ-1β и -8, что обусловливает более сильную анальгезию при его применении в сравнении с некоторыми другими НПВП [1, 15]. Лорноксикам также активно стимулирует выработку эндогенного динорфина и эндорфина, что является дополнительным физиологическим механизмом купирования болевых синдромов любой интенсивности и локализации [22]. В то же время в отличие от некоторых НПВП лорноксикам не угнетает активность 5-липоксигеназы и, таким образом, не подавляет синтез лейкотриенов, шунтируя метаболизм арахидоновой кислоты на 5-липоксигеназный путь [4]. Исследования in vitro демонстрируют лучший показатель сбалансированной ингибиции изоферментов ЦОГ у лорноксикама [26], что, без-условно, отображается на приемлемом профиле безопасности препарата.
Эффективность лорноксикама изучена во многих клинических испытаниях у пациентов с хронической болью различного генеза [22, 27]. Главным образом речь идет о применении этого препарата у пациентов с ОА, ревматоидным артритом при необходимости проведения послеоперационной анальгезии. В клинических испытаниях лорноксикам продемонстрировал высокую эффективность по сравнению как с плацебо, так и с другими препаратами.
В одной из работ сравнивалась долговременная эффективность лорноксикама с таковой признанного эталонного препарата в лечении ОА — диклофенака [21]. В исследовании приняли участие 135 больных ОА, курс лечения составил 12 нед. Пациентов распределили на группы с применением лорноксикама в дозе 4 мг 3 раза в сутки или 8 мг 2 раза в сутки либо диклофенака в дозе 50 мг 3 раза в сутки. Отмечено улучшение функционального индекса у пациентов всех групп в среднем на 1,5–1,9 пункта. Доля улучшения в отношении активности заболевания составила около 46 %, интенсивности боли — 42–48 % без существенной межгрупповой разницы. Дальнейшая терапия лорноксикамом на протяжении последующих 40 нед. также была успешной. Небольшое повышение функционального индекса (0,3–1,1 пункта) расценено как следствие отображения естественного прогрессирования заболевания, а не недостаточной эффективности терапии. Таким образом, лорноксикам 4 мг трижды в сутки и 8 мг дважды в сутки был столь же эффективен, как и диклофенак 50 мг 3 раза в сутки, для лечения ОА. Не было существенной разницы в переносимости этих схем. Таким образом, лорноксикам представляет собой полезную терапевтическую альтернативу диклофенаку у пациентов с болевым синдромом на фоне ОА.
Еще одно 12-недельное исследование продемонстрировало обезболивающие и противовоспалительные преимущества лорноксикама по сравнению с рофекоксибом у 2520 пациентов с ОA [27]. Оценивали интенсивность боли во время движения, в покое и в течение ночи, а также утреннюю скованность в пораженном суставе. Результаты показали статистически более значимое улучшение по каждому пункту в группе лорноксикама в сравнении с рофекоксибом. В группе лорноксикама интенсивность боли при ходьбе и в покое снизилась на 55,8 %, ночью — на 59,9 %, в то время как при применении рофекоксиба эти изменения составили 45,3; 42,0 и 42,5 % соответственно. Кроме того, количество пациентов, прекративших терапию в связи с недостаточной эффективностью при приеме рофекоксиба в сравнении с лорноксикамом, было почти в 3 раза больше (8,9 и 3,4 % соответственно). На протяжении экспериментального периода не выявлено ни одного случая возникновения серьезных побочных эффектов. Если говорить о незначительных побочных эффектах, процентное соотношение случаев их возникновения в группах лорноксикама и рофекоксиба составило 5,4 и 12,0 % от общего числа пациентов соответственно.
Традиционно считается, что прием неселективных НПВП ассоциируется с большим риском желудочно-кишечных осложнений, а применение селективных ЦОГ-2-ингибиторов — с повышенным риском сердечно-сосудистых событий [19]. Обсервационные исследования и метаанализы показали, что применение НПВП, особенно при назначении в больших дозах в течение длительного времени, потенциально может увеличить риск сердечно-сосудистых катастроф. Повышенный риск тромбоза, связанный с использованием НПВП, обусловлен главным образом их селективностью к ЦОГ-2 [18]. Вопрос гастробезопасности является ключевой проблемой при применении неселективных НПВП, прием которых устойчиво ассоциируется с развитием НПВП-гастропатии, повышенным риском кровотечений и перфораций желудочно-кишечного тракта.
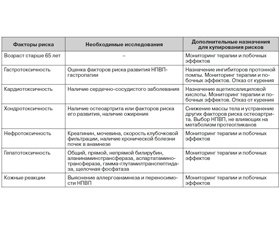
На сегодняшний день вопросы анальгетического потенциала НПВП уступают вопросам их клинической безопасности [2]. Поэтому проблема контроля безопасности должна считаться кардинальным аспектом рационального применения НПВП. В связи с этим принципиально важен правильный выбор препарата с учетом возможного риска и наличия коморбидной патологии. Несмотря на базовый сердечно-сосудистый и желудочно-кишечный риск каждого пациента, рекомендуется стратификация возможных рисков и нежелательных эффектов НПВП, а также мониторинг пациентов для оценки повышения артериального давления (АД), развития отеков, ухудшения функции почек или желудочно-кишечного кровотечения при длительном лечении НПВП [8]. В табл. 1 представлена модель стратификации нежелательных побочных эффектов при длительном применении НПВП.

Стратификация рисков заболеваний, предупреждение клинических дебютов и особые требования к стратегическому планированию лекарственной терапии становятся основными в сфере рутинной медицинской практики [2, 9].
Гастроинтестинальная безопасность лорноксикама продемонстрирована в большом сравнительном исследовании, результаты которого опубликованы в 2016 году [24]. Были объединены и проанализированы данные 60 клинических исследований лорноксикама: 34 исследования по облегчению легкой и средней интенсивности боли и 26 — по симптоматическому лечению ревматической боли. В общей сложности 6420 пациентов получали лорноксикам, 1192 — плацебо и 3770 — НПВП сравнения. Нежелательные побочные эффекты были зарегистрированы у 21 % пациентов, получавших лечение лорноксикамом (против 14 % с плацебо и 24 % с другими НПВП), причем наиболее часто отмечались случаи гастроинтестинальной токсичности (14 % против 8 % с плацебо). Тошнота (4,7 %), боли в животе (3,7 %), диспепсия (3,6 %), диарея (1,9 %) и рвота (1,4 %) были наиболее распространенными побочными реакциями. Однако в 15 исследованиях, сравнивающих лорноксикам (n = 1287) с другими НПВП (n = 1010), риск развития нежелательных гастроинтестинальных побочных эффектов был на 22 % ниже именно при приеме лорноксикама (0,78 (95% ДИ 0,64–0,96), p = 0,017). Частота развития нежелательных эффектов была достоверно связана с длительностью приема препарата и более высокой дозой. Интересно, что у женщин отмечался более высокий риск развития гастротоксичности — на 27 % выше, чем у мужчин; однако у пациентов пожилого возраста (≥ 65 лет) повышение риска гастроинтестинальных событий не отмечено. Перфорация, язва и кровотечение наблюдались у 30 пациентов, получавших лорноксикам (0,5 %), что соответствует частоте развития событий 2,7 %/год, тогда как у больных, принимавших НПВП сравнения, эта частота достигала 3,3 % [24].
Проблема кардиоваскулярной безопасности НПВП у больных с ревматическими заболеваниями, в частности с ОА, является сложной и неоднозначной [9]. Конечно, эти препараты могут вызывать нежелательные эффекты со стороны сердечно-сосудистой системы, в том числе повышая вероятность развития опасных тромботических осложнений. Однако боль и воспаление как основные проявления ревматической патологии уже сами по себе являются серьезным фактором риска прогрессирования сердечно-сосудистых заболеваний. Поэтому регулярный прием НПВП, позволяющий существенно уменьшить выраженность болевых ощущений и интенсивность системной воспалительной реакции, может оказывать парадоксальное влияние на развитие кардиоваскулярных осложнений, не только не повышая, но даже снижая их частоту [5].
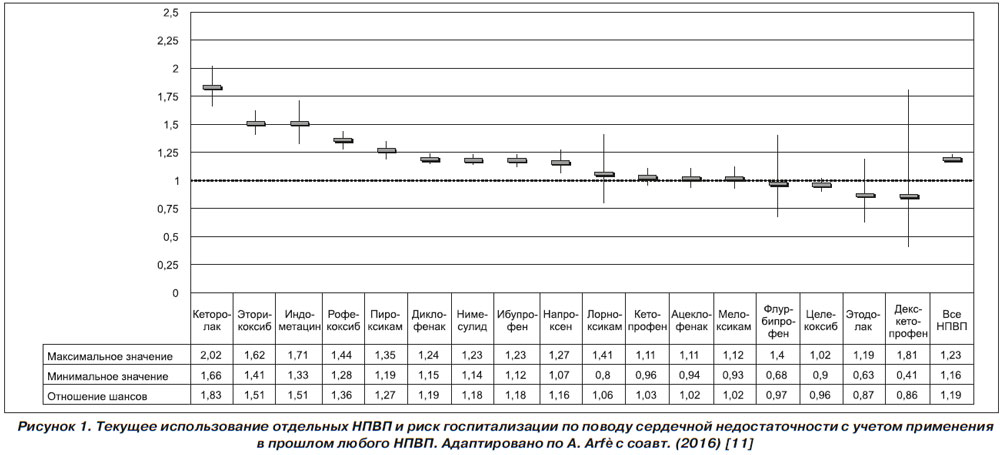
В прошлом году было опубликовано масштабное исследование по изучению кардиоваскулярной безо-пасности НПВП. В ретроспективном исследовании A. Arfe и соавт. [11] проанализирована взаимосвязь приема НПВП с повышением риска госпитализации по поводу сердечной недостаточности (СН) на основании данных пациентов, которые принимали НПВП с 2000 по 2010 г. в Нидерландах, Германии, Великобритании и Италии. Всего было идентифицировано 92 163 больных, госпитализированных по поводу СН. Соответствующий по полу и возрасту контроль составили 8 246 403 лица без СН. В среднем прием НПВП ассоциировался с 19% увеличением риска госпитализации по поводу СН: относительный риск (ОР) составил 1,19 (95% ДИ 1,17–1,22). Из 27 НПВП риск госпитализации повышался при приеме 7 традиционных (неселективных) НПВП (диклофенак, ибупрофен, индометацин, кеторолак, напроксен, нимесулид и пироксикам) и 2 ЦОГ-2-селективных ингибиторов (эторикоксиб и рофекоксиб). Наибольший риск был установлен для кеторолака (ОР 1,83; 95% ДИ 1,66–2,02), эторикоксиба (ОР 1,51; 95% ДИ 1,41–1,62) и индометацина (ОР 1,51; 95% ДИ 1,33–1,71). Важно отметить, что риск госпитализации по поводу СН при использовании в высоких дозах удваивался для некоторых НПВП (диклофенак, эторикоксиб, индометацин, пироксикам и рофекоксиб). Интересно отметить, что в данной работе был проведен анализ риска СН при приеме лорноксикама, кардиоваскулярная безопасность которого относительно редко оценивается в крупных эпидемиологических исследованиях; по результатам данного анализа риск госпитализаций по поводу СН при использовании лорноксикама не увеличивался (ОР 1,06; 95% ДИ 0,80–1,41). Результаты исследования схематически представлены на рис. 1.
Достаточно благоприятный профиль безопасности лорноксикама при длительном применении (12 мес.) был продемонстрирован еще в одном сравнительном исследовании у пациентов с ОА [2]. В исследование специально были включены больные (87 чел.) хроническими сердечно-сосудистыми заболеваниями (различные формы ишемической болезни сердца, артериальная гипертония или их сочетание) и хроническим болевым синдромом на фоне ОА. Пациенты были разделены на 2 группы, одна из которых получала лорноксикам в дозе 32 г/сут [согласно инструкции по медицинскому применению препарата Ксефокам, зарегистрированного в Украине, максимальная суточная доза препарата составляет 16 мг. — Прим. ред.], другая — диклофенак 100 мг/сут.
Было установлено, что применение лорноксикама сокращало число и длительность рецидивов хронического болевого синдрома при ОА у пациентов с кардиоваскулярными заболеваниями в течение 12 мес., оказывало более выраженное анальгетическое действие в сравнении с диклофенаком натрия. Явления диспепсии также были менее выражены в группе лорноксикама. В течение 12 мес. у пациентов, принимавших лорноксикам, частота развития НПВП-гастропатии была в два раза ниже по сравнению с пациентами, получавшими диклофенак натрия. Между исходным уровнем АД и АД через 12 мес. у пациентов, принимавших лорноксикам, значимая динамика отсутствует, тогда как у пациентов, получавших диклофенак натрия, отмечено увеличение систолического АД на 16,8 мм рт.ст., диастолического АД — на 9,6 мм рт.ст. (р < 0,05), а также увеличение толщины задней стенки левого желудочка. Отеки и пастозность голеней чаще отмечались у пациентов, принимавших диклофенак натрия. При применении лорноксикама в течение 12 мес. у пациентов не изменилась толщина хряща в коленном суставе (МРТ-контроль), тогда как при использовании диклофенака натрия отмечено недостоверное ее уменьшение на всех поверхностях коленного сустава [2].
Таким образом, анализ исследований лорноксикама позволяет выявить ряд дополнительных преимуществ этой молекулы НПВП для назначения при ОА: возможность длительного применения при относительно низком риске побочных эффектов со стороны желудочно-кишечного тракта и сердечно-сосудистой системы. Так, отмечены низкий процент эрозивно-язвенных поражений слизистой оболочки верхних отделов желудочно-кишечного тракта в спектре гастроэнтерологических побочных эффектов в сравнении с другими НПВП, отсутствие значимого влияния на АД, негативного влияния на течение сопутствующей ишемической болезни сердца, частоту госпитализации по поводу СН, а также на суставной хрящ. Низкое количество побочных эффектов лорноксикама даже при длительном применении (12 мес.), возможно, обусловлено его сбалансированным ингибированием ЦОГ-1 и ЦОГ-2, поэтому существуют предположения, что баланс простагландинов, продуцируемых обеими изоформами фермента, не будет нарушен.
Анализируя современные литературные данные, можно сказать, что лорноксикам сочетает оптимальный профиль безопасности с выраженным анальгетическим и противовоспалительным потенциалом и при этом может применяться длительно, что позволяет рассматривать его в качестве препарата выбора для лечения ОА. Благоприятный профиль безопасности лорноксикама (Ксефокам) является следствием того, что препарат представляет собой сбалансированный ингибитор ЦОГ-1/ЦОГ-2 и обладает относительно коротким периодом полувыведения по сравнению с другими НПВП.
Конфликт интересов. Не заявлен.
UA/XEF/0817/0054
При содействии ООО «Такеда Украина»
Список литературы
1. Безшейко В.Г. Новые подходы к терапии при болевом синдроме: лорноксикам с позиций доказательной медицины // Укр. мед. часопис. — 2013. — 1(93). — С. 81-84.
2. Верткин А.Л., Наумов А.В., Семенов П.А., Шарина Н.П., Шамуилова М.М. Оценка безопасности применения лорноксикама и диклофенака натрия в общемедицинской практике // Клиническая геронтология. — 2009. — 15(2). — С. 21-26.
3. Головач И.Ю. Остеоартрит: современные фундаментальные и прикладные аспекты патогенеза заболевания // Боль. Суставы. Позвоночник. — 2014. — 3(15). — С. 54-58.
4. Головач І.Ю. Ефективність і безпечність лорноксикаму (Ксефокаму) у лікуванні ревматичних захворювань суглобів // Травма. — 2013. — 14(2). — С. 90-94.
5. Каратеев А.Е. Что нового? Обзор международных публикаций за 2016 г., посвященных проблемам эффективности и безопасности нестероидных противовоспалительных препаратов // Современная ревматология. — 2017. — 11(1). — С. 38-45. — doi: 10.14412/1996-7012-2017-1-38-45.
6. Кашеварова Н.Г., Зайцева Е.М., Смирнов А.В., Алексеева Л.И. Боль как один из факторов риска прогрессирования остеоартроза коленных суставов // Научно-практическая ревматология. — 2013. — (51)4. — С. 387-390. — doi: 10.14412/1995-4484- 2013-1249.
7. Коваленко В.Н., Борткевич О.П. Остеоартроз і біль: стан проблеми // Боль. Суставы. Позвоночник. — 2011. — 1. — С. 10-14.
8. Наумов А.В., Верткин А.Л., Шамуилова М.М., Семенов П.А., Мендель О.И., Шарина Н.П. Стратификация риска и стратегические решения фармакотерапии остеоартроза в терапевтической практике // Справочник поликлинического врача. — 2009. — 5. — С. 38-45.
9. Яременко О.Б., Микитенко А.М. Мультимодальный подход к лечению болевого синдрома при остеоартрозе // Укр. мед. часопис. — 2016. — 4(114). — С. 38-44.
10. Инструкция по медицинскому применению препарата Ксефокам.
11. Arfè A., Scotti L., Varas-Lorenzo C. et al. Non-steroidal anti-inflammatory drugs and risk of heart failure in four European countries: nested case-control study // BMJ. — 2016. — 354. — i4857. — doi: 10.1136/bmj.i4857.
12. Bannuru R.R., Schmid Ch.H., Kent D.M. et al. Comparative Effectiveness of Pharmacologic Interventions for Knee Osteoarthritis: A Systematic Review and Network Meta-analysis // Ann. Intern. Med. — 2015. — 162(1). — Р. 46-54. — doi: 10.7326/M14-1231.
13. Bastick A.N., Runhaar J., Belo J.N., Bierma-Zeinstra S.M. Prognostic factors for progression of clinical osteoarthritis of the knee: a systematic review of observational studies // Arhritis Res. Ther. — 2015. — 17. — Р. 152-162. — doi: 10.1186/s13075-015-0670-x.
14. Berg J., Fellier H., Christoph T., Grarup J., Stimme-der D. The analgesic NSAID lornoxicam inhibits cyclooxygenase (COX)-1/-2, inducible nitric oxide synthase (iNOS), and the formation of interleukin (IL)-6 in vitro // Inflamm. Res. — 1999. — 48(7). — Р. 369-379.
15. Bjordal J.M., Klovning A., Ljunggren A.E. et al. Short-term efficacy of pharmacotherapeutic interventions in osteoarthritic knee pain: a meta-analysis of randomised placebo-controlled trials // Eur. J. Pain. — 2007. — 11. — Р. 125-138. — doi: 10.1016/j.ejpain.2006.02.013.
16. Bruyere O., Cooper C., Pelletier J.P. et al. A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis — From evidence-based medicine to the real-life setting // Semin. Arthritis Rheum. — 2016 Feb. — 45(4 Suppl.). — Р. 3-11. — doi: 10.1016/j.semarthrit.2015.11.010.
17. Dieppe P. Recommended methodology for assessing the progression of osteoarthritis of the hip and knee joints // Osteoarthritis Cartilage. — 1995. — 3. — Р. 73-77.
18. Fanella A., Ghisi D., Aprile P.L., Lapi F. Cardiovascular and cerebrovascular risk with nonsteroidal anti-inflammatory drugs and cyclooxygenase 2 inhibitors: latest evidence and clinical implications // Ther. Adv. Drug. Saf. — 2017. — 8(6). — Р. 173-182. — doi: 10.1177/2042098617690485.
19. Funk C.D., Fitzgerald G.A. COX-2 inhibitors and cardiovascular risk // J. Cardiovasc. Pharmacol. — 2007. — 50(5). — Р. 470-479. — doi: 10.1097/FJC.0b013e318157f72d.
20. Hunter D.J., Guermazi A., Roemer F. et al. Structural correlates of pain in joints with osteoarthritis // Osteoarthritis Cartilage. — 2013. — 21(9). — Р. 1170-1178. — doi: 10.1016/j.joca.2013.05.017.
21. Kidd B., Frenzel W. A multicenter, randomized, double blind study comparing lornoxicam with diclofenac in osteoarthritis // J. Rheumatol. — 1996. — 23(9). — Р. 1605-1611.
22. Kullich W., Klein G. Influence of the nonsteroidal antiinflammatory drug lornoxicami. v. on the secretion of the endogenous opiate peptides dynorphin and β-endorphin // Aktuel. Rheumatol. — 1992. — 17(4). — Р. 128-132.
23. Norholt S.E., Sindet-Pedersen S., Bugge C., Branebjerg P.E., Ersboll B.K., Bastian H.L. A randomized double-blind placebo-controlled, dose-response study of the analgesic effect of lornoxicam after surgical removal of mandibular third molars // J. Clin. Pharmacol. — 1995. — 35(6). — Р. 606-14.
24. Parada L., Marstein J.P., Danilov A. Tolerability of the COX-1/COX-2 inhibitor lornoxicam in the treatment of acute and rheumatic pain // Pain Manag. — 2016. — 6(5). — Р. 445-454. — doi: 10.2217/pmt.16.7.
25. Pelletier J.P., Martel-Pelletier J., Rannou F., Cooper C. Efficacy and safety of oral NSAIDs and analgesics in the management of osteoarthritis: Evidence from real-life setting trials and surveys // Semin. Arthritis Rheum. — 2016. — 45 (4 Suppl.). — Р. 22-27. — doi: 10.1016/j. semarthrit.2015.11.009.
26. Radhofer-Welte S., Rabasseda X. Lornoxicam, a new potent NSAID with an improved tolerability profile // Drugs Today (Barc.). — 2000. — 36(1). — Р. 55-76.
27. Rose P., Steinhauser C. Comparison of Lornoxicam and Rofecoxib in Patients with Activated Osteoarthritis (COLOR Study) // Clin. Drug. Inves. — 2004. — 24(4). — Р. 227-236.
28. Rosenow D.E., Albrechtsen M., Stolke D. A comparison of patient-controlled analgesia with lornoxicam versusmorphine in patients undergoing lumbar disk surgery // Anesth. Analg. — 1998. — 86(5). — Р. 1045-50.
29. Smith S.R., Deshpande B.R., Collins J.E. et al. Comparative pain reduction of oral non-steroidal anti-inflammatory drugs and opioids for knee osteoarthritis: systematic analytic review // Osteoarthritis Cartilage. — 2016. — 24(6). — Р. 962-72. — doi: 10.1016/j.joca.2016.01. 135.
30. Staunstrup H., Ovesen J., Larsen U.T., Elbaek K., Larsen U., Kroner K. Efficacy and tolerability of lornoxicam versus tramadol in postoperative pain // J. Clin. Pharmacol. — 1999. — 39(8). — Р. 834-41.
31. Zhang W., Jones A., Doherty M. Doesparacetamol (ace-taminophen) reduce the pain of osteoarthritis? A meta-analysis of randomised controlled trials // Ann. Rheum. Dis. — 2004. — 63. — Р. 901-907. — doi: 10.1136/ard.2003.018531.