В Украине в 2015 году родилось 411,8 тыс. детей [1]. С учетом известной распространенности вирусных гепатитов среди беременных [2] (1,1 % инфицированы вирусом гепатита В и 3,1 % — вирусом гепатита С) теоретически вирусами гепатита В и С могли быть инфицированы 17 295 новорожденных. При этом вероятность развития хронических форм инфекции при перинатальном инфицировании превышает 90 %. Они, как известно, могут прогрессировать в цирроз печени (ЦП) и гепатоцеллюлярную карциному — состояния, потенциально ограничивающие продолжительность жизни. Все это, в совокупности с неблагоприятной демографической ситуацией в Украине, делает проблему вирусных гепатитов у женщин репродуктивного возраста чрезвычайно актуальной.
Скрининг беременных на гепатит В, точнее, на наличие поверхностного антигена вируса гепатита В (HBsAg) более 30 лет был обязателен, и более или менее точными данными о распространенности гепатита В мы были обязаны именно систематическому скринингу беременных. Скрининг беременных на гепатит С в Украине является рекомендованным, а его стоимость пациентам не возмещается. Поэтому он проводится нерегулярно и о распространенности маркеров гепатита С мы знаем только из небольших популяционных исследований. Тем не менее, когда скрининг выполняется, в том числе и за собственные средства пациента, он должен быть проведен правильно (табл. 1).
Приводим клинический пример. Пациентка К., 1985 г.р., встала на учет в женской консультации 02.02.17. Срок беременности определен в 12 нед. Была обследована на маркеры гепатита и ВИЧ. Выявлен HBsAg. Пациентке было рекомендовано пройти повторное обследование и обратиться к инфекционисту. При повторных исследованиях 13 и 15 марта 2017 г. HBsAg не обнаружен. Печеночные пробы были в норме. При УЗИ органов брюшной полости (ОБП) выявлена гемангиома печени.
Приведенный пример демонстрирует необходимость придерживаться рекомендованной стратегии скрининга и не ограничиваться исследованием лишь одного HBsAg. Вероятнее всего, положительные результаты обследования от 02.02.17 являются лабораторной ошибкой. Однако с учетом того, что пациентка обследовалась повторно спустя полтора месяца, исключить острый гепатит В в начале февраля сложно, т.к. за это время она могла и выздороветь. Ретроспективно решить вопрос можно было единственным способом — обследовав пациентку на наличие антител к сердцевинному антигену вируса. Результат оказался отрицательным, что однозначно свидетельствует о лабораторной ошибке. В то же время, если бы пациентка была обследована на оба маркера сразу, как это предписывается методикой скрининга на гепатит В, подобной проблемы не возникло бы.
Оптимально, когда обследования на различные заболевания, в том числе и инфекционные, оказывающие неблагоприятное влияние на течение беременности и развитие плода, проводятся до беременности, на этапе ее планирования. И хотя это случается намного реже, чем нам хотелось бы, обсудить тактику врача при выявлении у женщины или ее полового партнера вирусного гепатита, безусловно, стоит. Хорошим примером могла бы быть история пациентки П.
У пациентки П., 1977 г.р., хронический вирусный гепатит С, генотип 1в, с минимальной активностью и фиброзом (A0-1F0-1 по шкале METAVIR согласно FibroTest). Перенесенный в прошлом острый гепатит В (со слов пациентки, ранее обнаруживали антитела к HBcAg). О гепатите С знает с 2002 года. Не лечилась. Периодически проходит обследование, которое подтверждает непрогрессирующий характер заболевания. Имеет двоих здоровых детей 8 и 10 лет. Причиной визита к инфекционисту было решение вопроса о возможных рисках инфицирования ребенка во время беременности и способах пред–отвращения передачи гепатита внутри семьи.
Настоящий пример является прекрасной иллюстрацией теоретических данных о низкой вероятности перинатального инфицирования вирусным гепатитом С. С большой долей уверенности можно было –утверждать, что и третья беременность завершилась бы рождением здорового ребенка. Однако минимальный совокупный риск все же существует и оценивается < 5 % для внутриутробного, интранатального инфицирования и при грудном вскармливании. Ранее считалось, что это настолько мало, что наличие гепатита С не следовало принимать во внимание при выборе способа родоразрешения (естественные роды или кесарево сечение) или решении вопроса о возможности грудного вскармливания. С другой стороны, решение о невмешательстве отчасти было продиктовано еще и отсутствием эффективных средств профилактики, таких как вакцинация или эффективная терапия, способная привести к излечению и, таким образом, нивелировать, пусть и минимальные, риски инфицирования.
В 2014 году FDA зарегистрировала Софосбувир для лечения вирусного гепатита С. В том же году была зарегистрирована и первая безынтерфероновая схема лечения заболевания. В начале 2015 года стали доступны другие препараты, большинство из которых применяется и ныне и позволяет излечить хронический вирусный гепатит С примерно у 95 % пациентов. Таким образом, появление противовирусных препаратов прямого действия внесло существенные коррективы в алгоритм действий врача в случае выявления у планирующей беременность женщины или ее полового партнера маркеров гепатита С (рис. 1).
Поэтому единственно верной рекомендацией пациентке П. было бы предложение пройти курс противовирусной терапии, а затем планировать беременность. Задержка в этом случае составляла бы около 6 месяцев (лечение гепатита С продолжается 12 недель, еще 12 — оценка его результатов).
Напротив, препараты, которые были бы в состоянии элиминировать хроническую HBV-инфекцию, пока не созданы. И поэтому при выявлении этой инфекции было бы правильно в первую очередь планировать беременность и роды, и только потом — лечение пациентки. Однако принятие решения подобного рода не избавляет врача от необходимости оценить риски влияния беременности на течение гепатита и гепатита — на беременность, включая инфицирование ребенка.
Вероятнее всего, беременность не окажет никакого влияния на течение гепатита в его начальных стадиях. В то же время у больных с циррозом печени беременность может вести к развитию тяжелых осложнений.
К счастью, беременность у больных ЦП маловероятна. По некоторым данным, она оценивается как 45 случаев на 100 000 женщин репродуктивного возраста [3]. Главной причиной этого являются метаболические и гормональные нарушения, которые ведут к ановуляции и аменорее. Вторая причина заключается в том, что ЦП развивается, как правило, в старшем возрасте, когда репродуктивная функция и без того угасает.
Если же беременность у больных ЦП все же развивается, резко возрастает риск кровотечения из вен пищевода, который оценивается в 18–23 %. Если диагноз портальной гипертензии был установлен до беременности, риск кровотечения составляет 50 %, и 78 % — если имело место варикозное расширение вен пищевода. –Летальность от кровотечения оценивается в 18–50 %.
У беременных с ЦП существует риск развития аневризмы селезеночной артерии и ее разрыва. Он невелик — всего 2,6 %, однако летальность при этом составляет 70–80 %. В 75 % случаев разрыв селезеночной артерии происходит в 3-м триместре беременности. Послеродовые маточные кровотечения встречаются у 7–10 % больных ЦП.
Печеночная недостаточность также развивается достаточно часто — практически у каждой четвертой пациентки с ЦП. Напротив, асцит является относительно редким, что связывают с повышением внутрибрюшного давления из-за беременности. Одним из проявлений печеночной недостаточности может быть энцефалопатия. Обычно она провоцируется артериальной гипертензией, гипоксией, приемом медикаментов (анальгетиков и седативных), гипогликемией, а иногда и обычным запором. Если у больной с ЦП развивается желудочно-кишечное кровотечение или какие-либо инфекционные осложнения, энцефалопатия также присутствует.
В свою очередь, ЦП примерно в 2 раза увеличивает вероятность аборта и преждевременных родов (30–40 % против 15–20 % и 25 % против 12,8 %). Перинатальная смертность в группе больных ЦП превосходит популяционную в 16 раз (18 % против 1,08 %).
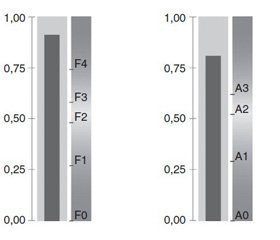
У больных хроническим гепатитом риск осложнений беременности существенно ниже, чем у больных ЦП. Однако было бы неправильно считать, что у всех пациенток с хроническим гепатитом он одинаков: чем больше выраженность фиброза, т.е. чем ближе гепатит к циррозу, тем выше риски взаимного отягчающего влияния гепатита и беременности. Поэтому правильно прогнозировать риски не по факту наличия у беременной хронического гепатита или цирроза, а по выраженности фиброза. Последний может быть легко оценен при помощи неинвазивных методов (FibroScan, FibroTest, сдвиговолновая УЗ-эластометрия) (рис. 2).
Оценка влияния гепатита на беременность диктует необходимость определения риска инфицирования плода. В целом при гепатите В он существенно выше, особенно в родах и при грудном вскармливании, и может достигать 90 % (табл. 2).
Высокая вирусная нагрузка, наличие HBeAg (при гепатите В), повышенный уровень трансаминаз, ко-инфекция ВИЧ увеличивают риск инфицирования, как и некоторые виды акушерского вмешательства (амниоцентез, инвазивный мониторинг плода, разрывы слизистой влагалища и/или промежности). Есть мнение, что плод женского пола более подвержен риску инфицирования [8], а при наличии инфекции у отца риск инфицирования также возрастает [9].
Наличие более высокого риска инфицирования при гепатите В полностью нивелируется вакцинацией (предотвращает интранатальное и постнатальное инфицирование) и профилактической противовирусной терапией (препятствует внутриутробному инфицированию), которая по показаниям может проводиться с конца 2-го триместра беременности.
Поскольку при гепатите В инфицирование происходит главным образом в родах, одновременное использование вакцины и иммуноглобулина (так называемая симультанная вакцинация) эффективно предупреждает инфицирование более чем в 90 % случаев. К сожалению, в Украине иммуноглобулин не производится и не зарегистрирован. В связи с этим может быть использована альтернативная ускоренная схема вакцинации (0–1–2–12 мес.) вместо стандартной (0–1–6 мес.).
К сожалению, у 3–10 % новорожденных вакцинация не предупреждает развитие гепатита В, т.к. инфицирование происходит внутриутробно. Это обычно бывает в случае высокой вирусной нагрузки у HBeAg-позитивной матери. В исследовании E. Wiseman с соавт. [10] внутриутробное инфицирование развивалось исключительно у женщин, которые были HBeAg-позитивными и имели вирусную нагрузку, превышающую 8 log копий/мл (рис. 3).
/12-1.jpg)
Как европейское, так и американское руководство по лечению гепатита В рекомендуют в этом случае профилактическое назначение противовирусной терапии, которая возможна уже с конца 2-го триместра беременности. Из использующихся ныне препаратов с этой целью могут применяться тенофовир, ламивудин и телбивудин в обычных для лечения гепатита В дозировках. В исследовании G.R. Han с соавт. назначение телбивудина в дозе 600 мг/день 135 женщинам с высокой (более 107 копий/мл) вирусной нагрузкой, в совокупности с симультанной вакцинацией новорожденных, предупреждало внутриутробное инфицирование, в то время как у 8 из 88 новорожденных, получивших только симультанную вакцинацию, чьи матери отказались от медикаментозной профилактики внутриутробного инфицирования, был выявлен HBsAg (рис. 4) [11].
/12-2.jpg)
Хотя при гепатите С риск перинатального инфицирования намного меньше и, скорее всего, не превы–шает 5 %, его никак нельзя предупредить. Многочисленными исследованиями было продемонстрировано, что в отличие от коинфицированных ВИЧ больных гепатитом С, кесарево сечение не снижает вероятность его вертикальной передачи [12, 13]. Нет достаточных доказательств того, что кесарево сечение предупреждает трансмиссию и гепатита В, если другие виды профилактических мероприятий проводятся своевременно и в полном объеме [14].
Таким образом, если женщина только планирует беременность, оптимальным способом профилактики вертикальной передачи гепатита С является его лечение до наступления беременности, а гепатита В — симультанная вакцинация в первые сутки жизни новорожденного и медикаментозная профилактика внутриутробного инфицирования у матерей с высокой вирусной нагрузкой с конца 2-го — начала 3-го триместра беременности.
Следует считать, что здоровье ребенка определяется здоровьем матери. Поэтому в семьях, где отец ребенка инфицирован гепатитом В или С, должны быть предприняты меры, направленные на предупреждение инфицирования будущей матери. В случае гепатита В у мужа это должна быть плановая вакцинация женщины по схеме 0–1–6 мес. В случае гепатита С риск инфицирования супругов при половых контактах минимален и, скорее всего, не превышает 5 %. Раньше этим можно было пренебречь. Однако в настоящее время следует предлагать лечение гепатита С, которое почти в 95 % случаев приводит к элиминации инфекции и, таким образом, нивелирует даже минимальные риски инфицирования. Правда, в этом случае, так же как и при вакцинации женщины, беременность должна быть отложена на 6 месяцев (3 месяца продолжается лечение гепатита С и в течение 3 месяцев оцениваются его результаты).
Похожей тактики следует придерживаться и при экстракорпоральном оплодотворении (ЭКО). Если женщина здорова, а муж болен гепатитом В, ее следует привить и планировать беременность после завершения полного курса вакцинации [15]. Это позволит предупредить инфицирование матери, а от нее — ребенка. Однако вакцинация никак не повлияет на шансы успешного ЭКО: известно, что у мужчин, больных HBV-инфекцией, снижается подвижность сперматозоидов. Пары, где мужчина инфицирован, имеют меньшую частоту фертилизации после ЭКО. Однако этот риск не связан с подвижностью сперматозоидов [16]. Имеется анекдотическое сообщение, что у 190 HBV-инфицированных женщин, которым впервые проводилось ЭКО, частота как беременностей (родов), так и имплантаций была выше по сравнению с неинфицированным контролем (53,3 % против 24,2 % и 43,3 % против 18,4 % соответственно) [17]. Однако надо полагать, что наличие гепатита у женщины, так же как и у мужчины, все-таки снижает шансы на успешное ЭКО. Так, N.F. Hanafi с соавт. показали отсутствие ответа на стимуляцию у женщин, больных гепатитом С, намного чаще, чем у серонегативных или анти-HCV-позитивных, но HCV ПЦР-негативных пациенток (P = 0,0001) [18]. Частота беременности была значительно ниже среди HCV ПЦР-позитивных пациенток по сравнению с остальными группами (5, 3 и 48 %). Возможно, это было связано с выявленной авторами обратной связью между числом ооцитов и вирусной нагрузкой (0,419; P = 0,007). Эти данные говорят в пользу необходимости предшествующего ЭКО лечения гепатита С независимо от того, кто инфицирован в супружеской паре — мужчина или женщина.
И хотя в эксперименте показан мутагенный эффект HCV на хромосомы сперматозоидов с риском генетических изменений и/или хромосомных аберраций вследствие способности гена С HCV проникать через мембрану сперматозоида и интегрироваться в геном, возможность инфицирования ребенка от больного гепатитом С отца при здоровой матери показана не была [19, 20]. В случае, если мужчина по каким-либо причинам отказывается от лечения гепатита С до проведения ЭКО, следует прибегнуть к отмыванию спермы или ее интрацитоплазматической инъекции [21]. Последний метод значительно снижает риск передачи инфекции от HCV-позитивного мужчины в случае серонегативного статуса женщины [22].
На основании приведенных выше данных оптимальная тактика подготовки к ЭКО в случае наличия гепатита у одного из супругов должна выглядеть следующим образом (рис. 5).
Таким образом, в случае гепатита С как мужчине, так и женщине должна предлагаться противовирусная терапия в расчете на то, что излечение увеличит шансы на успешное ЭКО и полностью предотвратит риск вертикальной трансмиссии гепатита в случае инфекции у женщины. В случае гепатита В у мужчины женщина должна быть вакцинирована до начала процедуры ЭКО. Если инфицирована женщина, мужчина также должен быть вакцинирован до начала ЭКО. Поскольку пока не существует лечения, которое бы приводило к гарантированной эрадикации HBV-инфекции, в отношении потомства инфицированной гепатитом В женщины должны быть предприняты меры, предупреждающие или снижающие риск инфицирования: превентивная противовирусная терапия в случае высокой вирусной нагрузки во время беременности и симультанная вакцинация новорожденного.
Конфликт интересов. Не заявлен.
Список литературы
1. The data of population Census of Ukraine 2017. Available from: http://www.ukrstat.gov.ua/operativ/operativ2007/ds/nas_rik/nas_u/nas_rik_u.html
2. Gural' AL, Marevskii VF, Sergeeva TA. Epidemiological aspects of hepatitis B and C in Ukraine. Zbіrnik naukovikh prats' spіvrobіtnikіv KMAPO іm. P. L. Shupika. 2000;9(4):56-60.
3. Tan J, Surti B, Saab S. Pregnancy and cirrhosis. Liver Transpl. 2008 Aug;14(8):1081-91. doi: 10.1002/lt.21572.
4. Tang JR, Hsu HY, Lin HH, Ni YH, Chang MH. Hepatitis B surface antigenemia at birth: a long-term follow-up study. J Pediatr. 1998 Sep;133(3):374-7. PMID: 9738719.
5. Tosone G, Maraolo AE, Mascolo S, Palmiero G, Tambaro O, Orlando R. Vertical hepatitis C virus transmission: Main questions and answers.World J Hepatol. 2014 Aug 27;6(8):538-48. doi: 10.4254/wjh.v6.i8.538.
6. Dunkelberg JC , Berkley EMF, Thiel KW, Leslie KK. Hepatitis B and C in Pregnancy: A Review and Recommendations for Care. J Perinatol. 2014; 34(12): 882-91. doi: 10.1038/jp.2014.167.
7. ACOG Committee Opinion. Breastfeeding and the risk of hepa–titis C virus transmission. Int J Gynaecol Obstet. 1999; 66(3):307-8. PMID: 10580686.
8. European Paediatric Hepatitis C Virus Network. A significant sex — but not elective cesarean section — effect on mother-to child transmission of hepatitis C virus infection. J Infect Dis. 2005;192:1872-9. doi: 10.1086/497695.
9. Valladares G, Chacaltana A, Sjogren MH. The management of HCV-infected pregnant women. Ann Hepatol. 2010;9 Suppl:92-7. PMID: 20714003.
10. Wiseman E, Fraser MA, Holden S, et al. Perinatal transmission of hepatitis B virus: an Australian experience. Med J Aust. 2009 May 4;190(9):489-92. PMID: 19413519.
11. Han GR, Cao MK, Zhao W, et al. A prospective and open-label study for the efficacy and safety of telbivudine in pregnancy for the prevention of perinatal transmission of hepatitis B virus infection. J Hepatol. 2011 Dec;55(6):1215-21. doi: 10.1016/j.jhep.2011.02.032.
12. Ghamar Chehreh ME, Tabatabaei SV, Khazanehdari S, Alavian SM. Effect of cesarean section on the risk of perinatal transmission of hepatitis C virus from HCV-RNA+/HIVmothers: a meta-analysis. Arch Gynecol Obstet. 2011 Feb;283(2):255-60. doi: 10.1007/s00404-010-1588-9.
13. Centers for Disease Control and Prevention. Recommendations for prevention and control of hepatitis C virus (HCV) infection and HCV-related chronic disease. Morbidity And Mortality Weekly Report. 1998;47(RR19):1-39.
14. American College of Obstetricians and Gynecologists. ACOG educational bulletin. Viral hepatitis in pregnancy. Number 248, July 1998 (replaces No. 174, November 1992). Int J Gynaecol Obstet. 1998;63(2):195-202.
15. Recommendations for reducing the risk of viral transmission during fertility treatment with the use of autologous gametes: a committee opinion. Fertility and Sterility. 2013;99(2):340-6. doi:10.1016/j.fertnstert.2012.08.028.
16. Oger P, Yazbeck C, Gervais A, et al. Adverse effects of he–patitis B virus on sperm motility and fertilization ability during IVF. Reprod Biomed Online. 2011 Aug;23(2):207-12. doi: 10.1016/j.rbmo.2011.04.008.
17. Lam PM, Suen SH, Lao TT, et al. Hepatitis B infection and outcomes of in vitro fertilization and embryo transfer treatment. Fertil Steril. 2010 Feb;93(2):480-5. doi: 10.1016/j.fertnstert.2009.01.137.
18. Hanafi NF, Abo Ali AH, Abo el kheir HF. ICSI outcome in women who have positive PCR result for hepatitis C virus. Hum Reprod. 2011 Jan;26(1):143-7. doi: 10.1093/humrep/deq317.
19. Zhu Y, Ma M, Huang J, et al. Effects of Hepatitis C Virus Infection on Human Sperm Chromosomes. Clin Lab. 2016;62(3):373-9. PMID: 27156326.
20. Ma M, Zhu Y, Wang D, Hou Z, et al. Research on the Vertical Transmission of Hepatitis C Gene from Father-to-child via Human Sperm. Clin Lab. 2016;62(1-2):1-6.
21. Garrido N, Gil-Salom M, Martínez-Jabaloyas JM, Meseguer M. First report of the absence of viral load in testicular sperm samples obtained from men with hepatitis C and HIV after washing and their subsequent use. FertilSteril. 2009 Sep;92(3):1012-5. doi: 10.1016/j.fertnstert.2009.01.159.
22. Nesrine F, Saleh H. Hepatitis C virus (HCV) status in newborns born to HCV positive women performing intracytoplasmic sperm injection. Afr Health Sci. 2012 Mar;12(1):58-62. PMCID: PMC3462519.

/10-1.jpg)
/11-1.jpg)
/11-2.jpg)
/12-1.jpg)
/12-2.jpg)
/13-1.jpg)