Вступ
Муковісцидоз (МВ) є частим аутосомно-рецесивним захворюванням, що обумовлено мутацією гена трансмембранного регулятора МВ (англ. Cystic Fibrosis Transmembrane conductance Regulator — CFTR) з ураженням екзокринних залоз життєво важливих органів і систем [1–3]. Частота МВ у популяціях різна, у середньому вона становить 1 : 2–5 тисяч новонароджених серед представників білої раси. Кожен 25-й європеєць є носієм гена даного захворювання. Щороку у світі народжуються 45–50 тисяч дітей із МВ, а гетерозиготних носіїв налічуються десятки мільйонів [4].
Вісімдесят п’ять відсотків смертності при МВ є результатом ураження легень. Легеневі загострення обумовлюють несприятливий вплив на якість життя пацієнтів і мають вагому частку в загальній вартості медичного обслуговування [5, 6].
Постійний інфекційний процес при тяжкому перебігу МВ, колонізація агресивними збудниками (Pseudomonas aeruginosa (Ps.aeruginosa), Staphylococcus aureus (S.aureus), Hemophilus influenzae, Stenotrophomonas maltophilia, Achromobacter xylosoxidans, Burkholderia cepacia сomplex та ін.) вимагають тривалого антибактеріального лікування, у тому числі профілактичного [7, 8].
Метою наукової роботи є аналіз клінічного випадку, який відображає перебіг МВ за умови відсутності адекватного антибактеріального лікування.
Матеріали та методи
Хвора П., 2 роки 3 місяці, спостерігалася з грудного віку у КЗОЗ «ОДКЛ № 1» м. Харкова (головний лікар — проф. Піонтковська О.В.) згідно з наказами МОЗ України № 128 від 19.03.2007 «Про затвердження протоколу надання медичної допомоги хворим на МВ» та № 59 від 29.01.2013 «Про затвердження уніфікованих клінічних протоколів надання медичної допомоги дітям із захворюваннями органів травлення».
Результати та обговорення
Хвора надійшла до пульмонологічного відділення стаціонару 17.06.2015 зі скаргами на кашель з виділенням гноєподібного мокротиння, задишку, підвищення температури тіла до 38,9 °С.
Анамнез життя та захворювання. Дитина народилась від І вагітності, що протікала на фоні загрози передчасних пологів у терміні гестації 28–32 тижні. Пологи І, у термін 39 тижнів гестації. Оцінка за шкалою Апгар — 8/8 балів. Маса при народженні — 3000 г, зріст — 51 см. Знаходилась на штучному вигодовуванні з народження. Щеплена лише проти туберкульозу (БЦЖ) у пологовому будинку. Спадковий анамнез: мати хворіє на псоріаз. Батько з родиною не проживає. Родина була соціально неблагополучною, мати — одиначка, дитина незапланована.
МВ виявлено своєчасно, під час неонатального скринінгу при визначенні імунореактивного трипсину у плямі крові на фільтрувальному папері, рівень якого під час першого дослідження становив 227,4 нг/мл (норма — до 40 нг/мл), повторно — 281,5 нг/мл. Дворазова позитивна пілокарпінова проба (109,1 та 112,1 ммоль/л при нормі до 40 ммоль/л), що була виконана в грудному віці, підтвердила діагноз МВ.
Кишкові прояви МВ відмічені з перших днів життя у вигляді панкреатичної недостатності (поліфекалія, стеаторея, недостатнє збільшення маси тіла — 305 г за перший місяць). З перших тижнів життя дівчинка отримувала замісну ферментну терапію. Легеневі прояви приєдналися з 3-місячного віку у вигляді постійного кашлю.
Знаходилась на обліку в невролога з приводу субепідуральної кісти головного мозку праворуч внаслідок перинатального гіпоксичного ураження центральної нервової системи (ЦНС), у кардіолога — з приводу функціонуючого овального вікна (ФОВ).
У 4 місяці діагностовано позагоспітальну правобічну полісегментарну пневмонію, з приводу чого дитина знаходилась на стаціонарному лікуванні та була виписана з одужанням.
У 5 місяців дитина госпіталізована з приводу загострення обструктивного бронхіту з розвитком дихальної недостатності ІІ ступеня та динамічної кишкової непрохідності. Діагностовано реактивний гепатит. Лабораторно було відзначено підвищення аланінамінотрансферази до
0,72 мкмоль/(мл × год), аспартатамінотрансферази — до 0,54 мкмоль/(мл × год), тимолової проби — до 12,4 од. При копрологічному дослідженні — збільшення кількості нейтрального жиру.
У 7 місяців повторна госпіталізація з приводу загострення бронхолегеневого запального процесу, дихальна недостатність ІІ ст., кандидоз слизової оболонки ротової порожнини, синдром рухових розладів внаслідок перинатального ураження ЦНС. Бактеріальний пейзаж при дослідженні промивних вод бронхів представлений наступними патогенами: Burkholderia cepacia (помірний зріст), Stenotrорhomonas maltofilia (одиничні колонії), Ps.aeruginosa (помірний зріст), Candida albicans (помірний зріст), Streptococcus spp. (помірний зріст). Вперше виявлена колонізація трахеобронхіального дерева Ps.aeruginosa, яка в 9 міс. набула резистентності. Під час імунологічного дослідження дані за імунодефіцит не виявлені.
У 9 місяців — вторинна кардіоміопатія, ФОВ, легенева гіпертензія І–ІІ ст. (за даними ультразвукового дослідження (УЗД)).
У віці 1 року 2 місяців під час планового УЗД органів черевної порожнини (ОЧП) були виявлені ознаки фіброзу печінки, збільшення селезінки.
У віці 1 року 3 місяців під час бактеріологічного дослідження слизової оболонки зіву був вперше виявлений S.aureus 103.
У 1 рік 4 місяці дитина була госпіталізована до стаціонару, де провела 120 ліжко-днів з приводу двобічної тотальної деструктивної пневмонії, затяжного перебігу, хронічної колонізації трахеобронхіального дерева резистентною інфекцією Ps.aeruginosa, інвазивного бронхолегеневого аспергільозу. Вторинна кардіоміопатія, легенева гіпертензія І ст. Дефіцитна анемія середнього ступеня тяжкості.
Гриби роду Aspergillus fumigatus були виявлені під час клінічного дослідження мокротиння.
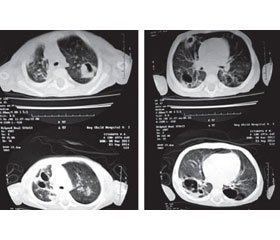
Під час комп’ютерної томографії органів грудної порожнини (КТ ОГП) виявлено: множинні порожнини із серпоподібним обідком діаметром 5–60 мм, ділянки фіброзу, переважно у верхніх і нижніх відділах правої легені, нерівномірно виражені ділянки ущільнення легеневої тканини за типом «матового скла» (рис. 1).
Через 3 тижні після одужання та виписки із стаціонару (1 рік 9 міс.) дитина госпіталізована з приводу позагоспітальної вторинної правобічної полісегментарної (S8–10) пневмонії, ускладненої обструктивним синдромом. Наступні госпіталізації — в 1 рік 11 міс., 2 роки 1 міс. з приводу аналогічного патологічного процесу.
Під час кожної госпіталізації проводилась антибактеріальна терапія у повному обсязі з урахуванням чутливості мікрофлори (цефтріаксон, цефтазидим, цефепім, тобраміцин, кларитроміцин, колістиметат натрію, меропенем, амікацин, лінезолід, пе–флоксацин), у результаті якої дитина набувала покращення, стабільного стану та виписувалась під амбулаторний нагляд дільничного педіатра з рекомендаціями продовження антибактеріальної терапії (цефотаксим, колістиметат натрію, тобраміцин, тіамфеникол гліцинат ацетилцистеїнат). Але дитина не отримувала рекомендовані ліки в повному обсязі у зв’язку із матеріальною неспроможністю родини, чим й пояснюється така висока частота загострень та госпіталізації до стаціонару.
У дитини зберігався кашель, останнє загострення — за 3 дні до надходження до стаціонару.
Об’єктивний статус. Стан розцінений як тяжкий за рахунок дихальної недостатності рестриктивного типу, метаболічних та водно-електролітних порушень. Дитина госпіталізована до відділення анестезіології та інтенсивної терапії (ВАІТ).
Температура — 36,8 °С, частота дихання — 38 за 1 хвилину, частота серцевих скорочень — 140 за 1 хвилину, артеріальний тиск — 100/60 мм рт.ст., сатурація кисню — 86 %.
Шкіра бліда, періоральний ціаноз, чиста. Слизова зіву гіперемована. Деформація пальців у вигляді «барабанних паличок», нігтів — «годинникового скла». Грудна клітка емфізематозно роздута. Перкуторно над легенями коробковий звук. Аускультативно послаблене дихання праворуч, на решті — жорстке дихання, вологі середньо- та крупнопухирчасті хрипи над усією поверхнею легень. Границі серця не розширені. Тони серця ритмічні, звучні. Живіт округлої форми, пальпаторно — м’який, безболісний. Печінка +4,0 см з-під краю реберної дуги. Селезінка не пальпується. Випорожнення 2–3 рази на добу, кашицеподібні, стеаторея.
Рентгенографічне дослідження органів грудної клітки (Rо ОГК) — нерівномірно виражені ділянки інфільтрації легеневої тканини правої легені з округлими дрібними просвітліннями, посилення легеневого рисунку за рахунок судинного компонента з вираженими гемодинамічними фіброзними змінами в легенях (переважно праворуч). На тлі хронічного захворювання бронхолегеневої системи ознаки правобічної пневмонії, кістозні бронхоектази правої легені.
Встановлено клінічний діагноз: МВ, легенево-кишкова форма, тяжкий перебіг. Хронічна панкреатична недостатність. Хронічний обструктивний бронхіт на тлі кістозних бронхоектазів переважно в правій легені. Вторинна позагоспітальна правобічна полісегментарна пневмонія, рецидивуючий перебіг. Хронічна дихальна недостатність ІІ ст. Вторинна кардіоміопатія, легенева гіпертензія І ст.
Дитині було призначено патогенетичне лікування в повному обсязі, з акцентом на антибактеріальні препарати з антисиньогнійною активністю. Через добу у зв’язку із стабілізацією стану дитина була переведена до пульмонологічного відділення.
У динаміці зберігалось в’язке гнійне мокротиння, змішана задишка з переважанням експіраторного компонента, періоральний ціаноз, фізикально в легенях зберігалось послаблене дихання праворуч, вологі дрібно- та середньопухирчасті хрипи. Збільшення печінки до 5,0 см з-під краю реберної дуги.
Лабораторно — збереження лейкоцитозу до 16 × 109/л, швидкість осідання еритроцитів (ШОЕ) — до 20 мм/год, С-реактивний протеїн (СРП) — +++, тимолова проба — до 15,4 од. Імунологічне дослідження: підвищення рівня IgM до 1,18 г/л (норма — 0,61 ± 0,19), що свідчить про гостру фазу запального процесу, інші показники — у межах норми. Бактеріологічне дослідження: мокротиння, слизової зіву, промивних вод трахеї, бронхів — полірезистентна Ps.aeruginosa 106.
Rо ОГК у динаміці: відсутність позитивної динаміки, збільшення нерівномірно виражених ділянок, зниження прозорості легеневої тканини, двобічна полісегментарна пневмонія.
Бронхоскопія: дифузний катаральний гнійний ендобронхіт.
Цитограма промивних вод трахеї, бронхів: плоский епітелій — помірна кількість, флора — коки, лейкоцити — до 50 екземплярів у полі зору (п/з), елементи епітелію бронхів — до 1/4 п/з, еозинофіли — поодинокі.
Середній тиск на легеневій артерії (за даними УЗД) — 24 мм рт.ст., у динаміці — 39 мм рт.ст.
УЗД: печінка збільшена, +4,5–5,0 см з-під краю реберної дуги, ознаки фіброзу, селезінка збільшена, панкреатопатія.
У терапію було додано імунозамісну терапію, синьогнійний бактеріофаг. Але, незважаючи на масивну етіопатогенетичну терапію, стан дитини погіршувався за рахунок інтоксикації, кардіореспіраторних і метаболічних порушень.
У зв’язку із наростанням бронхообструкції, стійким підвищенням температури тіла до фебрильних цифр, збереженням фізикальної картини в легенях, сатурації кисню 75 %, лейкоцитозу — 24 × 109/л, ШОЕ — 59 мм/год, СРП — ++++, бактеріологічним дослідженням крові на стерильність (Streptococcus epidermidis, C.аlbicans) дитина з ознаками септицемії була переведена до ВАІТ на 51-шу добу перебування у стаціонарі.
Незважаючи на інтенсивну терапію в умовах ВАІТ, на 59-ту добу приєдналася патологічна неврологічна симптоматика, у дитини розвивався синдром поліорганної недостатності, що й стало причиною смерті на 63-тю добу перебування у стаціонарі.
Заключний діагноз: МВ, легенево-кишкова форма, тяжкий перебіг. Хронічна панкреатична недостатність. Хронічний обструктивний бронхіт на тлі кістозних бронхоектазів переважно в правій легені. Вторинна позагоспітальна двобічна полісегментарна пневмонія, рецидивуючий перебіг. Хронічна колонізація трахеобронхіального дерева інфекцією Ps.aeruginosa. Дихальна недостатність ІІІ ст. Легенева гіпертензія ІІ ст. Вторинна кардіоміопатія. Фіброз печінки. Спленомегалія. Затримка темпів статокінетичного розвитку. Гіпоксично-метаболічне ураження ЦНС, гострий період. Церебрастенічний синдром. Синдром лікворно-венозної дистонії. Синдром поліорганної недостатності. Набряк головного мозку. Кома ІІІ ст.
Часті загострення бронхолегенового процесу були зумовлені відсутністю елімінаційних і профілактичних курсів антибактеріальної терапії, коли дитина знаходилась поза стаціонаром та після виписки мала отримувати амбулаторно антибактеріальну терапію, тому що родина матеріально не могла забезпечити необхідне лікування в повному обсязі, більшість ліків було надано за бюджетні кошти з фонду лікарні, за благодійні кошти, допомогу волонтерів, які були залучені лікарями відділення.
Матері померлої дитини рекомендовано поглиблене генетичне дослідження (пренатальна діагностика) при наступній вагітності для народження здорової дитини.
Останніми роками в країні досягнуто значного прогресу у лікуванні хворих на МВ — створено Всеукраїнську асоціацію допомоги хворим на МВ, затверджено сучасний протокол на засадах доказової медицини № 723 (наказ МОЗ України від 15.07.2016). Наші пацієнти отримують замісну терапію креоном за рахунок держбюджету та цілу низку життєво необхідних препаратів. Основною проблемою ведення хворих на МВ в Україні залишаються труднощі в організації базової профілактичної антибактеріальної терапії хронічної інфекції Pseudomonas. В Україні достатньо препаратів для внутрішньовенного застосування — на практиці ми з позитивним результатом застосовували схеми антибактеріальної терапії, що наведено у табл. 1.
/111-1.jpg )
Але для хворих на МВ в Україні недоступні антибактеріальні інгаляційні препарати внаслідок високої ціни та відсутності гарантованого державного забезпечення. При хронічній інфекції збудниками роду Pseudomonas рекомендовано курси терапії колістиметатом натрію або тобраміцином тривалістю 28 днів з 28-денною перервою — тривалий час (іноді — постійно).
Так, колістиметат натрію (коломіцин) — циклічний поліпептидний антибіотик, похідне Bacillus polymyxa varietas colitinus, який відноситься до групи поліміксинів, застосовується інгаляційно у мінімальній дозі 1 млн ОД 2 рази на добу (курс — 3 місяці), що коштує 30 000 грн на курс лікування.
Тобраміцин в Україні є вітчизняного виробництва — браксон («Юрія-Фарм»). Але форма випуску препарату — мала кількість діючої речовини (по 40 та 80 мг в ампулі) — ускладнює його застосування у хворих на МВ. Так, рекомендовані дози для інгаляційного застосування становлять 300 мг (4 ампули по 80 мг) 2 рази на добу. Ціна подібного лікування становить біля 300 грн на добу та 8000 грн на місяць.
У 2013 році в Україні було зареєстровано тобраміцин у вигляді капсул з порошком для інгаляцій і зручним інгалятором виробництва швейцарської компанії «Новартис» — Зотеон Подхайлер (Zoteon Podchailer). Рекомендована доза становить 112 мг (4 капсули по 28 мг) двічі на день. Але ціна препарату на 28 днів лікування — 65 000 грн. Жоден хворий в Харківському регіоні матеріально неспроможний отримувати дане лікування.
З вересня 2016 року на сайті Державного реєстру лікарських засобів України з’явилася інформація щодо реєстрації в Україні розчину для інгаляцій брамітоб (тобраміцин) 300 мг/4 мл («К’єзі Фармасьютикалс ГмбХ», Австрія), але нам не вдалося знайти інформацію щодо його наявності в аптеках та ціни в Україні.
Висновки
1. Даний клінічний випадок ілюструє перебіг МВ за умови відсутності адекватної елімінаційної (після виписки зі стаціонару) та профілактичної антибактеріальної терапії, що й стало причиною частих загострень бронхолегеневого процесу та смерті хворого.
2. Профілактичні курси антибактеріальної терапії, що повинні проводитися за рахунок держбюджету, — це невід’ємна частина на шляху до збільшення тривалості та якості життя хворих на МВ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про внесок кожного учасника
Клименко В.А. — консультації хворого, формулювання цілей та методики наукового спостереження.
Пасічник О.В. — постійне лікування та спостереження дитини в пульмонологічному відділенні.
Дробова Н.М. — аналіз історії розвитку дитини з моменту народження методом аналізу медичної документації та клінічне спостереження дитини з листопаду 2014 року та протягом останньої госпіталізації.

/109-1.jpg )
/111-1.jpg )