Гастроінтестинальна харчова алергія (ХА) обумовлена розвитком алергічного запалення в слизовій оболонці шлунково-кишкового тракту (ШКТ), механізмами якого є як імуноглобулін E (IgE)-опосередковані (оральний алергічний синдром (ОАС), негайна гастроінтестинальна гіперчутливість (НГГ)), так і не-IgE-опосередковані (білок-індукований ентероколітичний синдром (ЕКС), білок-індукована ентеропатія, білок-індукований алергічний проктоколіт) і змішані, IgE- та не-IgE-опосередковані реакції (еозинофільний езофагіт (ЕоЕ), еозинофільний гастрит, еозинофільний гастроентерит) [1, 2].
Згідно з Міжнародною класифікацією хвороб –10-го перегляду (МКХ-10), як варіанти гастроінтестинальної форми ХА виділені такі розділи:
— К20: Еозинофільний езофагіт;
— К52.2: Алергічний та аліментарний гастроентерит і коліт: гастроінтестинальна анафілаксія, оральний алергічний синдром, еозинофільний гастроентерит, алергічний проктоколіт, індукований харчовими білками, ентероколітичний синдром, індукований харчовими білками.
Слід зазначити, що дана класифікація є недосконалою, оскільки різні варіанти гастроінтестинальної алергії ще інтесивно вивчаються і немає остаточних доказових діагностичних критеріїв, які б дали можливість скласти довершену класифікацію. У 2017 р. очікується поява нової МКХ 11-го перегляду.
Гастроінтестинальні прояви ХА також поєднуються із симптомами атопічних захворювань, частіше з атопічним дерматитом, кропив’янкою, ангіо–набряком.
Клінічні прояви алергічного ураження ШКТ різноманітні та не є специфічними. До загальних ознак гастроінтестинальної алергії належать: блювання (виникає від декількох хвилин до 4–6 годин після прийому їжі); коліки (одразу чи через декілька годин після вживання їжі); запори; діарея (найчастіший симптом); відмова від їжі (від конкретного продукту або взагалі від прийому їжі); абдомінальний біль; метеоризм, наявність слизу та еозинофілів у випорожненнях; зниження апетиту; головний біль тощо [3].
Являють інтерес особливості клінічної симптоматики окремих нозологічних форм гастроінтестинальних уражень у дітей, викликаних харчовими алергенами, залежно від патогенетичних механізмів та підходів до їх діагностики.
IgE-опосередкована гастроінтестинальна харчова алергія
Негайна гастроінтестинальна гіперчутливість — це IgE-опосередковане захворювання, клінічними проявами якого є нудота, блювання, абдомінальний біль, що виникають через декілька хвилин або через 1–2 години після вживання причинних продуктів. Через 2–6 годин можливе приєднання діареї. Часто вищенаведені симптоми поєднуються з IgE-залежними реакціями з боку інших органів і систем, а також анафілактичною реакцією.
Найчастішою причиною НГГ є молоко, злаки, соя, яйця, морепродукти та арахіс. Для діагностики даного варіанта ХА має значення ретельний збір анамнезу, наявність у дитини підвищеного рівня специфічних IgE до харчових алергенів, позитивні шкірні тести з харчовими алергенами [3].
Оральний алергічний синдром — IgE-опосеред-кована алергічна реакція на харчові продукти, що виникає після попередньої сенсибілізації пилковими інгаляційними алергенами. Приблизно 20–70 % пацієнтів із підвищеною чутливістю до пилкових алергенів мають симптоми ОАС після вживання сирих фруктів, овочів, горіхів або деяких спецій [4, 5].
Cенсибілізація до алергенів їжі рослинного походження є найвищою у хворих з алергією на пилок берези [4]. Він має бути запідозрений у пацієнтів, які звертаються з характерними симптомами, що виникають відразу після прийому сирих фруктів, горіхів, овочів і спецій, а у відвареному вигляді дитина їх добре переносить. Разом з тим деякі рослинні алергени, які викликають ОАС, стійкі до нагрівання, проте більшість із них є термолабільними.
ОАС зустрічається у дітей з атопічним анамнезом. Продукти нерослинного походження, такі як коров’яче молоко, яйця, морепродукти, не викликають розвитку цих проявів. Хоча є дані про системні реакції на готові продукти з м’яса птиці (зокрема, курки), свинини, салямі, що виникли через сенсибілізацію до кліщових алергенів, що начебто пояснює причину ОАС за відсутності анамнезу пилкової алергії. Деякі автори стверджують, що ці випадки не повинні бути включені під назвою OAС [4].
Клінічні прояви ОАС. Оскільки травні ферменти ШКТ легко знешкоджують харчові алергени, найчастіше у фруктах, овочах і горіхах, прояви ОАС зазвичай обмежуються ротоглоткою, хоча іноді можуть розвиватися і системні реакції.
Симптоми ОАС звичайно виникають протягом декількох хвилин після вживання причинного продукту і тривають від декількох хвилин до 1–2 годин [2–4]. Найбільш поширеним симптомом є орально-глотковий свербіж, особливо губів і піднебіння; хоча і рідко, також може бути періоральний набряк [4]. Іноді виникають висипання на обличчі, свербіж в ділянці вушних раковин і носа, везикули на слизовій оболонці ротової порожнини, кон’юнктивіт, нежить. У 5 % хворих прогресують системні алергічні реакції з нудотою, блюванням, болями в животі, утрудненим диханням або навіть анафілаксією [6].
Діагностика ОАС базується на наявності в анамнезі орофарингеальних симптомів, пов’язаних із прийомом у їжу певних сирих фруктів або овочів, а також зумовлених пилковими алергенами. Найбільш практичний і вагомий результат у діагностиці ОАС мають шкірні прик-тести зі свіжими екстрактами овочів і фруктів порівняно з комерційними екстрактами. Радіоалергосорбентне тестування більш чутливе, ніж шкірне прик-тестування з комерційними екстрактами, але менш чутливе, ніж шкірні прик-тести зі свіжими екстрактами [4]. CAST-ELISA (клітинний тест антигенної стимуляції в поєднанні з імуноферментним аналізом) є більш специфічним для діагностики алергії на селеру, лісовий горіх, моркву порівняно зі шкірним прик-тестуванням із використанням комерційних екстрактів і визначенням специфічних комерційних тестів IgE [7]. Однак ретельно зібраного анамнезу захворювання і розуміння зв’язку пилково-харчової алергії достатньо для встановлення діагнозу ОАС у більшості випадків.
ОАС відрізняється від звичайної ХА тим, що остання розвивається після прямої сенсибілізації до харчових білків, а не є перехресною реактивністю між білками харчових та інгаляційних алергенів. Крім того, ХА може бути викликана як рослинними, так і нерослинними харчовими продуктами та виникає у відповідь на речовини, що відносно стабільні й здатні перенести обробку ШКТ і/або приготування їжі. Крім того, ХА найчастіше призводить до розвитку системних алергічних реакцій, включаючи анафілаксію [4]. Хоча елімінаційна дієта може негативно впливати на якість життя пацієнтів, уникнення харчових продуктів, які викликають скарги і прояви, залишається ключовим у веденні дитини з ОАС, особливо пацієнтів з тяжкими алергічними реакціями.
Змішані (IgE- та не-IgE-опосередковані) типи гастроінтестинальної харчової алергії
Eoзинофільний езофагіт — хронічне, імунне, антигенопосередковане захворювання стравоходу, що характеризується ознаками його дисфункції і гістологічно переважанням еозинофільного запалення [8]. Останніми роками спостерігається значне зростання поширеності ЕоЕ, що пов’язане одночасно зі збільшенням захворюваності, покращенням методів діагностики та поінформованості лікарів про дану патологію. Найбільша частота ЕоЕ реєструється в соціально й економічно розвинених країнах, найвищий показник його поширеності відзначається у США, Західній Європі та Австралії порівняно з Японією та Китаєм. У країнах Західної Європи поширеність ЕоЕ становить близько 4,4–9,5 випадку на 100 000 людського населення [9].
Хоча ЕоЕ може виникнути у будь-якому віці, включаючи ранній дитячий вік, частіше він зустрічається у школярів (середній вік — 8,6 року) або у віці 30–40 років (в середньому — 38 років) [10].
У дітей EoE часто асоціюється із супутніми атопічними захворюваннями та IgE-сенсибілізацією до харчових алергенів, а також до аероалергенів і перехресно реагуючих компонентів рослинних алергенів у дорослих. В цілому 42–93 % дітей з ЕоЕ мають алергічні захворювання під час звернення та близько 50–60 % — в анамнезі [8]. Пацієнти з EoЕ добре реагують на емпіричну елімінаційну дієту. Незважаючи на те, що харчові продукти визнані як тригери EoЕ, механізм, за допомогою якого він ініціює або сприяє еозинофільному запаленню, як видається, значною мірою незалежний від IgE і вимагає подальшого вивчення. Розуміння патогенетичної ролі харчових продуктів у розвитку EoЕ є необхідною умовою для розробки конкретних діагностичних критеріїв і прицільних терапевтичних процедур [10].
Клінічні прояви ЕоЕ в дітей є неспецифічними та залежать від віку. У новонароджених мають місце проблеми з годуванням, відмова від їжі із затримкою фізичного розвитку або без неї. У дітей старшого віку частіше зустрічається блювання, відчуття стороннього предмета в горлі, вибірковість у їжі, повільне її споживання; діти самостійно обмежують прийом їжі, вимагають запивати прийняту їжу великою кількістю рідини для того, щоб її проковтнути. Рефлюксні скарги — печія, відрижка повітрям, кислим або гірким, біль у животі в дітей цього віку зустрічаються з різною частотою [11]. У підлітків на перший план виступають симптоми, характерні для гастроезофагеальної рефлюксної хвороби (ГЕРХ): нудота, печія, зригування, біль у животі, симптоми дисфагії, відчуття стискання їжею, біль за грудиною, що часто пов’язані з прийомом твердої їжі.
Існує сильний зв’язок між ЕоЕ й атопічними хворобами та реакціями, особливо у дітей. Так, нерідко пацієнти з ЕоЕ скаржаться на напади бронхіальної астми, захриплість голосу, кашель, порушення сну (10–12 %) [8]. Близько 75 % дітей мають коморбідну алергічну патологію (атопічний дерматит, алергічний риніт, бронхіальну астму, IgE-опосередковану ХА). Тому має бути висока настороженість щодо наявності ЕоЕ у хворих з атопією в анамнезі та клінічними ознаками з боку верхніх відділів ШКТ.
До ускладнень ЕоЕ належать епізоди вклинення їжі в стравохід, стриктури, вузький стравохід та перфорації стравоходу. Вклинення їжі у стравохід виникає безпосередньо під час прийому їжі, коли після додаткового зусилля хворого їжа залишається в стравоході. Така ситуація зустрічається у 30–50 % дорослих пацієнтів, що для відновлення його прохідності вимагає невідкладного ендоскопічного втручання для усунення вмісту зі стравоходу [11].
Діагностика. EoE являє собою спектр клінічних симптомів, ендоскопічних знахідок, а також патогенетичних ознак. Проте терміни «імунний», «антиген–опосередкований» не вирішують питання, де саме EoE повинен розташовуватися в широкому діапазоні між автоімунними та алергічними захворюваннями. Окрім того, є пацієнти, які не відповідають цьому чіткому визначенню; наприклад, деякі з них мають менше 15 еозинофілів в полі зору мікроскопа високої потужності (× 400), але за іншими критеріями відповідають EoЕ [8].
EoE є клініко-патологічним діагнозом. Найбільш поширеними причинами еозинофілії стравоходу є ГЕРХ і EoE [8]. Останнім часом була визначена ще одна форма стравохідної еозинофілії, клінічні прояви і гістологічні особливості якої не відрізняютья від EoЕ, за винятком того, що вона реагує на високі дози інгібіторів протонної форми, тоді як EoE є гістологічно резистентним до препаратів цієї групи [12]. Є припущення, що ця форма еозинофілії стравоходу та ЕоЕ є наслідком одного й того ж базового імунного механізму, але необхідні додаткові дослідження, щоб підтвердити цю концепцію.
EoE і ГЕРХ мають істотні спільні клінічні та гістологічні ознаки. Наприклад, печія та еозинофілія слизової оболонки стравоходу досить поширені при обох цих станах. Тому сучасні рекомендації з діагностики та лікування ЕоЕ включають пробну терапію інгібіторами протонної помпи. Належно діагноз ГЕРХ рекомендований для тих пацієнтів, які відповіли на цю терапію, на противагу тим пацієнтам, в яких не було відповіді на зазначене лікування інгібіторами протонної помпи, у цьому випадку пацієнти розглядалися як хворі на ЕоЕ [8]. Однак застосування діагностичної проби з інгібіторами протонної помпи не показало чіткої користі для диференціальної діагностики ЕоЕ та ГЕРХ, але в результаті було виявлено групу пацієнтів із так званою езофагеальною еозинофілією, які чутливі до цих препаратів [12].
EoE є хронічним і прогресуючим захворюванням з ризиком розвитку таких серйозних ускладнень, як стриктури та перфорації стравоходу, для усунення яких необхідне якомога раннє підтвердження цих ускладнень для проведення вчасного й адекватного лікування [13]. Поряд з медикаментозною терапією дуже важливе значення має елімінаційна дієта. У наш час причинні продукти визначаються за результатами гістологічного дослідження і за настанням клінічної ремісії ЕоЕ після застосування елімінаційної дієти. На практиці після виключення причинно-значущого продукту і після його повторного введення має проводитися ендоскопічний і гістологічний контроль. Для того, щоб чітко визначити обсяг елімінаційної дієти, необхідні серії ендоскопій. Такий підхід вимагає великих витрат часу, коштів, викликає незручності для пацієнтів, впливає на якість їх життя [14].
Отже, існує необхідність розробки неінвазивних методів ідентифікації продуктів, що викликають ЕоЕ. Не існує єдиного лабораторного тесту для підтвердження діагнозу ЕоЕ. Помірна еозинофілія периферійної крові може бути, а може і не виявлятися. Як біомаркери моніторингу цієї хвороби можуть виступати еотаксин-3 (CCL26) та вивільнений еозинофілами нейротоксин [15]. Сьогодні проводиться вивчення діагностичної цінності методу визначення харчових специфічних IgG4 у сироватці крові. Також є припущення, що може бути корисним фенотипування пацієнтів, засноване на експресії гена стравоходу [16].
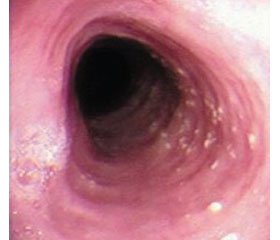
Під час ендоскопічного дослідження при ЕоЕ слизова оболонка стравоходу може бути незмінена. Окрім того, можуть виявлятися різноманітні неспецифічні ознаки запалення. Основними ендоскопічними ознаками EoЕ є: набряк, борозни і стриктури, кільця й ексудат (бляшки, наліт). Набряк визначається збідненим судинним рисунком і блідістю слизової оболонки. Перехідні концентричні кільця або трахеїзація може вказувати на поздовжнє скорочення м’язів стравоходу [1, 9] (рис. 1). Фіксовані кільця можуть вказувати на формування фіброзних стриктур внаслідок ремоделювання тканини. Ексудат або білі плями часто імітують кандидозний езофагіт, але гістологічно вони представлені еозинофільними мікроабсцесами. Борозни виникають внаслідок епітеліального набряку, мають вигляд вертикальних ліній, що проходять паралельно осі стравоходу. На жаль, хронічне еозинофільне запалення стравоходу може призвести до стриктур та рубців [17].
/91-1.jpg )
Частим ускладненням ЕоЕ є звуження його просвіту. Слизова оболонка, що нагадує гофрований папір, спостерігається внаслідок підвищеної крихкості слизової оболонки стравоходу під час проходження ендоскопа, але не після дилатації стравоходу. Якщо в одного і того ж пацієнта наявні більше ніж одна з вищеперерахованих ендоскопічних ознак, це не свідчить про специфічність саме для ЕоЕ [19].
Високоспецифічною ознакою для ЕоЕ є непіддатливість і пружність (туга еластичність) слизової оболонки стравоходу при проведенні біопсії. Прямим показанням до біопсії і подальшого гістологічного дослідження слизової оболонки стравоходу, незважаючи на нормальну ендоскопічну картину, є анамнестичні дані та скарги на дисфагію [20]. Рекомендовано проведення від 2 до 4 біопсій з проксимального і дистального відділів стравоходу (на 5 см вище від гастроезофагеального переходу), а також цільової біопсії зі змінених ділянок слизової оболонки, тобто ексудату, кілець, набряків, борозен і стриктур [11, 25]. Також з метою виключення еозинофільного гастроентериту рекомендовано проведення біопсії зі слизової шлунка та дванадцятипалої кишки [25].
Великими гістологічними критеріями ЕоЕ вважаються еозинофільна інфільтрація плоского епітелію (зазвичай > 15 еозинофілів у полі зору мікроскопа високої потужності), скупчення еозинофілів у поверхневому шарі та еозинофільні мікроабсцеси (≥ 4 еозинофілів) [8, 9, 21] (рис. 2). Часто зустрічаються у поверхневих шарах некротизовані сквамозні клітини [22]. Малі критерії включають хронічний запальний інфільтрат у власній пластинці слизової оболонки стравоходу з фіброзом власної пластинки слизової оболонки, гіперплазію м’язових шарів і базальних епітеліальних клітин з подовженням сосочків власної пластинки і міжклітинним набряком [22]. Було проведено дослідження, що виявило велику кількість IgG4 у плазматичних клітинах власної пластинки слизової оболонки стравоходу [23].
/92-1.jpg )
Патологічні зміни слизової оболонки стравоходу розподілені нерівномірно і загалом вражають стравохід по всій його довжині. Проте жодна гістологічна знахідка не є специфічною для еозинофільного езофагіту. Еозинофілія слизової оболонки стравоходу зустрічається при різних патологічних станах — ГЕРХ, еозинофілії стравоходу, що чутлива до інгібіторів протонної помпи, еозинофільному гастроентериті, гіпереозинофільному синдромі, хворобі Крона, хворобах сполучної тканини, медикаментозній гіперчутливості, паразитарних і грибкових інфекціях, ахалазії. У клінічній практиці виникають складнощі щодо диференціації ЕоЕ від ГЕРХ і стравохідної еозинофілії, чутливої до інгібіторів протонної помпи [24]. Дегрануляція еозинофілів у біоптатах розглядається як вагома риса скоріше ЕоЕ, ніж ГЕРХ. При EoЕ еозинофільне запалення виходить за межі слизової оболонки та уражає підслизовий і м’язовий шари [25].
Застосування інших методів діагностики є допоміжними у диференційній діагностиці ЕоЕ, оскільки вони не виявляють патогномонічних для ЕоЕ ознак. Так, при дослідженні з барієм картина стравоходу може бути нормальною, іноді виявляються звуження діаметра стравоходу, кільця та ізольовані стриктури [25]. Манометрія стравоходу зазвичай свідчить про нормальну його перистальтику. У дітей з ЕоЕ при пролонгованій манометрії та рН-метрії виявляється неефективна перистальтика стравоходу. Ехоендоскопія може виявити потовщення всіх шарів стінки стравоходу внаслідок запалення і набряку [25].
Еозинофільні гастрит і гастроентерит. На відміну від ЕоЕ при цих захворюваннях еозинофільна інфільтрація не обмежується одним органом, а уражає декілька відділів ШКТ — частіше одночасно до алергічного запалення залучаються шлунок і кишечник (еозинофільний гастроентерит).
Еозинофільний гастроентерит і еозинофільний езофагіт мають спільний патогенез. Їх загальні характеристики включають тканинне еозинофільне запалення, що асоційоване з алергічними реакціями, периферичну еозинофілію та сенсибілізацію до харчових алергенів. Аналіз кількох серій випадків дозволяє припустити, що еозинофільний гастроентерит також піддається елементній і елімінаційній дієті [26].
Клінічні прояви еозинофільних гастриту та гастроентериту. Залежно від глибини ушкодження гастроінтестинального тракту спостерігаються такі прояви: епігастральний біль, нудота, блювання, діарея (при ураженні тільки слизового шару шлунка та кишки); симптоми непрохідності — метеоризм, нудота, блювання (при ураженні м’язового шару цих відділів ШКТ); асцит (при концентруванні еозинофілів в субсерозному шарі) [18, 27].
Діагностика еозинофільних гастриту та гастроентериту. На відміну від ЕоЕ немає єдиних рекомендацій щодо діагностики еозинофільного гастроентериту. Діагноз ґрунтується на наявності типових симптомів у поєднанні зі збільшенням числа еозинофілів у слизовій оболонці шлунка та дванадцятипалої кишки за відсутності інших потенційних причин гастроінтестинальної еозинофілії. Ендо–скопічне дослідження з біопсією є інформативними при ушкодженні слизової оболонки. Ендоскопічні зміни — гіперемія, ерозії, нодулярність або поліпоїдні розростання в антрумі та/або тонкій кишці. [22]. Вважається, що відносно типовою ознакою для еозинофільного гастроентериту є наявність псевдополіпів [28]. Також не існує єдиної думки щодо конкретного рівня тканинної еозинофілії для встановлення діагнозу. Гістологічна ознака, що базується на дослідженнях групи здорових дітей, характеризує еозинофілію шлунка від 30 еозинофілів у полі зору мікроскопа високої потужності при еозинофільному гастриті та від 50 еозинофілів у полі зору мікроскопа високої потужності у дванадцятипалій кишці при еозинофільному дуоденіті [27]. Додаткові ознаки, такі як внутрішньозалозиста еозинофілія, внутрішньом’язова еозинофілія, також є вагомими у встановленні діагнозу еозинофільного гастроентериту. Інтенсивність еозинофільного запалення може бути неоднорідною в межах одного ураженого органу. Тому необхідно брати біопсію з 5–6 ділянок ураженого відділу ШКТ аналогічно до рекомендацій із діагностики ЕоЕ [11]. При еозинофільному ураженні м’язового або субсерозного шару шлунка або кишки діагноз може бути підтверджений при дослідженні біоптатів, які взяті під час операції, або цитологічному аналізі асцитичної рідини [22]. З урахуванням алергічного походження еозинофільного гастроентериту до його додаткових критеріїв належать наявність IgE-сенсибілізації до харчових алергенів і тканинна еозинофілія [28].
Клітинно-опосередкована гастроінтестинальна харчова алергія
До клітинно-опосередкованої гастроінтестинальної ХА належать ентероколітичний синдром, ентеропатія та проктоколіт, що індуковані харчовими білками.
Ентероколітичний синдром, індукований харчовими білками, має гострий і хронічний перебіг. Клінічна картина характеризується багаторазовим блюванням, що виникає через 1–2 години після прийому причинних продуктів, далі приєднується діарея. Іноді цей синдром супроводжується системними проявами, такими як млявість, зниження артеріального тиску, блідість, гіпотермія, кров у калі, симптоми кишкової непрохідності, іноді гіпертермія [29], що спочатку помилково розцінюється як сепсис або гостра хірургічна патологія.
До розвитку хронічного ЕКС у більшості випадків призводить щоденний або постійний вплив алергенного продукту. Цей стан характеризується періодичним блюванням, здуттям живота, хронічною діареєю (часто зі слизом або кров’ю), відставанням у зрості та масі тіла [29]. Вираженість симптомів зменшується через декілька днів після елімінаційної дієти. Загострення ЕКС виникають при повторному вживанні алергену, і, якщо кількість вживаного продукту велика, клінічні прояви можуть бути дуже тяжкими [30].
Однією з найпоширеніших причин ЕКС є алергія до білків коров’ячого молока, а також до алергенів сої у харчових сумішах [2, 31]. Раніше вважалося, що у дітей, які перебувають на грудному вигодовуванні, алергія не виникає, проте нещодавно з’явилася інформація щодо пацієнтів з ЕКС, в яких виникла реакція на білок коров’ячого молока і білок сої, що містилися у грудному молоці матері-годувальниці [18, 26]. Також отримано дані про такі причинні продукти при ЕКС: рис, овес, яйце [32, 34–36], картопля, куряче м’ясо, банани, баранина, кукурудза, цитрусові [34]. Зазвичай ЕКС маніфестує в перші півроку життя.
Діагностика ЕКС, індукованого харчовими білками. Завданням лікарів в успішному лікуванні ЕКС є вчасна діагностика, зменшення проміжку часу між першим епізодом і встановленням діагнозу. Адже пізня діагностика ЕКС загрожує високим ризиком неякісних діагностичних оцінок і помилкових методів лікування.
Діагностика базується на наявності комплексу клінічних проявів і певних результатах лабораторних методів дослідження. Критеріями діагностики вважаються [32]: 1) зникнення після повної елімінації з раціону антигенних продуктів блювання, діареї, крові та лейкоцитів у калі; 2) доведена відсутність іншої причини коліту; 3) відсутність повторних епізодів такої симптоматики на фоні вживання харчової суміші зі зниженим антигенним складом, при цьому маса тіла нормалізується протягом першого місяця такого харчування; 4) повернення симптомів після провокації сумішами на основі молока, сої або інших причинних продуктів. Оральний провокаційний тест вважається позитивним, якщо є три з таких п’яти ознак:
1) блювання та/або діарея;
2) кров у калі;
3) лейкоцити в калі;
4) еозинофілія калу;
5) зміни в крові числа поліморфноядерних нейтрофілів.
Оральний провокаційний тест є вирішальним у діагностиці даного захворювання, проте має великий ризик виникнення системних алергічних реакцій, тому при типовій клінічній картині може бути упущений для підтвердження діагнозу [33].
Останніми роками частіше використовуються такі критерії ентероколіту:
1) виникнення у дітей віком до 9 місяців;
2) повторний вплив причинних продуктів викликає діарею та/або рецидивне блювання протягом 24 годин без будь-яких інших причин для їх виникненя; 3) не було інших гастроінтестинальних симптомів на підозрювані харчові продукти [33].
Такі методи діагностики, як шкірний прик-тест і специфічні IgE сироватки крові до причинних продуктів, у більшості пацієнтів з ЕКС (понад 90 %) дають негативний результат. Однак у деяких пацієнтів виявляються специфічні IgE та позитивні прик-тести; спостерігаються симптоми з тенденцією до персистенції, у таких пацієнтів частіше розвивається IgE-опосередкована ХА. Через це роль специфічних IgE-антитіл у патогенезі ЕКС залишається до кінця нез’ясованою [32].
У пацієнтів з білок-індукованим ентероколітичним синдромом у слизовій оболонці дванадцятипалої кишки були виявлені специфічні IgE до причинних продуктів. Відзначено, що 4–30 % дітей з ЕКС мають спочатку або матимуть через деякий час підвищений рівень специфічних IgE до харчових продуктів [34]. Припустима думка, що у таких дітей сповільнений розвиток ЕКС. У більшості дітей, в яких були виявлені специфічні IgE, зберігається фенотип білок-індукованого ЕКС. Проте у 35 % дітей з ЕКС, викликаним білками коров’ячого молока, можуть виникати симптоми, типові для IgE-опосередкованої ХА на продукти харчування, які раніше індукували реакції ЕКС [35]. І навпаки, розвиток ЕКС було зареєстровано у дітей молодшого віку з IgE-опосередкованою ХА, викликаною декількома харчовими продуктами [36], тобто спостерігався розвиток алергічної реакції за двома патогенетичними шляхами: клітинно-залежним і IgE-опосередкованим. При уникненні харчових білків, що індукують ЕКС, може виникати IgE-сенсибілізація через альтернативні шляхи, а саме через шкіру. Зважаючи на відносно низьку відповідність (узгодженість) між шкірним прик-тестом і серологічним дослідженням у дітей раннього віку, для виявлення специфічних харчових IgE може виникнути необхідність у використанні обох методів дослідження [37].
Спірними також залишаються питання щодо корисності атопічних патч-тестів для первинної діагностики і прогнозу ЕКС. Є дані їх про високу чутливість і специфічність, а також точність у діагностиці реакції сповільненого типу в дітей із гастроінтестинальними симптомами. Проте є дослідження, що демонструють високу чутливість (67 %) і специфічність (100 %) у діагностиці алергічних гастроінтестинальних проявів у відповідь на пшеницю порівняно з нижчою чутливістю (21 %) для виявлення алергії до білків коров’ячого молока [38], що потребує уточнення діагнозу за допомогою провокаційного тесту.
При дослідженні периферійної крові нейтрофільоз зазвичай відзначається при гострих симптомах, через 6 годин після вживання причинного продукту. Тромбоцитоз виявляється в більше ніж 60 % випадків гострого ЕКС. Для хронічного ЕКС характерні лімфоцитоз, еозинофілія, гіпоальбумінемія. Також спостерігається підвищення рівня С-реактивного білка (СРБ). Зазвичай нормалізація лабораторних показників і зменшення вираженості клінічних проявів спостерігаються через 48 годин після елімінації причинного продукту [38].
Залежно від тяжкості та/або тривалості симптомів виявляють наявну або приховану кров, кристали Шарко — Лейдена, збільшення вмісту вуглеводів, лейкоцитів та еозинофілів при копрологічному дослідженні [39].
Оглядова рентгенографія може виявити збільшення петель кишечника, вільний газ, здуття кишечника, незначне потовщення стінки порожньої кишки. Дані ознаки можуть імітувати кишкову непрохідність або некротичний ентероколіт у немовлят [33].
При ендоскопічному дослідженні виявляються рихлість слизової оболонки товстої кишки, виразки та кровоточивість слизової оболонки прямої кишки [33].
При гістологічному дослідженні спостерігають нетипове запалення: набряк, атрофію ворсинок і клітинну інфільтрацію дванадцятипалої і порожньої кишки лімфоцитами, еозинофілами, мастоцитами. Значно підвищується проникнення TNF-α і мононуклеарів у власну пластинку, особливо якщо наявна атрофія ворсинок. Крім того, відзначено підвищену секрецію мононуклеарами периферійної крові TNF-α, а також виявлено велику його кількість у калі після провокації молоком у хворих на гастроінтестинальну алергію. TNF-α, як відомо, збільшує проникність кишечника, що відіграє певну роль у патогенезі ЕКС [32].
Отже, аналіз калу, рентгенологічна картина, ендоскопія можуть виявити деякі відхилення, що є неспецифічними і не є частиною рутинної діагностики ЕКС, яка переважно ґрунтується на клінічних проявах. Раннє розпізнавання ЕКС і усунення причинної їжі має вирішальне значення у профілактиці рецидивів і поліпшенні якості життя дітей.
Проктоколіт, індукований харчовими білками, маніфестує в перше півріччя життя. Характерні такі клінічні прояви: прожилки крові та слизу у випорожненнях у перші місяці життя; іноді з’являються коліки та часті випорожнення без відхилень у фізичному розвитку дитини. Розвиток системних реакцій нехарактерний (за винятком ректальної кровотечі) [32, 34]. Найчастішою причиною виникнення білок-індукованого проктоколіту є алергія до білків коров’ячого молока та алергія на соєві білки, що входять до складу сумішей. Хвороба розвивається навіть у дітей, які перебувають на грудному вигодовуванні у відповідь на продукти з раціону матері [32]. Якщо причина білок-індукованого проктоколіту не встановлена і буде продовжуватися вживання алергену, це може призвести до хронічного алергічного гастриту і гастродуоденіту, що будуть загострюватися при кожному вживанні причинного продукту.
Діагностика проктоколіту, індукованого харчовими білками, ґрунтується на клінічних ознаках, таких як ректальні кровотечі, в більшості випадків асоційованих із діареєю зі слизом, хоча випорожнення може бути і нормальним. Результати лабораторних досліджень у більшості пацієнтів без патологічних відхилень, проте в деяких випадках можна виявити анемію, гіпоальбумінемію або еозинофілію периферійної крові.
Гістологічно визначають еозинофільну інфільтрацію та скупчення еозинофілів із розвитком гранульом; іноді діагностують виразки в шлунку або дванадцятипалій кишці [40].
На жаль, немає неінвазивних специфічних діагностичних методів дослідження цього захворювання, а існуючим лабораторним або біохімічним методам дослідження не вистачає специфічності та чутливості. Ультразвукове дослідження здатне виявити лише потовщення слизової оболонки кишечника. Шкірні прик-тести та визначення рівня специфічних IgЕ демонструють негативні результати. Встановлення діагнозу захворювання принципово базується на детальному вивченні анамнезу та реакції пацієнта на усунення причинного продукту після виключення інших можливих захворювань — інфекцій, некротичного ентероколіту, інвагінації або анальної тріщини. У більшості випадків хвороба діагностується та лікується на емпіричній основі. Провокаційний тест є дуже корисним щодо підтвердження діагнозу, хоча і доволі небезпечним. Є дослідження, в яких шляхом ендоскопії та біопсії був підтверджений алергічний проктоколіт у 64 % зовнішньо здорових дітей з ректальною кровотечею. Ректоманоскопія і біопсія не є обов’язковими для рутинної діагностики, якщо пацієнт позитивно відреагував на елімінацію білків. У разі збереження клінічних проявів і скарг у відповідь на дієту мають бути застосовані ендоскопія та біопсія.
Ендоскопічна картина білок-індукованого проктоколіту характеризується набряком і гіперемією слизової оболонки з можливими поверхневими ерозіями або виразками, крововиливами, лімфонодулярною гіперплазією (рис. 3). Пошкоджені поверхні (зокрема, низхідної частини товстої кишки і сигмоподібної кишки) чергуються з незміненими ділянками (відновленими ділянками). Загальними гістологічними ознаками хвороби є лімфонодулярна гіперплазія та еозинофілія власної пластинки слизової оболонки, рідше абсцеси крипт [41].
Диференціальна діагностика не-IgE-опосередкова-ної гастроінтестинальної алергії включає такі патологічні стани: інфекції (бактеріальні, вірусні, паразитарні), хворобу Гіршпрунга, ГЕРХ, ідіопатичну гіпертрофію пілоруса, інвагінацію кишечника, мальротацію, кишкову непрохідність, запальні захворювання кишечника, первинні імунодефіцити, автоімунну ентеропатію, целіакію, розлади коагуляції.
Анафілаксія і особливо ізольовані IgE-опосе-редковані гастроінтестинальні реакції можуть бути сплутані з гострим білок-індукованим ентероколітичним синдромом. Відмінні риси на користь діагнозу ентероколітичного синдрому — повторні епізоди блювання фонтаном, блідість і млявість, відсутність респіраторних і шкірних алергічних ознак, відсутня IgE-сенсибілізація до причинного продукту. Також існує значна фенотипова відмінність між не-IgE-гастроінтестинальною ХА і первинними еозинофільними шлунково-кишковими розладами (група запальних гастроінтестинальних розладів, при яких еозинофіли інфільтрують кишечник за відсутності відомих причин для такої тканинної еозинофілії). При хронічному ЕКС після елімінації алергену та подальшої провокації причинним продуктом виникають гострі прояви тяжкого блювання, чого не спостерігається у хворих із первинними еозинофільними розладами.
При білок-індукованій ентеропатії тригерами її виступають декілька основних продуктів, у той час як первинні еозинофільні захворювання викликаються багатьма харчовими алергенами. За даними біоптатів білок-індукована ентеропатія характеризується атрофією ворсинок, лімфонодулярною гіперплазією, збільшенням числа інтраепітеліальних лімфоцитів з невеликою кількістю еозинофілів. На противагу цьому первинні еозинофільні ураження ШКТ відрізняються значним еозинофільним запаленням з інфільтрацією мастоцитами [42].
У диференціальній діагностиці білок-індукованого ентероколітичного синдрому, особливо у випадку, коли в ролі тригера виступають декілька харчових продуктів, варто як альтернативу розглянути некротичний ентероколіт і метаболічні розлади, такі як триметиламінурія та спадкова непереносимість фруктози [43]. У всіх дітей з хронічними гастроінтестинальними симптомами важливо виключити целіакію. Ще до початку елімінаційної дієти (яка, в свою чергу, передбачає усунення продуктів з пшениці) слід визначити рівні специфічних антитіл до тканинної трансглутамінази [44]. У разі відсутності поліпшення симптоматики на фоні точної елімінаційної дієти необхідно розглянути можливість існування інших захворювань, таких як ранній початок запалення кишечника та моногенних імунодефіцитних розладів [45, 46].
З огляду на типові клінічні симптоми та точні критерії для позитивного результату орального провокаційного тесту вважається, що ендоскопічне обстеження не є першочерговим у пацієнтів з підо–зрою на гострий білок-індукований ентероколітичний синдром, але може відігравати важливу роль при стійких і тяжких хронічних гастроінтестинальних проявах, які не чутливі до елімінаційної дієти, для виключення іншої патології ШКТ [31].
Діагноз білок-індукованого проктоколіту і білок-індукованої ентеропатії перш за все підтверджується результатами гістологічного дослідження в поєднанні зі звичайними клінічними проявами. Наявність лімфонодулярної гіперплазії в цибулині дванадцятипалої кишки та в ободовій кишці з наявністю ерозій або без них є характерною, але не однозначною особливістю білок-індукованої ентеропатії, також має місце збільшення числа інтраепітеліальних лімфоцитів (> 25/100 епітеліальних клітин) за відсутності целіакії [46].
Отже, діагностика гастроінтестинальної алергії базується на тестах, вибір яких залежить від типу алергічних реакцій (IgE-опосередкованої, не-IgE-опосередкованої та змішаної реакції) [2, 47, 48].
Методами високої чутливості та специфічності є:
— ретельний збір анамнезу: особливості сімейного та індивідуального алергологічного анамнезу (скарги, обтяжена спадковість, дані харчового щоденника), характер клінічних проявів — гастроінтестинальні прояви, супутні шкірний, респіраторний та інші синдроми);
— елімінаційна дієта (дієтодіагностика);
— відкритий провокаційний тест;
— ендоскопічне дослідження;
— біопсія слизової оболонки гастроінтестинального тракту.
Методи високої чутливості, але низької специфічності, що свідчать тільки про сенсибілізацію, а не про захворювання:
— визначення загального IgE у сироватці крові, специфічні IgE до харчових продуктів, шкірні прик-тести з харчовими алергенами (при IgE-залежній алергії);
— патч-тести з харчовими алергенами (при не-IgE-залежній алергії).
Зважаючи на неспецифічність клінічних проявів гастроінтестинальної ХА, диференціальну діагностику слід проводити з такими захворюваннями [2]:
— захворювання й аномалії розвитку травної системи;
— психічні та метаболічні порушення;
— інтоксикації;
— інфекційні хвороби;
— недостатність ендокринної функції підшлункової залози;
— целіакія;
— муковісцидоз;
— імунодефіцити;
— дисахаридазна недостатність;
— побічна дія лікарських засобів;
— ендокринна патологія;
— синдром подразненого кишечника.
Беручи до уваги результати власних спостережень, що базувались на порівняльній оцінці низки клінічних проявів з боку ШКТ у 60 хворих на ХА і дітей із захворюванням органів травлення без супутньої алергічної патології, ми дійшли висновку, що за характером скарг і даних об’єктивного обстеження істотної різниці між хворими обох груп не відзначено [49]. Так, пальпаторна болючість різного ступеня інтенсивності в епiгастрiї, точці Кера, зоні Шоффара, навколопупковiй дiлянцi, пiлородуоденальнiй зоні, по ходу кишечника, а також позитивний симптом Ортнера спостерігались у дітей обох груп порівняння, а у 28 % хворих на ХА біль у животі був відсутній. Спільними для хворих обох груп були диспептичні прояви та астеновегетативні розлади. Щодо характеру випорожнень, то схильність до діареї спостерігалась у 25 % дітей, а до запорів — у 18,3 % пацієнтів, у 76,7 ± 10,9 % хворих порушень випорожнення не було. Наведене вище свідчить про те, що скарги та об’єктивні ознаки шлунково-кишкових розладів не є патогномонічними лише для гастроінтестинальної форми ХА, і у випадку їх наявності у дитини з алергією слід провести ретельний харчовий анамнез і певне інструментально-лабораторне обстеження для підтвердження або виключення алергічного ураження ШКТ. У дітей з гастроінтестинальними проявами і коморбідною алергічною патологією частiше виявлялось пiдвищення рiвня еозинофiлiв периферичної крові та загального сироваткового IgE. При цьому рівні IgE не залежали від тяжкості стану дитини чи кількості наявних у неї алергічних захворювань. Спостерігалися варіанти поєднання ХА, бронхіальної астми та алергічного риніту, при яких рівень IgE залишався в межах вікових нормативів, натомість при легкій формі атопічного дерматиту та ХА рівень IgE був у декілька разів вищий за норму. Отже, розвиток алергічного ураження ШКТ відбувається за участю різних механізмів, не обов’язково із залученням IgE. Разом з тим визначення специфiчних IgE до конкретних харчових продуктів перш за все сучасними методами молекулярної алергодіагностики є доцільним і корисним, оскільки IgE-опосередкований механізм формування алергії зустрічається у 75 % хворих на гастроінтестинальну алергію, може поєднуватися з іншими імунними шляхами розвитку алергічних уражень ШКТ у дітей, і є корисним, хоча й не єдиним методом верифікації діагнозу гастроiнтестинальної форми ХА.
Незмикання кардiї у виглядi гастроезофагеального рефлюксу має вірогідне значення для дiагностики алергiчної патологiї ШКТ (χ2 (1) = 14,095, φ = 0,374, що свідчить про середню силу зв’язку) [49].
Ендоскопічна картина слизової оболонки верхнього відділу ШКТ у дiтей з проявами ХА і патологією ШКТ без ХА була різноманітною, але не спроможна чітко підтвердити алергічний характер виявлених патологічних змін.
При гістологічному дослідженні слизової оболонки ШКТ у дітей з ХА стравохiд не мав патологічних змін; а у шлунку і дванадцятипалій кишці виявлено ознаки хронiчного iмуно-алергiчного запалення: помiрна атрофія ворсинок з укороченням та розширенням крипт; у просвіті окремих залоз — щільний оксифільний секрет, а у власній пластинці слизової оболонки спостерігалась нерівномірна помірна інфільтрація плазматичними клiтинами з поодинокими лiмфоцитами та еозинофілами. У дітей групи порiвняння з боку стравоходу теж не виявлено патологічних знахідок. У шлунку і дванадцятипалій кишці помітні ознаки хронiчного неспецифiчного запалення з вогнищами субатрофiї, псевдополiпозної гіперплазії та щільної сполучної тканини, у власнiй пластинцi слизової оболонки визначено розсiяну лiмфоїдно-плазмоклiтинну iнфiльтрацiю, наявність лiмфатичних фолiкулів, крипт-абсцесів, вкорочення ворсинок.
Нами був проведений аналіз гастроінтестинальних проявів у дітей з атопічним дерматитом [50], який засвідчив, що ураження ШКТ спостерігалися у 82 % дітей, порушення випорожнення — у 36 % (з них у 14 % — запори, у 14 % — неоформлене випорожнення, у 8 % — чергування запорів з неоформленим випорожненням), панкреатопатії (у 23 %), гепатомегалії (у 14 %), а також відхилення з боку кишкової мікрофлори (у 46 %). Встановлено вікову залежність виникнення дисбактеріозу, що мав місце переважно в дітей молодшого віку. Найчастіше дисбактеріоз поєднувався з іншими порушеннями з боку ШКТ, лише у 9 % дітей він був ізольованим. Ранній дебют атопічного дерматиту частіше поєднується з ураженням органів травлення: у хворих грудного віку він спостерігався в 90 % випадків.
Отже, гастроінтестинальна форма ХА характеризуються розмаїттям і неспецифічністю проявів, що ускладнює диференціальну діагностику із захворюваннями різного походження, що мають перебіг із розладами ШКТ, внаслідок чого ускладнюється верифікація діагнозу. Існуючі методи діагностики гастроінтестинальної алергії є обмеженими та недосконалими, що вимагає подальших наукових пошуків і досліджень, спрямованих на вчасне виявлення цієї патології, профілактику виникнення у генетично схильних дітей, розробку оптимальних алгоритмів діагностики, попередження прогресування клінічних проявів, вибір індивідуальної дієтотерапії і адекватного медикаментозного лікування.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Балаболкин И.И. Пищевая аллергия у детей / Под ред. И.И. Балаболкина, В.А. Ревякиной. — М., 2010. — 190 с.
2. Caubet J.C. Non-IgE-mediated gastrointestinal food allergies in children / Caubet J.C., Szajewska H., Shamir R., Nowak-Węgrzyn A. Pediatr Allergy Immunol. — 2016. — Vol. 28. — P. 6-17.
3. Охотникова Е.Н. Гастроинтестинальная пищевая аллергия у детей / Е.Н. Охотникова // Клінічна імунологія. Алергологія. Інфектологія. — 2013. — № 2. — С. 5-13.
4. Price A. Oral Allergy Syndrome (Pollen-Food Allergy Syndrome) / Price A., Ramachandran S., Gideon P. et al. // Dermatitis. — 2015. — Vol. 26, № 2. — P. 88-78.
5. Flores E. Plant food allergy in patients with pollinosis from the Mediterranean area / Flores E., Cervera L., Sanz M.L., Diaz-Perales A., Fernández J. // Int. Arch. Allergy Immunol. — 2012. — Vol. 159, № 4. — P. 346-354.
6. Ma S., Sicherer S.H., Nowak-Wegrzyn A. A survey on the management of pollen-food allergy syndrome in allergy practices / Ma S., Sicherer S.H., Nowak-Wegrzyn A. // J. Allergy Clin. Immunol. — 2003. — Vol. 112, № 4. — P. 784-788.
7. Ballmer-Weber B.K. Predictive value of the sulfidoleukotriene release assay in oral allergy syndrome to celery, hazelnut, and carrot / Ballmer-Weber B.K., Weber J.M., Vieths S., Wüthrich B. // J. Investig. Allergol. Clin. Immunol. — 2008. — Vol. 18, № 2. — P. 93-99.
8. Liacouras C.A. Eosinophilic esophagitis: Updated consensus recommendations for children and adults / Liacouras C.A., Furuta G.T., Hirano I. et al. // J. Allergy Clin. Immunol. — 2011.— Vol. 128, № 1. — P. 3-20.
9. Dellon E. ACG clinical guideline: evidenced based approach to the diagnosis and management of esophageal eosinophilia and eosinophilic esophagitis (EoE) / Dellon E., Gonsalves N., Hirano I. et al. // Am. J. Gastroenterol. — 2013. — Vol. 108. — P. 679-692.
10. Simon D. Eosinophilic esophagitis is characterized by a non-IgE-mediated food hypersensitivity / Simon D., Cianferoni A., Spergel J.M. et al. // Allergy. — 2016. — Vol. 71, № 5. — P. 611-20.
11. Straumann A. Pediatric and adult eosinophilic esophagitis: similarities and differences / Straumann A., Aceves S., Blanchard C. et al. // Allergy. — 2012. — Vol. 67. — P. 477-490.
12. Molina-Infante J. Proton pump inhibitor-responsive oesophageal eosinophilia: an entity challenging current diagnostic criteria for eosinophilic oesophagitis / Molina-Infante J., Bredenoord A.J., Cheng E.et al. // Gut. — 2015. — Vol. 65. — P. 524-531.
13. Schoepfer A.M. Delay in diagnosis of eosinophilic esophagitis increases risk for stricture formation in a time-dependent manner / Schoepfer A.M., Safroneeva E., Bussmann C. et al. // Gastroentero–logy. — 2013. — Vol. 145. — P. 1230-1236.
14. Lucendo A.J. Empiric 6-food elimination dietm induced and maintained prolonged remission in patients with adult eosinophilic esophagitis: a prospective study in the food cause of the disease / Lucendo A.J., Arias A., Gonzalez-Cervera J. // J. Allergy Clin. Immunol. — 2013. — Vol. 131. — P. 797-804.
15. Konikoff M.R. Potential of blood eosinophils, eosinophil-derived neurotoxin, and eotaxin-3 as biomarkers of eosinophilic esophagitis / Konikoff M.R., Blanchard C., Kirby C. et al. // Clin. Gastroenterol. Hepatol. — 2006. — Vol. 4. — P. 1328-1336.
16. Wen T. Molecular diagnosis of eosinophilic esophagitis by gene expression profiling / Wen T., Stucke E.M., Grotjan T.M. et al. // Gastroenterology. — 2013. — Vol. 145. — P. 1289-1299.
17. Dellon E., Kim H., Sperry S. et al. A phenotypic analysis shows that eosinophilic esophagitis is a progressive fibrostenotic disease // Gastrointest. Endosc. — 2014. — Vol. 79. — P. 577-785.
18. Новик Г.А. Гастроинтестинальная аллергия у детей / Г.А. Новик, М.А. Ткаченко [Текст] // Лечащий врач. — 2012. — № 1. — С. 16-26.
19. Sopo M. Clinical management of food protein induced enterocolitis syndrome / Sopo M., Iacono D., Monicaa G., Giovannac M. // Curr. Opin. Allergy Clin. Immunol. — 2014. — Vol. 14, № 3. — P. 240-245.
20. Dellon E.S., Gebhart J.H., Higgins L.L., Hathorn K.E., –Woosley J.T., Shaheen N.J. The esophageal biopsy “pull” sign: a highly specific and treatment-responsive endoscopic finding in eosinophilic esophagitis / Dellon E.S., Gebhart J.H., Higgins L.L., Hathorn K.E., Woosley J.T., Shaheen N.J. // Gastrointest. Endosc. — 2016. — Vol. 83, № 1. — P. 92-100.
21. Monjur Ahmed. Eosinophilic esophagitis in adults: An update / Monjur Ahmed // World J. Gastrointest. Pharmacol. Ther. — 2016. — Vol. 7, № 2. — P. 207-213.
22. Odze R.D. Pathology of eosinophilic esophagitis: what the clinician needs to know / Odze R.D. // Am. J. Gastroenterol. — 2009. — Vol. 104. — P. 485-490.
23. Clayton F. Eosinophilic esophagitis in adults is associated with IgG4 and not mediated by IgE / Clayton F., Fang J.C., Gleich G.J., Lucendo A.J., et al. // Gastroenterology. — 2014. — Vol. 147. — P. 602-609.
24. Dellon E.S. Diagnosis and management of eosinophilic esophagitis / Dellon E.S. // Clin. Gastroenterol. Hepatol. — 2012. — Vol. 10. — P. 1066-1078.
25. Nurko S. Esophageal dysmotility in children with eosinophilic esophagitis: a study using prolonged esophageal manometry / Nurko S., Rosen R., Furuta G.T. // Am. J. Gastroenterol. — 2009. — Vol. 104. — P. 3050-3057.
26. Gonsalves N. A Prospective Clinical Trial of Six Food Elimination Diet or Elemental Diet in the Treatment of Adults with Eosinophilic Gastroenteritis / Gonsalves N., Doerfler B., Yang G.Y. et al. // Gastroenterology. — 2009. — Vol. 136, № 5. — P. 280-280.
27. Lwin T. Eosinophilic gastritis: histopathological characterization and quantification of the normal gastric eosinophil content / Lwin T., Melton S.D., Genta R.M. // Modern pathology. — 2011. — Vol. 24, № 4. — P. 556-563.
28. Prussin C. Eosinophilic gastrointestinal disease and peanut allergy are alternatively associated with IL-5+ and IL-5(−) T(H)2 responses / Prussin C., Lee J., Foster B. // The Journal of allergy and clinical immunology. — 2009. — Vol. 124, № 6. — P. 326-1332. e1326.
29. Masilamani M. Determinants of food allergy / Masilamani M., Commins S., Shreffler W. // Immunol. Allergy Clin. North Am. — 2012. — Vol. 32. — P. 11-33.
30. Caffarelli C. EWGPAG. Cow's milk protein allergy in children: a practical guide / C. Caffarelli // Pediatr. — 2010. — Vol. 15. — P. 36-45.
31. Sampson H. Food allergy: A practice parameter update-2014 / Sampson H., Aceves S., Bock A. et al. // Ibid. — 2014. — Vol. 134. — P. 1016-1025.
32. Morita H. Gastrointestinal food allergy in infants / Morita H., Nomura I., Matsuda A., Saito H., Matsumoto K. // Allergol. Int. — 2013. — Vol. 62, № 3. — P. 97-307.
33. Nowak-Wegrzyn A. Food protein-induced enterocolitis syndrome / Nowak-Wegrzyn A., Muraro A. // Curr. Opin. Allergy Clin. Immunol. — 2009. — Vol. 9, № 4. — P. 371-377.
34. Nomura I. Non-IgE-mediated gastrointestinal food allergies: distinct differences in clinical phenotype between Western countries and Japan / Nomura I., Morita H., Ohya Y., Saito H., Matsumoto K. // Curr. Allergy Asthma Rep. — 2012. — Vol. 12. — P. 297-303.
35. Scott H. Food protein-induced enterocolitis syndrome: case presentations and management lessons / Scott H., Sicherer // J. Allergy Clin. Immunol. — 2005. — Vol. 115, № 1. — P. 149-56.
36. Banzato C. Unusual shift from IgE-mediated milk allergy to food protein-induced enterocolitis syndrome / Banzato C., Piacentini G.L., Comberiati P., Mazzei F., Boner A.L., Peroni D.G. // Eur. Ann. Allergy Clin. Immunol. — 2013. — Vol. 45. — P. 209-11.
37. Mehl A., Niggemann B., Keil T., Wahn U., Beyer K. Skin prick test and specific serum IgE in the diagnostic evaluation of suspected cow’s milk and hen’s egg allergy in children: does one replace the other? / Mehl A., Niggemann B., Keil T., Wahn U., Beyer K. // Clin. Exp. Allergy. — 2012. — Vol. 42, № 8. — P. 1266-72.
38. Cudowska B. Atopy patch test in the diagnosis of food allergy in children with gastrointestinal symptoms / Cudowska B., Kaczmarski M. // Adv. Med. Sci. — 2010. — Vol. 55, № 2. — P. 153-60.
39. Stephanie A. Manifestations, diagnosis, and management of food protein-induced enterocolitis syndrome / Stephanie A., Leonard S.A., Nowak-Wegrzyn A. // Pediatr. Ann. — 2013. — Vol. 42, № 7. — P. 135-140.
40. Денисова С.Н. Диетотерапия гастроинтестинального синдрома у детей с атопическим дерматитом [Текст] / С.Н. Денисова // Лечащий врач. — 2012. — № 4. — С. 54-55.
41. Volonaki E. Gastrointestinal Endoscopy and Mucosal Biopsy in the First Year of Life: Indications and Outcome / Volonaki E., Sebire N.J. Borrelli O. et al. // J. Pediatr. Gastro Nutr. — 2012. — Vol. 55, № 1. — P. 62-5.
42. Rothenberg M.E. Eosinophilic gastrointestinal disorders (EGID) / Rothenberg M.E. // J. Allergy Clin. Immunol. — 2004. — Vol. 113, № 1. — P. 11-28.
43. Boyce J.A. Guidelines for the diagnosis and management of food allergy in the United States: report of the NIAID-sponsored expert panel / Boyce J.A., Assa’ad A., Burks A.W. et al. // J. Allergy Clin. Immunol. — 2010. — Vol. 126, № 6. — P. 58.
44. Husby S. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease / Husby S., Koletzko S., Korponay-Szabo I.R. et al. // J. Pediatr. Gastroenterol. Nutr. — 2012. — Vol. 54, № 1. —
P. 136-60.
45. Uhlig H.H. The diagnostic approach to monogenic very early onset inflammatory bowel disease / Uhlig H.H., Schwerd T., Koletzko S. et al. // Gastroenterology. — 2014. — Vol. 147, № 5. — P. 990-1007.e3.
46. Carroccio A. Non-celiac wheat sensitivity as an allergic condition: personal experience and narrative review / Carroccio A., Mansueto P., D’Alcamo A., Iacono G. // Am. J. Gastroenterol. — 2013. — Vol. 108. — P. 1845-53.
47. Guidelines for the Diagnosis and Management of Food Allergy in the United States: Report of the NIAID. Sponsored Expert Panel // The Journal of Allergy and Clinical Immunology. — 2010. — Vol. 126, № 6. — P. 1-58.
48. Шадрин О.Г. Современные подходы к ведению пациентов с пищевой аллергией / О.Г. Шадрин, В.А. Клименко, Ю.В. Карпушенко, Л.М. Адарюкова, Е.С. Ивахненко // Современная педиатрия . — 2012. — № 5(45) — C. 101-104.
49. Охотнікова О.М. Гастроінтестинальна форма харчової алергії у дітей — актуальна проблема сучасності / О.М. Охотнікова, Ю.І. Гладуш, Л.В. Бондаренко та ін. // Здоровье ребенка. — 2015. — Т. 1, № 60. — С. 29-35.
50. Охотнікова О.М. Гастроінтестинальні порушення у дітей з атопічним дерматитом / О.М. Охотнікова, Л.В. Бондаренко, Т.П. Іванова та ін. // Современная педиатрия. — 2014. — № 8. — С. 104-109.

/91-1.jpg )
/92-1.jpg )
/92-2.jpg )