Резюме
Актуальність. Підвищення рівня сечової кислоти (СК) є вкрай поширеним станом як у популяції в цілому, так і серед кардіологічних хворих зокрема, воно дуже негативно впливає на прогноз. Однак у нашій країні вивченню цього питання приділяють недостатньо уваги. Матеріали та методи. Обстежені 110 осіб, серед яких було 68 пацієнтів з артеріальною гіпертензією (АГ) та 42 особи із нормальним рівнем артеріального тиску (АТ). Пацієнтам було проведено такі дослідження: вимірювання зросту та маси тіла, індексу маси тіла, вимірювання офісних систолічного (САТ), діастолічного (ДАТ) артеріального тиску та частоти серцевих скорочень, добове моніторування АТ, неінвазивне визначення центрального САТ та швидкості поширення пульсової хвилі по артеріях еластичного та м’язового типів (ШППХе та ШППХм), біохімічне дослідження крові з визначенням рівнів сечової кислоти, глюкози, загального холестерину, тригліцеридів, холестерину ліпопротеїнів високої та низької щільності сироватки крові, ехокардіографію та ультразвукове обстеження сонних артерій. Статистичну обробку результатів проводили з використанням програмного забезпечення IBM Statistics SPSS 21. Результати. Пацієнти з АГ та особи групи контролю були порівнянні за віком. Першим етапом аналізу була оцінка поширеності гіперурикемії в обстежених осіб. У 55 % пацієнтів із АГ спостерігалося підвищення рівня СК. Тільки 17 % пацієнтів із нормальним рівнем АТ мали підвищений рівень СК. Групу пацієнтів із АГ було поділено на 2 підгрупи: перша підгрупа — із підвищеним рівнем сечової кислоти, друга — з нормальним її рівнем. В обох підгрупах пацієнти були одного віку та переважно з надмірною вагою тіла або ожирінням, чоловіків було більше в обох підгрупах. За основними клініко-демографічними характеристиками пацієнти не відрізнялися між собою. У підгрупі хворих з АГ та гіперурикемією ШППХе була достовірно вищою на 1,6 м/с (р = 0,044), ніж у підгрупі хворих із АГ та нормоурикемією. При цьому величина ШППХм була однаковою в обох підгрупах. Спостерігалася достовірна кореляція рівня СК із наявністю в анамнезі транзиторної ішемічної атаки або інсульту, ретинопатії, аритмії, а також із середньодобовими САТ і ДАТ. Також було продемонстровано достовірну кореляцію із центральним артеріальним тиском (R = 0,293; P = 0,007), часом викиду (R = 0,49; P < 0,001), субендокардіальним індексом життєздатності міокарда (R = 0,47; P < 0,001), тиском аугментації (R = 0,53; P < 0,001) та стандартизованим індексом аугментації (R = 0,24; P = 0,016), а також ШППХе (R = 0,47; P < 0,001). Достовірний взаємозв’язок рівня СК спостерігався з низкою ехокардіографічних та біохімічних параметрів. Висновки. Підвищений рівень сечової кислоти зустрічається в 55 % пацієнтів з АГ та 17 % пацієнтів зрілого віку без підвищення АТ. У пацієнтів з АГ та гіперурикемією швидкість поширення пульсової хвилі по артеріях еластичного типу була достовірно вищою, ніж у пацієнтів із АГ та нормальним рівнем сечової кислоти. Спостерігалася асоціація концентрації сечової кислоти в плазмі крові із жорсткістю артерій та показниками центрального артеріального тиску та індексу аугментації.
Актуальность. Повышение уровня мочевой кислоты (МК) является крайне распространенным состоянием как в популяции в целом, так и среди кардиологических больных в частности, оно очень негативно влияет на прогноз. Однако в нашей стране изучению этого вопроса уделяют недостаточно внимания. Материалы и методы. Обследованы 110 человек, среди которых было 68 пациентов с артериальной гипертензией (АГ) и 42 человека с нормальным уровнем артериального давления (АД). Пациентам провели следующие исследования: измерение роста и массы тела, индекса массы тела, измерение офисных систолического (САД), диастолического (ДАД) артериального давления и частоты сердечных сокращений, суточное мониторирование АД, неинвазивное определение центрального САД и скорости распространения пульсовой волны по артериям эластичного и мышечного типов (СРПВэ и СРПВм), биохимическое исследование крови с определением уровней МК, глюкозы, общего холестерина, триглицеридов, холестерина липопротеинов высокой и низкой плотности сыворотки крови, эхокардиографию и ультразвуковое обследование сонных артерий. Статистическую обработку результатов проводили с использованием программного обеспечения IBM Statistics SPSS 21. Результаты. Пациенты с АГ и лица группы контроля были сопоставимы по возрасту. Первым этапом анализа была оценка распространенности гиперурекемии у обследованных лиц. У 55 % пациентов с АГ наблюдалось повышение уровня МК. Только 17 % пациентов с нормальным уровнем АД имели повышенный уровень МК. Группу пациентов с АГ разделили на 2 подгруппы: первая подгруппа — с повышенным уровнем МК, вторая — с нормальным ее уровнем. В обеих подгруппах пациенты были одного возраста и преимущественно с избыточной массой тела или ожирением, мужчин было больше в обеих подгруппах. По основным клинико-демографическим характеристикам пациенты не отличались между собой. В подгруппе больных с АГ и гиперурикемией СРПВэ была достоверно выше на 1,6 м/с (р = 0,044), чем в подгруппе больных с АГ и нормоурикемией. При этом величина СРПВм была одинаковой в обеих подгруппах. Наблюдалась достоверная корреляция уровня МК с наличием в анамнезе транзиторной ишемической атаки или инсульта, ретинопатии, аритмии, а также со среднесуточными САД и ДАД. Также была продемонстрирована достоверная корреляция с центральным артериальным давлением (R = 0,293; P = 0,007), временем выброса (R = 0,49; P < 0,001), субэндокардиальным индексом жизнеспособности миокарда (R = 0,47; P < 0,001), давлением аугментации (R = 0,53; P < 0,001) и стандартизированным индексом аугментации (R = 0,24; P = 0,016), а также СРПВэ (R = 0,47; P < 0,001). Достоверная взаимосвязь уровня МК наблюдалась с рядом эхокардиографических и биохимических параметров. Выводы. Повышенный уровень мочевой кислоты встречается у 55 % пациентов с АГ и 17 % пациентов зрелого возраста без повышения АД. У пациентов с АГ и гиперурикемией скорость распространения пульсовой волны по артериям эластичного типа была достоверно выше, чем у пациентов с АГ и нормальным уровнем мочевой кислоты. Наблюдалась ассоциация концентрации мочевой кислоты в плазме крови с жесткостью артерий и показателями центрального артериального давления и индекса аугментации.
Background. Increased level of uric acid (UA) is an extremely common state in general population and among cardiologic patients in particular, the presence of which has a very negative effect on the prognosis. However, in our country this problem is not well studied. Materials and methods. 110 patients were examined, including 68 indiciduals with arterial hypertension and 42 — with normal level of blood pressure. The following studies were performed: measurements of height and weight, body mass index, office systolic (SBP) and diastolic blood pressure (DBP), heart rate, ambulatory blood pressure monitoring, non-invasive determination of central SBP and pulse wave velocity in the arteries of elastic and muscular types (PWVe and PWVm), biochemical blood test with definition of UA level, fasting glucose, total cholesterol, triglycerides, high and low density lipoproteins, echocardiography and ultrasound examination of carotid arteries. Statistical analysis of the results was performed using the IBM statistical software SPSS 21. Results. Patients with hypertension and controls were similar in age. The first stage of the analysis was the assessment of the prevalence of hyperuricemia in the examined samples. UA level was increased in 55 % of patients with hypertension. 17 % of persons with normal blood pressure had elevated UA levels. Individuals with hypertension were divided into 2 subgroups: the first one — with elevated levels of uric acid, the second one — with its normal level. In both subgroups, patients were of the same age and, predominantly, with excess body weight or obesity, there were more men in both subgroups. Patients did not differ significantly according to the basic clinical and demographic characteristics. In the subgroup of individuals with hypertension and hyperuricemia, PWVe was significantly higher — by 1.6 m/s (p = 0.044) than in the subgroup of patients with hypertension and normouricemia. But the value of PWVm was equal in both subgroups. There was a significant correlation between UA level and a history of transient ischemic attack or stroke, retinopathy, arrhythmia, as well as with the 24-h SBP and DBP. Also, we found reliable correlations with central arterial pressure (R = 0.293; P = 0.007), ejection duration (R = 0.49; P < 0,001), subendocardial viability ratio (R = 0.47; P < 0.001), augmentation pressure (R = 0.53; P < 0.001) and standardized augmentation index (R = 0.24; P = 0.016), as well as with PWVe (R = 0.47; P < 0.001). Reliable correlation with the level of UA was observed also for a number of echocardiographic and biochemical parameters. Conclusions. Elevated levels of uric acid were found in 55 % of patients with hypertension and in 17 % of middle-aged subjects without elevated blood pressure. In patients with hypertension and hyperuricemia, PWVe was significantly higher than in persons with hypertension and normal uric acid levels. There was an association of UA concentration with rigidity of arteries and central blood pressure and with augmentation index.
Вступ
Гіперурикемія — результат спадкового порушення обміну пуринів, що також призводить до розвитку хронічного запалення. З іншого боку, підвищення рівня сечової кислоти (СК) може бути результатом цього запалення, адже гіперурикемія є мультифакторною патологією, для розвитку якої окрім відповідної спадковості необхідна присутність додаткових чинників. З цього погляду привертає увагу проблема системного запалення низького ступеня в судинній стінці, що запускає каскад патологічних реакцій та процеси альтерації. Зазвичай наявність підвищеного рівня СК, як правило, сприймається як фактор ризику подагри, що вважається менш тяжким захворюванням, яке належить до групи ревматологічної патології. А тому корекції гіперурикемії у світі в цілому та в Україні зокрема не приділяється значної уваги.
Підвищення рівня СК є вкрай поширеним станом як у популяції в цілому, так і серед кардіологічних хворих зокрема, воно дуже негативно впливає на прогноз. За результатами світового реєстру [11], найчастіше гіперурикемія спостерігається серед населення Європейського Союзу (27 млн пацієнтів) порівняно із населенням США (21 млн пацієнтів) та Японії (9,6 млн пацієнтів). Причому діагноз подагри був встановлений лише 9 млн пацієнтів у Європейському Союзі, 7,5 млн пацієнтів у США та 3,2 млн пацієнтів у Японії. Отже, реальний ризик захворіти на подагру має лише невелика частка населення із гіперурикемією, у той же час ризик серцево-судинних захворювань є високим абсолютно в усіх таких пацієнтів. У тому ж дослідженні було показано, що при порівнянні найвищого квартиля рівня СК із найнижчим відношення ризиків серцево-судинної смертності становило 1,77 для чоловіків і 3,00 для жінок [11]. Тобто в нашому випадку 27 млн пацієнтів мешканців Європейського Союзу перебувають у групі високого ризику смерті від кардіальних причин тільки через рівень СК.
Рівень СК пов’язаний із серцево-судинним ризиком через декілька можливих механізмів. Гіперурикемія дуже часто зустрічається в осіб із метаболічним синдромом. Цей факт дозволив деяким вченим висловити припущення, що гіперурикемія також пов’язана із метаболічним синдромом, який лежить в основі всього кардіоваскулярного континууму. З іншого боку, зростання рівня СК пов’язане з високою активністю ферменту ксантиноксидази — потужного прозапального агента, що спричинює розвиток запалення й подальше ушкодження судинної стінки та активацію лейкотрієнів. Відомо, що підвищення рівня СК спостерігається у 25–60 % пацієнтів з уперше виявленою артеріальною гіпертензією [6]. У пацієнтів із гіперурикемією та подагрою частіше спостерігається атеросклеротичне ураження коронарних артерій [5].
Оскільки рівень СК належить до факторів ризику, які можна модифікувати, виявлення гіпер–урикемії на ранньому етапі та корекція рівня СК дозволить запобігти основним несприятливим серцево-судинним подіям. Метою даної роботи було оцінити роль гіперурикемії в пацієнтів з артеріальною гіпертензією (АГ), які проходили стаціонарне та амбулаторне лікування у відділенні симптоматичних гіпертензій ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України» або ж звернулися по медичну допомогу амбулаторно в поліклінічне відділення закладу, та розробити новітні шляхи покращення прогнозу в них, використовуючи рівень СК як маркер судинного запалення та як фактор ризику серцево-судинних захворювань.
Матеріали та методи
Обстежені 110 осіб, серед яких було 68 пацієнтів з АГ (офісний систолічний артеріальний тиск (САТ) > 140 мм рт.ст. та/або діастолічного артеріального тиску (ДАТ) > 90 мм рт.ст.) та 42 особи з нормальним рівнем АТ, порівнянних за віком, які становили контрольну групу. Діагностика пацієнтів проводилася відповідно до національних рекомендацій Уніфікованого клінічного протоколу первинної, екстреної та вторинної (спеціалізованої) медичної допомоги пацієнтам з АГ, затвердженого наказом МОЗ України № 384 від 24.05.2012 [1]. Усіх пацієнтів з АГ розподілили на дві підгрупи залежно від вихідного рівня СК: пацієнти з підвищеним рівнем (понад 357 мкмоль/л, n = 36) та пацієнти із нормальним рівнем СК (до 357 мкмоль/л, n = 32).
Критеріями включення пацієнтів у дослідження були вік чоловіків та жінок від 18 до 75 років; встановлений діагноз есенціальної артеріальної гіпертензії, що оцінюється за даними вимірювання офісного АТ у клініці (САТ > 140 мм рт.ст. та/або ДАТ > 90 мм рт.ст.), відсутність критеріїв виключення; власна згода пацієнта брати участь у дослідженні.
Критеріями невключення пацієнтів у дослідження були набряк Квінке в анамнезі; надмірно високий (> 5,5 ммоль/л) або низький (< 3,5 ммоль/л) рівень калію сироватки крові; вторинні форми АГ, стенотичне двостороннє ураження судин нирок; гостре порушення коронарного кровообігу; порушення серцевого ритму (постійна форма фібриляції передсердь, часта екстрасистолічна аритмія, пароксизми шлуночкової або надшлуночкової тахікардії, стійка синусова тахікардія (частота серцевих скорочень (ЧСС) понад 100 уд/хв); порушення атріовентрикулярної провідності, або синусова брадикардія, або синдром слабкості синусового вузла; наявність вад серця; вагітність або лактація; злоякісний перебіг артеріальної гіпертензії; епізоди ортостатичної гіпотензії (САТ нижче від 90 мм рт.ст.); бронхіальна астма; декомпенсовані захворювання печінки (рівень аспартатамінотрансферази (АСТ), аланін–амінотрансферази (АЛТ) вище від верхньої границі норми в 3 рази); гостра або хронічна ниркова недостатність (швидкість клубочкової фільтрації (ШКФ CKD-EPI) < 60 мл/хв); серцева недостатність вище від II функціонального класу (згідно з Нью-Йоркською класифікацією); інфаркт міокарда в анамнезі, після якого минуло менше ніж 6 місяців до моменту включення в дослідження; гостре порушення мозкового кровообігу в анамнезі; наявність стенокардії напруження ІІІ–IV функціонального класу або вазоспастичної стенокардії; інфекційні та онкологічні захворювання, стани, що супроводжуються ендогенною депресією (чи наявність депресивних станів у сім’ї); наявність цукрового діабету 1-го та 2-го типу; ожиріння з індексом маси тіла (ІМТ) > 35 кг/м2; синдром Рейно; симптомні ураження периферичних судин; стан після оперативних процедур (менше від одного місяця); тривалий прийом стероїдних препаратів та нестероїдних протизапальних засобів, оральних контрацептивів; тяжкі розлади психіки; існуючі протипоказання до відміни попередньої антигіпертензивної терапії або одного з її компонентів; участь у даний момент або протягом останніх трьох місяців у іншому клінічному дослідженні.
Пацієнтам було проведено такі дослідження: вимірювання зросту та маси тіла з подальшим розрахунком ІМТ, вимірювання САТ, ДАТ та ЧСС на брахіальній артерії, добове моніторування АТ (ДМАТ), неінвазивне визначення центрального САТ (цСАТ) та швидкості поширення пульсової хвилі по артеріях еластичного та м’язового типів — ШППХе та ШППХм, біохімічне дослідження крові (із визначенням рівнів калію, натрію, креатиніну та ШКФ, СК, АЛТ, АСТ, білірубіну, глюкози, загального холестерину, тригліцеридів, холестерину ліпопротеїнів високої та низької щільності сироватки крові), електрокардіографію. Крім того, у всіх пацієнтів було зібрано клінічний та сімейний анамнез.
Центральний АТ та ШППХ вимірювали за допомогою апарата Sphygmocor-PVx (AtCor Medical Pty Ltd, Австралія) з відповідним програмним забезпеченням, яке за допомогою вбудованої трансферної функції проводить аналіз контуру пульсової хвилі, що дозволяє проводити вимірювання центрального систолічного, діастолічного, середнього та пульсового АТ, тиску та індексу аугментації (AІx), а також нормалізованого до ЧСС 75 уд/хв індексу аугментації (AІx75), індексу субендокардіальної життєздатності та індексу часу викиду.
Також за допомогою цього апарата визначали ШППХ по артеріях еластичного та м’язового типів. Вимірювання проводили відповідно до стандартизованої методики із встановленням датчиків на загальній правій сонній артерії і на правій стегновій артерії, Також визначали ШППХ на сонній артерії та на радіальній артерії правого передпліччя. Конт–роль якості здійснювався візуально оператором та автоматично за допомогою програмного забезпечення апарата за відповідної програми приладу. АІх, цСАТ та центральний пульсовий АТ вимірювалися автоматично за допомогою вбудованої трансферної функції приладу з розрахунком індивідуальних референтних границь для кожного показника. ШППХ визначали за допомогою швидкісного аналізу пульсової хвилі приладу після вимірювання сантиметровою стрічкою відстані між відповідними артеріями та введення в поле обробки інформації для подальшого аналізу. Для оцінки пружно-еластичних властивостей артерій еластичного типу ШППХ визначали на сегменті «сонна артерія — стегнова артерія», для оцінки пружно-еластичних властивостей артерій м’язового типу — на сегменті «сонна артерія — радіальна артерія». Центральний АТ визначається автоматично на основі АТ на плечовій артерії та форми отриманої пульсової хвилі у висхідній аорті (формула визначена виробником, стандартизована за даними інтрааортального вимірювання АТ).
ДМАТ виконували з використанням портативного пристрою АВРМ-04 (Meditech, Угорщина). При цьому вивчали такі показники: середньодобовий, денний, нічний та максимальний САТ і ДАТ, ЧСС. За допомогою програмного забезпечення приладу ДМАТ для САТ і ДАТ розраховували індекс навантаження часом, що характеризує часове перевантаження тиском впродовж доби і визначається як відсоток вимірів АТ, що перевищує 140/90 мм рт.ст. вдень і 120/80 мм рт.ст. уночі. Також визначали індекс навантаження площею, що є площею між кривою підвищеного АТ та лінією границі норми, а також показник варіабельності обчислювали як стандартне відхилення величини АТ. Крім того, визначався добовий індекс — відсоток зниження нічного АТ порівняно з денним. ДМАТ проводили в такому режимі: у денний час — кожні 15 хв, уночі (з 22:00 до 6:00) — кожні 30 хв. Хворі вели звичайний спосіб життя з побутовими фізичними й психоемоційними навантаженнями [10].
Біохімічні показники визначали за допомогою автоматичного фотометра Livia (Сormay, Польща) в лабораторії ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України» (заві–дуюча відділенням Г.В. Пономарьова). Проводили визначення рівнів калію, натрію, креатиніну, білірубіну, глюкози, загального холестерину, тригліцеридів, холестерину ліпопротеїнів високої та низької щільності сироватки крові та обчислювали ШКФ, СК, АЛТ, АСТ. Кліренс креатиніну, що відображає ШКФ, визначали шляхом розрахунку за формулою CKD-EPI, затвердженою новими рекомендаціями KDIGO 2013 [7].
Ультразвукове вимірювання товщини комплексу інтима-медіа проводили згідно з Консенсусом Американського товариства ехокардіографії 2008 р. [7] тричі з визначенням середнього значення на апараті Sonos 5500, Hewlett Packard, США. Вимірювання гомілково-плечового індексу виконували за допомогою автоматичного приладу (Omron M-10, Японія), запрограмованого на проведення трьох послідовних вимірювань із визначенням середнього значення.
Допплер-ехокардіографію виконували (апарат So–nos 5500, Hewlett Packard, США) за розширеним протоколом відповідно до рекомендацій EАCVI та з визначенням основних розмірів та об’ємів камер серця й магістральних судин, фракції викиду лівого шлуночка, діастолічної функції та індексу маси міокарда лівого шлуночку (ІММЛШ) за формулою ASE [4], використання якої було рекомендовано Європейським товариством з артеріальної гіпертензії у 2013 р. [8].
Усі пацієнти з АГ приймали антигіпертензивну терапію протягом шести місяців, до її складу входили інгібітор ангіотензинперетворюючого ферменту (лізиноприл 40 мг) або блокатор рецепторів ангіотензину II (лозартан 100 мг), гідрохлортіазид 25 мг та дигідропіридиновий блокатор кальцієвих каналів (амлодипін 5–10 мг). Крім того, близько 75 % пацієнтів було призначено статини. Групи достовірно не відрізнялися за терапією.
На основі отриманих даних була створена база даних у системі програмного пакета IBM Statistics SPSS 21. Статистичну обробку результатів проводили за допомогою процесора програмного забезпечення IBM Statistics SPSS 21 з виконанням таких аналізів: стандартні методи описової статистики, що включали в себе визначення середньої арифметичної величини (М); стандартного відхилення від середньої арифметичної величини (m); моди, медіани та розмаху вибірки, максимального та мінімального значень її величин; коефіцієнта достовірності (Р). Відмінність вважали достовірною при Р < 0,05. Достовірність отриманих даних вираховували методом парного двовибіркового тесту з використанням t-критерію Стьюдента для середніх величин або використовували двовибірковий незалежний t-тест для середніх величин у групах з непараметричним розподілом (метод Mann — Whitney) після визначення характеру розподілу. Також проводили багатофакторний регресійний аналіз, кореляційний аналіз для незалежних варіант та парний факторний кореляційний аналіз з обрахунком коефіцієнта кореляції r за Spearmen.
Результати та обговорення
Обстежені 68 пацієнтів з АГ та 42 практично здорові особи, клінічну характеристику обох груп наведено в табл. 1.
Першим етапом аналізу була оцінка поширеності гіперурикемії в обстежених осіб. На рис. 1 подано частоту гіперурикемії серед наших пацієнтів з АГ та нормотензивних осіб контрольної групи.
Як видно з рис. 1, у 55 % пацієнтів з АГ спостерігалося підвищення рівня СК. Тільки 17 % пацієнтів із нормальним рівнем АТ мали підвищений рівень СК. Тобто навіть у популяції без АГ частота виявлення такого фактора ризику, як високий рівень СК, виявилася доволі високою. А це означає, що в нормотензивних пацієнтів із підвищеним рівнем СК є ризик розвитку АГ, а також буде вищим ризик розвитку серцево-судинних подій. На практиці такі пацієнти вважаються здоровими і не звертаються по медичну допомогу, а отже, у такій популяції практично неможливо провести адекватну первинну профілактику.
Групу пацієнтів з АГ було поділено на 2 підгрупи: перша підгрупа — з підвищеним рівнем сечової кислоти (n = 36), друга підгрупа — з нормальним рівнем сечової кислоти (n = 32). У табл. 2 наведено основні клінічні характеристики сформованих підгруп. Як видно з табл. 2, в обох підгрупах пацієнти були одного віку та переважно з надмірною вагою тіла або ожирінням, чоловіків було більше в обох підгрупах. За основними клініко-демографічними характеристиками пацієнти не відрізнялися між собою.
Однак ми спостерігали, що в підгрупі хворих із АГ та гіперурикемією ШППХе була достовірно вищою на 1,6 м/с (р = 0,044), ніж у підгрупі хворих з АГ та нормоурикемією.
ШППХе на сьогодні є золотим стандартом вимірювання жорсткості артерій. Згідно з Європейськими рекомендаціями з артеріальної гіпертензії 2013 р. [8], для пацієнтів із АГ усіх вікових груп підвищення ШППХе понад 10 м/с є ознакою асимптомного ураження судин та достовірно пов’язане з прогнозом. Як ми бачимо, в обох групах цей показник вищий за норму. І це не дивно, адже зростання ШППХе у пацієнтів із АГ є ознакою ураження судин як органа-мішені. Проте в пацієнтів групи з більш високим рівнем СК жорсткість судин виявилася достовірно більшою, а отже, втрата нормальних пружно-еластичних властивостей артерій у пацієнтів, які мають як високий рівень АТ, так і гіперурикемію, буде відбуватися значно швидше, ніж у пацієнтів, у яких діагностовано лише АГ. Більше того, численні рандомізовані дослідження продемонстрували, що жорсткість артерій еластичного типу напряму пов’язана з ризиком серцево-судинних подій та тяжких ускладнень АГ. Тобто отримані нами дані ілюструють взаємозв’язок між підвищенням рівня СК та зростанням серцево-судинного ризику в пацієнтів з АГ. А отже, з цієї точки зору ми можемо розглядати гіперурикемію як додатковий фактор ризику, який можна корегувати. При цьому величина ШППХм була однаковою в обох підгрупах.
Також варто зазначити, що в пацієнтів підгрупи з АГ та високим вмістом СК у сироватці крові рівень середньодобового САТ був на 8 мм рт.ст. вищим, ніж у пацієнтів із нормальним рівнем сечової кислоти. Однак ця різниця не була достовірною, ймовірно, унаслідок значної варіабельності цього показника в пацієнтів із нормоурикемію. Проте ці дані також підтверджують роль гіперурикемії в прогресуванні АГ.
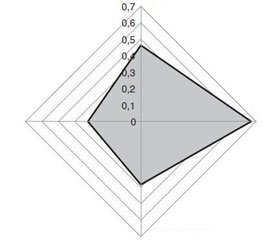
Для того щоб оцінити клінічну роль СК, ми дослідили показники, з якими рівень СК був асоційований у загальній групі пацієнтів з АГ (рис. 2). Як видно з рис. 2, спостерігалася достовірна кореляція рівня СК із наявністю в анамнезі транзиторної ішемічної атаки або інсульту та аритмії, які також могли бути причиною інсульту, а також із наявністю ретинопатії в анамнезі, що може вважатися показником ураження судин мікроциркуляторного русла. Крім того, спостерігався достовірний взаємозв’язок із середньодобовими САТ і ДАТ. Гіперурикемія може –зумовлювати тяжкість АГ та мати виражений вплив на ефективність стандартного лікування через асоціацію з ураженням судин. У нашому дослідженні було підтверджено наявністю достовірної кореляції з показниками контурного та швидкісного аналізу пульсової хвилі — центральним артеріальним тиском (R = 0,293; P = 0,007), часом викиду (ED) (R = 0,49; P < 0,001), субендокардіальним індексом життєздатності міокарда (SEVR) (R = 0,47; P < 0,001), тиском аугментації (AP) (R = 0,53; P < 0,001) та стандартизованим індексом аугментації (AІx75) (R = 0,24; P = 0,016), а також ШППХе (R = 0,47; P < 0,001).
Крім того, цілком виправдано, що рівень СК також достовірно корелював зі швидкістю клубочкової фільтрації (R = 0,31; P = 0,002). Достовірна асоціація концентрації СК у сироватці крові з рівнем глюкози натще (R = 0,43; P < 0,001), тригліцеридів (R = 0,515; P < 0,001) та індексом атерогенності (R = 0,86; P = 0,001) у нашому дослідженні також підтверджує думку про те, що гіперурикемія може асоціюватися з іншими метаболічними порушеннями.
Пацієнти з АГ приймали антигіпертензивну терапію й статини протягом шести місяців. Жоден пацієнт не приймав препарати, дія яких направлена на зниження концентрації СК. Через 6 місяців лікування ми виявили недостовірне зниження рівня СК. Її динаміка виявилася достовірно пов’язаною (рис. 3) з наявністю хронічної ниркової недостатності (ХНН) в анамнезі (R = 0,46; P = 0,035), варіабельністю САТ протягом доби (R = 0,67; P = 0,024) за даними амбулаторного моніторування, а також вихідним рівнем тригліцеридів (R = 0,32; P = 0,041) і холестерину (R = 0,38; P = 0,011).
/63-1.jpg )
Важливу роль СК як маркера судинного ураження також підтвердило те, що рівень сечової кислоти на початку лікування й через 6 місяців антигіпертензивної та ліпідознижуючої терапії достовірно асоціювався із динамікою ШППХ протягом лікування в пацієнтів з АГ (R = 0,537, P < 0,001). Тобто в пацієнтів із більш високою концентрацією СК на початку лікування покращення пружно-еластичних властивостей артерій буде відбуватися повільніше, а тому й результат від лікування може виявитися менш вираженим.
Ми також вирішили дослідити взаємозв’язок вихідного рівня СК та початкових параметрів ехокардіографії. Виявилося, що її концентрація достовірно асоціювалася з розмірами обох передсердь (R = 0,66; P < 0,001 для площі лівого передсердя (ЛП) та R = 0,65; P < 0,001 для площі правого передсердя (ПП)), що також, можливо, пояснює описаний вище взаємозв’язок із наявністю порушень ритму в анамнезі. Ми також виявили кореляцію із кінцевими систолічними (R = 0,65; P < 0,001) і діастолічними (R = 0,72; P < 0,001) об’ємами (КСО і КДО) лівого шлуночка та індексом маси міокарда лівого шлуночка (R = 0,74; P < 0,001).
Що цікаво, рівень СК достовірно асоціювався з багатьма параметрами діастолічної функції лівого шлуночка — відношенням Е/Е’ (R = 0,78; P < 0,001), часом сповільнення потоку Е (DT) (R = 0,67; P < 0,001) та часом ізоволюметричного розслаблення ЛШ (IVRT) (R = 0,73; P < 0,001).
Ми також виявили достовірний взаємозв’язок СК із рівнем систолічного тиску в легеневі артерії (СТЛА) за даними ЕхоКГ (R = 0,71; P < 0,001). Загалом рівень СТЛА, особливо в пацієнтів з АГ, залежить від рівня системного АТ. А тому при високих показниках САТ у таких пацієнтів нерідко зустрічається помірне підвищення СТЛА, що, однак, не є ознакою власне легеневої гіпертензії. Тому в нашому дослідженні ми використовували індексований показник СТЛА, який розраховуються за формулою: СТЛА/САТ × 100 %, причому нормальний показник не має перевищувати 30 %. Саме індекс СТЛА більш достовірно демонструє наявність легеневої гіпертензії в пацієнтів з АГ. У нашому дослідженні достовірний взаємозв’язок спостерігався також з індексом СТЛА (R = 0,57; P < 0,001).
Отримані дані доводять важливу діагностичну й прогностичну роль СК у пацієнтів з АГ, що підтверджується літературними даними. СК — це кінцевий продукт метаболізму пуринів, що утворюється в результаті ферментного окислення ксантину під впливом ксантиноксидази, що відкладається у вигляді кристалів. Взаємодія кристалів уратів, особливо покритих IgG і IgМ, із поліморфноядерними лейкоцитами та фагоцитами призводить до вивільнення та активації низки запальних медіаторів, у першу чергу нейтрофільного лейкотрієну В4. Нейтрофіли, які фагоцитують гострі голчасті кристали, гинуть, що сприяє вивільненню активних кисневих радикалів, кристалозалежного хемотаксичного фактора й великої кількості лізосомальних гідролаз. Макрофаги фагоцитують урати й клітинні уламки, виділяють цитокіни — інтерлейкіни-1, -6, -8, кахексин, а також простагландини. Усе це підсилює запалення й підтримує альтерацію [2, 12].
Лейкотрієни, у свою чергу, також є медіаторами запалення. За хімічною структурою це жирні кислоти, що утворюються з арахідонової кислоти. На даний час ідентифіковано лейкотрієни A4, B4, про який ішлося вище, C4, D4, E4. Синтезуються лейкотрієни з арахідонової кислоти, яка під дією 5-ліпоксигенази перетворюється на лейкотрієн A4. Потім у результаті каскадної реакції утворюються лейкотрієни В4 — C4 — D4 — E4, що беруть участь у патогенезі запальних змін. Лейкотрієн В4 — ключовий прозапальний цитокін, який відіграє головну роль у тканинному запаленні, перший стабільний продукт ліпоксигеназного шляху метаболізму арахідонової кислоти. Його синтез відбувається під впливом ферменту 5-ліпоксигенази [3].
Ці механізми на рівні патогенетичних реакцій можуть пояснити дані, які було отримано за результатами проведеного аналізу. На основі вивчення цих механізмів патогенезу можна розглядати основні перспективні напрямки корекції гіперурикемії та зниження рівня серцево-судинного ризику. Тому ми вважаємо проведення таких випробувань в умовах реальної клінічної практики перспективним напрямом, що допоможе вирішити ряд важливих наукових та практичних завдань сучасної кардіології.
Висновки
1. Підвищений рівень сечової кислоти зустрічається в 55 % пацієнтів з АГ та 17 % пацієнтів зрілого віку без підвищення АТ.
2. У пацієнтів з АГ та гіперурикемією швидкість поширення пульсової хвилі по артеріях еластичного типу була достовірно вищою, ніж у пацієнтів з АГ та нормальним рівнем сечової кислоти.
3. Вихідний рівень СК достовірно пов’язаний із динамікою пружно-еластичних властивостей артерій протягом лікування.
4. Спостерігалася асоціація концентрації сечової кислоти в плазмі крові з жорсткістю артерій та показниками центрального артеріального тиску й індексу аугментації.
5. Рівень сечової кислоти в пацієнтів з АГ достовірно корелював із розмірами камер серця та показниками діастолічної функції лівого шлуночка.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Наказ МОЗ України № 384 від 24.05.2012 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при артеріальній гіпертензії» [Електронний ресурс]. — Режим доступу: https://www.moz.gov.ua/ua/portal/dn_20120524_384.html.
2. Busso N., So A. Gout. Mechanisms of inflammation in gout // Arthritis Res. Ther. — 2010. — Vol. 12(2). — P. 206.
3. Hedi H., Norbert G. 5-Lipoxygenase Pathway, Dendritic Cells, and Adaptive Immunity // J. Biomed. Biotechnol. — 2004. — Vol. 2004(2). — P. 99-105.
4. Foppa M. Echocardiography-based left ventricular mass estimation. How should we define hypertrophy? / Foppa M., Duncan B., Rohde L. // Cardiovasc. Ultrasound. — 2005. — 3. — 17.
5. Kim S.Y., Guevara J.P., Kim K.M. et al. Hyperuricemia and Coronary Heart Disease: A Systematic Review and Meta-Analysis // Arthritis care & research. — 2010. — 62(2). — P. 170-180.
6. Kuwabara M. Hyperuricemia, Cardiovascular Disease, and Hypertension // Pulse (Basel). — 2016 Apr. — Vol. 3 (3–4). — P. 242-252.
7. Levey A. A new equation to estimate glomerular filtration rate / Levey A., Stevens L., Schmid C. [et. al.] // Ann. Intern. Med. — 2009. — 150(9). — 604-613.
8. Mancia G. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) / Mancia G., Fagard R., Narkiewicz K., Redón J., Zanchetti A., Böhm M., Christiaens T., Cifkova R., De Backer G., Dominiczak A., Galderisi M., Grobbee D.E., Jaarsma T., Kirchhof P., Kjeldsen S.E., Laurent S., Manolis A.J., Nilsson P.M., Ruilope L.M., Schmieder R.E., Sirnes P.A., Sleight P., Viigimaa M., Waeber B., Zannad F. // Journal of Hypertension. — 2013. — Vol. 31. — 1281-1357.
9. Stein J. Use of carotid ultrasound to identify subclinical vascular disease and evaluate cardiovascular disease risk: a consensus statement from the American Society of Echocardiography carotid intima-media thickness task force endorsed by the society of vascular medicine / Stein J., Korcarz C., Hurst R. [et. al.], American Society of Echocardiography Carotid Intima-Media Thickness Task Force // J. Am. Society Echoc. — 2008. — 21(2). — 93-111.
10. White W. Blood pressure monitoring in Cardiovascular Medicine and Therapeutics / White W. — N. Jersy: Humana Press, 2001.
11. Zhu Y., Pandya B.J., Choi H.K. Prevalence of gout and hyperuricemia in the US general population: the National Health and Nutrition Examination Survey 2007–2008 // Arthritis Rheum. — Vol. 2011 Oct. — 63(10). — P. 3136-3141.
12. Yagnik D.R., Hillyer P., Marshall D. et al. Noninflammatory phagocytosis of monosodium urate monohydrate crystals by mouse macrophages. Implications for the control of joint inflammation in gout // Arthritis Rheum. — 2000 Aug. — Vol. 43(8). — P. 1779-1789.

/61-2.jpg )
/61-1.jpg )
/62-1.jpg )
/63-1.jpg )