Резюме
У статті описано літературні дані та власне спостереження уреамікоплазмового інфікування в розвитку бронхолегеневої дисплазії (БЛД) у дітей раннього віку. Бронхолегенева дисплазія як патологія, що виникає у новонароджених дітей після проведення їм реанімаційної допомоги, зокрема кисневої терапії чи штучної вентиляції легень, активно вивчається патоморфологами та клініцистами. Актуальними й недостатньо вивченими на сьогодні залишаються питання ролі інфекції у формуванні БЛД як у недоношених, так і у доношених дітей. Численними дослідженнями показано, що колонізація дихальних шляхів немовляти такими мікроорганізмами, як Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Cytomegalovirus, асоціюється з високим ризиком розвитку БЛД порівняно з неінфікованими дітьми. Ureaplasma urealyticum — найбільш поширені мікроби, які виявлені в зараженій амніотичній рідині, плаценті та респіраторному тракті новонароджених дітей, і їх здатність викликати запалення на цих ділянках беззаперечна. Бронхолегенева дисплазія, що виникає на фоні інфікування даними мікроорганізмами, не обов’язково пов’язана із самими бактеріями, а, швидше за все, розвивається через їх потенційне стимулювання прозапальних цитокінів (TNF, IL-1 і IL-8) або можливого блокування цитокінів (IL-6 і IL-10). Описаний нами клінічний випадок ілюструє роль даних мікроорганізмів у розвитку тяжкої пневмонії з формуванням БЛД у народженої в строк дитини. Особливістю даного випадку є те, що при правильній лікарській тактиці стосовно інфікованої вагітної і, можливо, ранній профілактиці розвитку уреамікоплазмового інфікування немовляти розвиток тяжких незворотних змін у його легенях можна було б уникнути.
В статье описаны литературные данные и собственное наблюдение уреамикоплазменного инфицирования в развитии бронхолегочной дисплазии (БЛД) у детей раннего возраста. Бронхолегочная дисплазия как патология, возникающая у новорожденных детей после проведения им реанимационной помощи, в частности кислородотерапии или искусственной вентиляции легких, активно изучается патоморфологами и клиницистами. Актуальными и недостаточно изученными на сегодняшний день остаются вопросы о роли инфекции в формировании БЛД как у недоношенных, так и у доношенных детей. Многочисленными исследованиями показано, что колонизация дыхательных путей новорожденных такими микроорганизмами, как Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Cytomegalovirus, ассоциируется с высоким риском развития БЛД по сравнению с неинфицированными детьми. Ureaplasma urealyticum — наиболее распространенные микробы, обнаруженные в зараженной амниотической жидкости, плаценте и респираторном тракте новорожденных детей, и их способность вызывать воспаление на этих участках бесспорна. Бронхолегочная дисплазия, возникающая на фоне инфицирования этими микроорганизмами, не обязательно непосредственно связана с самими бактериями, а, скорее всего, развивается из-за их потенциального стимулирования провоспалительных цитокинов (TNF, IL-1 и IL-8) или возможной блокировки цитокинов (IL-6 и IL-10). Описанный нами клинический случай наглядно иллюстрирует роль данных микроорганизмов в развитии тяжелой пневмонии с исходом в БЛД у рожденного в срок ребенка. Особенностью случая является то, что при правильной врачебной тактике по отношению к инфицированной беременной и, возможно, ранней профилактике развития уреамикоплазменного инфицирования новорожденного развития тяжелых необратимых изменений в его легких можно было избежать.
The article describes literature data and own observation of ureacoplasmic infection as the cause of the development of bronchopulmonary dysplasia (BPD) in infants. Bronchopulmonary dysplasia as a pathology that occurs in newborn children after resuscitation, in particular oxygen therapy or mechanical ventilation is actively studied by pathomorphologists and clinicians. The questions about the role of infections in the development of BPD in both premature and term infants remain relevant and underinvestigated today. Numerous studies have shown that colonization of the respiratory tract of newborn organisms such as Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Cytomegalovirus, is associated with a high risk of developing BPD compared with uninfected children. Ureaplasma urealyticum are the most common microbes found in the infected amniotic fluid, placenta and respiratory tract of newborns, and their ability to cause inflammation in these areas is undeniable. Bronchopulmonary dysplasia associated with these microorganisms is not necessarily directly connected with bacteria, and most likely develops due to their potential to stimulate proinflammatory cytokines (TNF, IL-1 and IL-8) or possible blocking of cytokines (IL-6 and IL-10). The described case illustrates the role of these microorganisms in the development of severe pneumonia outcome in BPD in a term child. A feature of the case is that with proper medical tactics in relation to infected pregnant and as soon as possible early prevention of the development of infection of the newborn, the development of severe, irreversible changes in his lungs could have been avoided.
Бронхолегочная дисплазия (БЛД) как патология, возникающая у новорожденных детей после проведения им реанимационной помощи, в частности кислородотерапии или искусственной вентиляции легких, активно изучается патоморфологами и клиницистами [1–3]. БЛД характеризуется несколькими последовательно развивающимися клинико-рентгенологическими стадиями, продолжающимися в течение первых месяцев жизни. В результате развития болезни формируется интерстициальный и внутриальвеолярный фиброз на фоне недоразвития анатомических структур легких. Отсутствие выраженной специфической симптоматики, субклиническое течение «новой БЛД» на фоне недостаточных на сегодняшний день научных знаний по этому заболеванию и опыта практикующих врачей, вероятно, может привести к поздней диагностике необратимых изменений в легких у детей, их инвалидизации на фоне формирующейся хронической обструктивной болезни легких детского возраста.
Актуальными и недостаточно изученными на сегодня остаются вопросы о роли инфекции в формировании БЛД как у недоношенных, так и у доношенных детей и связанные с этим возможные пути профилактики с использованием антимикробной терапии. Многочисленными исследованиями показано, что колонизация дыхательных путей новорожденных такими микроорганизмами, как Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Cytomegalovirus, ассоциируется с высоким риском развития БЛД по сравнению с неинфицированными детьми [4–8]. Указанные возбудители могут вызывать хориоамнионит, преждевременные роды, а также легочные поражения (воспаление, сопровождающееся гиперреактивностью бронхов, инактивацию сурфактанта). В настоящее время установлена четкая ассоциация между внутриматочной колонизацией уреаплазмами и развитием бронхолегочной дисплазии у доношенных новорожденных [9–12]. По данным отечественных исследователей, заболеваемость новорожденных в неонатальном периоде в результате внутриутробного инфицирования микоплазменной инфекцией составляет от 5 до 41 %, уреаплазменной инфекцией — от 5,3 до 32,6 %, хламидийной инфекцией новорожденных — от 0,5 до 7 % живорожденных детей [6–8, 13]. Пути инфицирования: трансплацентарный, восходящий, нисходящий, трансдецидуальный, смешанный. При наличии возбудителя в околоплодных водах, родовых путях матери возможен контактный путь передачи. Плод и новорожденный обладают повышенной восприимчивостью к уреамикоплазмам, что связано с состоянием иммунодепрессии и отсутствием нормальной флоры в момент заражения [7, 8]. Специфические для данных возбудителей патоморфологические изменения обнаруживаются в легких, печени, почечной ткани, центральной нервной системе (ЦНС). Для уреаплазменной инфекции характерна длительная персистенция [4]. Факторами, обусловливающими патогенность микоплазм, являются их большая подвижность и способность прикрепляться к различным клеткам (эпителию, лейкоцитам, сперматозоидам), оказывать токсическое и деструктивное действие. Структурное сходство мембран клеток человека и мембран микоплазм, их тесное соседство способствуют обмену антигенами, что ведет к «маскировке» антигенов микоплазм, слабому распознаванию их как чужеродных агентов. Нередко в организме больного человека развивается аутоиммунный процесс, сходный по течению с процессом при гемолитической анемии, ревматоидном артрите.
Ureaplasma urealyticum — наиболее распространенные микробы, обнаруженные в зараженной амниотической жидкости, плаценте и респираторном тракте новорожденных детей, и их способность вызывать воспаление на этих участках бесспорна [5, 13–15]. Бронхолегочная дисплазия, связанная с этими микроорганизмами, не обязательно непосредственно связана с самими бактериями, а, скорее всего, развивается из-за их потенциального стимулирования провоспалительных цитокинов (TNF, IL-1 и IL-8) или возможной блокировки цитокинов (IL-6 и IL-10) [13]. Недавно проведенный опрос британских неонатологов и педиатров (2015) выявил повышенный их интерес к уреаплазме как одной из важных причин бронхолегочной дисплазии. Ureaplasma urealyticum (от лат. urea — мочевина) — мелкие, не имеющие клеточной стенки, размножающиеся простым делением бактерии, относящиеся к роду Ureaplasma семейства Mycoplasmataceae (микоплазмы). Как и другие микоплазмы, Ureaplasma urealyticum обычно обитают на слизистых оболочках. Основным питательным субстратом для них является мочевина, в связи с чем, очевидно, они склонны к заселению мочеполовой системы. После первого описания Ureaplasma urealyticum было выделено 14 серотипов этого вида микроорганизмов. Помимо уреазной активности, уреаплазмы проявляют также IgA-протеазную активность, что, вероятно, облегчает колонизацию слизистых оболочек, где иммуноглобулины А обеспечивают специфическую гуморальную защиту против микроорганизмов.
Антитела класса IgG к U.urealyticum являются свидетельством иммунного ответа, возникшего в ходе текущей или имевшей место в прошлом экспозиции к данным микроорганизмам. Это важный фактор иммунитета против данного микроорганизма, поскольку лица с гипогаммаглобулинемией проявляют очень высокую восприимчивость к инвазивной инфекции Ureaplasma. Антитела класса IgG к U.urealyticum можно обнаружить у людей без клинических проявлений инфекции. Но для инвазивных и экстрагенитальных форм инфекции характерно повышение титров специфических антител [4, 5]. В пользу текущей инфекции может свидетельствовать также выраженный рост титров специфических антител в парных сыворотках, взятых с интервалом в 2 недели (3–4-кратный). IgG (в отличие от IgM и IgA) способны проникать через плаценту из крови матери в кровь плода, поэтому в крови новорожденных в первые месяцы после рождения могут циркулировать материнские IgG, присутствие которых в однократно взятой пробе крови само по себе не свидетельствует об инфицировании.
Изменение воспалительной реакции под воздействием уреаплазмы происходит в связи с сопутствующей бактериальной инфекцией или гипероксией [9, 10]. Исследователи продемонстрировали способность уреаплазмы стимулировать макрофаги к образованию оксида азота. Данные, представленные в настоящее время, о способности уреаплазмы образовывать медиаторы воспаления и истории болезни острой уреаплазменной пневмонии ясно показывают возможности повреждения легких на бактериальном уровне.
Р. Мohagheghi и соавторы [12] проанализировали рентгенограммы грудной клетки 44 недоношенных детей с колонизацией Ureaplasma в нижних дыхательных путях и тех, у кого был отрицательный результат на данную культуру. Выяснилось, что пневмония встречалась в два раза чаще в группе с положительным результатом на уреаплазму (30 против 16 %). Важно, что ранние диспластические изменения в легких в течение 2 недель после рождения были значительно более распространены в Ureaplasma-положительной группе, независимо от гестационного возраста, расы и пола. Рентгенограммы грудной клетки Ureaplasma-положительных детей показали, что эмфизематозные изменения происходят уже на 5-й день инфицирования.
Для иллюстрации особенностей течения пневмонии, вызванной внутриутробным инфицированием Mycoplasma hominis и Ureaplasma urealyticum и формированием в последующем БЛД, приводим клинический случай из нашей практики ребенка М., 3 мес., который находился под наблюдением в городском пульмонологическом центре г. Днепра. Девочка была переведена из отделения реанимации и интенсивной терапии, где находилась с диагнозом «генерализованная интранатальная инфекция (уреаплазмоз, микоплазмоз). Двусторонняя интерстициальная пневмония, тяжелое течение. Дыхательная недостаточность III ст. Недостаточность кровообращения IIА ст. Острый пиелонефрит. Двусторонний гнойный конъюнктивит. Вторичная кардиомиопатия, гидроперикард. Врожденный порок сердца: вторичный дефект межпредсердной перегородки. Белково-энергетическая недостаточность средней степени тяжести».
Из анамнеза заболевания известно, что в роддоме у ребенка отмечались явления гнойного конъюнктивита (этиология не уточнялась, ребенок выписан домой). Дома на седьмой день жизни у девочки появилось покашливание, которое в динамике постепенно нарастало, затем мать заметила учащенное дыхание, и в возрасте 3 недель, в связи с появлением выраженных дыхательных расстройств, ребенок был госпитализирован из дома в отделение реанимации и интенсивной терапии, где находился в течение месяца в крайне тяжелом состоянии.
Из анамнеза жизни известно, что ребенок от II беременности, протекавшей на фоне угрозы прерывания, уреамикоплазмоза, хламидиоза. Лечение инфицирования антибактериальным препаратом, со слов матери, было начато, но полный курс не проведен. Не проводилось и обследование на инфицированность данными инфекциями в динамике. Роды I (1-я беременность закончилась самопроизвольным абортом), в сроке гестации 40 недель, через естественные родовые пути, масса тела при рождении — 3250 г, оценка по шкале Апгар — 7/8 баллов. Девочка была выписана домой с явлениями конъюнктивита.
При первичном осмотре в пульмонологическом отделении после перевода из отделения реанимации общее состояние ребенка тяжелое за счет дыхательных и гемодинамических расстройств, интоксикационного синдрома, белково-энергетической недостаточности. Субфебрильно лихорадит. Кашель нечастый, малопродуктивный. Одышка смешанного характера с преобладанием экспираторного компонента и выраженной ретракцией грудной клетки. Частота дыхательных движений — 80 в 1 минуту. Сатурация O2 в крови — 95 %. Дыхание самостоятельное, однако периодически нуждается в кислородной поддержке. Физическое развитие низкое. Кожные покровы бледные, мраморные, чистые. При минимальной физической нагрузке появляется периоральный цианоз. Подкожно-жировой слой истончен на туловище и конечностях. Периферические лимфоузлы не увеличены. Аускультативно: над легкими паравертебрально выслушиваются потрескивающие хрипы и участки бронхофонии. Перкуторно: неравномерность с очагами притупления и коробочного звука. Границы относительной сердечной тупости — в пределах возрастной нормы. Тоны сердца звучные, тахикардия. Живот мягкий, доступен глубокой пальпации. Печень и селезенка не увеличены. Мочеиспускание свободное, диурез достаточный.
Ребенок обследован на TORCH-комплекс (вирусы герпеса I и II типов, цитомегаловирус, Toxoplasma gondii, Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis) методом иммуноферментного анализа IgG (парные сыворотки). Выявлены IgG к Chlamidia trachomatis (1 : 20), Ureaplasma urealyticum (1 : 20) и Mycoplasma hominis (1 : 20). Ig M, G к Chlamydophila psittacki и Chlamydophila pneumonia не обнаружены. Бактериологический посев содержимого из зева и носа роста не дал. Бактериологический посев содержимого из вульвы выявил Mycoplasma hominis, чувствительную к джозамицину, тетрациклину, клиндамицину, пристинамицину, резистентную к эритромицину, кларитромицину, левофлоксацину, офлоксацину, рокситромицину и ципрофлоксацину.
Учитывая затяжной, нетипичный характер течения заболевания у ребенка, также исключалась наследственная патология (определение хлоридов пота и молекулярно-генетическое исследование на муковисцидоз дали отрицательные результаты), туберкулезная этиология (диаскинтест отрицательный), гастроэзофагеальный рефлюкс (по данным фиброэндогастроскопии патологии не выявлено).
Ультразвуковое исследование (УЗИ) органов брюшной полости: печень, желчный пузырь, поджелудочная железа, селезенка, почки — в пределах нормы. Мочевой пузырь — без особенностей.
Обзорная рентгенограмма органов грудной клетки в прямой и боковой проекции: на фоне усиленного бронхососудистого рисунка справа в проекции нижней доли и прикорневой зоны, а также над диафрагмой левого легкого определяется интенсивное снижение прозрачности легочной ткани за счет инфильтративных изменений, перибронхиальной инфильтрации. В проекции верхних долей — участки эмфизематоза. Корни легких повышены в интенсивности, малоструктурные. Контуры куполов диафрагмы нечеткие, синусы свободные. Верхушка сердца приподнята над диафрагмой.
УЗИ плевральной полости не выявило свободной жидкости в плевральных синусах.
Допплер-эхокардиография: вторичный дефект межпредсердной перегородки (d = 0,4 мм). Полости сердца не расширены (конечный диастолический размер — 2,13 см). Сократительная функция миокарда левого желудочка удовлетворительная (фракция выброса = 75 %). Гидроперикард с небольшим количеством жидкости.
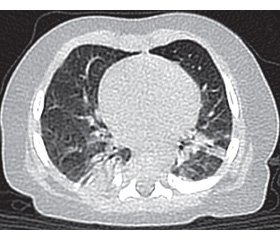
Компьютерная томография (КТ) органов грудной клетки высокого разрешения (рис. 1): справа — ателектаз S2, который книзу без видимой границы на уровне междолевой щели переходит в ателектаз S6, а ниже — в ателектазы S9, S10. Верхняя и нижняя доли правого легкого уменьшены в объеме. Воздушность S1, S3 и средней доли повышена. Слева определяются субсегментарный ателектаз в S2 и ателектаз S4. Отмечается гиповентиляция нижней доли левого легкого. Воздушность S3, S5 повышена. Трахея и главные бронхи проходимы. Увеличенные лимфатические узлы средостения не определяются. Аорта не расширена. Подмышечные лимфатические узлы не увеличены. Мягкие ткани грудной клетки структурные. Заключение: КТ-признаки бронхолегочной дисплазии.
/113-1.jpg )
С учетом данных компьютерной томографии ребенку была проведена лечебно-диагностическая бронхоскопия, во время которой пороки развития бронхов не определены. Специфические микробные возбудители в бронхоальвеолярной жидкости не выявлены. Ребенок консультирован узкими специалистами. Заключение невролога: перинатальное сочетанное гипоксически-травматическое поражение ЦНС (краниоцервикальный уровень) в форме негрубого спастического тетрапареза; окулиста: дакриоцистит новорожденного обоих глаз; иммунолога: данных о первичном иммунодефиците нет.
На основании данных проведенных обследований был установлен диагноз: «БЛД, хроническая форма, тяжелое течение. Дыхательная недостаточность II ст. Недостаточность кровообращения IIА ст.».
В отделении ребенку проводилась внутривенная (в/в) дезинтоксикационная терапия глюкозо-солевыми растворами, комбинированная антибактериальная терапия с учетом выделенной флоры и ее чувствительности (макролиды, цефалоспорины 3-го и 4-го поколений, карбапенемы), курс парентеральных глюкокортикостероидов (дексаметазон 0,5 мг/кг/сутки в/в) с переходом на пероральный прием метилпреднизолона из расчета 1 мг/кг/сут, с целью улучшения дренажной функции — муколитики в/в, β-адреномиметики ингаляционно, системная противогрибковая терапия.
В результате проведенного лечения в течение 45 дней состояние ребенка постепенно улучшалось: уменьшились дыхательные и гемодинамические расстройства, интоксикационный синдром, девочка перестала быть кислородозависимой. Аускультативно: над легкими дыхание стало проводиться более равномерно во все отделы, крепитирующие хрипы не выслушивались. На контрольной рентгенограмме органов грудной клетки — признаки тяжелой бронхолегочной дисплазии. Ребенок был выписан из отделения в относительно стабильном состоянии на амбулаторный этап под наблюдение семейного врача, пульмонолога с обязательным ежедневным контролем частоты дыхания, пульсоксиметрией и КТ органов грудной клетки в динамике через 3 месяца.
Таким образом, данный клинический пример иллюстрирует случай тяжелого течения пневмонии, вызванной, вероятно, интранатальным инфицированием Mycoplasma hominis, Ureaplasma urealyticum, с формированием БЛД на фоне данного инфицирования у рожденного в срок ребенка. Особенностью случая является то, что при правильной врачебной тактике по отношению к инфицированной беременной и, возможно, ранней профилактике развития уреамикоплазменного инфицирования новорожденного развития тяжелых необратимых изменений в его легких можно было избежать. Наличие у детей в раннем неонатальном периоде признаков –конъюнктивита, вульвита в сочетании с катаральным синдромом со стороны дыхательных путей должно насторожить врача по поводу возможного проявления интранатального инфицирования. Терапия воспалительного процесса, вызванного Mycoplasma hominis, Ureaplasma urealyticum, у детей раннего возраста длительная, не всегда эффективная, что связано с этиопатогенетическими особенностями воспаления и антибиотикорезистентностью микроорганизмов. Результатом такого воспаления у детей раннего возраста может быть формирование бронхолегочной дисплазии.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Okhotnikova EN, Sharikadze EV. Bronchopulmonary dysplasia as a predictor of the formation of a chronic pathology of respiratory organs in children (review of literature). Zdorov’ye Rebenka. 2009;5(20). (In Russian).
2. Duka YD, Cherginec VI, Ilchenko SI. Pathomorphological and clinical features of bronchopulmonary dysplasia at children in modern condition. Tavricheskij mediko-biologicheskij vestnik. 2010;4(52):47-50. (In Russian).
3. Duka YD, Cherginec VI, Ilchenko SI. Individualization of the prophylactic help to children with bronchopulmonary dysplasia on the basis of pathomorphological and clinical features of the current of disease in modern conditions. 2011;2(46):63-5. (In Russian).
4. Gavisova AA, Tverdikova MA, Tyutyunnik VL. Current approaches to management of ureaplasma infection. Effektivnaja farmakoterapija. Akusherstvo i Ginekologija. 2013;2(18):8-13. (In Russian).
5. Klisho VE, Lysenko IM, Barkun GK, Zhuravleva LN. Clinical and diagnostic criteria of ureamicoplasmic infection in newborns. Vestnik Vitebskogo gosudarstvennogo medicinskogo universiteta. 2009;3:1-12. (In Russian).
6. Poslova LJu. Clinical, epidemiological and etiological characteristics of intrauterine infections. Medicinskij al'manah. 2016;3(43):26-31. (In Russian). doi: 10.21145/2499-9954-2016-3-26-31.
7. Reznichenko GI, Reznichenko JuG, Reznichenko NJu. The role of Mycoplasma infection in the development of chronic inflammatory diseases in women and children. Zdorov’ye Rebenka. 2007;3(6). (In Russian).
8. Savenkova MS, Savenkov MP, Samitova ER, Bullikh AV, Zhuravleva IA, Yakubov DV, Kuznetsova ES. Mycoplasma infection: clinical types, variations of clinical course and diagnostic mistakes. Voprosі sovremennoj pediatrii. 2013;6:108-14.
(In Russian).
9. Viscardi RM, Hasday JD. Role of Ureaplasma species in Neonatal Chronic Lung Disease: Epidemiologic and Experimental Evidence. Pediatr Res. 2009;65(52):84-90. doi: 10.1203/PDR.0b013e31819dc2f9.
10. Viscardi RM, Kallapur SG. Role of Ureaplasma Respiratory Tract Colonization in Bronchopulmonary Dysplasia Pathogenesis: Current Concepts and Update. Clin Perinatol. 2015;42(4):719-38. doi: 10.1016/j.clp.2015.08.003.
11. Reiterer F. Neonatal Pneumonia. doi: 10.5772/54310. Available from: https://www.intechopen.com/books/neonatal-bacterial-infection/neonatal-pneumonia
12. Mohagheghi P, Khosravi N, Noorbakhsh S, Shekarabi M, Azad K, Looni T. Ureaplasma Urealyticum and Mycoplasma Hominis Colonization and Chronic Lung Disease in Preterm Neonates Under Ventilation. Journal of Comprehensive Pediatrics. 2013;4(2):110-4. doi: 10.17795/compreped-8192.
13. Kumar S, Maria A, Saigal SR, Maheshwari M. Mycoplasma pneumoniae as a cause of non-resolving pneumonia in a neonate. Journal of Medical Microbiology. 2010;59(Pt 6);731-2. PMID: 20185548. doi: 10.1099/jmm.0.017491-0.
14. Kotecha S, Hodge R, Schaber JA, Miralles R, Silverman M, Grant WD. Pulmonary Ureaplasma urealyticum is associated with the development of acute lung inflammation and chronic lung disease in preterm infants. Pediatr Res. 2004;55(1):61-8. PMID: 14605250. doi: 10.1203/01.PDR.0000100757.38675.50.
15. Lowe J, Watkins WJ, Edwards MO, Spiller OB, Jacqz-Aigrain E, Kotecha SJ, Kotecha S. Association between pulmonary ureaplasma colonization and bronchopulmonary dysplasia in preterm infants: updated systematic review and meta-analysis. Pediatr Infect Dis J. 2014;33(7):697-702. doi: 10.1097/INF.0000000000000239.

/113-1.jpg )