Введение
Выбор антибактериальных препаратов при лечении нозокомиальных пневмоний прежде всего зависит от этиологии заболевания. Наиболее часто встречаемыми мультирезистентными (multidrug-resistant — MDR) возбудителями госпитальной пневмонии являются: methicillin-resistant Staphylococcus aureus (MRSA), Pseudomonas aeruginosa, Klebsiella pneumoniae (ESBL), Legionella pneumophila, Acinetobacter species [3, 5, 19]. Метициллин-резистентные бактерии Staphylococcus aureus являются частыми MDR-патогенами, индуцирующими нозокомиальные пневмонии [28]. Установлено, что в этиологической структуре госпитальных пневмоний на MRSA приходится 20–30 % [10]. Хотя ванкомицин по-прежнему считают препаратом выбора при лечении пневмонии, вызванной MRSA, его клиническая эффективность в последнее время была поставлена под сомнение. Считают, что линезолид, представляющий семейство оксазолидинонов, является более эффективным антибактериальным препаратом, чем ванкомицин, при проведении терапии госпитальной MRSA-ассоциированной пневмонии [13]. Среди грамотрицательных MDR-бактерий наиболее причинно-значимыми возбудителями госпитальных пневмоний являются бактерии Pseudomonas aeruginosa, Acinetobacter baumanii и Enterobacteriacae, которые резистентны к действию пиперациллина/тазобактама и карбапенемов [26].
Антибактериальная терапия госпитальных пневмоний
При проведении антибактериальной терапии у больных детей с нозокомиальной пневмонией рекомендуют: выбирать антибиотик согласно чувствительности причинно-значимого возбудителя (сильная рекомендация с умеренной степенью доказательности); отдавать предпочтение препаратам с ограниченным спектром антибактериальной активности (сильная рекомендация с низкой степенью доказательности); использовать достаточную дозу антибиотика для обеспечения эффективной концентрации в месте инфицирования (сильная рекомендация с низкой степенью доказательности) [4].
Общие рекомендации ATS/IDSA по применению антибактериальных препаратов при лечении нозокомиальной пневмонии представлены в табл. 1.
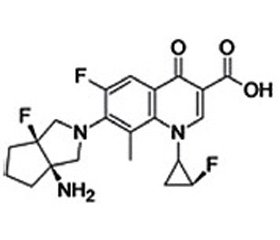
Для этиологической терапии госпитальных пневмоний предлагается использовать новые антибактериальные средства и их сочетания с известными и новыми ингибиторами β-лактамаз (табл. 2).
Таким образом, выбор антибактериального препарата при лечении больных с госпитальной пневмонией представляет достаточно сложную клиническую задачу. Первым шагом в алгоритме выбора антибиотика может быть учет риска наличия MDR-патогена как причинно-значимого возбудителя пневмонии (рис. 1).
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Arshad H, Fasanya A, Cheema T, Singh AC. Acute Pneumonia. Crit Care Nurs Q. 2016 Apr-Jun;39(2):148-60. doi: 10.1097/CNQ.0000000000000108.
2. Bassetti M, Righi E, Carnelutti A. New therapeutic options for respiratory tract infections. Curr Opin Infect Dis. 2016 Apr;29(2):178-86. doi: 10.1097/QCO.0000000000000251.
3. Bradley JS. Considerations unique to pediatrics for clinical trial design in hospital-acquired pneumonia and ventilator-associated pneumonia. Clin Infect Dis. 2010 Aug 1;51 Suppl 1:S136-43. doi: 10.1086/653063.
4. Bradley JS, Byington CL, Shah SS et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America. Clin Infect Dis. 2011 Oct;53(7):e25-76. doi: 10.1093/cid/cir531.
5. Cilloniz C, Martin-Loeches I, Garcia-Vidal C et al. Microbial Etiology of Pneumonia: Epidemiology, Diagnosis and Resistance Patterns. Int J Mol Sci. 2016 Dec 16;17(12). pii: E2120. doi: 10.3390/ijms17122120.
6. Connors KP, Housman ST, Pope JS. Phase I, open-label, safety and pharmacokinetic study to assess bronchopulmonary disposition of intravenous eravacycline in healthy men and women. Antimicrob Agents Chemother. 2014;58(4):2113-8. doi: 10.1128/AAC.02036-13.
7. de Souza Mendes Cd., de Souza Antunes A.M. Pipeline of Known Chemical Classes of Antibiotics. Antibiotics (Basel). 2013 Dec 6;2(4):500-34. doi: 10.3390/antibiotics2040500.
8. Eckburg PB, Ge Y, Hafkin B. Single- and Multiple-Dose Study to Determine the Safety, Tolerability, Pharmacokinetics, and Food Effect of Oral MRX-I versus Linezolid in Healthy Adult Subjects. Antimicrob Agents Chemother. 2017 Feb 6. pii: AAC.02181-16. doi: 10.1128/AAC.02181-16.
9. El Hajj MS, Turgeon RD, Wilby KJ. Ceftaroline fosamil for community-acquired pneumonia and skin and skin structure infections: a systematic review. Int J Clin Pharm. 2017 Feb;39(1):26-32. doi: 10.1007/s11096-016-0417-z.
10. European Centre for Disease Prevention and Control (ECDC). Antimicrobial resistance surveillance in Europe 2013. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). Stockholm: ECDC; 2014. Available from: https://ecdc.europa.eu/sites/portal/files/media/en/publications/Publications/antimicrobial-resistance-surveillance-europe-2013.pdf
11. Falcó V, Burgos J, Papiol E. et at. Investigational drugs in phase I and phase II clinical trials for the treatment of hospital-acquired pneumonia. Expert Opin Investig Drugs. 2016 Jun;25(6):653-65. doi: 10.1517/13543784.2016.1168803.
12. Ito-Horiyama T, Ishii Y, Ito A. et al. Stability of Novel Siderophore Cephalosporin S-649266 against Clinically Relevant Carbapenemases. Antimicrob Agents Chemother. 2016 Jun 20;60(7):4384-6. doi: 10.1128/AAC.03098-15.
13. Jiang H, Tang RN, Wang J. Linezolid versus vancomycin or teicoplanin for nosocomial pneumonia: meta-analysis of randomised controlled trials. Eur J Clin Microbiol Infect Dis. 2013 Sep;32(9):1121-8. doi: 10.1007/s10096-013-1867-z.
14. Jones TM, Johnson SW, DiMondi VP, Wilson DT. Focus on JNJ-Q2, a novel fluoroquinolone, for the management of community-acquired bacterial pneumonia and acute bacterial skin and skin structure infections. Infect Drug Resist. 2016 Jun 7;9:119-28. doi: 10.2147/IDR.S105620.
15. Le VT, Le HN, Pinheiro MG. et al. Effects of tedizolid phosphate on survival outcomes and suppression of production of staphylococcal toxins in a rabbit model of MRSA necrotizing pneumonia. Antimicrob Agents Chemother. 2017 Jan 30. pii: AAC.02734-16. doi: 10.1128/AAC.02734-16.
16. Liapikou A, Torres A. Emerging drugs for nosocomial pneumonia. Expert Opin Emerg Drugs. 2016 Sep;21(3):331-41. doi: 10.1080/14728214.2016.1206077.
17. Liu Y, Zhang Y, Wu J et al. A randomized, double-blind, multicenter Phase II study comparing the efficacy and safety of oral nemonoxacin with oral levofloxacin in the treatment of community-acquired pneumonia. J Microbiol Immunol Infect. 2015 Dec 1. pii: S1684-1182(15)00915-9. doi: 10.1016/j.jmii.2015.09.005.
18. Matsumoto T. Arbekacin: another novel agent for treating infections due to methicillin-resistant Staphylococcus aureus and multidrug-resistant Gram-negative pathogens. Clin Pharmacol. 2014 Sep 26;6:139-48. doi: 10.2147/CPAA.S44377.
19. McGrath EJ, Asmar BI. Nosocomial infections and multidrug-resistant bacterial organisms in the pediatric intensive care unit. Indian J Pediatr. 2011 Feb;78(2):176-84. doi: 10.1007/s12098-010-0253-4.
20. Mendes RE, Farrell DJ, Flamm RK. In Vitro Activity of Lefamulin Tested against Streptococcus pneumoniae with Defined Serotypes, Including Multidrug-Resistant Isolates Causing Lower Respiratory Tract Infections in the United States. Antimicrob Agents Chemother. 2016 Jun 20;60(7):4407-11. doi: 10.1128/AAC.00627-16.
21. Mischnik A, Baumert P, Hamprecht A et al. Susceptibility to cephalosporin combinations and aztreonam/avibactam among third-generation cephalosporin-resistant Enterobacteriaceae recovered on hospital admission. Int J Antimicrob Agents. 2017 Feb;49(2):239-242. doi: 10.1016/j.ijantimicag.2016.10.013.
22. Nagaoka K, Yanagihara K, Morinaga Y et al. In vivo antianaerobe activity of DS-8587, a new fluoroquinolone, against Fusobacterium necrophorum in a mouse model. J Infect Chemother. 2017 Mar;23(3):131-135. doi: 10.1016/j.jiac.2016.09.007.
23. Podos SD, Thanassi JA, Leggio M, Pucci MJ. Bactericidal activity of ACH-702 against nondividing and biofilm Staphylococci. Antimicrob Agents Chemother. 2012 Jul;56(7):3812-8. doi: 10.1128/AAC.00092-12.
24. Purrello SM, Garau J, Giamarellos E et al. Methicillin-resistant Staphylococcus aureus infections: A review of the currently available treatment options. J Glob Antimicrob Resist. 2016 Dec;7:178-186. doi: 10.1016/j.jgar.2016.07.010.
25. Shaw KJ, Barbachyn MR. The oxazolidinones: past, pre-sent, and future. Ann N Y Acad Sci. 2011 Dec;1241:48-70. doi: 10.1111/j.1749-6632.2011.06330.x.
26. Sligl WI, Dragan T, Smith SW. Nosocomial Gram-negative bacteremia in intensive care: epidemiology, antimicrobial susceptibilities, and outcomes. Int J Infect Dis. 2015 Aug;37:129-34. doi: 10.1016/j.ijid.2015.06.024.
27. Smart JI, Corey GR, Stryjewski ME et al. Assessment of Minimum Inhibitory Concentrations of Telavancin by Revised Broth Microdilution Method in Phase 3 Hospital-Acquired Pneumonia/Ventilator-Associated Pneumonia Clinical Isolates. Infect Dis Ther. 2016 Dec;5(4):535-544. PMID: 27718118. doi: 10.1007%2Fs40121-016-0133-y.
28. Teshome BF, Lee GC, Reveles KR et al. Application of a methicillin-resistant Staphylococcus aureus risk score for community-onset pneumonia patients and outcomes with initial treatment. BMC Infect Dis. 2015 Sep 18;15:380. doi: 10.1186/s12879-015-1119-1.
29. Van Bambeke F. Renaissance of antibiotics against difficult infections: Focus on oritavancin and new ketolides and quinolones. Ann Med. 2014 Nov;46(7):512-29. doi: 10.3109/07853890.2014.935470.
30. Viasus D, Ramos O, Ramos L et al. Solithromycin for the treatment of community-acquired bacterial pneumonia. Expert Rev Respir Med. 2017 Jan;11(1):5-12. doi: 10.1080/17476348.2017.1249852.
31. Villano S, Steenbergen J, Loh E. Omadacycline: development of a novel aminomethylcycline antibiotic for treating drug-resistant bacterial infections. Future Microbiol. 2016 Oct;11:1421-1434. PMID: 27539442. doi: 10.2217/fmb-2016-0100.
32. Vuong C, Yeh GY, Cheung M. Otto Investigational drugs to treat methicillin-resistant Staphylococcus aureus. Expert Opin Investig Drugs. 2016;25(1):73-93. doi: 10.1517/13543784.2016.1109077.
33. Yamada K, Yamamoto Y, Yanagihara K et al. In vivo efficacy and pharmacokinetics of biapenem in a murine model of ventilator-associated pneumonia with Pseudomonas aeruginosa. J Infect Chemother. 2012 Aug;18(4):472-8. doi: 10.1007/s10156-011-0359-2.
34. Zhang S, Chuong LI, Khang IC et al. Vivo efficacy of CB-027 against methicillin-resistant Staphylococcus aureus, and ceftazidime-resistant Pseudomonas aeruginosa and Klebsiella pneumoniae infections in mice. In: Proceedings of 52nd International Interscience Conference on Antimicrobial Agents and Chemotherapy; San Francisco, CA, USA. 10 September 2012.

/78-1.jpg )
/79-1.jpg )
/80-1.jpg )
/81-1.jpg )
/82-1.jpg )
/82-2.jpg )