Вступ
Спеціалісти всіх профілів часто констатують наявність астенії у своїх хворих, але нечасто займаються її лікуванням, а інколи навіть не повністю розуміють природу цього розладу. Все це відбувається при досить високій частоті (в межах 64 %) звернень пацієнтів з астенічними симптомами до лікаря. Більшість спеціалістів розцінюють астенію як винятково вторинний розлад і не займаються спеціально питанням терапії цього стану. Ситуація ускладнюється й тим, що лікарі не завжди використовують об’єктивні методи діагностики астенії, й оцінка стану хворих часто заснована лише на скаргах пацієнтів, які лише суб’єктивно оцінюються лікарями [3].
Термін «астенія» (від гр. а — без; sthenos — сила) означає відсутність енергії або сили і часто інтерпретується хворими як швидка втомлюваність, тривала слабкість і знесилення. Астенія, що триває понад 6 місяців, вважається хронічною. Висока частота симптомів астенії призводить до значних соціально-економічних наслідків і суттєвого погіршення якості життя пацієнта [15].
Одним із провідних симптомів астенії є зниження фізичної активності (незвичайна втомлюваність, підвищена потреба у відпочинку, відсутність відновлення після відпочинку). Другою складовою астенії є зниження розумової активності (зниження концентрації уваги, розсіяність). Третьою складовою астенії є емоційні симптоми (емоційна лабільність, роздратованість, плаксивість). Частим проявом астенічного стану є розлади циклу сну, що проявляються денною сонливістю, неглибоким, із частими просинаннями, сном, неприємними сновидіннями [6].
Більше ніж у половини випадків звичайною причиною хронічної астенії є депресія та коморбідні їй стани, насамперед тривога [15].
Депресія (лат. depressio — пригніченість) — це порушення, що характеризується патологічно зниженим настроєм із негативною, песимістичною оцінкою себе, свого положення в оточуючій реальності та майбутнього [2]. Також депресія супроводжується розладами структури сну, емоційної та фізичної сфер організму та часто пов’язана з тривалим і тяжким перебігом, а також збільшеним ризиком самогубства [8]. Тривога — найбільш поширене хронічне порушення, що коморбідне депресії в 30–75 % випадків. Серед діагностичних критеріїв депресії, згідно з МКХ-10, можна відзначити чотири симптоми, які є проявом астенічного синдрому (АС), а саме: швидка втомлюваність і зниження працездатності, порушення концентрації уваги і розумової діяльності, розлади сну і порушення апетиту [9]. За офіційними даними Міністерства охорони здоров’я України, в 2001 р. поширеність тривожно-депресивних розладів (ТДР) становила 284,5 на 100 тис. чоловік, а захворюваність — 78,1 на 100 тис. При цьому кількість тривожно-депресивних хворих, які не звернулися по медичну допомогу, значно більша. Слід підкреслити, що клінічна картина тривожно-депресивних розладів не вичерпується лише симптомами зниженого настрою. У більшості випадків у таких хворих виникають різноманітні соматичні скарги, які й є основною причиною їх звертання до різних лікарів загального профілю, наприклад до терапевтів, хірургів, сексопатологів, неврологів та ін. [4].
Патогенетичні механізми розвитку астенічного синдрому дотепер повністю не встановлені. Однак одним із факторів, який відіграє роль у розвитку АС, є порушення функції висхідної (активуючої) ретикулярної формації, яка являє собою нейрональну сітку, що відповідає за активацію структур головного мозку та регуляцію енергетичних процесів організму [1]. Крім того, при тривожно-депресивних розладах відбувається порушення обміну нейромедіаторів, насамперед серотоніну і норадреналіну, що також призводить до порушення процесів збудження і гальмування, пригнічення передачі нервового імпульсу в головному мозку та емоційних розладів, що значно впливає на розвиток АС при цих патологіях.
В першу чергу необхідно визначити й усунути першопричину АС, хоча до 20 % пацієнтів залишаються без діагнозу [15].
Розуміння механізмів астенії на клітинному рівні як порушення нормального метаболізму клітини призводить до цілеспрямованого використання метаболічних коректорів у комбінованому лікуванні хворих на АС. Використання сучасних метаболічних засобів при терапії АС дозволяє не тільки чинити безпосередній активуючий вплив на метаболізм клітини, а й знизити кількість побічних ефектів, включаючи седацію або гіперстимуляцію, опосередковану використанням психотропних засобів, особливо антидепресантів [1].
Відомим коректором клітинного метаболізму є мельдоній, що являє собою найпотужніший зворотний інгібітор гамма-бутиробетаїнгідролази, яка каталізує конверсію гамма-бутиробетаїну в карнітин, збільшуючи рівні гамма-бутиробетаїну в десятки разів. Тим самим мельдоній знижує карнітин-залежний транспорт жирних кислот у мітохондрії м’язової тканини та їх окислення за рахунок зниження рівнів карнітину на 40 %, сприяючи активації аеробного шляху окислення глюкози, що супроводжується додатковою появою антиішемічного ефекту [1, 7, 14]. Вищезазначений ефект особливо важливий для хворих на АС, оскільки встановлено наявність зв’язку між рівнем L-карнітину в плазмі крові й ризиком розвитку АС, а також ступенем дефіциту L-карнітину і порушенням обміну довголанцюгових жирних кислот з вираженістю симптомів АС [13].
Лікування неврологічних хворих із порушенням мозкового кровообігу препаратами мельдонію призводило до покращення настрою пацієнтів, підвищення їх фізичної активності, зменшення неврологічної симптоматики та АС. Дія мельдонію в орга–нізмі може бути обумовлена також за рахунок збільшення концентрації гамма-бутиробетаїну, який має потужний холіноміметичний ефект на М-холінорецептори завдяки схожості з молекулами ацетилхоліну, покращуючи проведення нервового імпульсу в центральній нервовій системі (ЦНС) і м’язах, а також завдяки здатності активувати ендотеліальну NO-синтазу, що призводить до утворення NO з подальшим судинорозширювальним ефектом. Всі ці ефекти також сприяють покращенню нейронального метаболізму на рівні мітохондрій, пригнічують перекисне окислення ліпідів і збільшують утворення ендогенних антиоксидантів, нормалізують експресію білків, залучених у нейродегенерацію, зменшують прояви запалення й апоптозу, відновлюють цілісність гематоенцефалічного бар’єра [7, 14].
Останніми роками в проведених дослідженнях була продемонстрована значна роль запальних реакцій у патофізіології розвитку депресивних розладів, що й лягло в основу нової запальної теорії депресії. Так, у хворих на депресію були виявлені високі рівні в крові та ЦНС прозапальних цитокінів (ІL-1, IL-6, TNF-α), білків гострої фази (C-реактивний білок, гаптоглобін, α-1-acid glycoprotein, α-1-antichymotrypsin), хемокінів і молекул адгезії (human macrophage chemoattractant protein-1 (MCP-1), soluble intra cellular adhesion molecule-1 (sICAM-1) і Е-селектин) [10, 12]. Тому засоби з протизапальною дією можуть мати додатковий позитивний ефект на перебіг депресії та її супутніх симптомів.
В одному з досліджень на моделі тварин було показано протизапальний ефект мельдонію, порівнянний з індометацином, при формалін-індукованому запаленні [11].
Зважаючи на механізми дії мельдонію, значний інтерес викликає можливість його впливу на АС при тривожно-депресивних розладах, оскільки немає достатньої кількості наукових даних щодо його ефективності в комплексному лікуванні даних патологій. В цьому контексті викликає інтерес вітчизняний препарат мельдонію — Тризипін® лонг 750 мг, таблетки пролонгованої дії (ТОВ НВХ «Мікрохім», Україна).
Метою дослідження було вивчення клінічної ефективності пролонгованої форми мельдонію (Тризипін® лонг 750 мг) у комплексному лікуванні астенічного синдрому у хворих із тривожно-депресивними розладами на амбулаторному етапі.
Матеріали та методи
Проведено обстеження та лікування 60 пацієнтів із тривожно-депресивними розладами різного ступеня вираженості, які становили дві групи. Критеріями включення були: наявність тривожно-депресивного розладу непсихотичного рівня різного походження, що відповідає діагностичним критеріям МКХ-10, вік хворого від 18 років і старше, інформована згода пацієнта на участь у дослідженні та наявність в нього установки на лікування. Критеріями виключення були: відмова пацієнта від прийому препарату, ускладнення та тяжкий перебіг соматичної хвороби, вагітність, годування груддю, клінічно значущі відхилення показників лабораторних досліджень.
До першої групи увійшли 30 пацієнтів (24 жінки та 6 чоловіків, середній вік яких становив 40,6 ± 13,5 року), які отримували стандартну терапію, що включала призначення антидепресанту з групи селективних інгібіторів зворотного захвату серотоніну флуоксетину (20 мг/добу), есциталопраму (10 мг/добу) або сертраліну (50 мг/добу) в комбінації з короткотривалим (2-тижневим) курсом анксіолітичних засобів, переважно гідазепамом (20–40 мг/добу).
До другої групи увійшли 30 пацієнтів (22 жінки та 8 чоловіків, середній вік яких був 37,8 ± 11,8 року), яким, окрім стандартної терапії, призначали Тризипін® лонг 750 мг 1 раз на добу вранці протягом 4 тижнів.
За основними соціально-демографічними показниками групи пацієнтів були однорідні. Лікування проводили амбулаторно, з контролем його ефективності через 4 тижні.
Процедура обстеження включала аналіз анамнестичних даних, розгорнуте клінічне інтерв’ю з аналізом психічного стану (за діагностичними критеріями МКХ-10) та використання діагностичних шкал, таких як: опитувальник депресії Бека (Beck А.Т., 1961); рівень тривоги за шкалою Спілбергера (Hanin Y.L., Spilberger C.D., 1989); візуально-аналогова шкала астенії (VAS-A), що дає можливість отримати кількісну оцінку суб’єктивної тяжкості стану за трьома параметрами: психічна астенія, соматична астенія та порушення соціального функціонування; шкала астенічного стану Малкової Л.Д., адаптована Чертовою Т.Г. (1997). Крім того, проводилися вимірювання артеріального тиску та частоти серцевих скорочень, запис ЕКГ. Відповідні дослідження здійснювали при зверненні хворого та в динаміці через 4 тижні лікування.
Під час порівняння даних використовували t-критерій Стьюдента (М ± σ), визначали 95% довірчий інтервал (95% ДІ). Різницю вважали статистично значимою при р < 0,05.
Результати та обговорення
Вихідний рівень значної депресії, за даними шкали депресії Бека, спостерігався у 9 хворих (30,0 %) основної групи та у 8 хворих (26,7 %) контро–льної групи. Середній рівень депресії в основній групі виявлявся у 20 хворих (66,7 %) та у 21 хворого (70,0%) контрольної групи. Легкий рівень депресії фіксували в кожній групі (по одному хворому, 3,3 %). В середньому за підрахунком балів рівень депресії в основній групі становив 26,3 ± 4,6 бала, в групі контролю — 25,7 ± 4,3 бала, дані достовірно не відрізнялись між собою (95% ДІ 1,7–2,9 бала) (р > 0,05).
Через 4 тижні лікування в середньому за бальною оцінкою рівень депресії в обох групах достовірно знизився порівняно з вихідним рівнем і в основній групі становив 17,3 ± 1,9 бала (95% ДІ 7,2–10,8 бала) (р < 0,001), у групі контролю — 18,0 ± 2,4 бала (95% ДІ 5,9–9,5 бала) (р < 0,001), дані достовірно не відрізнялись між собою (95% ДІ 0,4–1,8 бала) (р > 0,05). Серед хворих обох груп не спостерігалося значної депресії, серед хворих основної групи з середнім рівнем депресії залишилося 5 пацієнтів (16,7 %) і з легким рівнем — 25 пацієнтів (83,3 %); в контрольній групі у 6 пацієнтів визначався середній рівень депресії (20 %) та у 24 пацієнтів (80 %) — легкий рівень.
Вихідний рівень реактивної тривожності надвисокого рівня, за даними шкали Спілбергера, спостерігався у 7 хворих (23,3 %) основної групи та у 9 хворих (30,0 %) контрольної групи. Високий рівень тривожності в основній групі виявлявся у 23 хворих (76,7 %) та у 21 хворого (70,0%) контрольної групи. Середній та легкий рівень тривожності не фіксувався у хворих обох груп. В середньому за балами рівень тривожності в основній групі становив 66,2 ± 5,1 бала, в групі конт–ролю — 67,3 ± 5,1 бала, дані достовірно не відрізнялись між собою (95% ДІ 1,5–3,7 бала) (р > 0,05).
Через 4 тижні лікування в середньому за балами рівень тривожності в обох групах достовірно знизився порівняно з вихідним рівнем; в основній групі становив 58,0 ± 5,6 бала (95% ДІ 5,4–10,9 бала) (р < 0,001), в групі контролю — 59,4 ± 4,8 бала (95% ДІ 5,3–10,4) (р < 0,001), дані достовірно не відрізнялись між собою (95% ДІ –1,3–4,1 бала) (р > 0,05). Серед хворих обох груп не спостерігалося надвисокого рівня тривожності; серед хворих основної групи з високим рівнем тривожності залишилося 25 пацієнтів (83,3 %) і з середнім рівнем — 5 пацієнтів (16,7 %); в контрольній групі у 29 пацієнтів визначався високий рівень тривожності (96,7 %) та у 1 пацієнта (3,3 %) — середній рівень.
Отже, в обох групах спостерігалась помірна позитивна динаміка тривожно-депресивної симптоматики в процесі лікування, що можна пояснити дією антидепресантів та анксіолітика. Виявлялось покращення настрою, зменшення нудьги, тривоги та поліпшення сну. Покращення виявлялось також з боку зменшення вегетативної симптоматики, що проявлялось стабілізацією артеріального тиску (АТ) і частоти серцевих скорочень (ЧСС), зменшенням проявів соматоформних розладів, а також частоти та вираженості панічних атак.
АС практично завжди присутній у структурі тривожно-депресивних розладів і може значно погіршувати функціонування хворих та їх якість життя. В цьому дослідженні при використанні VAS-A, що дає можливість отримати кількісну оцінку суб’єктивної тяжкості стану за трьома параметрами: психічна астенія, соматична астенія і порушення соціального функціонування, була встановлена наявність різного ступеня астенії та вплив її на функціонування хворих. Згідно з даними шкали, вираженість різних проявів АС була практично однаковою в обох групах і достовірно групи за проявами АС не відрізнялись між собою. Оскільки причиною АС у даному випадку є тривожно-депресивний розлад, відповідне лікування антидепресантами призводило до редукції АС, що спостерігалось в обох групах (табл. 1).
Згідно з даними табл. 1, динаміка АС за шкалою VAS-A статистично значущо зменшувалась протягом лікування в обох групах хворих. Однак у групі пацієнтів, яким до лікування додатково було призначено Тризипін® лонг 750 мг, через 4 тижні порівняно з контрольною групою спостерігалось статистично значуще зменшення проявів як психічної астенії (95% ДІ 0,16–1,56) (р < 0,01), так і фізичної астенії (95% ДІ, 0,47–1,72) (р < 0,001). Показники соціального функціонування хоча й були дещо кращими в основній групі, однак статистично не відрізнялися від контрольної групи (95% ДІ –0,27–0,79) (р > 0,05).
Паралельно зі шкалою VAS-A для достовірності результату оцінку вираженості АС проводили також за шкалою астенічного стану Малкової Л.Д., адаптованою Чертовою Т.Г. (1997).
Відповідно до табл. 2, в процесі лікування через 4 тижні в основній групі, пацієнти якої на додаток до стандартного лікування отримували Тризипін® лонг 750 мг, у 26,7 % хворих спостерігався повний регрес астенічної симптоматики, тоді як у конт–рольній групі повний регрес спостерігався тільки у 6,7 % хворих, що вказувало на додатковий антиастенічний ефект препарату при відповідній патології. У хворих обох груп не спостерігалося вираженого рівня АС.
/12-2.jpg)
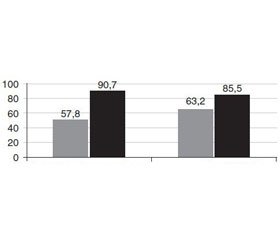
У середньому за балами рівень вираженості астенії в основній групі становив 90,7 ± 17,3 бала, в групі контролю — 85,5 ± 17,2 бала, і достовірно дані не відрізнялись між собою (95% ДІ –3,7–14,1 бала) (р > 0,05). Через 4 тижні лікування в середньому за бальною оцінкою рівень вираженості астенії в обох групах достовірно знизився порівняно з вихідним рівнем і в основній групі дорівнював 57,8 ± 9,2 бала (95% ДІ 25,7–40,0 бала) (р < 0,001), в групі конт–ролю — 63,2 ± 8,2 бала (95% ДІ 15,3–29,2 бала) (р < 0,001). Крім того, в основній групі через 4 тижні лікування вираженість астенії достовірно була нижчою порівняно з контрольною групою (95% ДІ 0,9–9,9 бала) (р > 0,05) (рис. 1).
/12-1.jpg)
Таким чином, регрес тривожно-депресивного розладу на тлі лікування антидепресантами й анксіолітиками призводить також до регресу АС, що вказує на наявність спільних механізмів їх виникнення. Оскільки вираженість астенії в основній групі після проведення лікування була достовірно менша порівняно з контрольною групою, даний ефект може бути обумовлений додатковою дією Тризипіну.
У більшості хворих із тривожно-депресивними розладами часто спостерігається дисфункція вегетативної нервової системи, що проявляється нестійкістю АТ і тенденцією до його підвищення та лабільність пульсу з розвитком тахікардії внаслідок переважання активності симпатичної нервової системи. Подібні зміни звертають на себе увагу хворого, сприяючи посиленню тривоги та порушенню його активності та функціонування. При порівнянні офісних показників АТ на початку лікування і після 4 тижнів лікування спостерігалась тенденція до стабілізації як систолічного артеріального тиску (САТ), так і діастолічного (ДАТ), з достовірним його зниженням в обох групах (табл. 3).
/13-1.jpg)
Після 4 тижнів лікування САТ і ДАТ в основній групі, яка отримувала Тризипін® лонг 750 мг, був дещо меншим порівняно з хворими контрольної групи, однак дані достовірно не відрізнялись між різними групами.
Показники ЧСС на початку лікування свідчили про переважання у хворих підвищеної активності симпатичної нервової системи з розвитком помірної тахікардії. В процесі лікування спостерігалось достовірне зниження ЧСС в обох групах зі стабілізацією в більшості хворих у міру регресу тривожно-депресивної симптоматики. В основній групі хворих, які отримували Тризипін® лонг, ЧСС після 4 тижнів лікування знизилася до рівня 77,8 ± 5,6 уд/хв і достовірно була меншою порівняно з контрольною групою, де ЧСС була в межах 81,5 ± 5,9 уд/хв, відповідно (95% ДІ 0,73–6,67) (р < 0,01).
Відповідна стабілізація вегетативного статусу з нормалізацією АТ і ЧСС у процесі лікування виникає переважно за рахунок стабілізації емоційного фону та зменшення рівня тривожності й, відповідно, зниження активності симпатоадреналової системи завдяки терапії антидепресантами й анксіолітиками. Однак тенденція до більш швидкої нормалізації АТ і особливо ЧСС у хворих основної групи може свідчити про додаткові можливості мельдонію щодо захисту серцево-судинної системи від впливу на неї негативних нейрогуморальних факторів і деякого зниження активності симпатичної нервової системи, сприяючи більш швидкому відновленню функціонування серцево-судинної системи.
Висновки
1. У клінічній структурі тривожно-депресивного розладу практично завжди наявний різного ступеня вираженості астенічний синдром, який також значно впливає на порушення функціонування й якості життя хворих, ускладнюючи при цьому перебіг захворювання.
2. Додавання препарату Тризипін® лонг в дозі 750 мг один раз на добу до стандартної терапії ТДР антидепресантами й анксіолітиками протягом 4 тижнів сприяє більш швидкому регресу психічних і соматичних проявів астенії, стабілізації вегетативних проявів ТДР, а також відновленню соціального функціонування та працездатності хворих.
3. Використання препарату Тризипін® лонг завдяки його нейрометаболічній дії та впливу на нейромедіаторні процеси приводить до більш швидкого регресу ТДР, прискорює початок дії антидепресивної терапії, сприяє зменшенню соматичних скарг при ТДР і з боку серцево-судинної системи.
4. Завдяки пролонгованій формі з використанням її 1 раз на добу, добрій переносимості, практичній відсутності побічних ефектів і взаємодії з іншими засобами препарат Тризипін® лонг є незамінним, ефективним і безпечним засобом для корекції супутнього АС при різних проявах ТДР незалежно від ступеня тяжкості.
Конфлікт інтересів. Не заявлений.

/12-2.jpg)
/12-1.jpg)
/13-1.jpg)