Вступ
Цукровий діабет (ЦД) — група метаболічних захворювань, що виникають внаслідок порушення секреції інсуліну підшлунковою залозою, дії інсуліну або поєднаного впливу цих чинників. ЦД вважається пандемією XXI століття. За даними Всесвітньої організації охорони здоров’я (ВООЗ), кількість пацієнтів із ЦД зросла від 108 млн у 1980 році до 422 млн у 2014 році [1, 2]. За прогнозами Міжнародної діабетичної федерації, число хворих на ЦД серед дорослого населення в світі до 2030 року становитиме понад 550 млн [3, 4]. У 2012 році 1,5 млн випадків смерті були безпосередньо спричинені діабетом. За прогнозами ВООЗ, ЦД буде посідати сьоме місце серед причин смертності в 2030 році [1, 2].
Однією з основних причин, які призводять до інвалідизації хворих на ЦД, є діабетична ретинопатія (ДР). Це мікросудинна патологія, що характеризується ураженням судин сітківки та розвитком мікроаневризм, крововиливів, ексудативних змін і новоутворенням судин на очному дні, внаслідок чого знижується гострота зору, розвивається сліпота [5]. На її частку припадає 80–90 % усієї інвалідності по зору, зумовленої ЦД [4]. Приблизно у 5 % випадків діагноз ДР встановлюється до моменту виявлення ЦД, а через 10 років після початку прогресування захворювання дане ускладнення призводить до змін очного дна більше ніж у 50 % хворих та у 75–90 % хворих, у яких ЦД триває понад 15 років [6]. На сьогодні в світі серед хворих на ЦД налічується 45 мільйонів сліпих людей та 180 мільйонів зі зниженим зором. Існує припущення, що за наступні 30 років кількість сліпих зросте на 27 %, а людей зі зниженим зором — на 45 % [7, 8]. Кількість пацієнтів із втратою зору внаслідок ЦД перебуває в межах від 26 % при ЦД 2-го типу до 84 % при ЦД 1-го типу.
Вперше ДР описана понад 100 років тому McKenzie (1879), проте і сьогодні це ускладнення залишається актуальною проблемою для теоретичної та практичної медицини [9, 10]. Встановлено, що у хворих на ЦД 1-го типу віком до 30 років після 10-річного спостереження ДР розвивалась у 89 % випадків, частка проліферативної ДР становила 30 %. У хворих на ЦД 2-го типу виявлена ДР у 20 % випадків при тривалості ЦД не більше двох років [11, 12]. За даними літератури, порушення ендотелію та еластичних властивостей артерій безпосередньо пов’язано з розвитком судинних ускладнень діабету [13–16].
Актуальність проблеми ДР обумовлює потребу в розробці та дослідженні нових методів корекції ушкоджень оболонок очного яблука [17]. Однак, зважаючи на біоетичні та моральні аспекти, розробка таких методів потребує адекватних експериментальних моделей.
В основі розробленої нами моделі лежить введення алоксану експериментальним тваринам.
Алоксан — структурний аналог глюкози, за рахунок цього він зв’язується з транспортером глюкози GLUT2 і вибірково накопичується в β-клітинах підшлункової залози експериментальних тварин. Механізм дії — генерація в циклічній реакції з діалуроновою кислотою активних форм кисню, що ініціюють руйнування β-клітин, які мають низький рівень антиоксидантного захисту. Результат — руйнування β-клітин — зменшення синтезу та секреції в кров інсуліну, і, як наслідок, у тварин розвиваються гіперглікемія та діабетичний синдром, аналогічний ЦД 1-го типу [18, 19].
Слід зауважити, що поширенню алоксанової моделі ЦД заважає її висока токсичність, що встановлено для раніше вживаних алоксанових моделей [20]. З літературних джерел відомо, що транспортер глюкози GLUT2, який також експресується в гепатоцитах і клітинах канальців нирок, має токсичний вплив на печінку та нирки [21]. Порівняно з β-острівцями гепатоцити мають більш високу антиоксидантну активність. Що стосується нефротоксичності, то в раніше відомих дозах введення алоксану призводило до некрозу окремих ділянок звивистих канальців нирок і, як наслідок, розвитку ниркової недостатності, що виникає в частини тварин ще до розвитку ЦД і може стати причиною смерті щурів у перші 5 діб після введення алоксану [20, 22].
Однак саме алоксанова модель ЦД у зв’язку з вищезазначеним механізмом дії алоксану на β-клітини є обґрунтованою для подальшого дослідження антиоксидантної терапії.
Мета — створення оптимальної для дослідження ДР моделі ЦД 1-го типу, яка також є придатною для дослідження ефективності коригуючої терапії, і при цьому не призводитиме до смерті експериментальних тварин. Гістологічне дослідження змін у тканинах очного яблука при відтворенні моделі ЦД для підбору нових ефективних методів метаболічного лікування ДР на ранніх стадіях.
Матеріали та методи
Результати отримані при дослідженні білих щурів лінії Вістар автобредного розведення масою 180–200 г. Відповідно до завдання тварини були ранжовані на дві групи. Перша група — 20 тварин, які не зазнавали жодного впливу і слугували конт–ролем; друга група — 30 тварин, у яких моделювали ЦД. Моделювання ЦД: триразове внутрішньоочеревинне введення алоксану з інтервалом 5 днів у дозі 7,5 мл/200 г маси тварини в комплексі з вільним напуванням тварин 5% розчином фруктози. Отримання піддослідними тваринами розчину фруктози є додатковим навантаженням на вуглеводний обмін, що дезінтегрує нормальний метаболічний процес. Тривалість експерименту — 30 діб. Після закінчення експерименту у тварин визначали рівень глюкози в крові, а також наявність цукру в сечі. Тварин виводили з досліду шляхом декапітації під легким ефірним наркозом згідно з «Правилами виконання робіт з використанням експериментальних тварин», затвердженими наказом МОЗ України та Законом України «Про захист тварин від жорстокого поводження» (1759-VI від 15.12.2009). Енуклеація: одне очне яблуко фіксували 24 години в 4% розчині параформальдегіду, потім матеріали проводили через спирти зростаючої концентрації і заливали в целоїдин за загальноприйнятою методикою. З отриманих блоків виготовляли гістологічні зрізи 7–9 мкм, які забарвлювали гематоксиліном-еозином. Отримані препарати досліджували під світловим мікроскопом і визначали структурні зміни в утвореннях очного яблука
Результати
Після закінчення експерименту в інтактних щурів вміст глюкози в крові становив 5,11 ± 0,22 ммоль/л за відсутності глюкози в сечі. Спостереження за інтактними тваринами показало, що вовна гладка, чиста, очі ясні, апетит присутній. Споживання води становить 10–12 мл на добу.
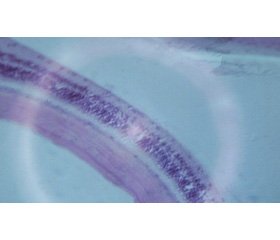
При гістологічному дослідженні стінки очного яблука: білкова оболонка представлена щільно упакованими фіброзними волокнами, серед яких рівномірно розподілені овальні темні ядра фібробластів. У судинній оболонці численні тонкостінні судини, місцями мають вигляд лакун. У сітчастій оболонці чітко проглядається шаруватість. Клітини гангліонарного шару із соковитими округлими ядрами розташовуються в один шар, рівномірно (рис. 1).
У гранулярних шарах клітини з темними округлими ядрами розташовуються щільними масивами. В пігментному шарі визначаються рівномірно розташовані темні гранули різних розмірів.
Кришталик оточений однорідною щільною мембраною, на внутрішній поверхні якої визначаються розташовані в один ряд клітини з дрібними темними ядрами. Тіло кришталика безбарвне, однорідне, на периферії ближче до капсули розсіяні витягнуті темні утворення, очевидно, ядра волокон.
Після закінчення експерименту в крові щурів з моделлю ЦД було визначено 8,07 ± 0,33 ммоль/л глюкози, що вірогідно вище, ніж у групі контролю — 5,11 ± 0,22 ммоль/л (відмінності статистично значущі за критерієм Стьюдента на рівні p < 0,001), а в сечі відзначалися сліди глюкози. Спостереження за тваринами, у яких моделювали ЦД, показали, що до кінця досліду маса тіла тварин дещо знизилася і становила 170–180 г, у той час як інтактні тварини мали масу 200–210 г. Вовна у тварин тьмяна, має недоглянутий вигляд, очі мутнуваті. Для тварин піддослідної групи характерна спрага, в деякі дні вони споживали до 30 мл рідини на одну тварину. Апетит звичайний, поведінка млява, рухливість знижена.
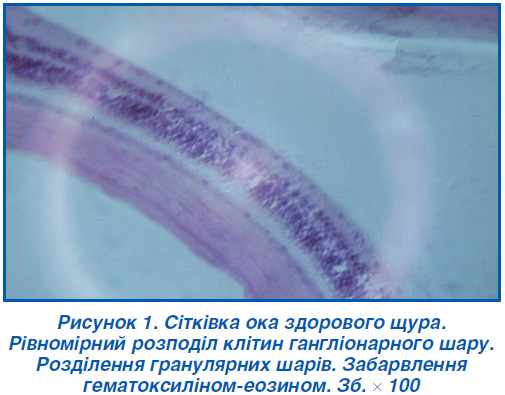
Гістологічне дослідження тканин очного яблука виявило таке. В білковій оболонці видно її волокнисту будову внаслідок набухання волокон. Ядра фібробластів овальні, візуально набряклі, помірного забарвлення. В судинах судинної оболонки відзначається фіброзне стовщення стінки, набухання й округлення ядер ендотелію, судини розширені до стану лакун, не визначаються (рис. 2).
Визначаються набряклі, безладно розташовані ендотеліоцити. У пігментному шарі численні великі гранули. Слід відзначити, що на відміну від здорових тварин вони не розташовуються компактним масивом, а розсіяні по всьому шару. Елементи шару колбочок, паличок блідо забарвлені, розташовуються дуже густо. Зовнішній зернистий
шар сітківки представлений округлими, нормально забарвленими ядрами. Розміри їх трохи збільшені, розподілені з певним розрідженням.
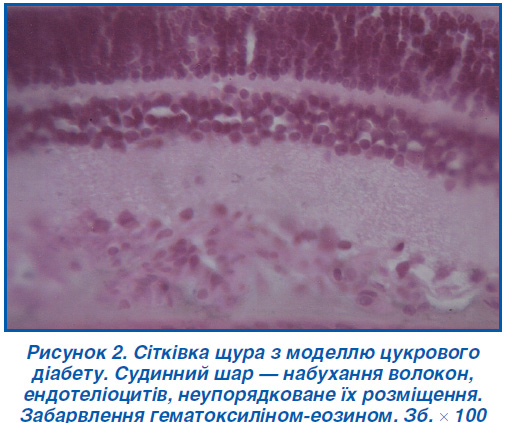
У внутрішньому зернистому шарі ядра так само збільшені, але інтенсивно на відміну від зовнішнього шару забарвлені й розподілені також досить інтенсивно. У гангліонарному шарі клітини розташовуються візуально рідше, ніж у контролі, ядра клітин різко збільшені в розмірах, набряклі, забарвлення помірне й бліде (рис. 3).
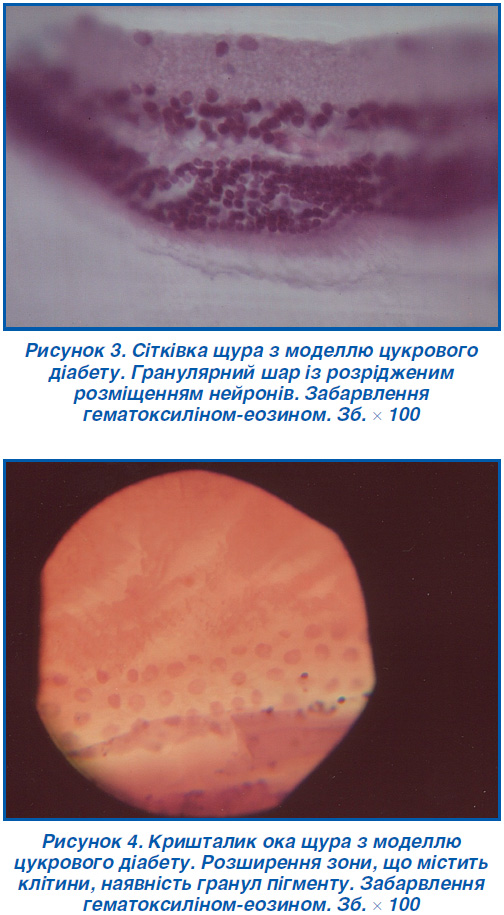
У кришталику звертала на себе увагу наявність пігментних гранул у товщі його тіла й збільшення числа ядер, розсіяних по периферії. Крім того ядра клітин, розташовані на капсулі, мали середні розміри та помірну забарвленість (рис. 4).
Обговорення
Упродовж тривалого часу ЦД, спричинений видаленням підшлункової залози, залишався єдиною моделлю цього захворювання. За її допомогою вдавалося з’ясувати деякі особливості дії інсуліну та зміни обміну речовин при його дефіциті. І лише у 1943 році було показано, що введення алоксану тваринам призводить до стану, схожого на ЦД у людей. З того часу інтерес до цієї хімічної сполуки не зменшується, особливо після встановлення наявності ендогенного алоксану в крові людини. Вміст алоксану в людей, собак і щурів становить 0,15–0,25 мг% [22]. Уведення глюкози сприяє його збільшенню, що, ймовірно, пояснює ушкодження острівцевих клітин після внутрішньовенного надходження великої кількості глюкози. Алоксан як похідне сечовини розчинний у воді або спиртах, легко зазнає автоокиснення з утворенням активних радикалів і викликає селективний некроз β-клітин панкреатичних острівців. Паралельно з самоокисненням молекули подібних ксенобіотиків здійснюється продукція реактивних форм кисню. Зазвичай алоксановий діабет викликається дворазовим підшкірним уведенням водного розчину алоксангідрату тваринам (кроликам, щурам, мишам та собакам), які попередньо голодували впродовж доби, та за клінічним перебігом відповідає ЦД 1-го типу [19]. Змінюючи дозу алоксану, можна викликати різний ступінь ушкодження клітин підшлункової залози. Найчастіше при моделюванні ЦД у щурів одноразова доза алоксану становить 55–65 мг/кг [20]. У випадку його уведення внутрішньоочеревинно ефективна доза повинна бути збільшена. Тому ЦД викликають шляхом одноразового внутрішньоочеревинного уведення дослідним щурам алоксану у дозі 100–200 мг/кг маси тіла тварини в 0,1 М цитратному буфері (рН 4,0) після 24-годинного голодування на фоні нормальних показників рівня глюкози крові. Алоксан і продукти його розпаду вступають у цикл перетворень, які закінчуються утворенням супероксидних радикалів, що, в свою чергу, призводить до утворення пероксиду водню. Вплив реактивних форм кисню з одночасним масивним зростанням рівня цитозольного кальцію викликає швидку деструкцію β-клітин підшлункової залози, оскільки саме ДНК панкреатичних острівців є однією з мішеней
їх дії. Недоліками моделювання алоксанового
діабету є токсичність речовини, а також те, що отримані результати клінічно та морфологічно відповідають ЦД 1-го типу, а для отримання ЦД 2-го типу слід застосовувати іншу експериментальну модель.
Висновки
Розрахована оптимальна доза введення алоксану, що не призводить до загибелі щурів (у проведеному експерименті летальність щурів була відсутньою), і при цьому є ефективною моделлю не лише ЦД у цілому, але й ДР.
Обрана доза алоксану дозволяє отримати менш грубі зміни, характерні для початкових стадій розвитку ЦД.
У результаті наших досліджень при моделюванні діабетичної ДР були виявлені зміни судин у вигляді фіброзу стінок, набряку ендотелію та спазму судин. Також відзначалися зменшення кількості пігментних гранул, дистрофічні зміни клітин гангліонарного шару та шару паличок і колбочок, що збігається з описами ушкодження оболонок очного яблука у хворих на ЦД.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Всесвітня організація охорони здоров’я. Діабет. Інформаційний бюлетень ВООЗ. Листопад 2016 р. [Електронний ресурс]. Режим доступу: http://www.who.int/mediacentre/factsheets/fs312/ru/
2. Mathers C.D., Loncar D. Projections of global morta–lity and burden of disease from 2002 to 2030 // PLoS Med. — 2006. — Vol. 3(11). — Р. 442. http://dx.doi.org/10.1371/journal.pmed.0030442.
3. Маслова О.В. Эпидемиология сахарного диабета и микрососудистых осложнений / О.В. Маслова, Ю.И. Сунцов // Сахарный диабет. — 2011. — № 3. — С. 6-11.
4. Паньків В.І. Цукровий діабет: визначення, класифікація, епідеміологія, фактори ризику / В.І. Паньків // Международный эндокринологический журнал. — 2013. — № 7(55). — С. 95-104.
5. Бездетко П.А., Горбачова О.В. Епідеміологія і частота цукрового діабету та діабетичної ретинопатії // Міжнародний ендокринологічний журнал. — 2006. — Т. 4, № 6. — С. 37-45.
6. Зелінська Н.Б., Хорошая О.О., Старинець Н.А. Частота діабетичної ретинопатії у хворих на цукровий діабет дітей та підлітків за даними скринінгу в регіонах України // Клінічна ендокринологія та ендокринна хірургія. — 2005. — № 4(13). — С. 27-31.
7. Semeraro F. Diabetic retinopathy: vascular and inflammatory disease / F. Semeraro, A. Cancarini, R. dell’Omo [et al.] // Journal of Diabetes Research. — 2015. — Vol. 3. — P. 1-17. http://dx.doi.org/10.1155/2015/582060.
8. Vergouwe Y. Progression to microalbuminuria in type 1 diabetes: development and validation of prediction rule / Y. Vergouwe, S. Soedamah-Muthu, J. Zgibor [et al.] // Diabetologia. — 2010. — Vol. 53. — P. 254-262. http://dx.doi.org/10.1007/s00125-009-1585-3.
9. Petrovski G. Oxidative stress, epigenetics, environment, and epidemiology of diabetic retinopathy // Journal of Diabetes Research / G. Petrovski, K. Kaarniranta, D. Petrovic — 2017. — Vol. 2. — P. 1-3. http://dx.doi.org/10.1155/2017/6419357.
10. Shaw J.E. Global estimates of the prevalence of diabetes for 2010 and 2030 / J.E. Shaw, R.A. Sicree, P.Z. Zimmet // Diabetes Res. Clin. Pract. — 2010. — Vol. 87(1). — P. 4-14. http://dx.doi.org/10.1016/j.diabres.2009.10.007.
11. Nentwich M.M. Diabetic retinopathy — ocular complications of diabetes mellitus / M.M. Nentwich, M.W. Ulbig // World J. Diabetes. — 2015. — Vol. 6(3). — P. 489-499. http://dx.doi.org/10.4239/wjd.v6.i3.489.
12. Ueda K. Retinal blood vessels are damaged in rat model of NMDA induced retinal degeneration / K. Ueda, T. Makahara, M. Hoshino [et al.] // Neuroscience Letters. — 2010. — Vol. 485, № 1. — P. 55-59. http://dx.doi.org/10.1016/j.neulet.2010.08.061.
13. Балаболкин М.И. Роль гликирования белков, окислительного стресса в патогенезе сосудистых осложнений при сахарном диабете // Сахарный диабет. — 2002. — № 4. — C. 8-16.
14. Verma S., Buchanan M.R., Anderson T.J. Endothelial Function Testing as a Biomarker of Vascular Disease // Circulation. — 2003. — Vol. 108. — P. 2054-2059. http://dx.doi.org/10.1161/01.CIR.0000089191.72957.ED.
15. Bonetti P.O., Lerman L.O., Lerman A. Endothelial Dysfunction: A Marker of Atherosclerotic Risk // Arterioscler Thromb Vascular Bio. — 2003. — Vol. 23. — P. 168-175.
16. Widlansky M.E., Gokce N., Keaney J.F. Jr, Vita J.A. The clinical implications of endothelial dysfunction // Journal of the A merican College of Cardiology. — 2003. — Vol. 42. — P. 1149-1160. http://dx.doi.org/10.1161/01.ATV.0000051384.
43104.FC.
17. The use of animal models in the study of diabetes mellitus / A. Chatzigeorgiou [et. al] // In Vivo. — 2009. — Vol. 23. — P. 245-58.
18. Пальчикова Н.А. Гормонально-биохимические особенности аллоксановой и стрептозотоциновой моделей экспериментального диабета / Н.А. Пальчикова, Н.В. Кузнецова, О.И. Кузьминова, В.Г. Селятицкая // Бюлетень СО РАМН. —
2013. — Т. 33, № 6. — С. 18-24.
19. Lenzen S. The mechanisms of alloxan- and streptozotocin-induced diabetes // Diabetologia — 2008. — Vol. 51. —
Р. 216-226. http://dx.doi.org/10.1007/s00125-007-0886-7.
20. Баранов В.Г., Соколоверова И.М., Гаспарян Э.Г. и др. Экспериментальный сахарный диабет. Роль в клинической диабетологии. — Л.: Наука, 1983. — 240 с.
21. Elsner M., Tiedge M., Guldbakke B. et al. Importance of the GLUT2 glucose transporter for pancreatic beta cell toxicity of alloxan // Diabetologia. — 2002. — Vol 45(11). — Р.1542-1549.
22. Evan A.P., Mong S.A., Connors B.A. et al. The effect of alloxan, and alloxan-induced diabetes on the kidney // Anat. Rec. — 1984. — Vol. 208(1). — Р. 33-47. http://dx.doi.org/10.1002/ar.1092080105.