Резюме
Актуальність. Деменція — захворювання, що впливає на всі аспекти життя хворих. Однак виявлення когнітивних порушень на ранніх етапах залишається складним завданням. Тому слід шукати можливий взаємозв’язок між ускладненнями цукрового діабету (ЦД) та когнітивними порушеннями. Деякі автори вважають, що дементні розлади за наявності ЦД спостерігаються не тільки через порушення передачі сигналів інсуліну в головному мозку, але й за рахунок оксидативного стресу, запалення та інших причин, тобто спільних шляхів патогенезу з розвитком периферичної діабетичної сенсомоторної нейропатії. Метою роботи було порівняти стан когнітивної функції в пацієнтів із периферичною сенсомоторною діабетичною нейропатією та без неї, вивчити її вплив на когнітивні порушення в людей із ЦД 2-го типу похилого віку. Матеріали та методи. Обстежено 115 пацієнтів із ЦД 2-го типу похилого віку. Вони були розподілені на дві групи: із сенсомоторною нейропатією та без неї. Периферичну діабетичну нейропатію визначали за даними порога вібраційної чутливості за допомогою градуйованого камертона. Результати. Виявлений позитивний взаємозв’язок між порогом вібраційної чутливості та когнітивною функцією. Чим вищий поріг вібраційної чутливості, тим кращий стан когнітивної функції в пацієнтів із ЦД 2-го типу. Висновки. Пацієнтам із периферичною діабетичною сенсомоторною нейропатією слід проводити скринінг когнітивних порушень для обліку ускладнень у клінічній практиці.
Актуальность. Деменция — это заболевание, которое влияет на все аспекты жизни пациентов. Однако выявление когнитивных нарушений на ранних этапах является сложной задачей. Поэтому необходимо искать возможную взаимосвязь между осложнениями сахарного диабета (СД) и когнитивными нарушениями. Некоторые авторы считают, что дементные нарушения у пациентов с СД наблюдаются не только из-за нарушения передачи сигналов инсулина в головном мозге, но и за счет оксидативного стресса, воспаления и других причин, то есть общих путей патогенеза с развитием периферической диабетической сенсомоторной нейропатии. Целью роботы было сравнить состояние когнитивной функции у пациентов с периферической диабетической сенсомоторной нейропатией и без нее и изучить влияние ее на когнитивные нарушения у пациентов с СД 2-го типа пожилого возраста. Материалы и методы. Обследовано 115 пациентов с СД 2-го типа пожилого возраста. Они были разделены на две группы: с диабетической сенсомоторной нейропатией и без нее. Периферическую диабетическую нейропатию определяли по данным порога вибрационной чувствительности с помощью градуированного камертона. Результаты. Выявлена положительная взаимосвязь между уровнем порога вибрационной чувствительности и состоянием когнитивной функции. Чем выше уровень порога вибрационной чувствительности, тем лучше состояние когнитивной функции у пациентов с СД 2-го типа. Выводы. Пациентам с периферической диабетической сенсомоторной нейропатией следует проводить скрининг когнитивных нарушений для учета осложнений в клинической практике.
Background. Dementia is a disease that affects all aspects of the patient’s life. But identifying cognitive impairment in the early stages is a difficult task. Therefore, it is necessary to search for a possible relationship between the complications of diabetes mellitus (DM), especially those that do not require special diagnostic methods, and cognitive impairment. Some authors believe that the dementia disorders in patients with DM are associated not only with impaired insulin signalling in the brain, but also with oxidative stress, inflammation and other causes, that is, common pathogenetic pathways with the development of peripheral diabetic sensorimotor neuropathy. The purpose of the work was to compare the state of cognitive function in patients with peripheral diabetic sensorimotor neuropathy and without it, and to study its effect on cognitive impairment in patients with type 2 DM. Materials and methods. 115 patients with type 2 DM were examined. They were divided into 2 groups: with diabetic peripheral neuropathy and without it. Evaluation of cognitive impairment was carried out in the morning using the following methods: 5 words test, Mini Mental State Examination, a battery of tests for frontal lobe dysfunction (FLD), an assessment of clock drawing test. Peripheral diabetic neuropathies were determined from the data of the threshold of vibration sensitivity with the support a graduated tuning fork. Statistical processing of the results of the study was carried out using the SPSS version 23 for Windows. Results. Patients with type 2 DM have a positive relationship between the level of the threshold of vibration sensitivity and the state of cognitive function, according to FLD, namely, the higher the level of the threshold of vibration sensitivity, the better the state of cognitive function. Conclusions. It is necessary to carry out a screening of cognitive impairment in patients with peripheral diabetic sensorimotor neuropathy to take into account complications in clinical practice.
Вступ
За останніми даними організації з вивчення хвороби Альцгеймера, кожні 3 хвилини виникає новий випадок деменції [1]. Деменція — таке ж хронічне захворювання, як і цукровий діабет (ЦД). Це захворювання впливає на всі аспекти життя хворих та супроводжується зміною пам’яті, мислення, уваги, швидкості обробки інформації, виконавчих здібностей поведінкової реакції. З огляду на тенденцію зростаючого числа літніх людей та збільшення темпів росту ЦД важливо зосередити увагу на літніх людях з їх унікальними фізичними та психологічними змінами, притаманними цьому віку. Однак виявлення когнітивних порушень на ранніх етапах залишається складним завданням. Коли виникають скарги на зниження пам’яті, уваги, вже діагностується дементний стан. Тому необхідно шукати можливий взаємозв’язок між ускладненнями ЦД, особливо тих, що не потребують спеціальних методів діагностики, та когнітивними порушеннями. До таких належить діабетична нейропатія, що характеризується прогресуючим ураженням нервових структур і призводить до різних клінічних проявів, а саме до діабетичної периферичної сенсомоторної нейропатії (ПДН) [2]. Вважається, що патогенез дементних розладів за наявності ЦД пов’язаний головним чином із порушенням передачі сигналів інсуліну в головному мозку [3, 4], але в деяких дослідженнях було висловлено припущення, що порушення відбуваються за рахунок оксидативного стресу, запалення та інших шляхів [5–8]. Таким чином, можна припустити, якщо механізми розвитку когнітивних порушень і діабетичної периферичної нейропатії спільні, то когнітивна функція буде більше порушена в пацієнтів із нейропатією.
Метою роботи було порівняти стан когнітивної функції в пацієнтів із периферичною сенсомоторною діабетичною нейропатією та без неї, вивчити її вплив на когнітивні порушення в пацієнтів із цукровим діабетом 2-го типу похилого віку.
Матеріали та методи
Обстежено 115 пацієнтів із ЦД 2-го типу, із них 78 жінок та 37 чоловіків. Пацієнти були розподілені на дві групи — із діабетичною периферичною нейропатією та без неї. Критерієм виключення з дослідження були наявність іншого типу ЦД, зловживання алкоголем, черепно-мозкова травма, інсульт в анамнезі, професійні захворювання, що могли б впливати на дослідження.
Оцінка порушення когнітивних проявів проводилась зранку за допомогою таких методів: тест
5 слів, шкала оцінки психічного статусу (MMSE), батарея тестів на лобну дисфункцію (БЛД), оцінка тесту малювання годинника.
Шкала MMSE включала визначення орієнтування в часі, місці, запам’ятовування, концентрацію уваги та рахування, згадування, мовлення та праксис. Якщо хворий набирав від 30 до 28 балів, це означало відсутність когнітивних порушень, 27–24 — переддементні когнітивні порушення, 23–20 — легкі дементні порушення, 19–11 балів — помірні порушення, 10 балів і менше — тяжка деменція [9, 10]. БЛД включала визначення концептуалізації, швидкості мовлення, динамічного праксису, просту та складну реакцію вибору та дослідження хватальних рефлексів. Якщо пацієнт набирав 18–16 балів, це відповідало нормальним когнітивним функціям, 15–12 балів — свідчило про помірну лобну дисфункцію за відсутності деменції, а 11 балів та нижче — про деменцію лобного типу [11–13].
Також хворому пропонували намалювати годинник, що показує певний час. Якщо зображений годинник оцінювався в 9 балів та нижче, це свідчило про клінічно значимі когнітивні порушення [14]. При проведенні тесту 5 слів, якщо хворий згадував менше 8 слів, це також оцінювалось як прояв когнітивних порушень [15].
Периферичну діабетичну нейропатію визначали за даними порогу вібраційної чутливості за допомогою градуйованого камертона.
Статистичну обробку результатів дослідження проводили за допомогою програми SPSS, версія 23 для Windows. Загальну лінійну модель (UNIANOVA) використовували для порівняння груп із діабетичною периферійною нейропатією та без неї. Також для порівняння даних між групами використовували t-test. Взаємозв’язок між показниками проводили за допомогою регресійного аналізу з поправкою на вік та рівень освіти. Розбіжності між показниками вважали вірогідними при рівні р < 0,05.
Результати
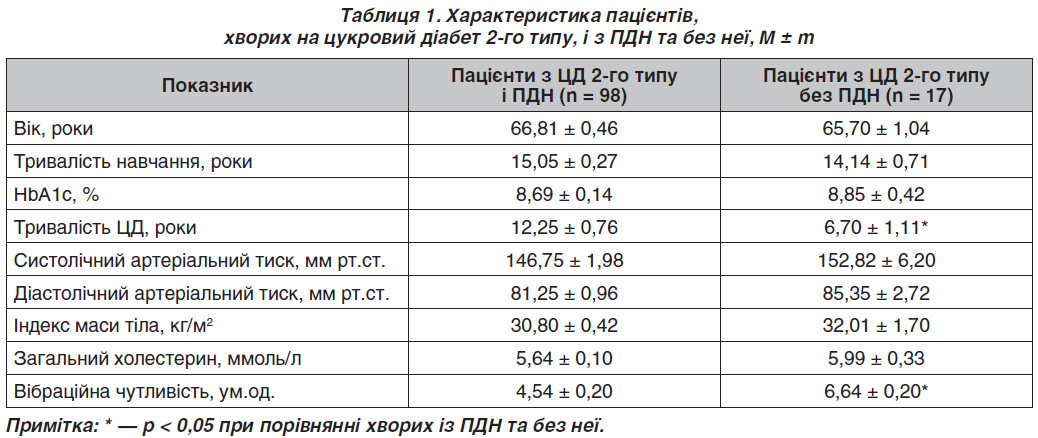
Пацієнти не мали статистично вірогідної різниці між групами за віком, тривалістю навчання, рівнем глікованого гемоглобіну (HbA1c), індексом маси тіла, рівнем артеріального тиску та рівнем загального холестерину. Але тривалість захворювання була менша в групі пацієнтів без ПДН, як і поріг вібраційної чутливості в цій групі був у межах нормальних значень. Характеристика пацієнтів подана в табл. 1. Дані наведені як середнє значення ± похибка середнього (М ± m).
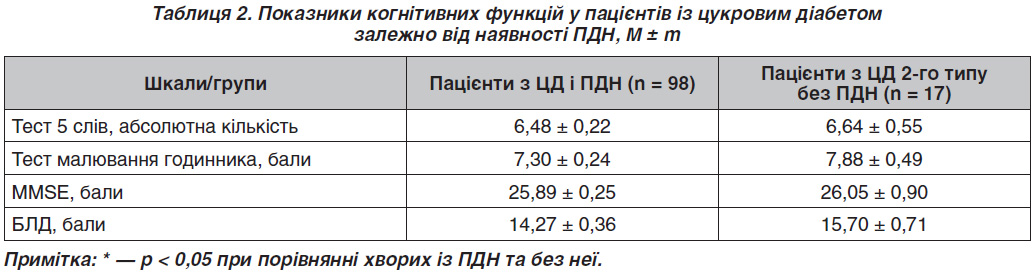
При дослідженні когнітивної функції в пацієнтів із ЦД 2-го типу як у групі з ПДН, так і без неї спостерігається зниження когнітивної функції за всіма проведеними тестами, а саме MMSE, БЛД, тестом 5 слів, тестом малювання годинника (табл. 2). Хоча відсутня вірогідна різниця між групами при виконанні цих тестів, у групі пацієнтів із ПДН показники гірші, ніж у групі без ПДН. Відсутність вірогідності результатів може бути обумовлена впливом таких факторів, як рівень освіти та вік пацієнтів. Так, при проведенні регресійного аналізу з метою виявлення взаємозв’язку між станом когнітивної функції за даними тесту БЛД, MMSE, тесту 5 слів, тесту малювання годинника, віком пацієнта та рівнем освіти був відмічений позитивний взаємозв’язок між MMSE (B (95% CI) = 0,264 (0,330/1,743); p = 0,004), БЛД (B (95% CI) = 0,242 (0,077/0,536), p = 0,009) та рівнем освіти. Щодо віку, то був виявлений негативний взаємозв’язок із тестом ММSE (B (95% CI) = –0,231 (–0,245/–0,029), p = 0,013) та БЛД (B (95% CI) = –0,191 (–0,289/–0,006), p = 0,041).
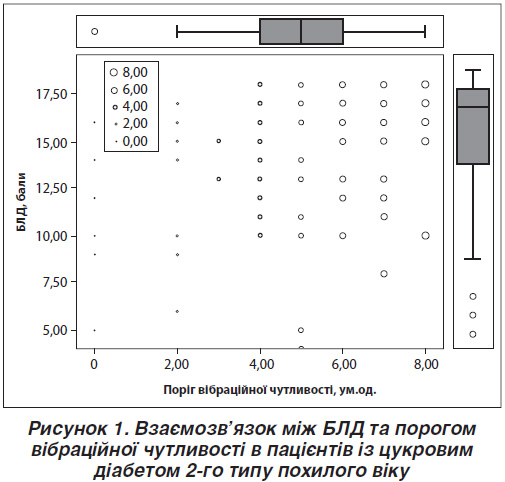
Було знайдено позитивну кореляцію за даними регресійного аналізу з поправкою на вік та рівень освіти між порогом вібраційної чутливості та БЛД (B (95% CI) = 0,319 (0,259/0,856); p < 0,0003) (рис. 1). Тобто чим вищий рівень порогу вібраційної чутливості, тим вищий рівень когнітивних функцій. Навпаки, чим нижчий рівень порога вібраційної чутливості, тим гірший стан когнітивних функцій у пацієнтів із ЦД похилого віку.
Обговорення
Взаємозв’язок між ЦД та когнітивними порушеннями на сьогодні не викликає сумнівів. Механізми ураження головного мозку за умов гіперглікемії такі ж, як і при формуванні інших ускладнень ЦД, що призводять до ураження нейронів. Так, у дослідженні ACCORD (Action to Control Cardiovascular Risk), що включало піддослідження з оцінки пам’яті ACCORD-MIND (2977 пацієнтів із ЦД 2-го типу), було продемонстровано наявність зв’язку між підвищеним рівнем HbA1c та зниженням рівня показників когнітивного тестування [16]. Деякі механізми вважаються спільними між розвитком діабетичної нейропатії та когнітивними порушеннями, включаючи оксидативний стрес, мікросудинну васкулопатію, дисліпідемію [5–8]. Але при дослідженні взаємозв’язку між периферичною діабетичною нейропатією та станом когнітивної функції деякі автори не знайшли залежності. Автори припустили, що когнітивні порушення, що виникають за наявності ЦД, можуть мати інші механізми, ніж ті, що впливають на периферичні нерви. До того ж вони припустили можливий вплив інших факторів, таких як порушення рівня ліпідів, компенсація ЦД, ожиріння [17]. При детальному вивченні робіт цих дослідників стало зрозуміло, що вони порівнювали абсолютні цифри без оцінювання результатів із поправкою на вік та рівень освіти. Інші дослідники отримали протилежні результати і підтвердили взаємозв’язок між діабетичною полінейропатією та когнітивною дисфункцією [18].
У проведеному дослідженні нами отримано позитивний взаємозв’язок між рівнем порогу вібраційної чутливості та станом когнітивних функцій за даними БЛД. Але при розрахунку даних за допомогою регресійного аналізу враховували такі показники, як вік та рівень освіти пацієнта, що, безумовно, мають вплив на виконання тестів [19].
Таким чином, можна стверджувати за отриманими результатами, що наявність ПДН може негативно впливати на стан когнітивної функції, як і навпаки.
Висновки
Виявлений позитивний взаємозв’язок між порогом вібраційної чутливості та когнітивною функцією, за даними БЛД, тобто чим вищий поріг вібраційної чутливості, тим кращий стан когнітивної сфери в пацієнтів із цукровим діабетом 2-го типу.
Пацієнтам із діабетичною периферичною сенсомоторною нейропатією слід проводити скринінг когнітивних порушень.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Міжнародна федерація з вивчення хвороби Альцгеймера (ADI) (сайт). — Режим доступу: www.worldalzreport2015.org.
2. Singh R. Diabetic peripheral neuropathy: current perspective and future directions / Singh R., Kishore., Kaur N. // Pharmacol. Res. — 2014. — Vol. 80. — P. 21-35.
3. Bloemer J. Impaired insulin signaling and mechanisms of memory loss / Bloemer J., Bhattacharya S., Amin R., Suppiramaniam V. // Prog. Mol. Biol. Transl. Sci. — 2014. — Vol. 121. — P. 413-449.
4. Moreira R. Type 2 Diabetes Mellitus and Alzheimer’s Disease: from physiopathology to treatment implications / Moreira R., Campos S., Soldera A. // Diabetes Metab. Res. Rev. — 2013. — doi:10.1002/dmrr.2442.
5. Pohanka M. Alzheimer’s Disease and Oxidative Stress: A Review / Pohanka M. // Curr. Med. Chem. — 2013. — Vol. 21(3) — P. 356-364.
6. Schrag M. Oxidative stress in blood in Alzheimer’s disease and mild cognitive impairment: a meta-analysis / Schrag M., Mueller C., Zabel M. et al. // Neurobiol. Dis. — 2013. — Vol. 59. — P. 100-110.
7. Umegaki H. Factors associated with cognitive decline in older adults with type 2 diabetes mellitus during a 6-year observation / Umegaki H., Kawamura T., Umemura T., Kawano N. // Geriatr. Gerontol. Int. — 2015. — Vol. 15(3). — P. 302-310.
8. Imamine R. Does cerebral small vessel disease predict future decline of cognitive function in elderly people with type 2 diabetes? / Imamine R., Kawamura T., Umemura T. et al. // Diabetes Res. Clin. Pract. — 2011. — Vol. 94(1). — P. 91-99.
9. Molloy D.W. A guide to the standardized Mini-Mental State Examination / Molloy D.W., Standish T.I. // Int. Psychogeriatr. — 1997. — Vol. 9. — P. 87-94.
10. Pangman V. An Examination of Psychometric Properties of the Mini-Mental State Examination and the Standardized Mini-Mental State Examination: Implications for Clinical Practice / Pangman V., Sloan J., Guse L. // Applied Nursing Research. — 2000. — Vol. 13(4). — P. 209-213.
11. Dubois B. The FAB: a frontal assessment battery at bedside / Dubois B., Slachevsky A., Litvan I., Pillon B. // Neuro–logy. — 2000. — Vol. 55. — P. 1621-1626.
12. Performance on the Frontal Assessment Battery is sensitive to frontal lobe damage in stroke patients? / Kopp B., Rösser N., Tabeling S. et al. // BMC Neurology. — 2013. — Vol. 13. — P. 179. — doi:10.1186/1471-2377-13-179.
13. Lavarone A. The Frontal Assessment Battery (FAB): normative data from an Italian sample and performances of patients with Alzheimer’s disease and frontotemporal dementia / Lavarone A., Ronga B., Pellegrino L. et al. // Functional Neuro–logy. — 2004. –Vol. 19(3). — P. 191-195.
14. Agrell B. The clock-drawing test / Agrell B., Dehljn O. // Age and Ageing. — 1998. — Vol. 27. — P. 399-403.
15. Mazzoleni R. The five-word test in memory deficiency / Mazzoleni R., Peeters J., Lakaye A. et al. // Rev. Med. Brux. — 2004. — Vol. 25(5). — P. 437-441.
16. Cukierman-Yaffe T. Relationship between baseline glycemic control and cognitive function in individuals with type 2 diabetes and other cardiovascular risk factors: the action to control cardiovascular risk in diabetes-memory in diabetes (ACCORD-MIND) trial / Cukierman-Yaffe T., Gerstein H., Williamson J. et al. // Diabetes Care. — 2009. — Vol. 32(2). — P. 221-226.
17. Moreira R. Is cognitive impairment associated with the presence and severity of peripheral neuropathy in patients with type 2 diabetes mellitus? / MoreiraR., Soldera A., Cury B. et al. // Diabetol. Metab. Syndr. — 2015. — Vol. 7. — P. 51. — http://doi.org/10.1186/s13098-015-0045-0.
18. Valkova M. Cognitive dysfunction in diabetic polyneuropathy / Valkova M., Stamenov B., Peychinska D., Danovska M. // Journal of IMAB. — 2011. — Vol. 17. — P. 183-188.
19. Lenehan M. Relationship between education and age-related cognitive decline: a review of recent research / Lenehan M., Summers M., Saunders N., Summers J., Vickers J. // Psyhogeriartrics. — 2015. — Vol. 15(2). — P. 154-162.