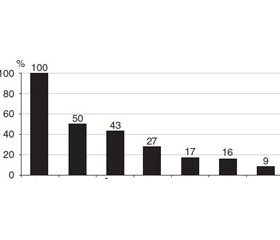
Не секрет, что в силу особенностей клинического течения вирусных гепатитов большинство больных не знают о наличии у них хронического заболевания печени. В то же время наличие подтвержденного диагноза не обязательно предполагает, что пациент будет получать лечение и оно приведет к эрадикации возбудителя. Зависит это как от пациента, так и от организации медицинской помощи данному контингенту больных. Однако первым и наиболее значимым препятствием к получению лечения все-таки является недиагностированный гепатит С, частота которого в США составляет около 50 % (рис. 1). В связи с этим совершенствование скрининга на вирусные гепатиты является едва ли не первоочередной задачей, призванной уменьшить бремя вирусных гепатитов для системы здравоохранения в развитых странах.
Традиционно под скринингом подразумевают некоторую совокупность мероприятий среди ограниченной популяции, направленных на выявление тех людей, у которых посредством последующего наблюдения (обследования) или лечения можно снизить риск возникновения заболевания или развития его осложнений.
Скрининг считается рациональным, если он удовлетворяет следующим критериям:
1. Заболевание является актуальной проблемой здравоохранения.
2. Разработаны методы лечения для распознанных случаев.
3. Средства диагностики и лечения легко применимы.
4. Возможно распознавание начальной либо латентной формы заболевания.
5. Имеются подходящие тесты для диагностики.
6. Естественное течение заболевания достаточно изучено.
7. Согласие потенциальных пациентов на лечение.
8. Стоимость нахождения случая и его лечения сбалансированы.
9. Нахождение случая заболевания не является самоцелью.
Согласно приведенным критериям скрининг на вирусные гепатиты должен быть отнесен к разряду рациональных. В пользу этого приведем следующие доводы, соответствующие критериям рационального скрининга.
Прежде всего вирусные гепатиты представляют актуальную проблему здравоохранения. В мире насчитывается порядка 300 млн больных гепатитом В и около 150 млн — гепатитом С [2, 3]. При естественном течении заболевание прогрессирует в цирроз печени (ЦП) и гепатоцеллюлярную карциному (ГЦК), которые ограничивают продолжительность жизни больных, а их лечение является существенным экономическим бременем для здравоохранения, в том числе и развитых стран.
В настоящее время эффективность терапии гепатита С приближается к 100 %, что стало возможным благодаря появлению противовирусных препаратов прямого действия. Успехи противовирусной терапии послужили толчком к формулировке концепции элиминации гепатита С в Европе и США к 2030 году [4].
В противоположность гепатиту С возможность элиминации HBV-инфекции в настоящее время более чем сомнительна, однако современная противовирусная терапия позволяет у подавляющего большинства больных гепатитом В контролировать инфекцию и эффективно препятствовать прогрессированию заболевания. Кроме того, существует эффективная вакцина против гепатита В, предупреждающая возникновение новых случаев заболевания.
Диагностика гепатита не требует проведения каких-либо сложных лабораторных или инструментальных исследований, а также не является особенно затратной. Фактическим подтверждением диагноза является обнаружение в крови больного маркеров HBV- или HCV-инфекции (табл. 1). Детализация диагноза предполагает углубленное серологическое обследование с целью выявления специфических антигенов вируса или антител к ним, а также определение вирусной нагрузки методом полимеразной цепной реакции (ПЦР). Активность и стадию заболевания в настоящее время определяют при помощи заменивших биопсию неинвазивных лабораторных (ФиброТест, ФиброМакс) или инструментальных (ФиброСкан, УЗИ-эластометрия) методов исследования.
/12-2.jpg)
Для скрининга чаще всего используют лабораторные тесты, основанные на методе иммуноферментного анализа (ИФА). Они обладают высокой чувствительностью и специфичностью, а большинство клиник располагает оборудованием для проведения этих исследований. В странах с низким уровнем экономического развития, а также в тех случаях, когда необходимо быстро установить, инфицирован больной или нет, с успехом используются ИХА-тесты, проведение которых не требует специальной подготовки и какого-либо оборудования [5].
Именно лабораторная диагностика дает возможность распознать гепатит на ранней стадии заболевания, поскольку клинические проявления болезни являются неспецифичными и в большинстве случаев гепатит протекает бессимптомно. Благодаря указанным клиническим особенностям гепатит С получил название «ласковый убийца», т.к. часто диагностировался у больных с уже развившимся ЦП или ГЦК.
Благодаря актуализации и популяризации проблематики гепатитов, население в достаточной степени информировано об этом заболевании, а современные ресурсы, прежде всего Интернет, позволяют получить необходимую информацию о диагностике и лечении гепатитов таким образом, что пациенты, даже при первом визите к врачу, оказываются подготовленными к беседе о методах диагностики и лечения, которые могут быть к ним применены. В настоящее время в мире нет ни одной страны, где бы не было проблем с доступностью противовирусной терапии всем уже диагностированным больным. Прежде всего это связано с ограниченным финансированием программ лечения больных гепатитом и высокой стоимостью противовирусных препаратов. Поэтому большинство пациентов высокомотивированы и изначально согласны на лечение.
Несколько сложнее обстоят дела со стоимостью скрининга, которая находится в обратной зависимости от его эффективности. Последняя определяется соотношением числа выявленных в процессе скрининга случаев заболевания и общего количества случаев в популяции обследованных лиц, если бы скрининг проводился поголовно. Очевидно, что чем выше распространенность гепатитов, тем менее затратным оказывается скрининг. Парадокс состоит в том, что высокая инфицированность, как правило, присуща развивающимся странам, где возможность скрининга существенно –ограничена материальными ресурсами.
Ну и наконец, даже в том случае, когда число уже выявленных больных намного превышает количество пациентов, получающих лечение, дальнейший скрининг на гепатиты не является самоцелью. Во-первых, пациент, который знает о наличии у него гепатита, может принять элементарные меры предосторожности, препятствующие, к примеру, внутрисемейному распространению инфекции. Во-вторых, вакцинация больных гепатитом против других вирусных гепатитов является важным фактором, препятствующим прогрессированию заболевания. То же можно сказать и об ограничении или полном отказе от приема алкоголя. В-третьих, некоторые из выявленных во время продолжающегося скрининга больных смогут лечиться самостоятельно.
Значит ли это, что все проблемы, связанные со скринингом, решены и к этому вопросу нет смысла возвращаться? Отнюдь нет.
Прежде всего следовало бы разграничить тестирование и скрининг на вирусный гепатит. Тестирование пациентов на маркеры гепатита представляет собой рутинный процесс лабораторного исключения/подтверждения инфекции у пациента. Скрининг же предполагает решение вопроса о необходимости тестирования.
Тестирование проводится повсеместно, скрининг, соответственно, тоже. А вот национальные программы скрининга в большинстве стран мира отсутствуют или охватывают небольшую популяцию потенциально инфицированных лиц (чаще всего это доноры крови).
Обычно критерии для тестирования определяются национальными протоколами (руководствами). Украина не является исключением, и, согласно документу «Вірусний гепатит С. Адаптована клінічна настанова, заснована на доказах» [6], обследованию на маркеры гепатита С подлежат:
— доноры крови/тканей;
— пациенты, находящиеся на гемодиализе;
— медицинские работники, планирующие работать в сфере, где необходимо проведение процедур с высоким риском инфицирования;
— пациенты с постоянно повышенным уровнем АЛТ неясной этиологии;
— потребители инъекционных наркотиков;
— ВИЧ-позитивные лица;
— реципиенты фактора свертывания крови до 1987 года;
— реципиенты крови и ее компонентов до сентября 1991 и трансплантированных органов/тканей в Соединенном Королевстве до 1992 года;
— дети, мать которых инфицирована вирусом гепатита С (ВГС);
— медицинские работники в случае попадания потенциально инфицированной крови на кожу или слизистые;
— лица, получившие медицинскую или стоматологическую помощь в странах с высокой распространенностью ВГС и низким инфекционным контролем;
— лица, у которых есть татуировки или пирсинг на теле, которые были сделаны в условиях, где инфекционный контроль является или может быть недостаточным;
— лица, имевшие полового партнера/бытовые контакты с лицом, инфицированным ВГС;
— лица, родившиеся в период с 1945 по 1965 год.
Приведенные критерии в той или иной редакции присутствуют в континентальных руководствах EASL и AASLD, а также в ряде национальных руководств [7, 8]. Большинство критериев могут быть отнесены к эпидемиологическим, и только один (повышенный уровень сывороточных трансаминаз) — к клиническим. Объясняется это довольно просто: у большинства больных вирусный гепатит протекает бессимптомно или сопровождается неспецифическими симптомами, которые не позволяют его заподозрить на основании клинических критериев.
Своеобразие эпидемиологических критериев украинского национального руководства связано с их заимствованием из британского руководства NICE «Hepatitis B and C: Ways to promote and offer testing to people at increased risk of infection» [9]. Правда, в комментарии рабочей группы сказано, что при определении групп риска в Украине не следует использовать временные рамки, установленные для Соединенного Королевства.
Рекомендации обследовать всех лиц, родившихся в период с 1945 по 1965 год, основываются на данных, полученных в США, согласно которым три четверти американцев, инфицированных вирусом гепатита С, родились именно в это время [10]. В Украине подобного рода исследования не проводились, поэтому, очевидно, использовать возраст в качестве критерия для тестирования нельзя. Было бы правильно конкретизировать и необходимость исследования реципиентов крови или донорских органов, сообразуясь со сроками введения обязательного тестирования донорской крови в Украине.
Интересно, что в странах с более близким нам уровнем оказания медицинской помощи и эпидемиологической ситуацией группы риска и, соответственно, критерии для тестирования пациента на маркеры гепатитов отличаются от предложенных нашим на–циональным руководством. В частности, в России, где эпидемиологический мониторинг предполагает отнесение пациента к одной из 20 групп риска, только 4 являются основными: это дети, рожденные инфицированными гепатитом матерями; заключенные; пациенты с хроническими заболеваниями печени и пациенты клиник для лечения заболеваний, передающихся половым путем, и наркоманов [11].
Можно привести еще несколько доводов, заставляющих с осторожностью относиться к рекомендациям общего характера по скринингу применительно к эпидемиологической ситуации, сложившейся в том или ином регионе.
Например, в странах с промежуточной частотой носительства HBsAg (все восточноевропейские, включая Украину, а также большинство средиземноморских государств и Индия) распространение инфекции происходит в основном при внутривенном введении наркотиков, татуировках и пирсинге. Хотя в прошлом там доминировали перинатальный, бытовой и половой путь инфицирования, как это имеет место в настоящее время в африканских и азиатских странах с высоким уровнем рождаемости.
Примером того, как общие рекомендации могут быть конкретизированы применительно к эпидемиологической ситуации, сложившейся в развитых странах, являются рекомендации по выделению основных факторов риска передачи гепатита В в Канаде [12]. Поскольку половой путь передачи инфекции играет там немаловажную роль в инфицировании лиц моложе 25 лет и так называемой «уличной молодежи», традиционные критерии (внутривенное введение наркотиков, другие виды наркомании) были дополнены фактом заболевания, передающегося половым путем, в прошедшем году, наличием нового сексуального партнера за прошедшие 2 месяца или двух или более сексуальных партнеров в прошедшем году, а также незащищенный секс с любой из предыдущих групп.
Аналогичное исследование, проведенное в 1997–1999 гг. в Рио-де-Жанейро, где респондентами были 1539 тестированных на ВГВ (60 % инфицированных), показало, что из 10 изученных предполагаемых факторов передачи ВГВ статистически значимым был лишь один, а именно риск инфицирования при множественных сексуальных контактах. Наркомания же, как это ни парадоксально, не имела существенного значения. Это было связано с тем, что подавляющее большинство бразильских наркоманов вводят наркотики (кокаин) интраназально, а риск инфицирования гепатитом В при этом хотя и существует, но очень низок [13].
Напротив, в Непале [14] значимыми факторами риска оказались внутривенное введение наркотиков, бытовые контакты с больными ХГВ и хирургические вмешательства в анамнезе. Особый интерес представляет последнее обстоятельство, свидетельствующее в первую очередь о низком уровне медицины в этой стране. По крайней мере, в западноевропейских и американских исследованиях медицинские манипуляции (кроме гемодиализа) к факторам риска не относят, хотя спорадические случаи и фиксируются [15]. В то же время нельзя забывать и о риске инфицирования пациентов от врачей, больных хроническим вирусным гепатитом В и проводящих инвазивные вмешательства [16–19].
Даже если на определенной территории доминирует, скажем, половой путь передачи вируса, это не значит, что среди некоторых декретированных контингентов, к примеру заключенных, он также будет преобладать. По некоторым данным, удельный вес внутривенных наркоманов в греческих тюрьмах достигает 68 %, 35 % из них стали наркоманами именно в тюрьме. Зараженность HBV-инфекцией среди них составила 57,6 % (вирусом гепатита С (HCV) — 58,2 %) [20]. Аналогичные данные были получены и при исследовании заключенных тюрем Марселя. Ввиду высокого уровня инфицированности среди этого контингента авторы последнего исследования предлагают вакцинировать всех заключенных без прескрининга, который будет экономически невыгоден при столь значительном уровне инфицированности [21].
Хотя механизм передачи ВГВ и ВГС одинаков, тем не менее удельный вес различных путей инфицирования при этих гепатитах существенно различается. Основным фактором риска, безусловно, является внутривенное введение наркотиков. Проведенное в 19 городах Великобритании исследование показало, что инфицированность наркоманов варьирует от 59 до 98 %. Вероятность обнаружения вируса зависела от длительности применения наркотиков: среди наркоманов со стажем до 5 лет — 18 %, более 5 лет — 42 %, что совпадает с данными других авторов [22].
В отличие от ВГВ, вероятность инфицирования HCV при половых контактах значительно ниже [23–26]. При моногамных отношениях она вряд ли превышает 5 %, возрастая до 20 % и более у пациентов с множественными и неустойчивыми половыми связями, особенно у страдающих другими заболеваниями, передающимися половым путем [27–29]. Определенную роль в распространении инфекции играет бытовой путь передачи, удельный вес которого также составляет не более 5 % [30–32]. Особую роль он играет в неэндемичных по гепатиту С регионах. Например, в Японии вероятность обнаружения инфицированного родственника в семейном кругу составляет от 5,7 [33] до 23,6 % [34]. А в европейских странах и Корее — от 0 до 2,3 % [35–37].
Внутрибольничная передача HCV, как и ВГВ, весьма вероятна в отделениях гемодиализа, у пациентов, получающих многочисленные инфузии препаратов крови, в первую очередь антигемофильной плазмы и криопреципитата [38–40]. Вероятность инфицирования при хирургических и стоматологических манипуляциях очень низкая, хотя и существует [41–43].
Как и при ВГВ, при вирусном гепатите С риск вертикальной трансмиссии варьирует, в зависимости от наличия факторов риска, в значительных пределах (от 2 до 40 %) [44]. Наибольший риск наблюдается у женщин с коинфекцией ВИЧ и высоким уровнем виремии [45, 46]. Установлено, что риск вертикальной передачи не повышался при последующих беременностях у HCV-положительных матерей, которые инфицировали своих детей во время предыдущих родов [47].
Итак, можно выделить несколько факторов, определяющих различия в стратегии скрининга на ВГС и ВГВ: а) меньшая в мире, но большая в Украине распространенность HCV-инфекции; б) низкая вероятность инфицирования при половых контактах и медицинских манипуляциях; в) низкий удельный вес трансмиссии вируса в родах и при грудном вскармливании; г) отсутствие вакцины, предотвращающей развитие заболевания у лиц, контактирующих с больным.
Значительное влияние на результаты скрининга оказывает его организация. С одной стороны, радио, телевидение и Интернет могут быстро донести до населения необходимость скрининга. Такая методика достаточно эффективна, когда потенциальный кандидат легко может отнести себя к той или иной группе риска, а эти группы составляют значительную часть населения. Например, в Европе значительную часть инфицированных составляют выходцы из африканских стран, с Ближнего и Среднего Востока. В Израиле это эмигранты из бывших советских республик. В связи с этим там часто можно встретить постеры на русском языке, призывающие к необходимости тестирования на вирусный гепатит.
В том случае, когда человеку не очевидно, что он относится к группе риска, или же когда такие группы малочисленны, организация скрининга через средства массовой информации малоэффективна. Более того, для успеха скрининга необходимо частое повторение информации в эфире, что довольно затратно и снижает его экономическую эффективность.
Гораздо более эффективным оказывается скрининг, проводимый медицинскими работниками. В этом случае возможна работа с относительно малыми по численности группами риска и обследование по нескольким показаниям одновременно. Кроме того, если тестирование проводится медицинскими работниками, качество скрининга намного возрастает за счет меньшего охвата, чем при организации его через средства массовой информации, при одновременном увеличении удельного веса инфицированных в обследуемой популяции (врач решает точнее, чем пациент, относится ли последний к группе риска) [48, 49].
Изменение эпидемиологической ситуации в регионе коренным образом меняет стратегию скрининга и, как следствие, его стоимость. В настоящее время в Европе и США скрининг декретированных контингентов (заключенных, наркоманов, ВИЧ-инфицированных, гомосексуалистов) близок к завершению. Концепции же поиска инфицированных среди населения без очевидных факторов риска нет. Большинство исследователей настаивают на необходимости разработки такой концепции, ибо в противном случае амбициозная цель — элиминация HCV-инфекции на континенте к 2030 году — достигнута быть не может.
Для оправдания расходов на скрининг, когда число выявляемых кандидатов для терапии весьма невелико, используют сложные экономические расчеты. В случае масштабного скрининга обычной стратегией является сравнение стоимости QALY (качественный скорректированный год жизни) в скрининговой и контрольной популяции. В одном из таких исследований [50] было показано, что скрининг экономически эффективен, если инфицированность HCV в группе превышает 1 %, даже если на терапию ответят меньше чем 20 % пациентов. В других исследованиях авторы пытаются определить либо стоимость выявления случая ХВГС, либо стоимость одного устойчивого ответа на терапию [51–54], учитывающую затраты на скрининг популяции. В цитируемых исследованиях определялась значимость: а) использования опросников с балльной системой (респондента относили к группе риска, если он набирал определенное количество очков); б) уравнений множественной линейной регрессии, где в качестве переменных фигурировали формализованные эпидемиологические критерии; в) прескрининга на АЛТ. Оказалось, что наибольшей чувствительностью обладала стратегия с регрессионным уравнением, а наименьшей — прескрининг с AЛТ. В ряде исследований [52] была сделана попытка найти наиболее подходящую комбинацию лабораторных маркеров ВГС. Исследовали различные варианты сочетания полимеразной цепной реакции, ИФА, иммуноблотинга (RIBA) с определением AЛT. Лучшей стратегией была признана комбинация «ИФА + ПЦР». «ПЦР + ПЦР» — наилучшая чувствительность и специфичность, но крайне высокая цена. ИФА — лучшая рентабельность, но недостаточная чувствительность. Необходимо отметить, что экономическая эффективность скрининга в настоящее время является едва ли не главной его характеристикой с учетом того, что в Европе и США стоимость одного выявленного случая гепатита постоянно возрастает.
Подводя итоги, следует сказать, что скрининг является инструментом, открывающим для больных гепатитом путь к противовирусной терапии и, соответственно, к излечению. Скрининг должен быть правильно организован, т.к. в противном случае он будет неэффективным или чрезвычайно затратным мероприятием. Общепринятые критерии для скрининга должны быть адаптированы к эпидемиологической ситуации в регионе с учетом преобладающих путей инфицирования. Рекрутировать пациентов для скрининга можно через средства массовой информации, но наиболее эффективным остается отбор, проводимый медицинскими работниками. Всегда следует помнить о том, что со временем эпидемиологическая ситуация меняется и соответственно этому должна пересматриваться стратегия скрининга.
Конфликт интересов. Не заявлен.
Список литературы
1. Yehia B, Schranz A, Umscheid C, Lo Re III V. The Treatment Cascade for Chronic Hepatitis C Virus Infection in the United States: A Systematic Review and Meta-Analysis. 2014; 9(7):e101554. doi: 10.1371/journal.pone.0101554
2. Ascione A, Tartaglione T, Giuseppe Di Costanzo G. Natural history of chronic hepatitis C virus infection. Dig Liver Dis. 2007 Sep;39 Suppl 1:S4-7. doi: org/10.1016/S1590-8658(07)80003-X
3. Gay N, Edmunds W, Bah E, Nelson C. Estimating the global burden of hepatitis B. Geneva: World Health Organization, Department of Vaccines and Biologicals; 2001. doi: 10.3748%2Fwjg.v21.i42.11941
4. Combating hepatitis B and C to reach elimination by 2030.
5. Marwaha N, Sachdev S. Current testing strategies for hepatitis C virus infection in blood donors and the way forward. World J Gastroenterol. 2014 Mar 21;20(11):2948-54. doi: 10.3748/wjg.v20.i11.2948
6. Viral Hepatitis C. Adopted Clinical Evidence-Based Guidelines. Aktual'naya Infektologiya. 2015;4(9):115-86. (in Ukrainian)
7. EASL Recommendations on Treatment of Hepatitis C 2015. European Association for Study of Liver. J Hepatol. 2015 Jul;63(1):199-236. doi: 10.1016/j.jhep.2015.03.025
8. Hepatitis C guidance: AASLD-IDSA recommendations for testing, managing, and treating adults infected with hepatitis C virus. AASLD/IDSA HCV Guidance Panel. Hepatology. 2015 Sep;62(3):932-54. doi: org/10.1002/hep.27950
9. Hepatitis B and C: ways to promote and offer testing to people at increased risk of infection. NICE public health guidance 43. Availa–ble from: https://www.nice.org.uk/guidance/ph43. Accessed: December, 2012.
10. Smith BD, Morgan RL, Beckett GA, Falck-Ytter Y, Holtzman D, Ward JW. Hepatitis C virus testing of persons born du–ring 1945-1965: recommendations from the Centers for Disease Control and Prevention. Ann Intern Med. 2012;157(11):263-270. doi: 10.7326/0003-4819-157-9-201211060-00529
11. Mukomolov S, Trifonova G, Levakova I, et al. Hepatitis C in the Russian Federation: challenges and future directions. Hepa–tic Medicine: Evidence and Research 2016;8:51-60. doi: 10.2147/HMER.S50172
12. Patrick D, Embree J, Sutherland D, Pilon L. Canadian STD Guidelines; 1998. 236р.
13. Lewis-Ximenez LL, Kycia MR do Ó, Ginuino С, et al. Risk factors for hepatitis B virus infection in Rio de Janeiro, Brazil. BMC Public Health. 2002;2(1):2-26 doi: 10.1186/1471-2458-2-26
14. Sagliocca L, Stroffolini T, Amoroso P, et al. Risk factors for acute hepatitis B: a case-control study. Journal of Viral Hepatitis. 1997;4(1):63-66. doi: org/10.1046/j.1365-2893.1997.00121.x
15. Schalm SW, van Wijngaarden JK. Doctor-to-patient transmission of viral hepatitis B: is it a problem, is there a solution? Journal of Viral Hepatitis. 2000;7:245-9. doi: org/10.1046/j.1365-2893.2000.00239.x
16. Centers for Disease Control. Recommendation for preventing transmission of human immunodeficiency virus and hepatitis B virus to patients during exposure-prone invasive procedures. MMWR. 1991;40(RR08):1-9.
17. Sundkvist T, Hamilton GR, Rimmer D, et al. Fatal outcome of transmission of hepatitis B from an e antigen negative surgeon. Commun Dis Public Health. 1998;1:48-50.
18. The Incident Investigation Teams. Transmission of hepatitis B to patients from four infected surgeons without hepatitis Be antigen. N Engl J Med. 1997;336:178-84. doi: 10.1056/NEJM199701163360304
19. Halle M. Surgeon had mutant form of hepatitis B. BMJ;1996:313-771. doi: 10.1136/bmj.313.7060.771a
20. Malliori M, Sypsa V, Psichogiou M, et al. A survey of bloodborne viruses and associated risk behaviours in Greek prisons. Addiction. 1998;93(2):243-251. doi: 10.1046/j.1360-0443.1998.9322438.x
21. Bourliere M, Galinierpujol A. HBV and HIV screening, and hepatitis-B immunization program in the prison of Marseilles, France // International Journal of STD & AIDS. 1997;8(12):753-759.
22. Weild AR, Gill ON, Bennett D, et al. Prevalence of HIV, hepa–titis B, and hepatitis C antibodies in prisoners in England and Wales: a national survey. Commun Dis PublicHealth. 2000;3:121-126.
23. Rice PS, Smith DB, Simmonds P, Holmes E. Heterosexual transmission of hepatitis C virus. Lancet. 1993;342(8878):1052-3. doi: 10.1016/0140-6736(93)92908-C
24. Skidmore SJ, Collingham KE, Drake SM. Sexual transmission of hepatitis C. J Med Virol. 1994; 242:247-248.
25. Sanchez-Beiza L, Bravo R, Toribio R, et al. Sexual transmission of two different hepatitis C virus types causing acute hepatitis C. Vox Sang. 1996;71:244-245.
26. Healey CJ, Smith DB, Walker JL et al. Acute hepatitis C infection after sexual exposure. Gut. 1995;36:148-50. doi.org/10.1136/gut.36.1.148
27. Caporaso N, Ascione A, Danonio M et al. Prevalence of anti-HCV among spouses and offspring of anti-HCV positive subjects: an Italian multicenter study. Ital J Gastroenterol. 1995;27:5-7.
28. Shev S, Hermodsson S, Lindholm A, et al. Risk factor exposure among hepatitis C virus RNA positive Swedish blood donors — the role of parenteral and sexual transmission. Scand J Infect Dis. 1995; 27:99-104. doi: 10.3109/00365549509018987
29. Stern M, Manny N, Klein A, et al. A study of Israeli blood donors, asymptomatic carriers of hepatitis C virus, in relation to liver disease cryoglobulinemia and transmission. Isr J Med Sci. 1995;31:277-9.
30. Ackerman Z, Ackerman E, Paltiel O. Intrafamilial transmission of hepatitis C virus: a systematic review. Journal of Viral Hepatitis. 2000;7:93-103. doi: 10.1046/j.1365-2893.2000.00203.x
31. Buscarini E, Tanzi E, Zanetti AR, et al. High prevalence of antibodies to hepatitis C virus among family members of patients with anti-HCV positive chronic liver disease. Scand J Gastroenterol. 1993;28:343-346. doi: 10.3109/00365529309090253
32. Caporaso N, Ascione A, Stroffolini T. Spread of hepatitis C virus infection within families. Journal of Viral Hepatitis. 1998;5:67-72. doi: 10.1046/j.1365-2893.1998.00085.x
33. Hayashi J, Kioshihara Y, Yamaji K et al. Transmission of hepatitis C virus by health care workers in a rural area in Japan. Am J Gastroenterol. 1995;90(5):794-9.
34. Noguchi S, Sata M, Suzuki H, et al. Routes of transmission of hepatitis C virus in an endemic rural area of Japan. Scand J Infect Dis. 1997;29:23-28.
35. Napoli N, Fiore G, Vella F, et al. Prevalence of antibodies to hepatitis C virus among family members of patients with chronic hepatitis C. Eur J Epidemiol. 1993;9:629-32.
36. Kim YS, Ahn YO, Kim DW. Familial clustering of hepatitis B and C viruses in Korea. J Korean Med Sci. 1994;9:444-449. doi: org/10.3346/jkms.1994.9.6.444
37. Demelia L, Vallebona E, Poma R, et al. Hepatitis C virus transmission in family members of subjects with HCV-related chro–nic liver disease. Eur J Epidemiol. 1996;12:45-50. doi: 10.1007/BF00144427
38. Enomoto A, Yoshino S, Hasegawa H, et al. Phylogenetic investigation for the risk of hepatitis C virus transmission to surgical and dental patients. Journal of Viral Hepatitis. 2001;8:148-153. doi: 10.1046/j.1365-2893.2001.00261.x
39. Hayashi J, Nakashima K, Kajiyama W et al. Prevalence of antibody to hepatitis C virus in hemodialysis patients. Am J Epidemiol. 1991;134:651-657.
40. Schlipkoeter U, Roggendorf M, Rasshofer R et al. Hepatitis C virus antibodies in haemodialysis patients. Lancet. 1990;335:1409. doi: 10.1016/0140-6736(90)91296-M
41. Panlilio AL, Shapiro CN, Schable CA, et al. Serosurvey of human immunodeficiency virus, hepatitis B virus, and hepatitis C virus infection among hospital-based surgeons. J Am Coll Surg. 1995;180:16-24. PMID: 8000651
42. Lodi G, Porter SR, Scully C. Hepatitis C virus infection: review and implications for the dentist. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998;86:8-22. PMID: 9690239
43. Thomas DL, Gruninger SE, Siew C, et al. Occupational risk of hepatitis C infections among general dentists and oral surgeons in North America. Am J Med. 1996;100:41-45. doi: org/10.1016/S0002-9343(96)90009-1
44. Thomas SL, Newell ML, Peckham CS, Ades AE, Hall AJ. A review of hepatitis C virus (HCV) vertical transmission: risks of transmission to infants born to mothers with and without HCV viraemia or human immunodeficiency virus infection. Int J Epidem. 1998;27:108-117. PMID: 9563703
45. Dusheiko GM, Khakoo S, Soni Р, Grellier L. А rational approach to the management of hepatitis С infection. Br. Med. J. 1996;312:357-421.
46. Tovo РА, Palomba Е, Ferraris G, et al. Increased risk of matenal-infant hepatitis С transmission for women coinfected with human immunodeficiency virus type 1. Сlin Infect Dis. 1997;25:1121-1125
47. Kuzmin V.N. Viral hepatits C in pregnancy. Lechashhij vrach. 1999;6:54-75.
48. Aspinall EJ, Doyle JS, Corson S, et al. Targeted hepatitis C antibody testing interventions: a systematic review and meta-analysis. Eur J Epidemiol. 2015;30:115-129. doi: 10.1007/s10654-014-9958-4
49. Bechini A, Levi М, Falla А et al. The role of the general practitioner in the screening and clinical management of chronic viral hepatitis in six EU countries. J Prev Med Hyg. 2016;57:E51-E60.
50. Ishizuka M. Economic evaluation of health care program for hepatitis C virus antibody screening. Nippon Koshu Eisei Zasshi. 1999;46:447-65.
51. Leal P, Stein K. Cost utility of screening for HCV in intravenous drug users and GUM clinic attenders. Report to the South West Development and Evaluation Committee. Bristol, NHS Executive (South West); 1998.
52. Rotily M, Loubiere S, Nixon J, et al. Should hepatitis C be screened? Socioeconomic analysis of different screening strategies for chronic hepatitis C in the French population. Gastroenterol Clin Biol. 1997;21:33-40.
53. Kaur S, Rybicki LB, Bacon BR, et al. Performance chara–cteristics and results of a large-scale screening programme for viral hepatitis and risk factors associated with exposure to viral hepatitis B and C: results of the National Hepatitis Screening Survey. Hepatology. 1996;24:979-986.
54. Desenclos JC, Dubois F, Mariotte N, Goudeau A. Should hepatitis C be screened? Analysis of oriented screening strategies for hepatitis C virus infection. Gastroenterol Clin Biol. 1997;21:25-32. (in French)

/12-1.jpg)
/12-2.jpg)