Актуальность
Диабетическая ретинопатия (ДР) является ведущей причиной потери зрения во всем мире [1]. Примерно из 285 миллионов человек с сахарным диабетом (СД) во всем мире у около одной трети отмечаются признаки ДР. Выявление модифицируемых факторов риска ДР, таких как гипергликемия и артериальная гипертензия, послужило основой для формирования системы контроля этих факторов для предотвращения возникновения и прогрессирования ДР. В связи с вышеизложенным является актуальным дальнейшее исследование влияния гипергликемии на развитие ДР, особенно у больных с СД 2-го типа (СД2), в сочетании с метаболическим синдромом, кластерами которого являются инсулинорезистентность, сахарный диабет, артериальная гипертензия, дислипидемия и другие [2].
Цель исследования: изучить уровень гликемии и инсулинорезистентности у больных с ДР на фоне СД2 и ожирения.
Материалы и методы
Исследования проведены у 137 пациентов (234 глаза), разделенных на две группы. Первая группа (контрольная) состояла из 20 лиц с избыточной массой тела или ожирением без СД2 (мужчины и женщины, средний возраст составил 57,46 ± 4,46 года), вторая — из 117 пациентов обоих полов с ДР, СД2 и ожирением (средний возраст — 59,61 ± 3,23 года, средний стаж диабета — 9,23 ± 2,04 года, средний уровень гликированного гемоглобина (HbA1C) — 10,78 ± 1,59 %). Критериями включения в исследование были возраст старше 18 лет, наличие у пациентов СД2, ДР и ожирения (или избыточной массы тела), а критериями исключения — наличие эндокринной и соматической патологии, приводящей к ожирению, СД 1-го типа, острые инфекционные заболевания, онкологические заболевания (в т.ч. в анамнезе), декомпенсация коморбидной патологии, психические расстройства, прием нейролептиков и антидепрессантов, наличие протеинурии, клинически значимой макулопатии, глаукомы и катаракты.
Исследования выполнены в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации 2008 года. Наличие избыточной массы тела или ожирения в группах устанавливали по индексу массы тела (ИМТ) (более 24,99 кг/м2). Вид сахароснижающей терапии определяли, исходя из назначения: 1) диеты и метформина; 2) диеты, метформина и других пероральных сахароснижающих препаратов; 3) диеты, метформина и инсулинотерапии. Уровень HbA1C в крови устанавливали с помощью метода высокоскоростной жидкостной хроматографии, содержание глюкозы — ферментативного кинетического колориметрического метода, инсулина (иммунореактивного инсулина) — иммуноферментного метода с использованием наборов фирмы DRG diagnostics (Германия). Целевым уровнем HbA1C с учетом среднего возраста пациентов и ожидаемой продолжительности жизни был выбран уровень менее 8 % (более жесткие критерии составляют 7 %, но с риском развития гипогликемических состояний), глюкозы крови натощак — менее 7 ммоль/л, постпрандиальной глюкозы — менее 9,0 ммоль/л [3, 4]. Индекс инсулинорезистентности НОМА-IR (Homeostatic Model Assessment Insulin Resistance), индекс чувствительности к инсулину QUICKI (QUantitative Insulin sensitivity ChecK Index) рассчитывали по соответствующим формулам [5, 6], индекс функции β-клеток HOMA-%B — с помощью программы HOMA-2 Calculator Центра диабета, эндокринологии и обмена веществ Оксфордского университета [7].
Офтальмологическое обследование включало визометрию, тонометрию, компьютерную периметрию Humphry, биомикроскопию, офтальмоскопию, исследование глазного дна с помощью линзы Гольдмана, оптическую когерентную томографию, исследование и фотографирование глазного дна с помощью фундус-камеры, при необходимости — флуоресцентную ангиографию. Стадию ДР определяли по классификации Американской академии офтальмологии (2003). В соответствии с этой классификацией больные с ДР были распределены в 3 подгруппы: 2а — минимальная и легкая непролиферативная ДР, 2б — умеренная и тяжелая непролиферативная ДР, 2в — пролиферативная ДР.
Статистический анализ включал в себя дисперсионный (ANOVA) анализ. Использовали параметрический критерий Фишера или непараметрический критерий Крускала — Уоллиса. Статистические характеристики представлены в виде среднего арифметического (M) и стандарт–ной ошибки (± m), а также 95% доверительного интервала (СІ). Различия считали значимыми при р < 0,05. Статистический анализ данных проводился с помощью компьютерной программы SPSS 9.0.
Результаты
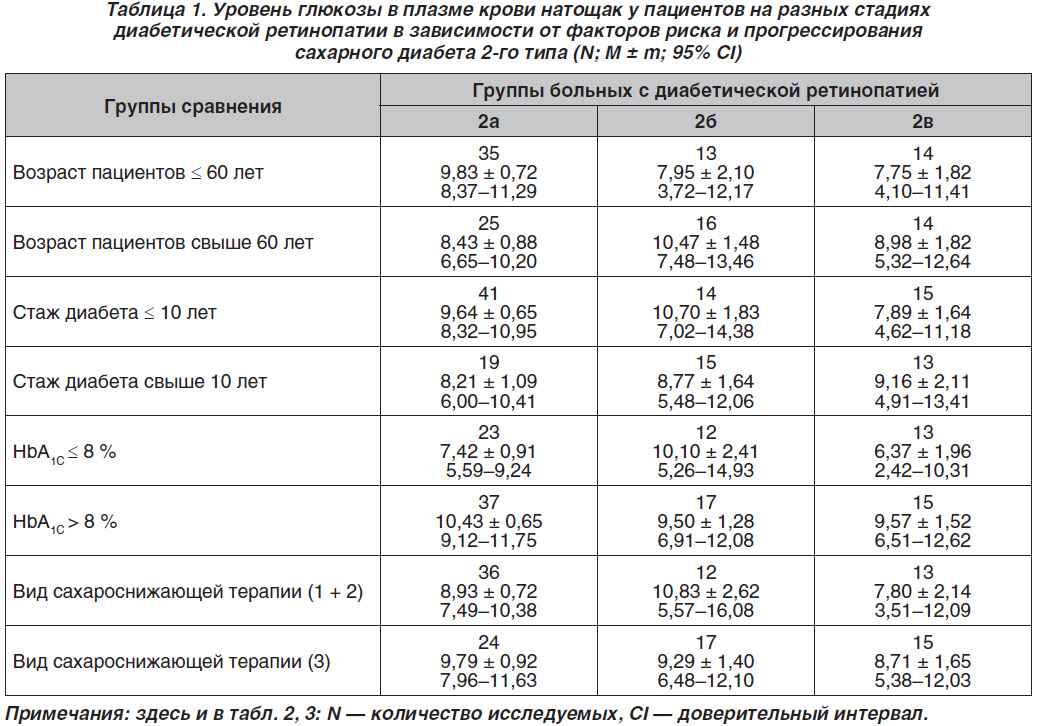
Двухфакторный дисперсионный анализ причин вариабельности уровней глюкозы натощак, обусловленной такими факторами, как возраст пациентов, длительность диабета, компенсация углеводного обмена и вид сахароснижающей терапии, показал определенные отличия, представленные в табл. 1. Установлено, что в возрасте менее 60 лет наибольшие значения гликемии натощак наблюдались у больных 2а группы, а при возрасте старше 60 лет — 2б группы. При этом в возрасте младше 60 лет самый низкий средний уровень гликемии натощак был у больных групп 2б и 2в, а в возрасте более 60 лет — у больных 2а группы. Показано, что при стаже СД2 до 10 лет наибольшие значения среднего уровня гликемии натощак отмечались у пациентов 2б группы, а при стаже диабета свыше 10 лет — у больных с пролиферативной ДР. При длительности диабета до 10 лет самый низкий средний уровень гликемии натощак был у пациентов 2а группы, при стаже диабета более 10 лет — у больных групп 2б и 2в. Обнаружено, что при уровне HbA1C ≤ 8 % наибольший средний уровень гликемии натощак наблюдался у больных 2б группы, а при HbA1C > 8 % — у больных 2а группы. У пациентов с HbA1C ≤ 8 % наименьший средний уровень гликемии натощак был у больных 2в группы, на что повлияло, по-видимому, наличие инсулинотерапии, так как согласно доверительному интервалу (СІ) у пациентов отмечались гипогликемии (до 2,42 ммоль/л). У пациентов с HbA1C > 8 % наименьший средний уровень гликемии был в группах 2б и 2в. Как показали результаты исследований, при сахароснижающей терапии, не включающей инсулинотерапию, наибольший средний уровень гликемии натощак отмечался у больных 2б группы, а при инсулинотерапии — групп 2а и 2в. Наименьший средний уровень гликемии натощак с видом указанной выше терапии был у больных с пролиферативной ДР, а при инсулинотерапии — также у больных с непролиферативной стадией ДР.
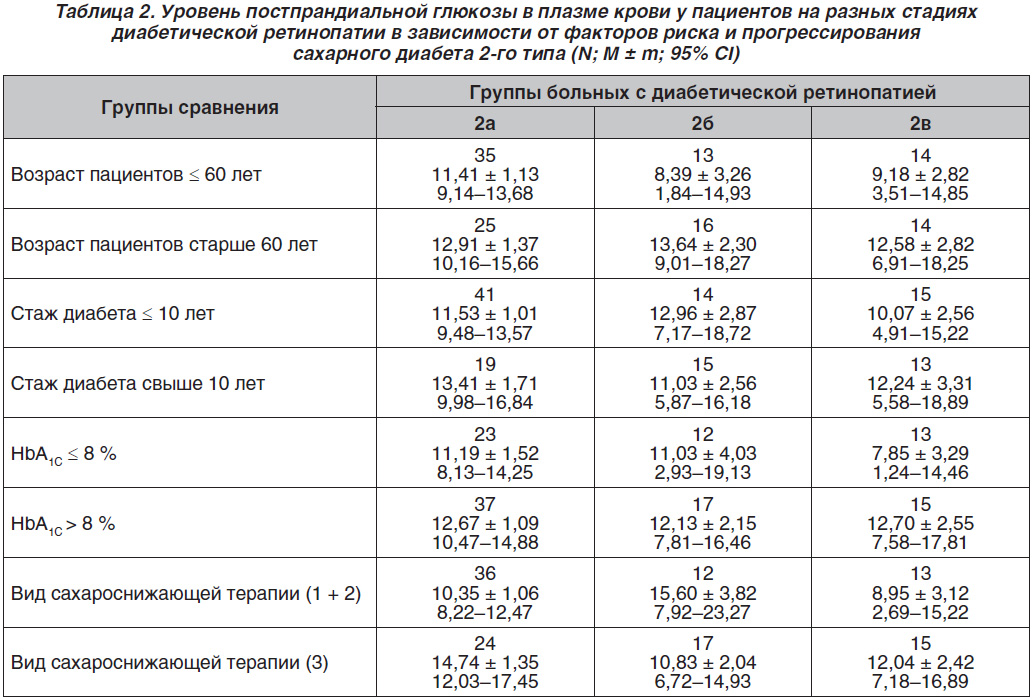
Данные вариабельности уровней постпрандиальной глюкозы в зависимости от возраста пациентов, стажа диабета, уровня компенсации углеводного обмена и вида сахароснижающей терапии отражены в табл. 2.
Выявлено, что в возрасте младше 60 лет наибольшие значения постпрандиальной гипергликемии наблюдались у больных 2а группы, а в возрасте старше 60 лет — 2б группы, подобно данным гликемии натощак. При этом в возрасте младше 60 лет самый низкий средний уровень постпрандиальной гипергликемии был обнаружен у больных 2б группы, а в возрасте старше 60 лет — групп 2а и 2в.
При стаже СД до 10 лет наибольшие значения среднего уровня постпрандиальной гипергликемии отмечались у пациентов 2б группы, а у лиц со стажем СД свыше 10 лет — 2а группы. У пациентов со стажем СД до 10 лет самый низкий средний уровень постпрандиальной гипергликемии был у больных 2в группы, а у пациентов со стажем СД более 10 лет — у пациентов 2б группы.
Показано, что при уровне HbA1C ≤ 8 % наибольший средний уровень постпрандиальной гипергликемии наблюдался у пациентов групп 2б и 2в, а при HbA1C > 8 % ее уровень был одинаковым у пациентов на двух стадиях ДР. У больных с HbA1C ≤ 8 % наименьший средний уровень постпрандиальной гипергликемии был на пролиферативной стадии ДР, на что повлияла, по-видимому, также инсулинотерапия, так как по доверительному интервалу (СІ) здесь наблюдались гипогликемии (до 1,24 ммоль/л). Как показали результаты работы, среди больных с видом сахароснижающей терапии, не включающей инсулинотерапию, наибольший средний уровень постпрандиальной гипергликемии отмечался у пациентов 2б группы, а при инсулинотерапии — у больных 2а группы. Наименьший средний уровень постпрандиальной гипергликемии был у пациентов с видом терапии 1 + 2 на пролиферативной стадии ДР, а при инсулинотерапии — у больных 2б группы.
Следующим этапом нашей работы по исследованию углеводного обмена у больных с ДР
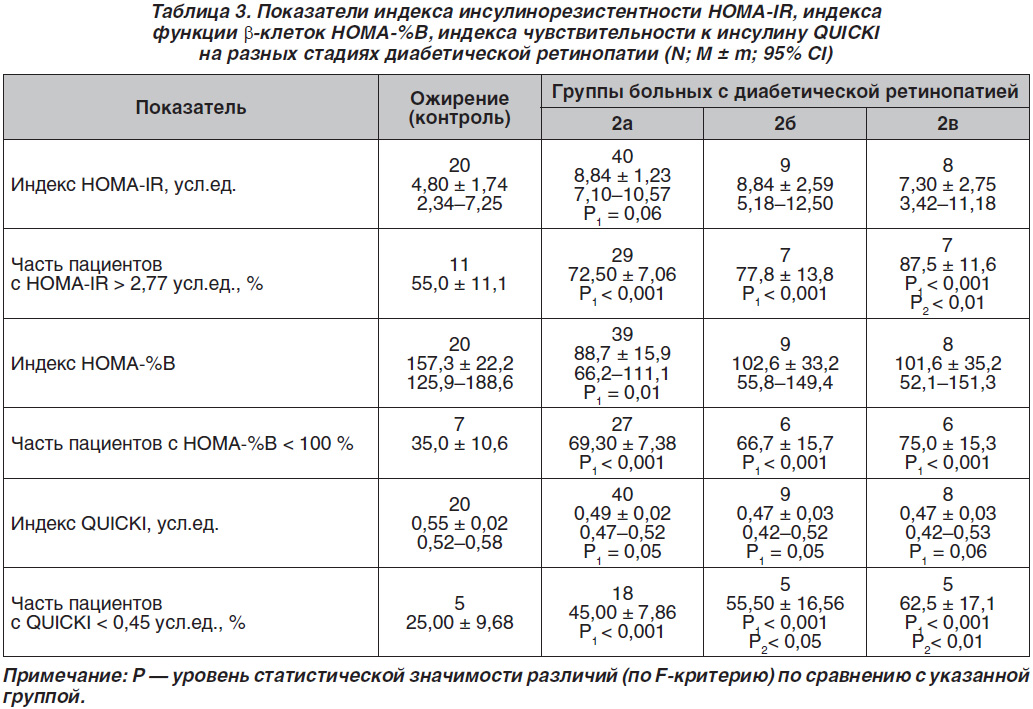
и СД2 была оценка показателей инсулино–резистент–ности (табл. 3). Показано, что индекс HOMA-IR как маркер степени инсулинорезистентности превышал верхнюю границу нормы во всех группах сравнения, практически статистически значимо (р = 0,06) увеличиваясь у больных 2а группы по сравнению с контролем. Относительная частота пациентов с индексом HOMA-IR, превышающим верхние референтные значения, была статистически значимо выше на всех стадиях ДР по сравнению с контролем (р < 0,001) и статисти–чески значимо больше на пролиферативной стадии по сравнению со 2б группой.
Индекс функции β-клеток (индекс HOMA-%B) был статистически значимо (р = 0,01) большим и максимальным у пациентов с ожирением по сравнению с больными 2а группы, а относительная частота снижения индекса HOMA-%B (ниже 100 %) была статистически значимо выше на всех стадиях ДР по сравнению с контролем (р < 0,001).
Индекс QUICKI, ассоциирующийся с ожирением и кардиоваскулярным риском, был статистически значимо меньше (хуже) у всех пациентов с ДР по сравнению с группой сравнения (р = 0,05, р = 0,05 и р = 0,06 соответственно), а относительная частота пациентов с неблагоприятным индексом QUICKI была статистически значимо больше на всех стадиях ДР по сравнению с контролем (р < 0,001), а также статистически значимо выше у больных групп 2б и 2в по сравнению с 2а группой (р < 0,05, р < 0,01).
Обсуждение
В настоящей работе отражены результаты исследования с помощью двухфакторного дисперсионного анализа показателей инсулинорезистент–ности как главного кластера метаболического синдрома на разных стадиях ДР, а также показателей углеводного обмена как одного из ведущих факторов прогрессирования ретинопатии при СД2 с учетом отягощающих составляющих течения СД2 (возраст больных, стаж диабета, его компенсация) и вида сахароснижающей терапии в лечении пациентов с СД2. По результатам работы видно, что среднестатистические уровни гипергликемии натощак и постпрандиальной глюкозы у пациентов с СД2 на различных стадиях ДР статистически значимо не отличались между собой в группах ранжирования.
Однако фактически пациенты всех групп находились в состоянии хронической гипергликемии (как натощак, так и после еды), превышающей целевые значения. Показано, что более чем в половине случаев уровень гликемии повышается у больных 2б группы и только на пролиферативной стадии ДР средние показатели гликемии начинают снижаться, что является следствием проводимого, по-видимому, более интенсивного лечения диабета, что несет определенные угрозы для больных в виде гипогликемий, которые отмечены при анализе доверительных интервалов: 1,24 ммоль/л при субкомпенсации СД2, 1,84 ммоль/л и 3,54 ммоль/л в более молодой группе больных, 2,62 ммоль/л при виде терапии, не включающей инсулинотерапию. Следовательно, оценка неблагоприятных факторов, влияющих на динамику развития ретинопатии, должна проводиться с учетом не только средних значений, но и доверительного интервала (дисперсионный анализ).
Что касается показателей индексов инсулинорезистентности, то следует учитывать, что модель определения индекса НОМА-IR считается надежным маркером наличия инсулинорезистентности как таковой. Этот показатель отражает взаимоотношения между глюконеогенезом и продукцией инсулина β-клетками поджелудочной железы и имеет доказанную взаимосвязь с другими кластерами метаболического синдрома (эндотелиальная дисфункция, гиперкоагуляция и дислипидемия даже без нарушения толерантности к углеводам) [5]. Индекс HOMA-%B воплощает структурную модель, которая имитирует физиологические процессы, влияющие на уровни глюкозы и инсулина в крови, с целью получения оценки функции β-клеток [6]. Индекс QUICKI содержит важную информацию, полученную в эксперименте у здоровых людей без ожирения, с ожирением и у больных СД2 с ожирением, о чувствительности тканей к инсулину [8].
Исходя из полученных данных, можно сказать, что возникновение непролиферативной стадии ДР характеризуется статистически значимым увеличением инсулинорезистентности (индекс HOMA-IR), снижением функции β-клеток (индекс HOMA-%B), чувствительности тканей к инсулину (индекс QUICKI). По мере прогрессирования непролиферативной ДР сохраняется декомпенсация СД2, увеличивается количество больных со сниженной чувствительностью тканей к инсулину (индекс QUICKI). На пролиферативной стадии ДР выявляется статистически значимое увеличение количества больных с инсулинорезистентностью (по индексу HOMA-IR) и сниженной чувствительностью к инсулину (по индексу QUICKI), т.е. большая часть больных с неблагоприятными индексами инсулинорезистентности находится на пролиферативной стадии ДР.
Выводы
Для всех пациентов с ДР независимо от исследуемой группы характерно состояние хронической гипергликемии и декомпенсации СД2.
Гипогликемии, влияющие на средние уровни глюкозы в крови, возникают у больных на пролиферативной стадии ДР.
На пролиферативной стадии ДР определяется наибольшее количество больных с неблагоприятными индексами инсулинорезистентности.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.