Вступ
Нова хвиля зацікавленості сечовою кислотою пов’язана з розумінням ролі безсимптомної гіпер–урикемії як незалежного й здатного до модифікації фактора ризику розвитку не тільки подагри й уратної нефропатії, але й хронічної хвороби нирок (ХХН), серцево-судинної захворюваності й смерті, що підтверджується численними епідеміологічними й проспективними дослідженнями [11, 15, 16]. На сьогодні доведена роль гіперурикемії (NHANES, Framingham Heart Study, MONICA/KORA Cohort Study) як незалежного предиктора кардіоваскулярної захворюваності й смертності у хворих на ішемічну хворобу серця, хронічну та гостру серцеву недостатність, артеріальну гіпертензію (АГ) і передгіпертензію, метаболічний синдром [13].
Підвищене вживання з їжею пуринів і/або білків, високі дози алкоголю або порушення в системі ферментів, що метаболізують ксантини, зниження швидкості клубочкової фільтрації (ШКФ), прийом тіазидних або тіазидоподібних діуретиків приводять до збільшення рівня сечової кислоти в плазмі [4–6]. Підвищення рівня сечової кислоти пов’язане з ризиком розвитку АГ у нормотензивних осіб. Крім того, у підлітків з уперше виявленою АГ поширеність підвищення рівня сечової кислоти становить 90 %. Безсимптомна гіперурикемія зустрічається у 25 % хворих на АГ, 75 % хворих із тяжкою АГ і в половини пацієнтів, які отримують тіазидні й тіазидоподібні діуретики, і, як правило, є наслідком порушеного кліренсу уратів нирками [10, 11]. Підтвердженням цього стали висновки дослідження SHEP: застосування терапевтичних доз діуретиків призводить до безсимптомного підвищення рівня сечової кислоти в асоціації зі значним збільшенням кількості кардіоваскулярних подій — на 42 % у половини хворих протягом року. Гіперурикемія також розглядається як важливий компонент метаболічного синдрому, і безсимптомна гіперурикемія відіграє значну роль у розвитку нефролітіазу у хворих із метаболічним синдромом [3, 17].
Гіперурикемія, як компонент метаболічного синдрому, у пацієнтів є предиктором кардіоваскулярної смертності, розвитку цукрового діабету (ЦД), АГ та нефролітіазу [6]. Підвищення рівня сечової кислоти також є незалежним чинником ризику розвитку субклінічного коронарного атеросклерозу, а в пацієнтів з АГ, найбільш імовірно, відображає порушення ниркової гемодинаміки, викликає мікроальбумінурію та дисфункцію ендотелію [7, 8, 10, 12].
Поширеність гіперурикемії в популяції, за даними різних авторів, коливається від 5–8 % (у Європі) до 25 % в окремих регіонах Китаю та Японії [18, 19]. Цей показник суттєво зростає серед осіб, хворих на ХХН (з 24 % серед пацієнтів з ХХН II–III стадії до 80 % серед хворих після трансплантації нирки) [9, 14, 20].
Отже, гіперурикемія — сильний, незалежний і, головне, здатний до модифікації предиктор, тому необхідна розробка методів корекції гіперурикемії із застосуванням препаратів, що не тільки мають урикостатичну дію, а й відзначаються передусім урикозуричною дією.
Терапевтичною метою гіпоурикемічної терапії є досягнення цільового рівня сечової кислоти в сироватці крові, розчинення наявних кристалів моноурату натрію й профілактика нового кристалоутворення [1, 2]. При лікуванні слід враховувати високий ризик пошкодження нирок і застосовувати препарати, що сприяють розчиненню й запобігають утворенню сечокислих і змішаних каменів та практично позбавлені токсичності. Комбінований препарат рослинного походження Уролесан® сприяє посиленому кровообігу нирок, має діуретичну дію, утворює захисний колоїд у сечі та нормалізує тонус гладенької мускулатури верхніх сечовивідних шляхів. Уролесан® збільшує виділення сечовини та хлоридів, сприяє виведенню дрібних конкрементів та піску із сечового міхура й нирок. Вищеперераховані властивості препарату Уролесан® визначили доцільність і обґрунтованість його застосування для корекції гіперурикемії при уратній нефропатії при супутніх ЦД 2-го типу і АГ з метою покращення не тільки обмінних процесів, але й функціонального стану нирок, мінімізації й усунення ризик-факторів прогресування ХХН, серцево-судинних ускладнень.
Метою даного дослідження було вивчення ефективності комплексної гіпоурикемічної терапії в пацієнтів із гіперурикемією, уратною нефропатією на тлі супутньої патології (ЦД 2-го типу, АГ). Вивчення ефективності комплексної терапії базувалось на динаміці урикемії, урикозурії, функціонального стану нирок, мінімізації й усуненні ризик-факторів прогресування ХХН.
Матеріали та методи
У дослідженні брали участь 67 пацієнтів з гіпер–урикемією, уратною нефропатією із супутньою патологією (ЦД 2-го типу, АГ), які перебували на стаціонарному та амбулаторному лікуванні в Інституті ендокринології та обміну речовин імені В.П. Комісаренка НАМН України, Національному науковому центрі «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України, ДУ «Інститут урології» НАМН України (клініках кафедр ендокринології, кардіології, нефрології та нирково-замісної терапії, урології Національної медичної академії післядипломної освіти імені П.Л. Шупика). Серед них 46 пацієнтів чоловічої статі (68,7 %) і 21 — жіночої статі (31,3 %). Вік досліджуваних пацієнтів становив від 18 до 65 років (53,6 ± 1,0 року). Критеріями виключення стали: ШКФ < 30 мл/хв, вагітність, АГ ІІІ ст.
Залежно від схеми лікування всі хворі були розподілені на такі групи: пацієнтам основної групи (n = 35) призначали перорально Уролесан® капсули виробництва ПАТ «Київмедпрепарат» (Україна) по 1 капсулі 3 рази на добу протягом 1 місяця разом з фебуксостатом (40 мг) при уратній нефропатії й гіперурикемії із супутньою патологією (ЦД 2-го типу, АГ І–ІІ ст.) зі стабільною цукрознижувальною терапією та антигіпертензивними препаратами. Група контролю (n = 32) отримувала на стаціонарному й амбулаторному етапах відповідну терапію без застосування Уролесану. Обидві групи були порівнянні за загальноклінічними показниками, такими як глюкоза крові, холестерин, білірубін, креатинін, печінкові маркери, та статистично не відрізнялись між собою.
Для оцінки терапевтичної ефективності й переносимості комплексної гіпоурикемічної терапії пацієнтам проводилось обстеження з застосуванням наступних методів: збір анамнезу, об’єктивне обстеження, загальний аналіз крові, біохімічне дослідження крові, ШКФ, визначення цистатину С, рівень екскреції альбуміну із сечею, транспорт солей (рівень сечової кислоти в сироватці крові й сечі), огляд спеціалістів за необхідності, УЗД (табл. 1).
Критерії ефективності комплексної гіпоурикемічної терапії: нормалізація процесів обміну сечової кислоти (нормалізація рівня сечової кислоти в сироватці крові й збільшення екскреції її із сечею); покращення ШКФ; зменшення рівня екскреції альбуміну.
Оцінка ефективності. Оцінка ефективності комплексної гіпоурикемічної терапії проводилась за такою шкалою:
— висока ефективність — нормалізація процесів обміну сечової кислоти (нормалізація рівня сечової кислоти в сироватці крові й збільшення екскреції її із сечею); покращення ШКФ; зменшення рівня екскреції альбуміну через 1 місяць лікування;
— помірна ефективність — покращення процесів обміну сечової кислоти (зниження рівня сечової кислоти в сироватці крові й екскреції її із сечею); стабільність ШКФ; стабільність рівня екскреції альбуміну через 1 місяць лікування;
— низька ефективність — відсутність позитивної динаміки в рівні сечової кислоти в сироватці крові й екскреції її із сечею); погіршення ШКФ; відсутність змін у рівні або наростання екскреції альбуміну через 1 місяць лікування.
Переносимість препарату оцінювалась на підставі симптомів та суб’єктивних відчуттів, про які повідомляли хворі, і об’єктивних даних, отриманих у процесі лікування. Враховувалась динаміка лабораторних показників, а також частота виникнення й характер побічних реакцій.
Дані клінічних і лабораторних досліджень статистично оброблялись методом варіаційної статистики з урахуванням параметричного критерію Стьюдента, непараметричного критерію χ2 і наводились у формі таблиць. Для оцінки вірогідності отриманих результатів прийнято рівень значимості р < 0,05.
Результати та обговорення
Аналіз динаміки рівня сечової кислоти в сироватці крові показав, що в пацієнтів із гіперурикемією, які в комплексному лікуванні отримували Уролесан®, через 1 місяць при контрольному обстеженні спостерігалося зниження рівня сечової кислоти в сироватці крові з 0,537 ± 0,006 ммоль/л до 0,325 ± 0,060 ммоль/л порівняно з групою контролю, у якій відповідний показник знизився з 0,529 ± 0,007 ммоль/л до 0,358 ± 0,050 ммоль/л (р < 0,05). Дані наведені в табл. 2.
Динаміка урикозурії при контрольному обстеженні після прийому Уролесану характеризувалась збільшенням екскреції сечової кислоти із сечею на 34,7 %, що демонструє урикозуричний ефект Уролесану порівняно з групою контролю, у якій через місяць лікування рівень екскреції сечової кислоти із сечею не змінився порівняно з вихідним вмістом (р < 0,05).
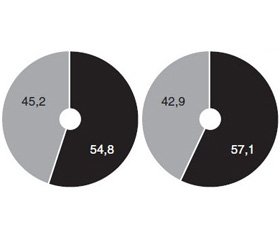
Рівень екскреції альбуміну до призначення лікування в 52,4 % пацієнтів не перевищував 300 мг/добу й у 47,6 % пацієнтів становив > 300 мг/добу. Дані наведені на рис. 1.
Через місяць комплексного лікування із застосуванням Уролесану кількість пацієнтів із протеїнурією (> 300 мг/добу) зменшилася до 42,9 %, а в групі контролю — до 45,2 % відповідно.
ШКФ до призначення лікування в середньому становила 76,20 ± 1,19 мл/хв/1,73 м2. При контрольному обстеженні через місяць у пацієнтів основної групи, які додатково отримували Уролесан®, було відмічено позитивну тенденцію щодо покращення функціонального стану нирок, що відображав рівень ШКФ — 78,3 ± 1,24 мл/хв/1,73 м2 на відміну від групи контролю, у якій ШКФ через місяць лікування становила 74,6 ± 1,35 мл/хв/1,73 м2. Дані наведені на рис. 2.
/29-1.jpg)
Результати дослідження продемонстрували пряму кореляційну залежність між рівнем сечової кислоти в сироватці крові й рівнем цистатину С — ендогенним маркером ШКФ. Дані наведені на рис. 3. Діапазон сечової кислоти в сироватці крові 0,36–0,48 ммоль/л поєднувався з рівнем цистатину С до 1,24 мг/л на відміну від гіперурикемії > 0,48 ммоль/л, що корелювала з більш високим рівнем цистатину С (до 1,8 мг/л) і більш низькою ШКФ, що дає підстави розглядати сечову кислоту як незалежний фактор прогресування ХХН у пацієнтів з гіперурикемією, уратною нефропатією із супутньою патологією (цукровий діабет 2-го типу, артеріальна гіпертензія).
При зіставленні результатів, отриманих у пацієнтів обох груп через 1 місяць, відмічено, що висока ефективність лікування зареєстрована у 86,7 % пацієнтів основної групи й 73,3 % пацієнтів групи контролю, помірна ефективність — в 13,3 % пацієнтів основної групи й 26,7 % пацієнтів групи конт–ролю відповідно (р < 0,05).
Побічні ефекти у хворих із боку нервової системи, шлунково-кишкового тракту, серцево-судинної, дихальної системи, зміни показників загального й біохімічного аналізів крові не відмічались. Оцінка переносимості препарату Уролесан® задокументована нами як добра. Пацієнти відмічали зручність застосування препарату Уролесан® капсули.
Висновки
1. Сечова кислота — незалежний фактор прогресування ХХН у пацієнтів з гіперурикемією при уратній нефропатії із супутньою патологією (ЦД 2-го типу, АГ).
2. Результати дослідження продемонстрували високу ефективність, безпеку й переносимість комплексної гіпоурикемічної терапії із застосуванням фітодіуретика Уролесан® у 86,7 % пацієнтів з гіперурикемією, уратною нефропатією на тлі супутньої патології (ЦД 2-го типу, АГ).
3. Корекція гіперурикемії в пацієнтів з уратною нефропатією із супутньою патологією (ЦД 2-го типу, АГ) з застосуванням фітодіуретика Уролесан® приводить до нормалізації обмінних процесів, покращення ШКФ і зменшення рівня екскреції альбуміну.
4. Отримані результати визначили перспективу й доцільність застосування препарату Уролесан® для корекції гіперурикемії при уратній нефропатії, супутніх ЦД 2-го типу, АГ з метою покращення не тільки обмінних процесів, але й функціонального стану нирок, мінімізації й усунення ризик-факторів прогресування хронічної хвороби нирок, серцево-судинних ускладнень.
Конфлікт інтересів. Не заявлений.
Рецензенти: проф. Ю.М. Сіренко, проф. Л.К. Соколова.
Список литературы
1. Іванов Д.Д. Нефрологія в практиці сімейного лікаря / Д.Д. Іванов, О.М. Корж. — Донецьк: Видавець Заславський О.Ю., 2014. — 464 с.
2. Сечокам’яна хвороба, дисметаболічна нефропатія, кристалурія: Методичні рекомендації / Іванов Д.Д., Возіанов С.О., Кушніренко С.В. та ін. — Київ, 2014. — 36 с.
3. Bhole V., de Vera M., Rahman M.M. et al. Epidemiology of gout in women: Fifty-two-year followup of a prospective cohort // Arthritis Rheum. — 2010. — 62(4). — 1069-1076.
4. Bobulescu I.A. Renal Transport of Uric Acid: Evolving Concepts and Uncertainties / Bobulescu I.A., Orson W.M. // Adv. Chronic. Kidney Dis. — 2012. — № 19(6). — Р. 358-371. Doi: 10.1053/j.ackd.2012.07.009.
5. Bose B. Effects of uric acid-lowering therapy on renal outcomes: a systematic review and meta-analysis / Bose B., Badve S.V., Hiremath S.S., Boudville N., Brown F.G., Cass A., Zoysa J.R., Fassett R.G., Faull R., Harris D.C., Hawley C.M., Kanellis J., Palmer S.C., Perkovic V., Pascoe E.M., Rangan G.K., Walker R.J., Walters G., Johnson D.W. // Nephrol. Dial. Transplant. — 2014. — № 29. — Р. 406-413. Doi: 10.1093/ndt/gft378.
6. Gaffo A.L., Roseman J.M., Jacobs D.R. Jr. et al. Serum urate and its relationship with alcoholic beverage intake in men and women: findings from the Coronary Artery Risk Development in Young Adults (CARDIA) cohort // Ann. Rheum. Dis. — 2010 Jun 4. [Epub ahead of print].
7. Giordano C. Uric Acid as a Marker of Kidney Disease: Review of the Current Literature / Giordano C., Karasik O., King-Morris K., Asmar A. // Hindawi Publishing Corporation Disease Markers. — Vol. 2015. — Article ID 382918, 6 pages. — http://dx.doi.org/10.1155/2015/382918
8. Jala D.I. Uric Acid as a Target of Therapy in CKD / Jala D.I., Chonchol M., Chen W., Targher G. // Am. J. Kidney Dis. — 2013. — № 61(1). — Р. 134-146. Doi:10.1053/j.ajkd.2012.07.021.
9. Johnson R.J. Uric acid and chronic kidney disease: which is chasing which? / Johnson R.J., Nakagawa T., Jalal D., Sánchez-Lozada L.G., Kang D.H., Ritz E. // Nephrol. Dial. Transplant. — 2013. — № 28. — Р. 2221-2228. Doi: 10.1093/ndt/gft029.
10. Kim I.Y. The Role of Uric Acid in Kidney Fibrosis: Experimental Evidences for the Causal Relationship / Kim I.Y., Lee D.W., Lee S.B., Kwak I.S. // Hindawi Publishing Corporation. BioMed Research International. — Vol. 2014. — Article ID 638732, 9 pages. — http://dx.doi.org/101155/2014/638732.
11. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease // Kidney international supplements. — 2013. — Vol. 3, Is. 1. — Р. 73.
12. Krishnan E. Hyperuricemia and the risk for subclinical coronary atherosclerosis — data from a prospective observational cohort study / E. Krishnan, B.J. Pandya, L. Chung, O. Dabbous // Arthritis Res. Ther. — 2011. — Vol. 13(2). — Р. 66.
13. Lottmann K. Association between gout and all-cause as well as cardiovascular mortality: a systematic review / K. Lottmann, X. Chen, P.K. Schadlich // Curr. Rheumatol. Rep. — 2012. — Vol. 14(2). — P. 195-203.
14. Nacak H. Uric acid is not associated with decline in renal function or time to renal replacement therapy initiation in a referred cohort of patients with Stage III, IV and V chronic kidney disease / Nacak H., Diepen M., Qureshi A.R., Carrero J.J., Stijnen T., Dekker F.W., Evans M. // Nephrol. Dial. Transplant. — 2015. — № 30. — Р. 2039-2045. Doi: 10/1093/ndt/gfv225.
15. Prasad O.S. Associations Between Hyperuricemia and Chronic Kidney Disease: A Review / Om Shankar Prasad Sah, Yu Xue Qing Sah // Nephro Urol. Mon. — 2015. — № 7(3). — e272-33. Doi: 10.5812/numonthly.
16. Rodenbach K.E., Schneider M.F., Furth S.L., Moxey-–Mims M.M., Mitsnefes M.M., Weaver D.J., Warady B.A., Schwartz G.J. Hyperuricemia and Progression of CKD in Children and Adolescents: The Chronic Kidney Disease in Children (CKiD) Cohort Study // Am. J. Kidney Dis. — 2015 Dec. — 66(6). — 984-92. doi: 10.1053/j.ajkd.2015.06.015. Epub 2015 Jul 21.
17. Roughley M.J., Belcher J., Mallen C.D., Roddy E. Gout and risk of chronic kidney disease and nephrolithiasis: meta-analysis of observational studies // Arthritis Res. Ther. — 2015 Apr 1. — 17. — 90. doi: 10.1186/s13075-015-0610-9.
18. Ryu E.S. Uric acid-induced phenotypic transition of renal tubular cells as a novel mechanism of chronic kidney disease / E.S. Ryu, M.J. Kim, H.S. Shin // The American Journal of Phy–siology. Renal Physiology. — 2013. — Vol. 304, № 5. — Р. 471-480. Doi: 10.1152/ajprenal.00560.2012.
19. Toyama Т. Relationship between Serum Uric Acid Levels and Chronic Kidney Disease in a Japanese Cohort with Normal or Mildly Reduced Kidney Function / Toyama T., Furuichi K., Shimizu M., Hara A., Iwata Y., Sakai N., Perkovic V., Kobayashi M., Mano T., Kaneko S., Wada T. // PLoS One. — 2015. — № 10(9). — e0137449. Doi: 10.1371/journal.pone.0137449.
20. Wang W., Bhole V.M., Krishnan E. Chronic kidney disease as a risk factor for incident gout among men and women: retrospective cohort study using data from the Framingham Heart Study // BMJ Open. — 2015 Apr 13. — 5(4). — e006843. Doi: 10.1136/bmjopen-2014-006843.

/28-1.jpg)
/29-2.jpg)
/29-1.jpg)
/30-1.jpg)