Резюме
Актуальність. Прогресування неалкогольної жирової хвороби печінки відбувається в генетично схильних індивідуумів унаслідок розвитку системної й локальної запальної відповіді в паренхімі печінки, щільно асоційованої з формуванням інсулінорезистентності. Існуючі дані демонструють, що в пацієнтів з неалкогольною жировою хворобою печінки спостерігаються високі рівні сироваткових запальних маркерів. Мета: встановити взаємозв’язки між показниками ліпідного спектра, інсулінорезистентності, антропометричними даними, показниками системного запалення та ступенем стеатозу печінки в дітей з неалкогольною жировою хворобою печінки; оцінити роль фактора некрозу пухлини альфа (TNF-α), інтерлейкіну-6 (IL-6), інтерлейкіну-10 (IL-10) у прогресуванні неалкогольної жирової хвороби печінки в дітей. Матеріали та методи. Під спостереженням перебували 34 дитини віком від 6 до 17 років. Визначення наявності й ступеня стеатозу печінки здійснено за допомогою апарату FibroScan® 502-touch із дослідженням контрольованого параметра ультразвукового згасання (САР). Розподіл за групами відбувся за показником САР: контрольну групу (S0) становив 21 пацієнт без стеатозу печінки (61,8 %), групу S1 — 4 пацієнти з 1-м ступенем стеатозу (11,8 %), групу S2 — 4 пацієнти з 2-м ступенем стеатозу (11,8 %), групу S3 — 5 пацієнтів із 3-м ступенем стеатозу (14,8 %). Усім пацієнтам виконано антропометричні виміри, загальний аналіз крові з визначенням швидкості осідання еритроцитів (ШОЕ), рівня лейкоцитів із підрахунком лейкоцитарної формули. Кількісне визначення концентрації IL-6, IL-10, TNF-α, рівня інсуліну крові в сироватці крові проводили імуноферментним методом. У сироватці крові визначали вміст загального холестерину, тригліцеридів (ТГ), холестерину ліпопротеїнів високої щільності (ЛПВЩ) з подальшим розрахунком вмісту ліпопротеїнів низької та дуже низької щільності (ЛПДНЩ), коефіцієнту атерогенності. Результати. Ожиріння та надмірна вага спостерігались у 100 % дітей груп S1, S2, S3 та 47,6 % хворих без стеатозу (р < 0,05). Виявлено, що група S3 характеризувалась підвищеними середніми рівнями лейкоцитів (7,13 ± 0,51 Г/л) та ШОЕ (15,50 ± 4,04 мм/год) порівняно з групою S0 (5,34 ± 1,17 Г/л та 10,19 ± 7,74 мм/год відповідно, р < 0,05). При дослідженні показників вуглеводного обміну встановлено, що рівень інсуліну в досліджуваних групах зі стеатозом був вірогідно підвищений відповідно до зростання ступеня стеатозу у хворих: у групі S0 — у 1,3 раза, у групі S1 — у 2,4 раза, у групі S2 — у 2,8 раза і у S3 групі — в 6,3 раза порівняно з контролем. Показник ШОЕ мав позитивну кореляцію з рівнем інсуліну (r = 0,90, p < 0,05) та індексом НОМА (r = 0,57, p < 0,05). Рівень ТГ (r = 1,0, p < 0,05) та ЛПДНЩ (r = 0,8, p = 0,04) сироватки крові позитивно корелював з рівнем інсуліну; рівень ЛПВЩ, у свою чергу, мав негативну кореляцію з даним показником (r = –0,7, p < 0,05). Максимальний рівень TNF-α спостерігався в групі S3 (1,8 ± 0,8 пг/мл), що вірогідно відрізняло її від групи S0 та інших груп зі стеатозом. Рівень IL-6 прогресивно збільшувався зі зростанням ступеня стеатозу, сягаючи максимальних значень у групі S3 (р < 0,05): так, у групі S0 середній рівень становив 1,2 ± 0,2 пг/мл, S1 — 1,55 ± 0,30 пг/мл, S2 — 4,8 ± 0,5 пг/мл, S3 — 6,1 ± 0,5 пг/мл. Рівні протизапального цитокіну IL-10 змінювались неоднозначно: мінімальним рівень цього показника був у групі S1, що вірогідно відрізняло її від групи S0. Концентрація IL-10 сягала максимальних значень у групі S2 (9,5 ± 1,1 пг/мл) й критично знижувалась у хворих групи S3. Висновки. Неалкогольна жирова хвороба печінки в дітей проявляється дисбалансом про- та протизапальних цитокінів зі зростанням IL-6, TNF-α та зменшенням IL-10 при наростанні ступеня жирової інфільтрації печінки на фоні прогресування дисліпідемії та збільшення рівня інсулінорезистентності.
Актуальность. Прогрессирование неалкогольной жировой болезни печени происходит у генетически предрасположенных индивидуумов вследствие развития системной и локальной воспалительной реакции в паренхиме печени, тесно связанной с формированием инсулинорезистентности. Существующие данные демонстрируют, что у пациентов с неалкогольной жировой болезнью печени наблюдаются высокие уровни сывороточных воспалительных маркеров. Цель: установить взаимосвязи между показателями липидного спектра, инсулинорезистентности, антропометрическими данными, показателями системного воспаления и степенью стеатоза печени у детей с неалкогольной жировой болезнью печени; оценить роль фактора некроза опухоли альфа (TNF-α), интерлейкина-6 (IL-6), интерлейкина-10 (IL-10) в прогрессировании неалкогольной жировой болезни печени у детей. Материалы и методы. Под наблюдением находилось 34 ребенка в возрасте от 6 до 17 лет. Определение наличия и степени стеатоза печени осуществлено с помощью FibroScan® 502-touch с исследованием контролируемого параметра ультразвукового затухания (САР). В соответствии с показателем САР пациенты были распределены на группы: контрольную группу (S0) составил 21 пациент без стеатоза печени (61,8 %), группу S1 — 4 пациента с 1-й степенью стеатоза (11,8 %), группу S2 — 4 пациента со 2-й степенью стеатоза (11,8 %), группу S3 — 5 пациентов с 3-й степенью стеатоза (14,8 %). Всем пациентам выполнены антропометрические измерения, общий анализ крови с определением скорости оседания эритроцитов (СОЭ), определение уровня лейкоцитов с подсчетом лейкоцитарной формулы. Количественное определение концентрации IL-6, IL-10, TNF-α, уровня инсулина крови в сыворотке крови проведено иммуноферментным методом. В сыворотке крови определяли содержание общего холестерина, содержание триглицеридов (ТГ), холестерина липопротеинов высокой плотности (ЛПВП) с расчетом уровня холестерина липопротеинов низкой и очень низкой плотности (ЛПОНП), коэффициента атерогенности. Результаты. Ожирение и избыточный вес наблюдались у 100 % детей групп S1, S2, S3, и у 47,6 % больных без стеатоза (р < 0,05). Выявлено, что группа S3 характеризовалась повышенным средним уровнем лейкоцитов (7,13 ± 0,51 г/л) и СОЭ (15,50 ± 4,04 мм/ч) по сравнению с группой S0 (5,34 ± 1,17 г/л и 10,19 ± 7,74 мм/ч соответственно, р < 0,05). При исследовании показателей углеводного обмена установлено, что уровень инсулина в исследуемых группах со стеатозом повышался в соответствии с ростом степени стеатоза: в группе S0 — в 1,3 раза, в группе S1 — 2,4 раза, в группе S2 — 2,8 раза и в группе S3 — в 6,3 раза по сравнению с контролем. Показатель СОЭ обнаружил положительную корреляцию с уровнем инсулина (r = 0,90, p < 0,05) и индексом НОМА (r = 0,57, p < 0,05). Уровень ТГ (r = 1,0, p < 0,05) и ЛПОНП (r = 0,8, p = 0,04) сыворотки крови положительно коррелировал с уровнем инсулина; уровень ЛПВП, в свою очередь, обнаружил отрицательную корреляцию с данным показателем (r = –0,7, p < 0,05). Максимальные уровни TNF-α наблюдались в группе S3 (1,8 ± 0,8 пг/мл, р < 0,05), что достоверно отличало их от S0 группы и других групп со стеатозом. Уровень IL-6 прогрессивно увеличивался с ростом степени стеатоза, достигая максимальных значений в группе S3 (р < 0,05): так, в группе S0 средний уровень составил 1,2 ± 0,2 пг/мл, S1 — 1,55 ± 0,30 пг/мл, S2 — 4,8 ± 0,5 пг/мл, S3 — 6,1 ± 0,5 пг/мл. Уровни противовоспалительного цитокина IL-10 изменялись неоднозначно: минимальным уровень этого показателя был в группе S1, достоверно отличаясь от группы S0. Концентрация IL-10 достигала максимальных значений в группе S2 (9,5 ± 1,1 пг/мл) и критически снижалась у больных группы S3. Выводы. Неалкогольная жировая болезнь печени у детей проявляется дисбалансом про- и противовоспалительных цитокинов, ростом концентрации IL-6, TNF-α и уменьшением концентрации IL-10 в сыворотке крови при нарастании степени жировой инфильтрации печени на фоне прогрессирования дислипидемии и увеличения уровня инсулинорезистентности.
Background. Progression of nonalcoholic fatty liver disease occurs in genetically predisposed children due to the development of systemic and local inflammatory response in the liver parenchyma closely related to the formation of insulin resistance. The accumulated data indicates that patients with nonalcoholic fatty liver disease are characterized by a high level of serum inflammatory markers. The aim of the present study was to establish the relationship between blood lipids, insulin resistance, anthropometric data, indicators of systemic inflammation and the degree of liver steatosis in children with nonalcoholic fatty liver disease; to assess the role of tumor necrosis factor alpha (TNF-α), interleukin-6 (IL-6), interleukin-10 in the progression of nonalcoholic fatty liver disease in children. Materials and methods. We examined 34 children aged 6–17 years. Determination of the presence and degree of hepatic steatosis was made using FibroScan® 502-touch with evaluation of the controlled attenuation parameter (CAP). Patients were divided into 3 groups according to CAP level: a control group (S0) consisted of 21 patients without hepatic steatosis (61.8 %), group S1 — 4 persons with grade 1 steatosis (11.8 %), group S2 — 4 patients with grade 2 steatosis (11.8 %), group S3 — 5 individuals with grade 3 steatosis (14.8 %). All patients underwent anthropometric measurements, blood tests with determination of erythrocyte sedimentation rate, level of leukocytes and leukocyte formula. We studied levels of the IL-6, IL-10, TNF-α, insulin in the blood serum, also serum samples were tested for total cholesterol, triglycerides (TG), high density lipoprotein (HDL) cholesterol with calculation of low-density lipoprotein (LDL), very-low-density lipoprotein (VLDL) levels, atherogenic index. Results. Obesity and overweight were observed in 100 % of children in S1. S2, S3 groups, and in 47.6 % of patients without steatosis (S0 group) (p < 0.05). We revealed that S3 group was characterized by higher average levels of white blood cells (7.13 ± 0.51 g/l) and erythrocyte sedimentation rate (15.50 ± 4.04 mm/h) compared with S0 group (5.34 ± 1.17 g/l, 10.19 ± 7.74 mm/h, respectively; p < 0.05).We found that insulin level increased with growth of steatosis grade: in group S0 — by 1.3 times, group S1 — by 2.4 times, group S2 — by 2.8 times and in S3 group — by 6.3 times compared to the controls. Also, we found a presence of significant differences between the content of HDL cholesterol in groups S3 and S0. The level of TG (r = 1.0; p < 0.05) and VLDL (r = 0.8; p = 0.04) positively correlated with the level of insulin, and showed a negative correlation with HDL level (r = –0.7; p < 0.05). Maximum levels of TNF-α were observed in group S3 (1.8 ± 0.8 pg/ml), which differed significantly from S0 group and other groups with steatosis. The level of IL-6 increased progressively with growth of steatosis grade: S0 — 1.2 ± 0.2 pg/ml, S1 — 1.55 ± 0.30 pg/ml, S2 — 4.8 ± 0.5 pg/ml, S3 — 6.1 ± 0.5 pg/ml. Level of anti-inflammatory cytokine IL-10 changed ambiguous: the minimum level of this index was in S1 group, that was significantly lower comparing to S0 group. The concentration of IL-10 reached maximum value in S2 group (9.5 ± 1.1 pg/ml) and critically decreased in patients from S3 group. Conclusions. Nonalcoholic fatty liver disease in children manifested by imbalance of pro- and anti-inflammatory cytokines with increase of IL-6, TNF-α and decrease in IL-10 level was associated with the grade of hepatic steatosis on the background of dyslipidemia and insulin resistance.
Вступ
Ожиріння є багатофакторним захворюванням, що супроводжується численними метаболічними й нейрогуморальними порушеннями з функціональними змінами органів та їх систем [1]. За даними ВООЗ, кожна третя дитина віком 6–9 років має надмірну вагу або ожиріння, причому поширеність дитячого ожиріння в Європі є вищою, ніж на будь-якому іншому континенті [2]. Існує вірогідний зв’язок між ожирінням і неалкогольною жировою хворобою печінки (НАЖХП): близько 85 % дітей зі стеатозом печінки мають ожиріння або надмірну вагу [3].
Механізм розвитку й прогресування НАЖХП є складним і полікомпонентним. Згідно з теорією багатьох паралельних ударів, прогресування стеатозу печінки відбувається в генетично схильних індивідуумів унаслідок розвитку системної й локальної запальної відповіді в паренхімі печінки, щільно асоційованої з формуванням інсулінорезистентності. Провідну роль у її виникненні відіграють адипоцитокіни та сигнали інтестинального походження [4, 5]. Інфільтрація імуноцитами жирової тканини призводить до поляризації імунної відповіді як на клітинному (переважно макрофагальному та Т-клітинному), так і гуморальному рівнях, активації прозапальних шляхів із секрецією відповідних цитокінів і розвитком низькорівневого запалення [6]. Основними ефектами прозапальних цитокінів, зокрема фактора некрозу пухлини альфа (tumor necrosis factor alpha — TNF-α), інтерлейкіну-6 (IL-6), є порушення рецепції інсуліну з розвитком інсулінорезистентності [7–9].
Дані когортних досліджень свідчать, що в пацієнтів з ожирінням спостерігаються високі рівні сироваткових запальних маркерів. На сьогодні більшість досліджень, присвячених взаємозв’язку між НАЖХП, рівнями сироваткових запальних маркерів й інсулінорезистентністю, проведені в дорослих пацієнтів [2, 5].
Мета роботи: встановити взаємозв’язки між показниками ліпідного спектра, інсулінорезистентності, антропометричними даними, показниками системного запалення та ступенем стеатозу печінки в дітей із НАЖХП; оцінити роль TNF-α, IL-6, інтерлейкіну-10 (IL-10) у прогресуванні НАЖХП у дітей.
Матеріали та методи
Під спостереженням були 34 дитини з патологією шлунково-кишкового тракту, які перебували на стаціонарному лікуванні у відділенні дитячої гастроентерології ДУ «Інститут гастроентерології НАМН України». Критерієм включення в дослідження була наявність факторів ризику розвитку НАЖХП. Критерій виключення — наявність маркерів вірусного, автоімунного гепатиту, спадкових порушень обміну міді та заліза.
Визначення наявності й ступеня стеатозу печінки здійснено за допомогою FibroScan® 502-touch з дослідженням контрольованого параметра ультразвукового згасання (САР). Розподіл за групами відбувся за показником САР [10]: контрольну групу (S0) становив 21 пацієнт без стеатозу печінки (61,8 %), групу S1 — 4 пацієнти з 1-м ступенем стеатозу (11,7 %), групу S2 — 4 пацієнти з 2-м ступенем стеатозу (11,7 %), групу S3 — 5 пацієнтів із 3-м ступенем стеатозу (14,8 %).
Середній вік пацієнтів становив 11,73 ± 2,89 року. Групи були однорідними за віковим та статевим розподілом.
Оцінку стану трофіки проводили за рекомендаціями ВООЗ згідно з центильними таблицями значень індексу маси тіла (ІМТ) відповідно до віку й статі [11]. При перевищенні показника ІМТ середніх значень у межах від 1 до 2 стандартних відхилень діагностували надлишкову вагу. При збільшенні ІМТ понад 2 стандартних відхилення діагностували ожиріння. Проводили вимірювання обводу талії, стегна й порівняння отриманих значень з даними центильних таблиць, рекомендованих Міжнародною діабетичною федерацією (IDF) [11].
Усім пацієнтам проведено загальний аналіз крові з визначенням швидкості осідання еритроцитів (ШОЕ), рівня лейкоцитів з підрахунком лейкоцитарної формули. Кількісне визначення концентрації IL-6, IL-10, TNF-α в сироватці крові проведено за допомогою імуноферментного аналізатора Stat Fax 303 Plus (США) з використанням тест-систем ЗАО «Вектор-Бест» (м. Новосибірськ).
У сироватці крові визначали вміст загального холестерину (ХС), вміст тригліцеридів (ТГ), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ). У подальшому розраховували вміст ліпопротеїнів низької (ЛПНЩ) та дуже низької щільності (ЛПДНЩ), коефіцієнт атерогенності (КА) за відповідними формулами:
ХС ЛПНЩ = ХС – ХС ЛПВЩ – ТГ/2,18 (ммоль/л); (1)
ХС ЛПДНЩ = ТГ/2,18 (ммоль/л); (2)
КА = (ХС – ХС ЛПВЩ)/ХС ЛПВЩ. (3)
Дослідження проводили з використанням наборів реактивів Cormey (Польща) за допомогою біохімічного аналізатора Stat Fax 1904 Plus, Awareness Technology (США).
Уміст інсуліну в сироватці крові визначали імуноферментним методом тест-набором фірми DRG International, Inc. (Німеччина). Індекс НОМА (homeostasis model assessment-estimated insulin resistance — індекс інсулінорезистентності) розраховували за формулою:
HOMA-IR = (глюкоза натще (ммоль/л) × інсулін натще (мкОд/мл))/22,5. (4)
Статистичний аналіз одержаних даних проведений за допомогою пакета прикладних програм Statistica 6,0. Для статистичного аналізу даних використовували дескриптивну статистику; порівняння середніх значень змінних здійснювали за допомогою параметричних методів (t-критерію Стьюдента) за умов нормального розподілу даних ознак. В інших випадках використовували непараметричний метод (U-критерій Манна — Уїтні). Різниця вважалася вірогідною, якщо досягнутий рівень значущості (р) був нижчим за 0,05. Кореляційний аналіз виконували із розрахунком коефіцієнтів кореляції Спірмена та Пірсона.
Результати
Антропометричні дані
При аналізі антропометричних даних виявлено вірогідні відмінності між середніми значеннями ваги в дітей досліджуваних груп, максимальні показники ваги були зафіксовані в групі S2 (табл. 1). За середніми показниками зросту групи вірогідно не відрізнялись між собою, дещо вищими показники зросту були в групі S2.
Показник ІМТ був вірогідно вищим у групах дітей із стеатозом (S1–3) (табл. 1). Ожиріння та надмірна вага спостерігались у 100 % дітей груп S1, S2, S23, та у 47,6 % хворих без стеатозу (р < 0,05).
При порівнянні показників обводу талії були виявлені значущі відмінності між групами дітей зі стеатозом і групою дітей без стеатозу, збільшення обводу талії було асоційоване зі зростанням ступеня стеатозу печінки.
Показники вуглеводного обміну
Рівень інсуліну у хворих зі стеатозом печінки був вірогідно підвищений відповідно до зростання ступеня стеатозу: у групі S0 — у 1,3 раза, у групі S1 — в 2,4 раза, у групі S2 — у 2,8 раза й у групі S3 — у 6,3 раза порівняно з контролем (табл. 2).
Індекс HOMA перевищував нормативні значення у хворих зі стеатозом печінки й набував максимального значення в групі S3 (табл. 2).
Показники ліпідного обміну
При дослідженні ліпідного спектра сироватки крові встановлено, що за показниками ліпідограми діти групи S1 майже не відрізнялись від дітей без стеатозу (S0). Спостерігалась тенденція до підвищення вмісту ТГ в 1,5 раза і ХС ЛПДНЩ — у 1,6 раза порівняно з групою S0 (табл. 3).
У дітей групи S2 також спостерігалось підвищення вмісту ТГ в 1,55 раза та вірогідне зниження ХС ЛПВЩ у 1,5 раза (р < 0,05), уміст ХС ЛПДНЩ зростав в 1,7 раза порівняно з групою S0 (табл. 3). Такі зміни призводили до зростання КА в 1,4 раза.
На пізніх стадіях стеатозу (S3) концентрація ТГ у крові у 2 рази перевищувала аналогічний показник групи S0 (р < 0,05). Встановлено наявність вірогідної відмінності між вмістом ХС ЛПВЩ у групах S3 та S0: у групі S3 цей показник зменшувався в 1,3 раза. КА в цій групі зростав в 1,5 раза порівняно з групою S0 (р < 0,05).
Показники системного запалення
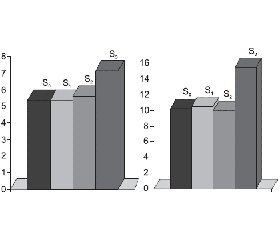
Група S3 характеризувалась підвищеними середніми рівнями лейкоцитів (95% довірчий інтервал (ДІ) 6,31–7,94), сегментоядерних нейтрофілів (95% ДІ 41,83–7,94) та ШОЕ (95% ДІ 9,07–21,93) порівняно з групою S0 (рис. 1).
При дослідженні цитокінового профілю встановлено підвищення концентрації TNF-α у хворих зі стеатозом порівняно з групою S0, але кореляції із ступенем стеатозу виявлено не було. Максимальними рівні TNF-α були в групі S3 (1,8 ± 0,8 пг/мл), що вірогідно відрізняло її від групи S0 та інших груп зі стеатозом. Рівень IL-6 прогресивно збільшувався зі зростанням ступеня стеатозу, сягаючи максимальних значень у групі S3 (р < 0,05): так, у групі S0 середній рівень становив 1,2 ± 0,2 пг/мл, S1 — 1,55 ± 0,30 пг/мл, S2 — 4,8 ± 0,5 пг/мл, S3 — 6,1 ± 0,5 пг/мл (рис. 2).
Рівні протизапального цитокіну IL-10 змінювались неоднозначно: мінімальним рівень цього показника був у групі S1, що вірогідно відрізняло її від групи S0. Концентрація IL-10 сягала максимальних значень у групі S2 (9,5 ± 1,1 пг/мл) й критично знижувалась у хворих групи S3.
Взаємозв’язок між показниками системного запалення, антропометричними даними й параметрами ліпідного та вуглеводного обміну
Встановлено, що перевищення показником обводу талії значень 90-го перцентиля мало позитивний кореляційний зв’язок середньої сили з рівнем IL-6 та TNF-α (р < 0,05) (табл. 4). При цьому наявність абдомінального ожиріння характеризувалась тенденцією до зростання рівня ТГ (r = 0,4, p = 0,08) та ЛПНЩ (r = 0,4, p = 0,07).
Рівень інсуліну виявив сильну позитивну кореляцію з рівнями ТГ, ЛПДНЩ та негативну кореляцію середньої сили з рівнем ЛПВЩ (табл. 5).
При аналізі залежності показників системного запалення та параметрів вуглеводного обміну встановлено, що показник ШcОЕ мав сильний позитивний кореляційний зв’язок з рівнем інсуліну та помірний — з індексом НОМА (табл. 5).
Встановлено позитивний кореляційний зв’язок між рівнями ТГ і ЛПДНЩ сироватки крові та рівнем інсуліну, а також сильний негативний кореляційний зв’язок рівня ЛПВЩ з рівнем інсуліну (p < 0,05) (табл. 5).
Обговорення
У багатьох дослідженнях продемонстровано, що НАЖХП асоціюється з ожирінням, інсулінорезистентністю й дисліпідемією [6, 13]. У нашій роботі ми спостерігали підвищення рівня інсуліну в сироватці хворих із НАЖХП, при цьому рівень інсуліну корелював зі ступенем стеатозу печінки. При порівняльному груповому аналізі за індексом НОМА-IR встановлено, що у 25 пацієнтів із стеатозом печінки (100 %) мали місце ознаки інсулінорезистентності, тобто НОМА-IR перевищував 2,78 (що відповідає 75-му процентилю для нормальних суб’єктів).
Інсулін зазвичай регулює енергетичний баланс через поглинання глюкози в периферичних тканинах і шляхом пригнічення вивільнення ліпідів із жирової тканини [14]. Інсулін активує ліпопротеїнліпазу, що сприяє катаболізму багатих тригліцеридами ліпопротеїнів, таких як хіломікрони і ЛПДНЩ, а також регулює кліренс ЛПНЩ. Результати нашого дослідження продемонстрували поступове зростання фракції тригліцеридів і зниження ХС ЛПВЩ в умовах розвитку стеатозу, що є ознаками атерогенної дисліпідемії, характерної для метаболічного синдрому. Також виявлено залежність вираженості цих змін від ступеня жирової інфільтрації (максимальні зміни зареєстровані в групі з найвищим ступенем стеатозу).
Вісцеральний тип ожиріння та пов’язана з ним інсулінорезистентність асоційовані з хронічним низькорівневим запаленням, а також секрецією прозапальних медіаторів різними типами клітин, включаючи клітини імунної системи й адипоцити. У нашому дослідженні виявлена присутність помірного позитивного кореляційного зв’язку ІМТ та обводу талії з прозапальними маркерами (IL-6 та TNF-α). Встановлено, що рівень інсуліну сильно позитивно корелював з рівнями ШОЕ, ТГ, ЛПДНЩ та помірно негативно корелював з рівнем ЛПВЩ, що свідчить про тісний зв’язок між наявністю інсулінорезистентності, дисліпідемією та системним запаленням.
TNF-α, як відомо, активує внутрішньоклітинні сигнальні шляхи, у тому числі Jun N-термінальну кіназу та інгібітор ядерного фактора каппа В, що робить клітини стійкими до дії інсуліну [13]. Наявні дані свідчать про те, що клітинні механізми резистентності до інсуліну також активують продукцію TNF-α [15]. TNF-α активізує проатерогенні шляхи частково за рахунок зниження рівня ХС ЛПВЩ, підвищеної експресії холестериногенних генів, що супроводжується збільшенням потенційно небезпечних метаболітів, а також зниження виведення холестерину [16]. TNF-α також стимулює синтез жирних кислот у печінці, підвищує рівень тригліцеридів у сироватці крові й стимулює продукцію ЛПДНЩ [17], може індукувати як клітинну загибель гепатоцитів, так і проліферацію гепатоцитів, обумовлюючи розвиток фіброзу печінки. У нашому дослідженні продемонстровано наявність кореляційного зв’язку прозапальних маркерів (TNF-α) з ожирінням (ІМТ) взагалі та абдомінальним типом ожиріння зокрема.
IL-6, як і TNF-α, є багатофункціональним цитокіном, здатним стимулювати печінковий ліпогенез, змінювати чутливість до інсуліну, впливаючи на різні етапи сигнального інсулінового каскаду [18, 19]. Вважається, що IL-6, який виробляється білою жировою тканиною, сприяє інсулінорезистентності пацієнтів, які страждають від ожиріння, при цьому експресія IL-6 у печінці корелює з тяжкістю НАЖХП [17]. За даними Yamaguchi (2015), блокування IL-6 в експериментальних тварин призводить до зменшення запалення при стеатогепатиті та зменшення ступеня стеатозу печінки [18]. За даними нашого дослідження, рівень IL-6 зростав у міру збільшення ступеня стеатозу печінки та позитивно корелював з величиною обводу талії та наявністю ожиріння взагалі та абдомінального ожиріння зокрема. Рівень IL-6 також позитивно корелював з рівнем TNF-α, що свідчить про їх спільну участь у запальному каскаді в дітей із НАЖХП [19].
IL-10 відіграє захисну роль у механізмах ушкодження печінки. Інгібування IL-10 сприяє експресії цитокінів, що беруть участь у запальних процесах [20, 21]. У нашому дослідженні виявлено неоднозначні зміни концентрації даного інтерлейкіну: підвищення в групі S2 можна пояснити напруженням імунної відповіді при прогресуванні стеатозу, а критичне зниження в групі S3 може свідчити про виснаження протизапальної відповіді. Проте з огляду на обмежену кількість досліджуваних пацієнтів існує необхідність у подальшому вивченні цього питання.
Слід зауважити, що підвищений рівень ШОЕ за відсутності гострих захворювань є маркером системного запалення, пов’язаним із кардіоваскулярним ризиком [22, 23]. У нашому дослідженні виявлено кореляцію рівня інсуліну й індексу НОМА з показником ШОЕ, що підтверджує вагомий внесок інсулінорезистентності в розвиток системного запального процесу.
Отже, дані дійсного дослідження підтвердили наявність міцного зв’язку надмірної ваги та ожиріння з маркерами системного запалення, інсулінорезистентності та атерогенної дисліпідемії в дітей. Прогресування структурних змін печінки й зростання ступеня стеатозу супроводжується активацією прозапальної відповіді, виснаженням протизапальних механізмів, прогресуванням дисліпідемії, що, у свою чергу, обтяжує перебіг НАЖХП.
Висновки
1. В основі розвитку НАЖХП у дітей лежить абдомінальне ожиріння, асоційоване із системною запальною відповіддю, інсулінорезистентністю, змінами ліпідного спектра сироватки крові у вигляді гіпертригліцеридемії та зниження концентрації ХС ЛПВЩ.
2. Зростання ступеня жирової інфільтрації печінки в дітей супроводжується активацією прозапальної відповіді (зростанням ШОЕ, рівня сегментоядерних нейтрофілів, концентрації IL-6, TNF-α), виснаженням протизапальних факторів (IL-10) на фоні прогресуючого наростання дисліпідемії та інсулінорезистентності.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Management of metabolic syndrome in children and adolescents / L. Pacifico, C. Anania, F. Martino [et al.] // Nutr. Metab. Cardiovasc. Dis. — 2011. — № 21. — P. 455-466. doi: 10.1016/j.numecd.2011.01.011.
2. WHO. The WHO nutrition policy [Online]. 2015. — http://www.euro.who.int/en/health-topics/disease-prevention/nutrition/policy.
3. Serum infammatory markers in overweight children and adolescents with non-alcoholic fatty liver disease / G. Neuman, R. Sagi, S. Shalitin, S. Reif // IMAJ. — 2010. — Vol. 12. — Р. 410-415.
4. Неалкогольна жирова хвороба печінки у дітей: сучасний погляд на можливості діагностики та лікування (частина I) / Степанов Ю.М., Абатуров О.Є., Завгородня Н.Ю., Скирда І.Ю. [та ін.] // Гастроентерологія. — 2015. — № 2. — С. 99-107.
5. Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis / Tilg H., Moschen A.R. // Hepatology. — 2010. — Vol. 52, № 5. — Р. 1836-1846. doi: 10.1002/hep.24001.
6. Paquissі F.C. Immune Imbalances in Non-Alcoholic Fatty Liver Disease: From General Biomarkers and Neutrophils to Interleukin-17 Axis Activation and New Therapeutic Targets / F.C. Paquissі // Frontiers in Immunology. — 2016. — Vol. 7 (Article 490). — Р. 1-13. doi:10.3389/fimmu.2016.00490.
7. Неалкогольна жирова хвороба печінки у дітей: сучасний погляд на можливості діагностики та лікування (частина II) / Степанов Ю.М., Абатуров О.Є., Завгородня Н.Ю. [та ін.] // Гастроентерологія. — 2015. — № 3. — С. 122-131.
8. Rolo A.P. Role of oxidative stress in the pathogenesis of nonalcoholic steatohepatitis / A.P. Rolo, J.S. Teodoro, C.M. Palmeira // Free Radic. Biol. Med. — 2012. — Vol. 52. — P. 59-9. doi:10.1016/j.freeradbiomed.2011.10.003 89. doi: 10.1016/j.freeradbiomed.2011.10.003.
9. Fibrogenesis and carcinogenesis in nonalcoholic steatohepatitis (NASH): involvement of matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinase (TIMPs) / I. Okazaki, T. Noro, N. Tsutsui [et al.] // Cancers (Basel). — 2014. — Vol. 6. — P. 1220-1255. doi:10.3390/ cancers6031220.
10. Controlled attenuation parameter for noninvasive assessment of hepatic steatosis using Fibroscan®: validation in chronic hepatitis B / Y.Q. Mi, Q.Y. Shi, L. Xu [et al.] // Digestive diseases and sciences. — 2015. — Vol. 60, № 1. — P. 243-251. doi: 10.1007/s10620-014-3341-x.
11. WHO. The WHO child growth standards website [Online]. 2006. — http://www.who.int/childgrowth/en/
12. Waist circumference percentiles in nationally representative samples of African-American, European-American, and Mexican-American children and adolescents / J.R. Fernández, D.T. Redden, A. Pietrobelli, D.B Allison // J. Pediatr. — 2004. — Vol. 145, № 4. — Р. 439-44. doi:10.1016/j.jpeds.2004.06.044.
13. Subir Kumar Das, Balakrishnan V. Role of Cytokines in the Pathogenesis of Non-Alcoholic Fatty Liver Disease / Subir Kumar Das, V. Balakrishnan // Ind. J. Clin. Biochem. — 2011. — Vol. 26, № 2. — P. 202-209. doi 10.1007/s12291-011-0121-7.
14. Bugianesi E. Insulin resistance: a metabolic pathway to chro-nic liver disease / E. Bugianesi, A.J. McCullough, G. Marchesini // Hepato–logy. — 2005. — Vol. 42, № 5. — P. 987-1000. doi:10.1002/hep.20920.
15. Das S.K. Evaluation of blood oxidative stress related parameters in alcoholic liver disease and non-alcoholic fatty liver disease / S.K. Das, V. Balakrishnan, S. Mukherjee, D.M. Vasudevan // Scand. J. Clin. Lab. Invest. — 2008. — Vol. 68, № 4. — P. 323-334. doi: 10.1080/00365510701673383.
16. Diehl A.M. Cytokines and the pathogenesis of non-alcoholic steatohepatitis / A.M. Diehl, Z.P. Li, H.Z. Lin, S.Q. Yang // Gut. — 2005. — Vol. 54, № 2. — P. 303-306. doi:10.1136/gut.2003.024935.
17. Asrih M., Jornayvaz F.R. Inflammation as a potential link between nonalcoholic fatty liver disease and insulin resistance / M. Asrih, F.R. Jornayvaz // J. Endocrinol. — 2013. — Vol. 218, № 3. — P. 5-36. doi: 10.1530/JOE-13-0201.
18. Blockade of interleukin 6 signalling ameliorates systemic insulin resistance through upregulation of glucose uptake in skeletal muscle and improves hepatic steatosis in high-fat diet fed mice / K. Yamaguchi, T. Nishimura, H. Ishiba [et al.] // Liver International. — 2015. — Vol. 35, № 2. — P. 550-561. doi: 10.1111/liv.12645.
19. Akinobu T. Multiple Hits, Including Oxidative Stress, as Pathogenesis and Treatment Target in Non-Alcoholic Steatohepatitis (NASH) / Akinobu T., Kawai D., Yamamoto К. // International Journal of Molecular Sciences. — 2013. — № 14. — P. 20704-20728. doi:10.3390/ijms141020704.
20. Harmonizing the metabolic syndrome: Task Force on Epidemiology and prevention — statement of the International Diabetes Federation; –National Heart, Lung, and Blood Institute; American Heart Association; Heart Federation; International Atherosclerosis Society; and International Association for Study of Obesity / K.G. Alberti, R.H. Eckel, S.M. Grundy [et al.] // Circulation. — 2009. — Vol. 120. — P. 1640-1645. doi: 10.1161/CIRCULATIONAHA.109.192644
21. Joseph L., Gokce N. Adipose macrophage infiltration is associated with insulin resistance and vascular endothelial dysfunction in obese subjects / L. Joseph, N. Gokce // Arterioscler. Thromb. Vasc. — 2008. — Vol. 28. — P. 1654-1659. doi: 10.1161/ATVBAHA.108.170316.
22. Red blood cell adhesiveness/aggregation, C-reactive protein, fbrinogen, and erythrocyte sedimentation rate in healthy adults and in those with atherosclerotic risk factors / G. Fusman, T. Mardi, D. Justo [et al.] // Am. J. Cardiol. — 2002. — Vol. 90. — Р. 561-563. doi: http://dx.doi.org/10.1016/S0002-9149(02)02539-0.
23. P-selectin, endocan, and some adhesion molecules in obese children and adolescents with non-alcoholic fatty liver disease / A. Ustyol, E. Aycan Ustyol, F. Gurdol // Scand. J. Clin. Lab. Invest. — 2017. — Vol. 77, № 3. — P. 205-209. doi: 10.1080/00365513.2017.1292363.

/36-1.gif)
/37-1.gif)
/38-1.gif)