Ожирение (Ож) и связанная с ним патология — одна из основных проблем здравоохранения в США и европейских странах. На практике наличие и степень Ож определяются по величине индекса массы тела (ИМТ), уровень которого от 30,0 кг/м2 и выше расценивается как Ож [1]. В то же время ИМТ не дает информации о содержании жировой массы в процентах или килограммах, а также тощей массы, которая в основном представлена скелетной мускулатурой (СМ) [2].
Нужно отметить, что исследованиями, в которых изучается мышечная система, до настоящего времени занимаются преимущественно представители спортивной медицины. Благодаря им на сегодняшний день существует целый ряд установленных закономерностей, которые необходимо знать и представителям других медицинских специальностей, в том числе эндокринологам.
Толчком к активному исследованию мышечной системы в определенной мере послужили данные последнего десятилетия относительно более неблагоприятного отдаленного прогноза у лиц, в том числе больных сахарным диабетом (СД) 2-го типа, с нормальной массой тела (нормМТ), чем при избыточной массе тела (избМТ) и Ож I степени.
Опубликованы материалы динамического наблюдения над контингентом в 2,88 млн человек. Оказалось, что отдаленная выживаемость среди тех, кто имел нормМТ, меньшая, чем при избМТ и Ож I степени [3]. До этого, с 1999 г., появлялись отдельные публикации с аналогичными результатами, в том числе касающиеся и больных СД 2-го типа [4, 5]. Однако в достаточной мере они не впечатлили научное сообщество, а игнорировать такой обширный материал стало невозможным.
Появился ряд гипотез относительно причин и механизмов негативного прогноза у лиц с нормМТ. Среди них наиболее обсуждаемыми стали следующие:
— у лиц с нормМТ отмечается снижение массы мышечной ткани [6];
— при нормМТ нарушен баланс между жировой и мышечной тканью [7];
— при нормМТ может развиться абдоминальное ожирение, которое не всегда можно выявить, пользуясь действующими нормативами величины окружности талии [8, 9].
Активизировались научные исследования относительно физиологии и патофизиологии мышечной ткани, проводимые с учетом современных достижений фундаментальной иммунологии и совершенствования диагностических технологий. Следует отметить, что именно такие подходы используются при исследовании жировой и костной тканей. Появился новый медицинский термин «саркопения» (сарко — тело, пения — снижение) (СП).
Об актуальности проблемы свидетельствует создание Европейской рабочей группы по саркопении у лиц старшего возраста (EWGSOP) с целью разработки Европейского консенсуса по определению, что такое СП, по методам ее диагностики, которые могут использоваться в научной деятельности и практической работе. Рабочая группа включала представителей Европейского медицинского гериатрического общества, Европейского общества по метаболизму и питанию, Международной ассоциации геронтологов и гериатров и Международной ассоциации «Питание и старение». Ими был утвержден окончательный документ в виде консенсуса [10, 11].
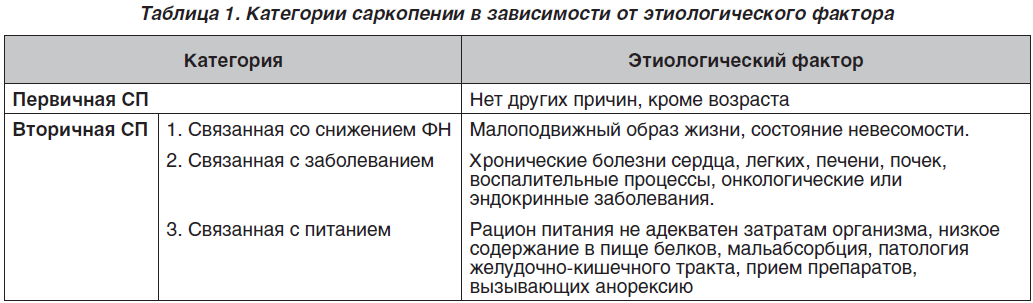
В консенсусе дано определение СП как синдрома, который характеризуется связанной с возрастом прогрессирующей и генерализованной потерей массы СМ и ее силы, что ведет к снижению физической способности мышечного аппарата, качества жизни и возможному смертельному исходу [12–14]. Представлена классификация СП, в которой выделяют первичную (возрастзависимую) и вторичные ее формы, когда, кроме возраста, отмечают другие факторы, способствующие появлению СП (табл. 1).
Среди этиологических факторов возможной СП в консенсусе указаны инсулинорезистентность (ИР) и СД 2-го типа. В литературе в настоящее время представлены результаты исследований, цель которых — объяснить механизмы, связывающие недостаточность объема и функции СМ и состояние углеводного обмена.
Итак, следует констатировать, что возникла необходимость всестороннего исследования мышечной системы. Прежде всего следует ответить на вопрос: а что же на сегодняшний день уже известно о ней?
В определенной мере в противовес жировой ткани (ЖТ) природой предусмотрены аналогичные свойства мышечной ткани:
— СМ недавно была идентифицирована как эндокринный орган, который продуцирует цитокины и другие пептиды, классифицируемые как миокины, именно они оказывают паракринный, аутокринный или эндокринный эффекты [15, 16];
— в результате исследований выявлена связь между мышечным сокращением и гуморальными изменениями. Последние названы фактором упражнений [17–19];
— на сегодняшний день экспериментальными и клиническими исследованиями подтверждено, что миокины, в частности, способствуют увеличению продукции адипоцитами адипонектина, благотворно влияющего непосредственно на сердце и сосуды [20];
— установлено, что именно миоциты IIb типа синтезируют гликопротеин-фоллистатиноподобный фактор 1 с мощным ангио- и кардиопротективным действием [21].
Основной функцией СМ является ее способность к сокращению. При этом происходит трансформация химической энергии в механическую работу. С другой стороны, СМ является основной тканью, в которой происходит усвоение инсулинстимулированной глюкозы крови. Эта глюкоза инкорпорируется в виде гликогена [22]. Таким образом, существует логическая связь между содержанием гликогена и инсулиновой чувствительностью, что подтверждено в эксперименте [23].
Гликоген является молекулярной формой углеводов, необходимой для создания их запасов в организме человека (и других млекопитающих). У человека примерно 80 % гликогена сохраняется в СМ, которая, в свою очередь, составляет 40–50 % массы тела [23]. В печени концентрация гликогена выше, но так как масса печени составляет примерно 1,5 кг, то общее количество гликогена в ней примерно 100 г [24]. Небольшие запасы гликогена содержат мозг и сердце [25].
Основная функция гликогена — поддержание физиологической концентрации глюкозы в крови, но только печеночный гликоген непосредственно включен в процесс высвобождения глюкозы в кровь. СМ не может высвобождать глюкозу, так как в ней отсутствует глюкозо-6-фосфатаза [26]. Поэтому мышечный гликоген является в основном локальным энергетическим субстратом для физических упражнений, а не источником для поддержания уровня глюкозы в крови при голодании. В то же время мышечный гликоген способен распадаться до лактата, который может быть транспортирован в печень и способствовать поддержанию эугликемии. Тем не менее у людей не выявлено значительного снижения гликогена в СМ во время голодания [27, 28]. В отличие от этого в печени гликоген при голодании быстро уменьшается. В сердце и мозге гликоген может генерировать анаэробную энергию во время кратковременного дефицита кислорода, способствуя выживанию [29].
Что происходит при физических нагрузках?
При кратковременной интенсивной нагрузке (например, бег на 100 и 200 м), когда ресинтез аденозинтрифосфата обеспечивается анаэробными реакциями, используется внутримышечный углевод — гликоген. Под действием фермента фосфоролазы гликоген СМ расщепляется до молочной кислоты, то есть происходит гликолиз. Содержание молочной кислоты в крови резко повышается, часть ее выделяется с мочой и потом [30].
В печени тоже усиливается расщепление гликогена. Но этот процесс (гликогенолиз) происходит с образованием не молочной кислоты, а глюкозы, которая поступает в кровь. В крови повышается уровень глюкозы, которая доходит до скелетных мышц только через 8–9 с даже при максимальной скорости кровотока, то есть к концу острой фазы физической нагрузки (ФН) [31].
При более длительных ФН по мере их продолжения расход гликогена мышц ослабляется, и мышцы начинают использовать резервные углеводы печени. При работе предельной длительности возможно расходование гликогена сердечной мышцы и головного мозга. Глюкоза, поступающая в СМ из крови при участии аденозинтрифосфата, фосфорилируется, а образовавшиеся гексозофосфорные эфиры окисляются анаэробно или аэробно — в зависимости от снабжения органов кислородом [32].
В период отдыха после нагрузки происходит ресинтез гликогена: сначала — в головном мозге и сердце, затем — в СМ и в последнюю очередь — в печени [33].
Установлено, что снижение уровня гликогена в СМ повышает чувствительность к инсулину. В свою очередь, повышенная инсулиночувствительность является важным фактором для восполнения гликогена [34].
Инсулин регулирует многие биологические функции в СМ, но одним из наиболее важных процессов, регулируемых инсулином, является стимуляция усвоения мышцами глюкозы [35]. Инсулин стимулирует СМ к усвоению глюкозы посредством повышения процесса транслокации глюкозного транспортера GLUT4 из внутриклеточного хранилища к плазменной мембране и поперечным канальцам [36]. В СМ инсулин связывается с инсулиновыми рецепторами и рецепторами аутофосфориляции. Это индуцирует фосфориляцию и взаимодействие между протеинами, что опосредует передачу сигналов инсулина [37].
Существует ряд доказательств ключевой роли фосфорилирования и активации протеинкиназы В (РКВ) в регуляции усвоения инулинстимулированной глюкозы [38]. Именно изоформа РКВ контролирует глюкозный гомеостаз в организме [39]. Инсулин также активирует гликогенсинтазу (GS) и стимулирует ее дефосфориляцию [34].
GS также активируется с помощью глюкозо-6-фосфата [40]. При этом активность GS с высоким содержанием глюкозо-6-фосфата не зависит от фосфориляции.
В эксперименте установлено, что аллостерическая активация GS необходима для регуляции синтеза гликогена в СМ [41].
Общей характеристикой лиц с СД 2-го типа является невозможность поддерживать сахар крови в норме. При ИР в СМ снижается инсулинстимулированный синтез гликогена и особенно — неоксидативный глюкозный гомеостаз [42].
Влияние физической нагрузки на чувствительность к инсулину
Физическая нагрузка повышает чувствительность к инсулину. Установлено, что это связано с адаптационными процессами в СМ, такими как повышение экспрессии ключевых протеинов: GLUT4, гексокиназы II и GS, вовлеченных в метаболизм инсулинстимулированной глюкозы [43]. Однако сигнальные механизмы, которые ведут к повышению чувствительности к инсулину после ФН, не установлены. Ряд исследователей определили ассоциацию между повышением инсулинчувствительности и увеличением фосфориляции и экспрессии РКВ [43, 44].
В покое утилизация гликогена в СМ низкая или отсутствует. При ФН около 79 % основных источников глюкозы составляет мышечный гликоген [45].
Уровень гликогена вносит вклад в регуляцию усвоения глюкозы при мышечном сокращении. При этом при нормальном уровне гликогена потребление глюкозы коррелирует с распадом гликогена при разной степени стимуляции мышц. Стимулированное снижение поступления глюкозы отрицательно коррелирует с уровнем гликогена до мышечного сокращения [46]. Способность инсулина стимулировать усвоение глюкозы значительно повышается в мышцах с низким уровнем гликогена. Высокий уровень гликогена снижает синтез инсулинстимулированного гликогена и повышает гликолитический эффект [47]. Такие изменения глюкозного гомеостаза могут со временем вызывать ИР [34]. Ряд исследований документировали такое взаимоотношение между уровнем гликогена и метаболической регуляцией. Показано, что содержание протеина GLUT4 на клеточной поверхности отрицательно коррелирует с уровнем гликогена при инсулиновой стимуляции [48]. Это подтверждает, что транслокация GLUT4 регулируется уровнем мышечного гликогена [49].
Инсулинстимулированная фосфориляция и активность РКВ повышаются в мышцах с низким содержанием гликогена [47]. Это свидетельствует, что активация РКВ может вносить вклад в усвоение мышцами с низким гликогеном инсулинстимулированной глюкозы [23].
Уровень гликогена отражает баланс между доступной глюкозой и чувствительностью к инсулину в СМ. Исследования на крысах показали, что ФН увеличивает экспрессию GLUT4, но чувствительность к инсулину в СМ не повышается, так как уровень гликогена также увеличивается [38]. Острая адаптация к ФН включает повышение уровня гликогена при стабильной чувствительности к инсулину. В то же время продолжительная ФН повышает чувствительность к инсулину и коррелирует с окислительной способностью в СМ [23]. Экспрессия GLUT4 в СМ тоже регулирует чувствительность к инсулину и коррелирует с уровнем ресинтеза гликогена [49]. Это подтверждает важность гликогена с эволюционной точки зрения. Источником энергии для быстрого ресинтеза гликогена являются глюкоза крови и быстрое ее извлечение из крови. При СД 2-го типа нарушено усвоение глюкозы из крови, так как нарушен и инсулинстимулированный синтез гликогена [42]. ФН будет стимулировать распад гликогена в СМ, экстракцию глюкозы крови и повышение чувствительности к инсулину. Поэтому именно повышение чувствительности к инсулину после ФН может сыграть ключевую роль в профилактике ИР и СД 2-го типа.
При СД 2-го типа происходит нарушение сигналинга инсулина и инсулинстимулированного транспорта глюкозы в мышцы [50]. Но такая ИР развивается постепенно.
Механизм развития ИР в СМ не до конца установлен, но считается, что в этот процесс вносит свой вклад аккумуляция липидов и промежуточных продуктов липидного обмена [51]. Кроме того, избыток энергоемких субстратов повышает продукцию реактивных окислительных специй (ROS) [52, 53]. Продукция ROS растет, когда большое количество глюкозы и жира одновременно поступает в митохондрии, и влияет на включение электронов в электронные транзиторные цепи [53]. Предотвращение продукции ROS в СМ является профилактикой развития в ней ИР [52], а высокий уровень гликогена будет способствовать метаболическому стрессу в СМ.
ИР в мышцах характеризуется рядом изменений (экспрессия сигнальных протеинов и активация сигнальных путей), и механизмы ее инициации могут варьировать [23].
В СМ с низким уровнем гликогена глюкоза будет накапливаться в виде мышечного гликогена. При этом СМ способна извлекать глюкозу из крови, когда поставляется с пищей большое количество углеводов [23].
Здоровые лица обладают возможностью накапливать глюкозу в виде липидов, конвертируя в день 475 г глюкозы в 150 г липидов [54].
De novo синтез липидов происходит без развития гипергликемии, но уровень триглицеридов повышается в 10 раз [54]. Сама по себе аккумуляция жира не вызывает ИР [55], но липидные аcyl-CoA, церамиды или диацилглицерол нарушают сигналинг инсулина и вызывают ИР [51, 56].
Высказано предположение, что аккумуляция липидных промежуточных продуктов, в свою очередь, повышает уровень гликогена, а острая ФН снижает синтез липидов при глюкозной нагрузке. Более того, отмечаются сообщения о том, что лица с ИР накапливают большую часть потребленной глюкозы в виде липидов в СМ и печени по сравнению с инсулинчувствительными людьми, в то время как синтез гликогена в СМ ниже у лиц с ИР [50].
Снижение способности накапливать глюкозу в виде гликогена способствует развитию липогенеза, который нарушает инсулинчувствительность в связи с аккумуляцией жира. Повышение синтеза гликогена после ФН обеспечивает выживание в эволюционной перспективе. Эффект ФН может оказаться профилактикой СД 2-го типа в современном обществе.
Основными физиологическими стимуляторами глюкозного транспорта в СМ являются инсулин и ФН. Оба этих фактора усиливают усвоение глюкозы в СМ путем транслокации основного глюкозного транспортера, экспрессируемого в СМ, — GLUT4 из внутриклеточной локации к плазменной мембране и t-канальцам [38].
Мышечное сокращение является многофакторным процессом, включающим изменение клеточного энергетического статуса (повышение соотношения АМФ/АТФ), повышение внутриклеточного кальция, активацию протеинкиназы С.
АМФ-активированная протеинкиназа активируется комплексом механизмов, в том числе повышением баланса АМФ/АТФ, модификацией и фосфориляцией предшествующих киназ [57].
Итак, для функционирования обоих указанных механизмов, способствующих усвоению глюкозы крови СМ, необходимы достаточная ФН и должный уровень чувствительности к инсулину. Поэтому при ИР, в том числе при СД 2-го типа, ключевыми моментами в поддержании глюкозного гомеостаза являются:
— повышение чувствительности к инсулину;
— регулярные ФН, повышающие инсулиннезависимое усвоение глюкозы в СМ.
На сегодняшний день в распоряжении диабетологов имеется целый ряд инсулинсенситайзеров. Необходимость их назначения при наличии ИР отражена в протоколах лечения СД 2-го типа, причем, в соответствии с обновленным в 2015 году консенсусом EASD и ADA, именно с препаратов этой группы рекомендовано начинать лечение таких больных [58]. Эффективность их влияния на чувствительность к инсулину подтверждена большим числом клинических наблюдений [59–61]. Доказано, что представитель этой группы метформин активирует АМФ-киназу и снижает образование глюкозы в печени [62].
Что касается рекомендаций относительно ФН, то такой опыт имеют специалисты по спортивной медицине, исследованиями которых установлены особенности влияния (в том числе на углеводный обмен) нагрузки различной продолжительности и интенсивности. Этот опыт, без сомнения, необходимо учитывать, так как он дал основание сделать вывод, что при оценке состояния здоровья в каждом конкретном случае нужно принимать во внимание не только ИМТ, но и композицию тела, так как она существенно влияет на состояние здоровья [2].
Существует хорошо документированная ассоциация между композицией тела, заболеваемостью и смертностью [63, 64].
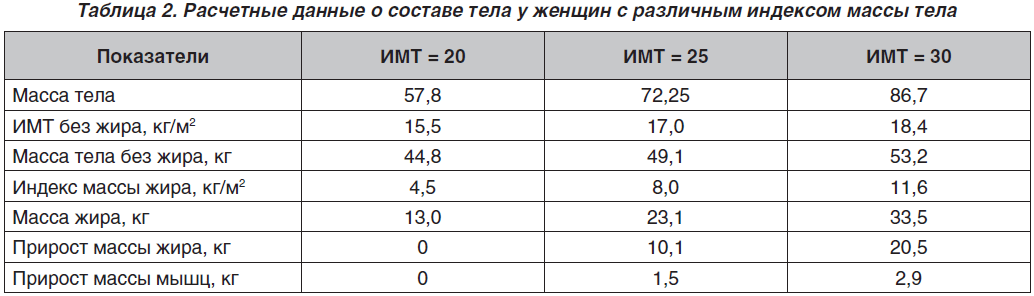
Представляют интерес расчетные данные о составе тела у женщин в градациях: тощие, с нормальной массой тела и ожирением при гипотетическом росте 170 см (табл. 2) [21].
Из этих расчетов следует, что при увеличении ИМТ от 20 до 25 и 30 кг/м2 масса жира в организме повышается с 13 до 23,1 и 33,5 кг. То есть женщина с ожирением (ИМТ 30 кг/м2) постоянно выполняет ФН по переносу в своем теле дополнительных 10,4 кг по сравнению с женщиной с ИМТ 25 кг/м2 и 20,5 кг — с ИМТ 20 кг/м2. Эта нагрузка направлена преимущественно на мышцы-разгибатели нижнего отдела туловища, противостоящие земной гравитации.
Такая нагрузка приводит к гипертрофии СМ. Если представить ЖТ в виде инертной массы, то человек с Ож при одинаковой ФН кажется более тренированным физически [65].
Установлено, что ФН способствует различным метаболическим и морфологическим изменениям в мышцах, включая митохондриальный биогенез и повышенные пропорции тех или иных мышечных волокон.
При статической (силовой) тренировке, в том числе связанной с перемещением собственной массы тела, в организме происходит накопление быстрых мышечных волокон IІb типа (белые мышцы), бедных митохондриями. При этом повышается скорость метаболических процессов в организме. На фоне увеличения потребления глюкозы растет концентрация пировиноградной кислоты в крови и происходит активация печеночных ферментных систем глюконеогенеза. Именно с «натренированной» СМ с возросшей мощностью глюконеогенеза связывают энергетическую защищенность организма от стрессовых ситуаций и болезней [66]. Именно миоциты IІb типа повышают продукцию кардиопротекторных факторов [15, 67].
При циклической ФН (ходьба, бег, езда на велосипеде и т.д.) начинают превалировать медленные мышечные волокна I типа (красные мышцы). Они могут длительно поддерживать работоспособность организма за счет более эффективной работы митохондрий. Именно сжиганием калорий этими мышечными волокнами обеспечивается эффект при Ож.
Имеющаяся на сегодняшний день доказательная база роли мышечной системы в поддержании физического уровня глюкозного гомеостаза обосновывает важность достаточной ФН для профилактики СД 2-го типа и использования ее в комплексной системе мониторинга таких больных. Для них особенно неблагоприятным является наличие первичной, связанной с возрастом, и вторичной, связанной в том числе с СД 2-го типа, саркопении [13, 68, 69].
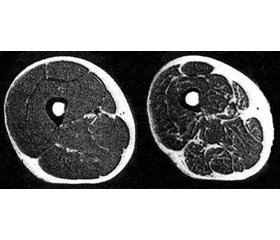
Для определения мышечной массы используются компьютерная, магнитно-резонансная томо–графия, рентген-исследование, абсорбциометрия и биоимпедансный анализ.
Биоимпедансный анализ позволяет определить процент жира и тощей массы. Метод недорогой, воспроизводимый, результаты коррелируют с данными магнитно-резонансной томографии [70].
Нами проанализированы данные биоимпедансного исследования у 114 больных СД 2-го типа в возрасте 52,3 ± 1,7 года с различным ИМТ. Конт–рольные группы составили 110 лиц такого же возраста без СД 2-го типа.
Биоимпедансное исследование проведено с помощью диагностических весов. Результаты анализировали с использованием таблиц, в которых представлены возрастные нормы этих показателей у мужчин и женщин. Статистический анализ данных проводился с оценкой t-критерия Стьюдента. Достоверными считались различия между показателями при значении р < 0,05.
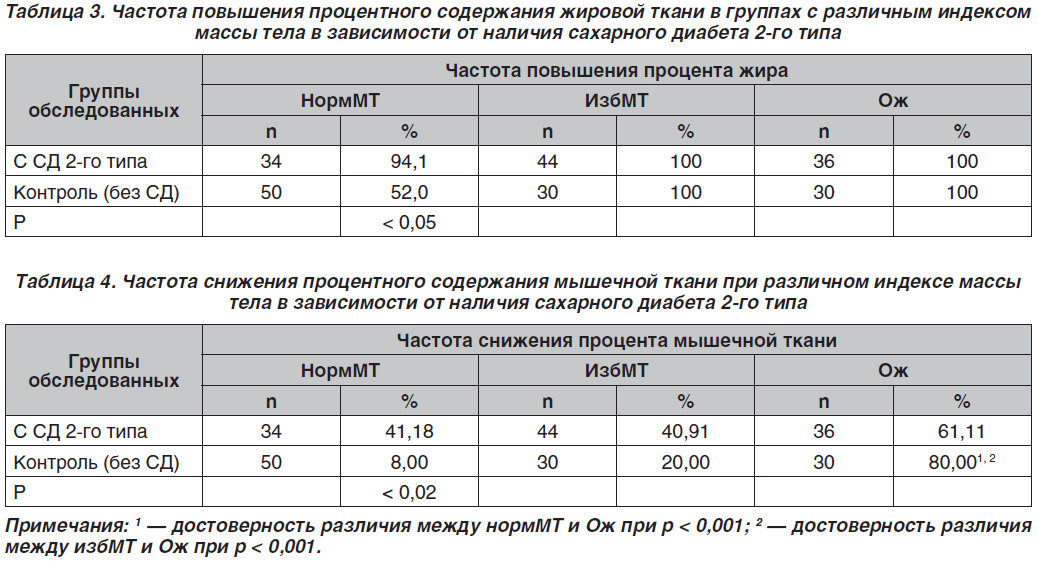
Полученные данные свидетельствуют, что в группах с избМТ и Ож, независимо от наличия СД 2-го типа, у всех лиц наблюдается повышение возрастной нормы процентного содержания ЖТ. В то же время при нормМТ в группе без СД процентное содержание ЖТ превышало возрастные нормативы более чем у половины обследованных (52,0 %), а при наличии СД 2-го типа — почти у всех (94,1 %) (табл. 3).
Эти результаты дают основание считать превышение возрастных норм процентного содержания ЖТ при нормМТ одним из факторов риска СД 2-го типа.
В соответствии с данными литературы негативную прогностическую роль в формировании сердечно-сосудистой патологии играет факт не только повышения процентного содержания ЖТ в организме, но и нарушения определенного соотношения между ЖТ и мышечной тканью [63]. Следует учитывать, что это соотношение может повыситься и за счет снижения процентного содержания мышечной ткани. Поэтому нами исследована частота такого снижения у лиц с СД 2-го типа и без диабета в зависимости от уровня ИМТ (табл. 4).
Обращает на себя внимание то, что в контрольных группах процент лиц с СП был минимальным при нормМТ (8 %), а по мере увеличения ИМТ он достоверно повышался: до 20 % — при избМТ (р < 0,001) и до 80 % — в группе с Ож (р < 0,001), по сравнению с лицами, имеющими избМТ. Эти данные позволяют сделать вывод, что синдром первичной СП в большей мере присущ контингенту лиц с Ож, а не с нормМТ.
В то же время на фоне СД 2-го типа частота СП у лиц с нормМТ выросла более чем в 5 раз по сравнению с аналогичной группой здоровых лиц (р < 0,02), при избМТ она вдвое превысила данные аналогичной по ИМТ контрольной группы. Вместе с тем при Ож на фоне СД 2-го типа она оказалась ниже, чем в контроле (различие недостоверно). Таким образом, у больных СД 2-го типа развитие СП (вторичной) практически не зависит от показателя ИМТ.
Выводы
1. У больных СД 2-го типа саркопения (по данным биоимпедансного исследования) определялась чаще, чем у лиц аналогичного возраста без СД 2-го типа.
2. При СД 2-го типа саркопения чаще определяется у больных с ожирением, чем при нормальной массе тела.
3. С учетом того, что продолжительная ФН способствует увеличению объема мышечной массы за счет гипертрофии мышечных волокон, несомненно, такая нагрузка показана всем пациентам с СД 2-го типа независимо от наличия у них избыточной массы тела или ожирения.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. World Health Organization. Report of the WHO consultation on obesity. Obesity: preventing and managing the global epidemic. — Geneva: World Health Organization, 1998.
2. Bahadori B., Uitz E., Tonninger-Bahadori K., Pestemer-Lach I. et al. Body composition: the fat-free mass index (FFMI) and the body fat mass index (BFMI) distribution among the adult Austrian population — results of a cross-sectional pilot study // International Journal of Body Composition Research. — 2006. — Vol. 4(3). — P. 123-128.
3. Association of all-cause mortality with overweight and obesity using standard body mass index categories: a systematic review and meta-analysis / K.M. Flegal, B.K. Kit, H. Orpana et al. // JAMA. — 2013. — Vol. 309(1). — P. 71-82.
4. Adults who are normal weight at time of diabetes diagnosis have higher rate of death than those who are overweight at diagnosis / M.R. Carnethon et al. // JAMA. — 2012 — Vol. 308(6). — P. 619-620.
5. Mullen J.T., Moorman D.W., Davenport D.L. The obesity paradox: body mass index and outcomes in patients undergoing nonbariatric general surgery // Ann. Surg. — 2009. — Vol. 250(1). — P. 166-172.
6. Трушкина И.В., Филиппов Г.П.. Леонтьева И.В. Оценка структуры тела у пациентов с различной степенью избытка веса // Сибирский медицинский журнал. — 2010. — Т. 25, № 3. — С. 38-44.
7. Romero-Corral A., Somers V.K., Sierra-Johnson J. Normal weight obesity: a risk factor for cardiometabolic dysregulation and cardiovascular mortality // Eur. Heart J. — 2010. — Vol. 6. — P. 737-746.
8. Гончарова О.А., Парцхаладзе В.И., Ильина И.М. Метаболическое ожирение при нормальной массе тела. Нерешенные вопросы диагностики // Эндокринология. — 2013. — № 4. — С. 50-54.
9. Караченцев Ю.І., Гончарова О.А., Парцхаладзе В.І., Ільїна І.М. Діагностика метаболічного ожиріння за цукрового діабету 2 типу у пацієнтів з нормальною масою тіла. Антропометричні методи: Інформаційний лист. — К., 2014. — 4 с.
10. Cruz-Jentoft A.J., Baeyens J.P., Bauer J.M., Boirie Y., Cederholm T., Landi F., et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People// Age Ageing. — 2010. — Vol. 39(4). — P. 412-423.
11. Cruz-Jentoft A.J., Landi F., Topinková E., Michel J.P. Understanding sarcopenia as a geriatric syndrome // Curr. Opin. Clin. Nutr. Metab. Care. — 2010. — Vol. 13(1). — P. 1-7.
12. Cawthon P.M., Marshall L.M., Michael Y. et al. Frailty in older men: prevalence, progression, and relationship with mortality // J. Am. Geriatr. Soc. — 2007. — Vol. 55. — P. 1216-1223.
13. Delmonico M.J., Harris T.B., Lee J.S. et al. Alternative definitions of sarcopenia, lower extremity performance, and functional impairment with aging in older men and women // J. Am. Geriatr. Soc. — 2007. — Vol. 55. — P. 769-774.
14. Goodpaster B.H., Park S.W., Harris T.B. et al. The loss of skeletal muscle strength, mass, and quality in older adults: The health, aging and body composition study // J. Gerontol. Biol. Sci. Med. Sci. — 2006. — Vol. 61. — P. 1059-1064.
15. Pedersen B.K., Febbraio M.A. Muscle as an Endocrine Organ: Focus on Muscle-Derived Interleukin-6 // Physiol. Rev. — 2008. — Vol. 88. — Р. 1379-1406.
16. Васина А.Ю., Дидур М.Д., Иыги А.А. и др. Мышечная ткань как эндокринный регулятор и проблема гиподинамии // Вестник Санкт-Петербургского университета. Серия 11. Медицина. — 2014. — № 2. — С. 5-15.
17. Чернозуб А.А. Безпечні та критичні рівні фізичних навантажень для тренованих та нетренованих осіб в умовах м’язової діяльності силової спрямованості // Фізіологічний журнал. — 2016. — Т. 62(2). — С. 110-116.
18. Сахаров Д.А., Тевис М., Тоневицкий А.Г. Анализ основных изоформ гормона роста человека до и после интенсивных физических нагрузок // Бюл. эксперим. биологии и медицины. — 2008. — Т. 146, № 10. — С. 446-450.
19. Lima-Cabello E., Cuevas M.J., Garatachea N. et al. Eccentric exercise induces nitric oxide synthase expression through nuclear factor-kB modulation in rat skeletal muscle // J. Appl. Physiol. — 2010. — Vol. 108. — Р. 578-583.
20. Stofkova A. Leptin and adiponectin: from energy and metabolic dysbalance to inflammation and autoimmunity // Endocrine Regulation. — 2009. — Vol. 43(4). — P. 157-168.
21. Носков С.М., Маргазин В.А., Носкова А.С. Парадокс ожирения: мышечная гипотеза и тактика физической реабилитации // Леч. физкульт. cпорт. мед. — 2010. — № 6. — С. 53-60.
22. Shulman G.I., Rothman D.L., Jue T., Stein P., DeFron–zo R.A., Shulman R.G. Quantification of muscle glycogen synthesis in normal subjects and subjects with non-insulin-dependent dia–betes by 13C nuclear magnetic resonance spectroscopy // N. Engl. J. Med. — 1990. — Vol. 322. — P. 223-228.
23. Jensen J., Rustad P., Kolnes A.J., Lai Y.C. The Role of Skeletal Muscle Glycogen Breakdown for Regulation of Insulin Sensitivity by Exercise // Front. Physiol. — 2011. — Vol. 2(112). — P. 56-67.
24. Volek J.S., Freidenreich D.J., Saenz C. et al. Metabolic characteristics of ketoadapted ultra-endurance runners // Metabolism. — 2016. — Vol. 65(3). — P. 100-110.
25. Матюнина Ю.В., Курашвили В.А. Роль эндогенного гликогена в повышении выносливости организма // Вестник спортивных инноваций. — 2016. — № 52. — С. 1-30.
26. Методические указания для самостоятельной подготовки студентов медицинских и стоматологического факультетов по биологической химии / Наконечная О.А., Горбач Т.В., Мартынова С.Н., Ярмыш Н.В., Ткачен–ко А.С. — Харьков: ХНМУ, 2016. — 35 с.
27. Vendelbo M.H., Clasen B.F., Treebak J.T. et al. Insulin resistance after a 72-h fast is associated with impaired AS160 phosphorylation and accumulation of lipid and glycogen in human skeletal muscle // Am. J. Physiol. Endocrinol. Metab. — 2012. — Vol. 302. — Р. 190-200.
28. Vendelbo M.H., Møller A.B., Christensen B. et al. Fasting Increases Human Skeletal Muscle Net Phenylalanine Release and This Is Associated with Decreased mTOR Signaling // PLoS ONE. — 2014. — Vol. 9(7). — Р. 1020-1031.
29. Prebil M., Jensen J., Zorec R., Kreft M. Astrocytes and energy metabolism // Arch. Physiol. Biochem. — 2011. — Vol. 117. — P. 64-69.
30. Общая патология: патологическая физиология: Учебник / В.Г. Овсянников. — Ростов-на-Дону: Изд-во РостГМУ, 2015. — 247 с.
31. Egan B., Zierath J.R. Exercise Metabolism and the Molecular Regulation of Skeletal Muscle Adaptation // Cell. Metabolism. — 2013. — Vol. 17(2). — P. 162-184.
32. Rui L. Energy metabolism in the liver // Compr. Physiol. — 2014. — Vol. 4(1). — P. 177-197.
33. Matsui T., Ishikawa T., Ito H. et al. Brain glycogen supercompensation following exhaustive exercise // Physiol. — 2012. — Vol. 590(3). — P. 607-616.
34. Jensen J. The role of skeletal muscle glycolysis in whole body metabolic regulation and type 2 diabetes in glycolysis: regulation, processes and diseases, ed. Lithaw H. — 2009. — P. 5-83.
35. Taniguchi C.M., Emanuelli B., Kahn C.R. Critical nodes in signalling pathways: insights into insulin action // Nat. Rev. Mol. Cell Biol. — 2006. — Vol. 7. — P. 85-96.
36. Lauritzen H.P. Insulin- and contraction-induced glucose transporter 4 traffic in muscle: insights from a novel imaging approach // Exerc. Sport Sci. Rev. — 2013. — Vol. 41(2). — P. 77-86.
37. Shepherd P.R. Mechanisms regulating phosphoinositide 3-kinase signalling in insulin-sensitive tissues // Acta Physiol. Scand. — 2005. — Vol. 183. — P. 3-12.
38. Larance M., Ramm G., James D.E. The GLUT4 code // Mol. Endocrinol. — 2008. — Vol. 22. — P. 226-233.
39. Schultze S.M., Jensen J., Hemmings B.A. et al. Promiscuous affairs of PKB/AKT isoforms in metabolism // Arch. Physiol. Biochem. — 2011. — Vol. 117. — P. 70-77.
40. Li M.V., Chen W., Harmancey R.N. et al. Glucose-6-phosphate mediates activation of the carbohydrate responsive binding protein (ChREBP) // Biochem. Biophys. Res. Commun. — 2010. — Vol. 395(3). — P. 395-400.
41. Adiponectin: a relevant player in PPAR-agonist-mediated improvements in hepatic insulin sensitivity? / M. Bouskila, U.B. Pajvani, P.E. Scherer // Int. J. Obes. Relat. Metabol. Disord. — 2005. — Vol. 29, Suppl. 1. — P. 17-23.
42. Højlund K., Beck-Nielsen H. Impaired glycogen synthase activity and mitochondrial dysfunction in skeletal muscle: markers or mediators of insulin resistance in type 2 diabetes? // Curr. Diabetes Rev. — 2006. — Vol. 2. — P. 375-395.
43. Frosig C., Rose A.J., Treebak J.T. et al. Effects of endurance exercise training on insulin signaling in human skeletal muscle: interactions at the level of phosphatidylinositol 3-kinase, Akt, and AS160 // Diabetes. — 2007. — Vol. 56. — P. 2093-2102.
44. Wadley G.D., Konstantopoulos N., Macaulay L. et al. Increased insulin-stimulated Akt pSer473 and cytosolic SHP2 protein abundance in human skeletal muscle following acute exercise and short-term training // J. Appl. Physiol. — 2007. — Vol. 102. — P. 1624-1631.
45. van Loon L.J., Greenhaff P.L., Constantin-Teodosiu D. et al. The effects of increasing exercise intensity on muscle fuel utilisation in humans // J. Physiol. (Lond.). — 2001. — Vol. 536. — P. 295-304.
46. Otto Buczkowska E., Dworzecki T. The role of skeletal muscle in the regulation of glucose homeostasis // Endokrynol. Diabetol. Chor. Przemiany Materii Wieku Rozw. — 2003. — Vol. 9(2). — P. 93-97.
47. Jensen J., Jebens E., Brennesvik E.O. et al. Muscle glycogen inharmoniously regulates glycogen synthase activity, glucose uptake, and proximal insulin signaling // Am. J. Physiol. Endocrinol. Metab. — 2006. — Vol. 290. — P. 154-162.
48. Derave W., Hansen B.F., Lund S. et al. Muscle glycogen content affects insulin-stimulated glucose transport and protein kinase B activity // Am. J. Physiol. — 2000. — Vol. 279. — P. 947-955.
49. Garcia-Roves P.M., Han D.H., Song Z. et al. Prevention of glycogen supercompensation prolongs the increase in muscle GLUT4 after exercise // Am. J. Physiol. Endocrinol. Metab. — 2003. — Vol. 285(4). — P. 729-736.
50. Petersen K.F., Dufour S., Savage D.B. et al.The role of skeletal muscle insulin resistance in the pathogenesis of the metabolic syndrome // Proc. Natl. Acad. Sci. U.S.A. — 2007. — Vol. 104. — P. 12587-12594.
51. Aas V., Rokling-Andersen M., Wensaas A.J. et al. Lipid metabolism in human skeletal muscle cells: effects of palmitate and chronic hyperglycaemia // Acta Physiol. Scand. — 2005. — Vol. 183. — P. 31-41.
52. Hue L., Taegtmeyer H. The Randle cycle revisited: a new head for an old hat // Am. J. Physiol. Endocrinol. Metab. — 2009. — Vol. 297. — P. 578-591.
53. Hoehn K.L., Salmon A.B., Hohnen-Behrens C. et al. Insulin resistance is a cellular antioxidant defense mechanism // Proc. Natl. Acad. Sci. U.S.A. — 2009. — Vol. 06. — P. 17787-17792.
54. Acheson K.J., Schutz Y., Bessard T. et. al. Glycogen storage capacity and de novo lipogenesis during massive carbohydrate overfeeding in man // Am. J. Clin. Nutr. — 1988. — Vol. 48. — P. 240-247.
55. Haemmerle G., Lass A., Zimmermann R. et al. Defective lipolysis and altered energy metabolism in mice lacking adipose triglyceride lipase // Science. — 2006. — Vol. 312. — P. 734-737.
56. Perry R.J., Samuel V.T., Petersen K.F., Shulman G.I. The role of hepatic lipids in hepatic insulin resistance and type 2 diabetes // Nature. — 2014. — Vol. 510(7503). — P. 84-91.
57. Srivastava R.A., Pinkosky S.L., Filippov S. et al. MP-activated protein kinase: an emerging drug target to regulate imbalances in lipid and carbohydrate metabolism to treat cardio-metabolic diseases // J. Lipid Res. — 2012. — Vol. 53(12). — P. 490-514.
58. Inzucchi S.E., Bergenstal R.M., Buse J.B. et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) // Diabetes Care. — 2015. — 38(1). — P. 140-149.
59. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) // Lancet. — 1998. — Vol. 352. — P. 854-865.
60. Jones K.L., Arslanian S., Peterokova V.A. et al. Effect of metformin in pediatric patients with type 2 diabetes: a rando–mized controlled trial // Diabetes Care. — 2002. — Vol. 25(1). — P. 89-94.
61. Lamanna C., Monami M., Marchionni N., Mannucci E. Effect of metformin on cardiovascular events and mortality: a meta-analysis of randomised clinical trials // Diabetes Obes Metab. — 2011. — Vol. 13. — P. 221-228.
62. Ouyang J., Parakhia R.A., Ochs R.S. Metformin activates AMP kinase through inhibition of AMP deaminase // J. Biol. Chem. — 2011. — Vol. 286(1). — P. 1-11.
63. Oreopoulos A., Ezekowitz J.A., McAlister F.A. et al. Association between direct measures of body composition and prognostic factors in chronic heart failure // Mayo Clin. Proc. — 2010. — Vol. 85(7). — P. 609-617.
64. Oreopoulos A., Padwal R., Kalantar-Zadeh K. Body mass index and mortality in heart failure: a meta-analysis // Am. Heart J. — 2008. — Vol. 156(1). — P. 13-22.
65. Rolland Y., Luawers-Cances V., Pahor M. et al. Muscle strength in obese elderly women: effect of recreation physical activity in a cross-sectional study // Am. J. Clin. Nutr. — 2004. — Vol. 79. — Р. 552-557.
66. Shibata R., Ouchi N., Kihara S. et al. Adiponectin stimulates angiogenesis in response to tissue ischemia through stimulation of amp-activated protein kinase signaling // J. Biol.Chem. — 2004. — Vol. 279. — Р. 28670-28674.
67. Walsh K. Adipokines, myokines and cardiovascular disease // Circ. J. — 2009. — Vol. 73(1). — Р. 13-18.
68. Olde Rikkert M.G., Rigaud A.S., van Hoeyweghen R.J. et al. Geriatric syndromes: medical misnomer or progress in geriatrics? // Neth. J. Med. — 2003. — Vol. 6. — P. 83-87.
69. Cawthon P.M., Marshall L.M., Michael Y. et al. Frailty in older men: prevalence, progression, and relationship with mortality // J. Am. Geriatr. Soc. — 2007. — Vol. 55. — P. 1216-1223.
70. Kyle U.G., Genton L., Karsegard L. et al. Single prediction equation for bioelectrical impedance analysis in adults aged 20–94 years // Nutrition. — 2001. — Vol. 1. — P. 248-253.