Резюме
Вивчена вікова динаміка вмісту цинку (Zn) у хлопців пубертатного віку та його зміни при затримці росту та статевого розвитку. Мета дослідження: поглиблення існуючих уявлень щодо впливу дефіциту Zn на формування порушень фізичного та статевого розвитку в підлітків. Матеріали та методи. У 70 хлопців-підлітків 10–17 років оцінено вміст Zn з урахуванням характеру соматостатевого розвитку, наявності дифузного нетоксичного зоба (ДНЗ). Підлітки розподілені на групи: 1) 20 хлопців 10–17 років із нормальним об’ємом щитоподібної залози, нормальним фізичним та статевим розвитком; 2) 17 хлопців 14–17 років із нормальним статевим розвитком та ДНЗ; 3) 15 хлопців 14–17 років із затримкою статевого розвитку (ЗСР) та нормальним об’ємом щитоподібної залози; 4) 18 хлопців 14–17 років із ДНЗ та ЗСР. Результати. Найбільший рівень Zn визначали у період власне пубертату при фізіологічному його перебігу ((16,52; 14,27–18,66) ммоль/л), що вірогідно більше, ніж у препубертатному віці ((13,53; 12,77–16,41) ммоль/л; p < 0,05) та в період пізнього пубертату ((12,59; 10,22–16,07) ммоль/л; p < 0,05). У хлопців із ЗСР ((14,41; 12,67–15,83) ммоль/л) та низьким зростом ((12,53; 8,80–15,46) ммоль/л) діагностовано зменшення рівня Zn, особливо в разі наявності в них ДНЗ ((10,03; 8,51–13,76) ммоль/л). Під час регресійного та факторного аналізу вивчено характер взаємозв’язку між антропометричними показниками, ступенем розвиненості вторинних статевих ознак і рівнем Zn, функціональним станом статевої та тиреоїдної системи. Визначена необхідність проведення вторинної профілактики та корекції дефіциту Zn із застосуванням «Цинкіту» у вигляді моно- або комплексної терапії. Висновки. Протягом пубертату змінюються показники Zn із максимальним його рівнем у період власне пубертату. Затримка росту та статевого розвитку відбувається на тлі зменшення концентрації Zn у крові. Найменший рівень Zn притаманний підліткам із ДНЗ та ЗСР. Вивчено характер взаємозв’язку між антропометричними показниками, ступенем розвиненості вторинних статевих ознак із Zn, функціональним станом статевої та тиреоїдної системи. Обґрунтовано доцільність застосування «Цинкіту» при проведенні вторинної профілактики та лікування дефіциту Zn у підлітків із порушенням соматостатевого розвитку.
Изучена возрастная динамика содержания цинка (Zn) у мальчиков пубертатного возраста и его изменения при задержке роста и полового развития. Цель исследования: углубление существующих представлений о влиянии дефицита Zn на формирование нарушений физического и полового развития у подростков. Материалы и методы. У 70 мальчиков-подростков 10–17 лет изучено содержание Zn с учетом характера соматополового развития и наличия диффузного нетоксичного зоба (ДНЗ). Подростки разделены на группы: 1) 20 мальчиков 10–17 лет с нормальным объемом щитовидной железы, нормальным физическим и половым развитием; 2) 17 подростков 14–17 лет с нормальным половым развитием и ДНЗ; 3) 15 подростков 14–17 лет с задержкой полового развития (ЗПР) и нормальным объемом щитовидной железы; 4) 18 подростков 14–17 лет с ДНЗ и ЗПР. Результаты. Самый высокий уровень Zn определяли в период собственно пубертата при физиологическом его течении ((16,52; 14,27–18,66) ммоль/л), что достоверно больше, чем в препубертатном ((13,53; 12,77–16,41) ммоль/л; p < 0,05) и позднем пубертатном периоде ((12,59; 10,22–16,07) ммоль/л; p < 0,05). У подростков с ЗПР ((14,41; 12,67–15,83) ммоль/л) и низким ростом ((12,53; 8,80–15,46) ммоль/л) диагностировано уменьшение уровня Zn, особенно при наличии у них ДНЗ ((10,03; 8,51–13,76) ммоль/л). Во время регрессионного и факторного анализа изучен характер взаимосвязи между антропометрическими показателями, степенью развития вторичных половых признаков и уровнем Zn, функциональным состоянием половой и тиреоидной системы. Доказана необходимость проведения вторичной профилактики и коррекции дефицита Zn с использованием препарата «Цинкит» в виде моно- или комплексной терапии. Выводы. В течение пубертата изменяются показатели Zn с максимальным его уровнем в период собственно пубертата. Задержка роста и полового развития происходит на фоне уменьшения концентрации Zn в крови. Наименьшие значения Zn присущи подросткам с ДНЗ и ЗПР. Изучен характер взаимосвязи между антропометрическими показателями, степенью развития вторичных половых признаков с Zn, функциональным состоянием половой и тиреоидной системы. Обоснована целесообразность применения «Цинкита» при проведении вторичной профилактики и лечения дефицита Zn у подростков с нарушением соматополового развития.
Background. The study investigated the age changes of zinc (Zn) in pubertal boys and its changes in delayed growth and sexual development. The aim of the study was to expand existing concepts about the influence of Zn deficiency disorders on the physical and sexual development in adolescents. Materials and methods. In 70 adolescent boys aged 10–17 years Zn level was evaluated, taking into account somato-sexual development and the presence of diffuse nontoxic goiter (DNG). Teens were divided into groups: 1) 20 boys aged 10–17 years with normal volume of the thyroid gland, normal physical and sexual development; 2) 17 adolescents aged 14–17 years with normal sexual development and DNG; 3) 15 adolescents aged 14–17 years with sexual development delay (SDD) and normal thyroid volume; 4) 18 adolescents aged 14–17 years with SDD and DNG. Results. The highest values of Zn were determined during the physiological puberty by itself within its physiologic course ((16.52; 14.27–18.66) mmol/l), which is significantly more than in the pre- ((13.53; 12.77–16.41) mmol/l; p < 0.05) and late puberty ((12.59; 10.22–16.07) mmol/l; p < 0.05). The adolescents with SDD ((14.41; 12.67–15.83) mmol/l) and short stature ((12.53; 8.80–15.46) mmol/l) had decreased Zn level, especially in the case of DNG ((10.03; 8.51–13.76) mmol/l). Regression and factor analysis studied the nature of the relationship between anthropometric indices, the degree of development of secondary sexual characteristics and Zn, functional state of the thyroid and reproductive systems. Conclusions. During puberty period Zn rates varies achieving its maximum level during the puberty by itself. Delayed growth and sexual development are associated with reduced Zn concentration in blood. The lowest Zn value is typical for the adolescents with DNG and SDD. There was grounded the necessity of Zincite drug application as a monotherapy or included into the complex treatment for the secondary prevention and treatment of Zn deficiency.
Вступ
Стабільність хімічного складу організму є одним із найважливіших і обов’язкових умов його нормального функціонування. Відповідно, відхилення в мікроелементному статусі може призводити до формування преморбідного фону, в умовах якого відбувається погіршення соматичного та психічного здоров’я, порушення соматостатевого розвитку та зниження репродуктивного потенціалу [1, 8, 10, 11]. Саме тому вивчення впливу хімічних речовин на репродуктивне здоров’я є актуальним напрямком сучасних наукових досліджень.
Одним із найбільш значущих для репродуктивної системи мікроелементів є цинк (Zn), який належить до важливих і незамінних для життєдіяльності організму людини мікроелементів [14, 15]. За вмістом у людському організмі цей елемент знаходиться на другому місці після заліза. Здатність Zn брати участь у процесах лігандоутворення з органічними молекулами пояснює надзвичайно широкий спектр його участі в різних біологічних процесах. Це супроводжується й відносною безпекою цього елемента, особливо відсутністю оксидантних властивостей (на відміну від заліза й міді), що покращує транспорт і метаболізм Zn в організмі і сприяє швидкому засвоєнню його клітинами. Zn незамінний для генної експресії та метаболізму нуклеїнових кислот, а відповідно, і для всіх процесів клітинного росту й диференціації. Він є структурним компонентом біологічних мембран, клітинних рецепторів, протеїнів, входить до складу понад 200 ензиматичних систем, завдяки чому даний метал бере участь у формуванні рецепторної чутливості до різних гормонів, факторів росту (забезпечує контроль експресії генів у процесі реплікації та диференціювання клітин) і т.п.
Zn необхідний для росту й репродукції [5, 11]. У жінок Zn відіграє важливу роль у статевому розвитку, овуляції й регуляції менструального циклу. Зокрема, процес фолікулогенезу, пов’язаний з антиоксидантними явищами в клітині, регулюється рівнем Zn. Крім того, цей елемент входить до структури рецепторів естрогенів, регулюючи таким чином усі естрогенозалежні процеси [2].
Обговорюють значення цинкдефіцитного стану під час вагітності у формуванні акушерських ускладнень [9]. За оцінками ВООЗ, понад 80 % вагітних жінок у світі не отримують Zn у достатній кількості, споживаючи в середньому 9,6 мг Zn на добу, що значно нижче від рекомендованих мінімальних денних рівнів споживання [14]. Установлено, що під час двох останніх триместрів вагітності жінка повинна отримувати 3 мг елементарного Zn на добу, що відповідає прийому 15 мг Zn. У свою чергу, дефіцит Zn у матері під час вагітності може становити загрозу для розвитку дитини й призводити до патологічного перебігу пологів. Через низькі рівні Zn в плазмі зменшується його трансплацентарне перенесення, що може вплинути на кількість Zn, який надходить до плода. При цьому виникає цинкдефіцитний стан, що асоціюється зі збільшенням кількості спонтанних абортів, народженням незрілого плода з дефіцитом маси, а також формуванням вад розвитку [2, 12, 13]. Саме тому під час вагітності жінкам рекомендоване застосування Zn у вигляді фармакологічних препаратів та харчових добавок. Доведено, що немовлята, народжені від матерів, які приймали Zn, мали вищий гестаційний вік та більш високі значення за шкалою Апгар при народженні [16].
Доведена безумовна необхідність Zn для чоловічої статевої системи [5, 18, 19]. Так, Zn справляє модулюючий вплив на систему регуляції «гіпоталамус — гіпофіз — яєчка». Центральна дія Zn полягає в пригніченні синтезу пролактину, відносному підвищенні рівня гонадотропних гормонів — фолікулостимулюючого гормону (ФСГ) і лютеїнізуючого гормону (ЛГ). Підтримка необхідного рівня тестостерону (Тс) у чоловічому організмі відбувається за умов достатнього вмісту Zn шляхом посилення чутливості рецепторів клітин Лейдіга до гонадотропних гормонів, що стимулює синтез тестостерону. Даний мікроелемент регулює продукцію активного метаболіту Тс — дигідротестостерону, пригнічує активність 5-альфа-редуктази, тим самим впливає на перетворення Тс у Е2 (естроген). Він входить до складу понад 70 внутрішньоядерних ферментів, які каталізують ключові етапи синтезу ДНК і РНК, тому Zn покращує процеси ділення й диференціювання сперматозоїдів. Цитрат цинку є важливим компонентом секрету передміхурової залози, збільшує кількість та поліпшує рухливість сперматозоїдів у еякуляті. При зниженні рівня Zn поділ клітин уповільнюється, зменшується кількість сперматозоїдів та їхня рухливість, що призводить до погіршення якості сперми.
Відповідно до сучасних даних, фізіологічні потреби в Zn змінюються з віком дитини та досягають свого піку в підлітковому віці під час пубертатного стрибка росту, який зазвичай трапляється у дівчаток віком від 10 до 15 років і у хлопчиків віком від 12 до 15 років. Але навіть у старшому пубертатному віці, коли процеси росту уповільнюються, потреба в Zn вища, ніж у дорослих та літніх людей [13, 14]. Однією з найбільш вивчених клінічних ознак, пов’язаних із дефіцитом цинку, є погіршення фізичного та статевого розвитку [11, 15]. Однак механізми, залучені до ретардації соматостатевого розвитку за умов дефіциту мікроелемента, залишаються до кінця не визначеними.
Мета дослідження: поглиблення існуючих уявлень щодо впливу дефіциту цинку на формування порушень фізичного та статевого розвитку в підлітків.
Матеріали і методи
В умовах ендокринологічного відділення ДУ «Інститут охорони здоров’я дітей та підлітків НАМН України» проведено комплексне обстеження 70 хлопців-підлітків 10–17 років. Фізичний розвиток (ФР) оцінювали шляхом порівняння основних антропометричних показників (росту й маси тіла) із віковими нормативами відповідно до «Протоколів надання медичної допомоги дітям за спеціальністю «Дитяча ендокринологія» [7]. Характер статевого розвитку визначений за ступенем розвиненості вторинних статевих ознак, розраховували індекс маскулінізації (ІМ), значення якого зіставляли з нормативними показниками. Затримку статевого розвитку (ЗСР) діагностували в разі уповільнення темпів статевого розвитку більше ніж на два роки [3, 6].
Стан щитоподібної залози (ЩЗ) визначався візуально-пальпаторним методом за методологією, рекомендованою ВООЗ/МРКЙДЗ (2001), та за даними УЗД, проведеного за допомогою ультразвукового сканера SLE-101 PC з лінійним датчиком 51 мм з частотою 7,5 МГц. Стан ЩЗ та характер тиреоїдної патології визначали відповідно до чинних протоколів [7].
Вивчення гормонального статусу передбачало визначення рівня гонадотропних гормонів (ЛГ та ФСГ), тиреотропіну (ТТГ) методом імуноферментного аналізу на фотометрі Humareader (Німеччина) за допомогою комерційних наборів фірми «Алкор Біо» (Санкт-Петербург). Радіоімунним методом за допомогою стандартних комерційних наборів Immunotech (Чехія) визначали концентрацію загальних фракцій статевих (Т та Е2) та вільних фракцій тиреоїдних (тироксину — fT4 і трийодтироніну — fT3) гормонів.
Уміст Zn у сироватці крові вивчали із застосуванням комерційних наборів BIO-LA-TEST (Республіка Чехія).
Залежно від характеру статевого дозрівання та стану тиреоїдної системи підлітків розподілено на групи: 1) контрольна група (нормальний статевий розвиток, НСР) — підлітки 10–17 років із нормальним об’ємом ЩЗ, гармонійним фізичним розвитком та фізіологічним перебігом пубертату, які не мали хронічної соматичної патології в стадії загострення (20 хлопців); 2) із нормальним статевим розвитком та дифузним нетоксичним зобом (ДНЗ + НСР) — 17 хлопців; 3) підлітки із затримкою статевого розвитку та нормальним об’ємом щитоподібної залози (ЗСР) — 15 хлопців; 4) підлітки із ДНЗ та затримкою статевого розвитку (ДНЗ + ЗСР) — 18 хлопців.
Результати обстеження підлітків об’єднано в електронний банк даних, їх математична обробка була проведена за допомогою пакетів програм SPSS Statistics 17.0, Microsoft Excel-2007. Статистичний аналіз припускав оцінку нормальності розподілу змінних, які вивчалися з використанням тесту Колмогорова — Смирнова. За умов відсутності нормального розподілу даних у ряді наведено показники медіани та квартилів (Me; Lq-Uq). Для оцінки вірогідності відмінностей використовували критерій Вілкоксона — Манна — Уїтні. Уточнення взаємозв’язку між досліджуваними параметрами проводили під час регресійного та факторного аналізу [5]. Критичний рівень значущості для перевірки статистичних гіпотез приймався рівним 0,05.
Результати
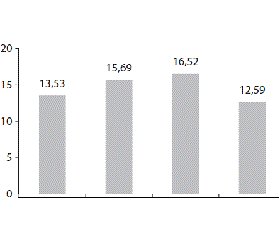
Аналіз показників Zn у хлопців із нормальним об’ємом ЩЗ, гармонійним фізичним розвитком та фізіологічним перебігом пубертату визначив чітку залежність між концентрацією мікроелемента та рівнем статевого розвитку. Доведено, що найбільші значення концентрації Zn у крові визначали у хлопців 14–16 років із нормальним характером статевого дозрівання в період власне пубертату ((16,52; 14,27–18,66) ммоль/л). Вірогідно менші значення були притаманні підліткам у препубертатний та пізній пубертатний період ((13,53; 12,77–16,41) ммоль/л (p < 0,05) та (12,59; 10,22–16,07) ммоль/л (p < 0,05) відповідно) (рис. 1).
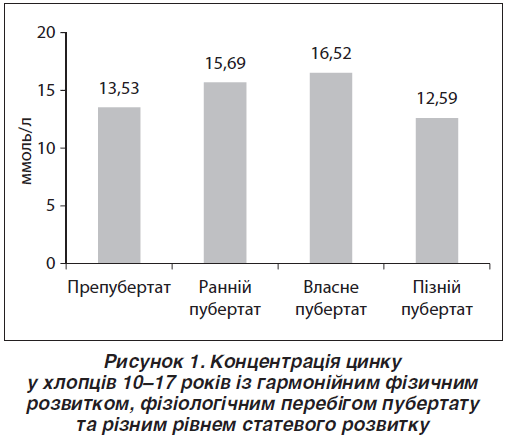
Результати зіставлення показників Zn у хлопців старшого віку (14–17 років) із фізіологічним та патологічним перебігом пубертату показали, що в підлітків із ЗСР рівень мікроелемента був вірогідно нижчим, ніж у хлопців із нормальним статевим розвитком ((14,41; 12,67–15,83) проти (17,07; 14,79–18,36) ммоль/л; p < 0,05). Індивідуальний аналіз показників Zn у підлітків із ЗСР визначив зниження його концентрації менше, ніж 10,0 ммоль/л, майже в 2/3 обстежених.
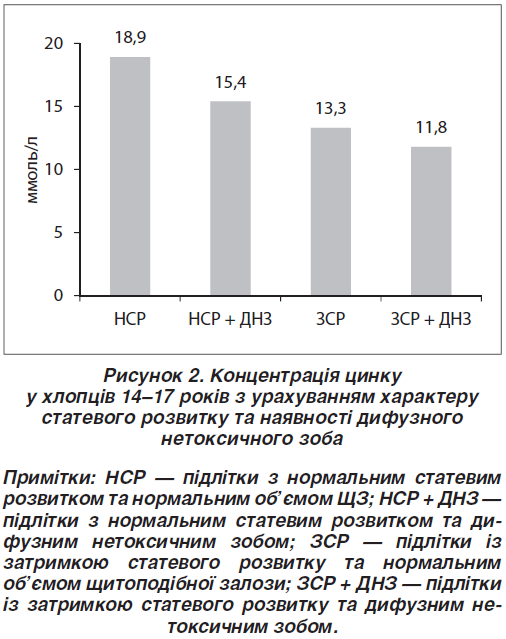
Слід зазначити, що у хлопців із ДНЗ, незалежно від перебігу пубертату, визначали вірогідно менші показники Zn, ніж у хлопців із нормальним об’ємом ЩЗ (рис. 2).
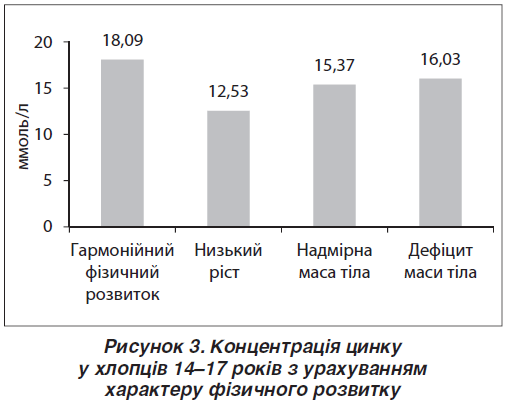
Визначена залежність між рівнем Zn та характером фізичного розвитку. Так, найменший рівень Zn був у підлітків із низьким зростом, значення якого вірогідно відрізнялись від показників, отриманих у хлопців із гармонійним фізичним розвитком ((12,53; 8,80–15,46) проти (18,09; 14,19–20,64) ммоль/л; p < 0,05) (рис. 3). Найменші показники були притаманні хворим із низьким зростом та ЗСР, особливо в разі виявлення в них ДНЗ ((10,03; 8,51–13,76) ммоль/л).
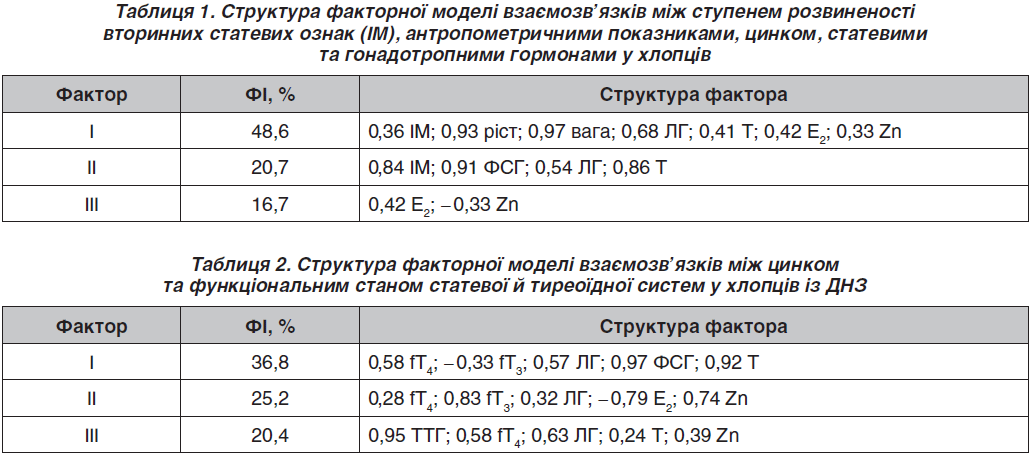
Наявність взаємозв’язку Zn зі станом гіпофізарно-гонадної системи підтверджено під час проведення регресійного та факторного аналізу. Так, отримані регресійні рівняння свідчать про вплив Zn на показники статевих гормонів (Тс = –6,8 + 0,7 ЛГ + 0,5 ФСГ + 1,2 Е2 + 0,4 Zn; R2 = 83,6 %; p = 0,01; та Е2 = 0,1 Zn; R2 = 89,4 %; p = 0,01), а структура факторної моделі віддзеркалює зв’язок ступеня розвиненості вторинних статевих ознак (рівень ІМ), антропометричних показників із Zn, статевими та гонадотропними гормонами (табл. 1).
Zn увійшов у I та III фактори із загальною факторною інформативністю (ФІ) 65,3 %, який у I факторі пов’язаний із ІМ, зростом, вагою, ЛГ та статевими гормонами (ФІ 48,6 %), а у III факторі — зворотно із Е2 (ФІ 16,7 %).
Також за допомогою факторного аналізу вивчено особливості взаємозв’язку між Zn, функціональним станом статевої й тиреоїдної систем у хлопців із ДНЗ. Відповідно до побудованої факторної моделі, яка описує 82,8 % дисперсії підлітків, Zn увійшов до II та III факторів із загальною ФІ 45,4 % та був пов’язаний із вільними фракціями тиреоїдніх гормонів, ЛГ та Е2 у II факторі та з ТТГ, вільною фракцією тироксину, ЛГ та Тс — у III факторі (табл. 2). Зазначене свідчить про вплив Zn на рівень ТТГ, гонадотропних, тиреоїдних та статевих гормонів, які безпосередньо забезпечують статевий та фізичний розвиток підлітків.
Обговорення
Таким чином, отримані результати свідчать про вірогідне зменшення вмісту Zn у підлітків із дисгармонійним фізичним розвитком та патологічним перебігом пубертату, особливо за наявності тиреоїдної патології. Зазначене може бути зумовлене впливом мікроелемента на кількість циркулюючого інсуліноподібного фактора росту 1 (IGF-1), активність фосфорилювання IGF-1 рецептора та підвищення активності трийодтироніну, які беруть безпосередню участь у процесах росту [15].
За сучасними даними [8], дефіцит Zn може виникати з багатьох причин: через невідповідне харчування, порушення процесів всмоктування в слизовій кишечника, неадекватне або порушене зв’язування цинку з альбумінами, погане засвоєння цинку клітинами, конкурування його з іншими металами (наприклад, кальцієм або кадмієм). Очевидно, що в основі проблеми лежать не тільки медичні, а й соціально-економічні причини, серед яких значне місце займає порушення раціональної системи харчування населення країни протягом багатьох поколінь.
Усе це свідчить про необхідність проведення профілактичних та лікувальних заходів із метою корекції дефіциту означеного есенціального мікроелемента. Відсутність адекватного режиму харчування в підлітків, у раціоні яких переважають вуглеводи при недостатньому надходженні білків тваринного походження, обмежена кількість продуктів, збагачених Zn, обумовлюють доцільність застосування фармакологічних препаратів та харчових добавок, які містять солі Zn (сульфат цинку, глюконат цинку або ацетат цинку) [16]. Відповідно до вікових нормативів рекомендовані дози Zn для дітей віком від 7 місяців до 3 років становлять 5 мг/добу і 10 мг/добу для дітей старшого віку [13].
Засобом вибору для корекції дефіциту Zn у підлітковому віці є «Цинкіт» виробництва компанії «Вьорваг Фарма» (Німеччина), представлений у формі шипучих розчинних таблеток, які містять 44,0 мг цинку сульфату (відповідає 10,0 мг цинку), що відповідає добовій потребі підлітків. Приймати «Цинкіт» для вторинної профілактики та корекції цинкдефіцитних станів рекомендовано по 1 шипучій таблетці 1 раз на добу протягом двох місяців і повторювати цей курс 2–3 рази на рік. Препарати Zn можна використовувати як для моно–терапії, так і у складі диференційованої терапії, характер якої визначають індивідуально.
Ефективність лікування та вторинної профілактики оцінюють за показниками соматостатевого розвитку та тиреоїдної системи. У разі відсутності позитивного ефекту необхідно проводити комплексну оцінку мікроелементного балансу з визначенням есенціальних (цинк, селен, залізо) та токсичних (свинець, кадмій) мікроелементів, умісту вітамінів (ретинол, токоферол, групи В), які впливають на стан гіпофізарно-гонадної та тиреоїдної систем, із подальшим призначенням адекватної терапії для корекції їх дисбалансу.
Висновки
1. Протягом пубертату змінюються показники Zn із максимальним його рівнем у період власне пубертату.
2. Затримка зросту та статевого розвитку відбувається на тлі зменшення концентрації Zn у крові. Найменші значення Zn притаманні підліткам із ДНЗ та ЗСР.
3. Вивчено характер взаємозв’язку між антропометричними показниками, ступенем розвиненості вторинних статевих ознак із Zn, функціональним станом статевої та тиреоїдної системи.
4. Обґрунтовано доцільність застосування «Цинкіту» при проведенні вторинної профілактики та при лікуванні дефіциту Zn у підлітків із порушенням соматостатевого розвитку.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Білецька Е.М. Мікроелементний дисбаланс у харчуванні жінок промислового міста як фактор ризику погіршення репродуктивного здоров’я / Е.М. Білецька, Н.М. Онул // Materiály IX Mezinárodni vĕdecko-praktická konference [«Vádecký pokrok na přelomu tysyachalety-2013»]. Dil. 31. Lekarstvi. Praha, 2013. — P. 79-81.
2. Белецкая Э.Н. Влияние цинка на репродуктивную функцию экспериментальных животных / Э.Н. Белецкая, Н.М. Онул // Микроэлементы в медицине. — 2015. — Т. 15, № 2. — С. 22-28.
3. Демченко А.Н. Клиническая диагностика и терапия мужского препубертатного гипогонадизма : метод. рек. / Мин-во здравоохранения Украины / сост. А.Н. Демченко. — Х., 2000. — 16 с.
4. Наследов А. SPSS 1: Профессиональный статистический анализ данных / А. Наследов. — СПб.: Питер, 2008. — 416 c.
5. Олина А.А.Значение дефицита цинка в формировании нарушений репродуктивного здоровья (обзор литературы) / А.А. Олина, Г.К. Садкова // Пермский медицинский журнал. — 2015. — Т. 32, № 5. — С. 138-143.
6. Оцінка статевого розвитку хлопців (вікові нормативи) : метод. рекомендації / [Плехова О.І. та ін.] / ДУ «ІОЗДП АМНУ». — Х., 2010. — 25 с.
7. Протокол надання медичної допомоги дітям за спеціальністю «Дитяча ендокринологія» : наказ МОЗ України № 254 від 27.04.2006 р. / МОЗ України. — К., 2006. — 88 с. — (Нормативний документ МОЗ України).
8. Взаємодія мікроелементів: біологічний, медичний і соціальний аспекти / [Трахтенберг І.М., Чекман І.С., Линник В.О. та ін.] // Вісник національної академії наук України. — 2013. — № 6. — С. 11-21.
9. Badru A.A. Some effects of zinc on maternal and fetal integrity in pregnancy / A.A. Badru, B.I. Kukoyi, O.E. Ukponmwan // Nigerian Journal of Physiological Sciences. — 2006. — Vol. 21(1–2). — P. 91-97.
10. Black M.M. Zinc deficiency and child development / M.M. Black // Am J Clin Nutr. — 1998. — Vol. 68 (2). — P. 464-469.
11. Brown K.H. Commentary: Zinc and child growth / K.H. Brown // Int. J. Epidemiol. — 2003. — Vol. 32 (6). — P. 1103-1104.
12. Chaffee B.W. Effect of zinc supplementation on pregnancy and infant outcomes: a systematic review / B.W. Chaffee, J.C. King // Paediatric and Perinatal Epidemiology. — 2012. — Vol. 26 (1). — P. 118-137.
13. Brown K.H. Effect of supplemental zinc on the growth and serum zinc concentrations of prepubertal children: A meta-analysis of randomized controlled trials / J.M. Peerson, J. Rivera, L.H. Allen // Am. J. Clin. Nutr. — 2002. — Vol. 75. — P. 1062-71.
14. International Zinc Nutrition Consultative Group (IZiNCG). International Zinc Nutrition Consultative Group (IZiNCG) technical document 1. Assessment of the risk of zinc deficiency in populations and options for its control /
K.H. Brown, J.A. Rivera, Z. Bhutta [et al.] // Food Nutr. Bull. — 2004. — Vol. 25. — P. 99-203.
15. Prasad A.S. Discovery of Human Zinc Deficiency: Its Impact on Human Health and Disease / S.A. Prasad // Adv. Nutr. March. — 2013. — Vol. 4. — P. 176-190.
16. Prasad A.S. Zinc in humans: health disorders and therapeutic effects / A.S. Prasad // Микроэлементы в медицине. — 2014. — Vol. 15 (1). — P. 3-12.
17. Maret W. Zinc requirements and the risks and benefits of zinc supplementation / W. Maret, H.H. Sandstead // J. Trace Elem. Med. Biol. — 2006. — Vol. 20. — P. 3-18.
18. Myers S.A. Zinc Transporters, Mechanisms of Action and Therapeutic Utility: Implications for Type 2 Diabetes Mellitus / S.A. Myers, Alex Nield, Mark Myers // Journal of Nutrition and Metabolism. — 2012. doi: 10.1155/2012/173712
19. Zinc and its importance for human health: An integrative review / N. Roohani, R. Hurrell, R. Kelishadi, R. Schu–lin // J. Res. Med. Sci. — 2013. — № 18 (2). — Р. 144-157.