Уже более 30 лет прошло с тех пор, как австралийскими исследователями Уорреном и Маршаллом была открыта инфекция H. pylori, однако интерес гастроэнтерологов во всем мире к этой проблеме остается высоким. Это объясняется высокой распространенностью данной инфекции, четко установленной и доказанной связью ее с патологией гастродуоденальной зоны, а также с определенными сложностями, которые в ряде случаев имеют место в лечении хеликобактерной инфекции.
В 90-х годах прошлого столетия специалисты, занимающиеся проблемой хеликобактериоза, попытались упорядочить накопленные знания в области изучения инфекции H. pylori и сформулировать общие правила, общие направления в диагностике и лечении хеликобактерной инфекции. Большие усилия в этом направлении прилагала Европейская группа по изучению H. pylori (European Helicobacter pylori Study Group), основанная в 1987 г. В итоге деятельности этой группы в 1996 г. в голландском городе Маастрихт был принят консенсус по проблеме хеликобактериоза, который получил название «Маастрихтский консенсус».
В первом Маастрихтском консенсусе была обозначена необходимость антихеликобактерной терапии у всех больных с H. pylori-ассоциированной язвенной болезнью. Уже тогда указывалось на важность применения ингибиторов протонной помпы в эрадикационных схемах, а среди антибиотиков рекомендовались кларитромицин, амоксициллин, метронидазол. В то время эрадикационная терапия предлагалась на 7 дней, что сегодня считается недостаточным по длительности [1].
В 2000 г. на основании дальнейшего прогресса в изучении хеликобактерной инфекции был принят Маастрихтский консенсус-2. В нем предложена стратегия test-and-treat. Были четко обозначены ключевые (обязательные) показания к эрадикации H. pylori при наличии у пациентов этой инфекции: язвенная болезнь, MALT-лимфома, отягощенная наследственность по раку желудка, состояния после резекции по поводу рака желудка, атрофический гастрит. Из диагностических исследований особо обозначены дыхательный уреазный тест и стул-тест. А что касается лечения, то в этом консенсусе показаны 2 линии эрадикационной терапии: первая — ингибитор протонной помпы, кларитромицин, амоксициллин или метронидазол; вторая — ингибитор протонной помпы, висмут, метронидазол, тетрациклин [2].
В третьем Маастрихтском консенсусе (2005) продолжена та же диагностическая и лечебная стратегия, что и в Маастрихте-2. Показана необходимость эрадикационной терапии при наличии инфекции у больных с железодефицитной анемией и идиопатической тромбоцитопенической пурпурой. Определена полезность эрадикации H. pylori при гастроэзофагеальной рефлюксной болезни и НПВП-гастропатиях. Но главное, что было обозначено в Маастрихте-3, — это вопрос канцеропревенции: было показано, что эрадикация H. pylori способствует уменьшению риска развития рака желудка [3].
В 2010 г. был обсужден и принят четвертый Маастрихтский консенсус. В нем с учетом новых данных продолжено рассмотрение вопросов, касающихся показаний к эрадикационной терапии, диагностики и лечения хеликобактерной инфекции, важности антихеликобактерной терапии в профилактике рака желудка. В Маастрихте-4 было обращено особое внимание на увеличивающуюся резистентность H. pylori к кларитромицину и впервые разделены подходы к лечению в разных регионах в зависимости от степени резистентности к кларитромицину [4]. Начиная с четвертого консенсуса данный документ обозначается как Маастрихт/Флоренция.
Проанализировав положения этих 4 консенсусов, можно проследить, как исторически дополнялись и менялись подходы к вопросам, связанным с H. pylori-инфекцией.
В октябре 2016 г. в журнале «Gut» был опубликован новый Маастрихтский консенсус — пятый (Management of Helicobacter pylori infection — the Maastricht V/Florence Consensus Report) [5]. Что нового в этом документе? На какие аспекты следует обратить внимание практическим врачам?
В Маастрихтском консенсусе-5 содержатся 5 разделов, соответствующих 5 рабочим группам, их разрабатывавшим: 1) показания, ассоциации; 2) диагностика; 3) лечение; 4) профилактика; 5) взаимосвязь с желудочной микробиотой.
Первое утверждение консенсуса указывает, что хеликобактерный гастрит — это инфекционное заболевание независимо от наличия симптомов и осложнений. Таким образом, здесь подтверждены положения, высказанные в недавнем Киотском консенсусе (2015) [6]. H. pylori вызывает хронический активный гастрит у всех инфицированных пациентов. В дальнейшем он потенциально может привести к язвенной болезни, атрофическому гастриту, раку желудка и MALT-лимфоме. Успешная эрадикация H. pylori препятствует прогрессированию или рецидивированию заболеваний.
По-прежнему в консенсусе рекомендуется стратегия test-and-treat (определение H. pylori и лечение) при неисследованной диспепсии у молодых пациентов [7]. Однако в случае симптомов тревоги (потеря массы тела, дисфагия, кровотечение, анемия, пальпируемое образование и другие) обязательным является проведение эндоскопии. Эндоскопическое обследование необходимо при высоком риске рака желудка, а также у пациентов старшего возраста [8].
В Маастрихте-5 обсуждается взаимосвязь между H. pylori-инфекцией и желудочной секрецией. При неатрофическом антральном гастрите может отмечаться повышение желудочной кислотности вследствие увеличения уровня гастрина и снижения соматостатина. Результатом этого может быть развитие дуоденальной язвы и неязвенной диспепсии у этих пациентов. При атрофическом гастрите антрального отдела и тела желудка чаще имеет место сниженная кислотная продукция. В этом случае более часто могут развиваться язвы желудка и предраковые изменения в желудке, повышается риск развития рака желудка. Таким образом, H. pylori может разнопланово влиять на кислотность желудка в зависимости от преимущественной локализации бактерии [9]. Успешное устранение H. pylori способно вызвать полный или частичный регресс нарушений кислотности (гиперацидности и гипоацидности) [10].
Давно известно, что применение ингибиторов протонной помпы у больных с H. рylori-инфекцией, локализованной в антральном отделе, способно вызывать транслокацию хеликобактерий из антрума в тело желудка, превращая антральный гастрит в пангастрит преимущественно тела желудка, что также имеет влияние на уровень желудочной кислотности [11]. Этот вопрос актуально звучит в отношении пациентов с гастроэзофагеальной рефлюксной болезнью. Несмотря на имеющиеся данные об обратной зависимости между H. pylori-инфекцией и гастроэзофагеальной рефлюксной болезнью, доказано, что успешная эрадикация H. pylori не вызывает ни развития, ни ухудшения течения гастроэзофагеальной рефлюксной болезни [12, 13]. Соответственно, эрадикация H. pylori может назначаться без ограничений у пациентов с гастроэзофагеальной рефлюксной болезнью, особенно в аспекте необходимости длительного применения ингибитора протонной помпы у данной категории больных.
В нынешнем руководстве продолжается рассмотрение вопроса взаимоотношений между хеликобактерным гастритом и функциональной диспепсией. Сделано заключение, что H. pylori-индуцированный гастрит — отдельный диагноз (это соответствует положениям недавнего Киотского консенсуса) и может вызывать симптомы диспепсии у части пациентов. Эрадикация H. pylori способна уменьшить проявления диспепсии, однако в исследованиях это улучшение отмечается лишь на 10 % чаще в сравнении с плацебо или антисекреторной терапией [14]. Хеликобактерный гастрит является органическим заболеванием в отличие от функциональной диспепсии, которая является функциональным заболеванием. В Маастрихтском консенсусе-5 указывается, что диагноз истинной функциональной диспепсии должен устанавливаться только в отсутствие H. рylori-инфекции или после успешной эрадикации.
Обсуждается также вопрос взаимосвязи между H. рylori-инфекцией и приемом нестероидных противовоспалительных препаратов (НПВП), аспирина, других антиагрегантов и антикоагулянтов. Считается, что H. pylori, НПВП, аспирин являются независимыми факторами риска развития пептической язвы и ее осложнений [15]. Однако рассматривается и обсуждается также возможность аддитивного (взаимодополняющего) действия H. pylori и НПВП на риск развития язв и кровотечений [16]. Авторы консенсуса рекомендуют тестировать на H. рylori-инфекцию пациентов, принимающих НПВП и аспирин, с наличием в анамнезе пептической язвы, а также обязательно рекомендовать им прием ингибиторов протонной помпы и при выявлении бактерии — антихеликобактерную терапию.
Известно, что существует доказанная взаимосвязь между H. рylori-инфекцией, железодефицитной анемией, идиопатической тромбоцитопенической пурпурой и витамин В12-дефицитной анемией [17–19]. В консенсусе подтверждается необходимость тестирования на H. pylori у этой категории пациентов, и в случае обнаружения этой инфекции — необходимость эрадикации H. pylori.
Еще более важной является индикация H. pylori у пациентов с MALT-лимфомой. Как известно, есть четко доказанная связь между H. pylori и этой злокачественной опухолью. При обнаружении MALT-лимфомы на ранней стадии эрадикация H. pylori может излечить ее у 60–80 % пациентов [20]. Поэтому при ранней, локализованной стадии MALT-лимфомы эрадикация H. pylori является терапией первой линии. В других случаях MALT-лимфомы требуется альтернативная терапия (химиотерапия или лучевая терапия). В любом случае пациенты с данной патологией должны быть под тщательным наблюдением, в том числе и после успешного лечения, так как имеют повышенный риск развития аденокарциномы желудка и предраковых изменений желудка [21].
Рассматривается также возможная связь (положительная и отрицательная) между H. рylori-инфекцией и нежелудочной патологией: атеросклерозом, болезнью Альцгеймера, болезнью Паркинсона, инсультом, бронхиальной астмой, ожирением и другими [22–24]. Однако современные данные являются недостаточными, чтобы уверенно говорить об этой взаимосвязи.
В отношении диагностики H. рylori-инфекции Маастрихтский консенсус-5 указывает, что 13С-уреазный дыхательный тест является наиболее исследованным и рекомендуемым тестом в контексте стратегии test and treat [25]. Также высокочувствительным и специфичным тестом является определение антигена H. pylori в кале [26]. Что касается серологических тестов, рекомендуется использовать только тесты, проверенные в данном географическом регионе, так как в разных географических областях они могут действовать по-разному. Маастрихтский консенсус не рекомендует использовать быстрые (офисные) серологические тесты в рутинной практике из-за их невысокой чувствительности и специфичности [27].
Маастрихтский консенсус-5 поднимает важный вопрос: во время лечения ингибиторами протонной помпы, антибиотиками и препаратами висмута при выполнении 13С-уреазного дыхательного теста, стул-теста, быстрого уреазного теста возможно получение ложноотрицательных результатов. Это связано со снижением уреазной активности хеликобактерий при использовании данных препаратов. Это не касается применения Н2-блокаторов и антацидов. Возникает вопрос, который часто задают практические врачи: сколько времени должно пройти после использования препаратов, влияющих на уреазную активность H. pylori, чтобы можно было точно диагностировать H. pylori-инфекцию? В Маастрихте-5 даются четкие ответы на эти вопросы. В отношении ингибиторов протонной помпы рекомендуемое время проведения данных тестов после окончания лечения должно составлять 14 дней, хотя указывается, что в отдельных случаях достаточным является и 7-дневный срок [28]. Что касается антибиотиков и препаратов висмута, то необходимо 4 недели после окончания лечения данными препаратами для точной индикации H. рylori-инфекции.
В случае необходимости эндоскопии в диагностике пациентов методом выбора является быстрый уреазный тест, который имеет 90% чувствительность и 95–100% специфичность. Ложноположительным данный тест бывает редко. Ложноотрицательным — при недавних кровотечениях, сопутствующем лечении ингибиторами протонной помпы, антибиотиками, препаратами висмута, при наличии выраженной атрофии и кишечной метаплазии. То есть отрицательный результат на H. pylori при быстром уреазном тесте не исключает полностью отсутствие хеликобактерий, положительный тест указывает на наличие H. pylori. Для большей точности данной методики рекомендуется взятие биопсии не только из антрального отдела, но и из тела или дна желудка. Быстрый уреазный тест обычно не используется для проверки эффективности эрадикации.
Гистологическое исследование биоптатов позволяет диагностировать не только H. рylori-инфекцию, но также и морфологические изменения слизистой оболочки желудка (в частности, атрофию и кишечную метаплазию). Маастрихтский консенсус рекомендует с этой целью брать два биоптата из середины антрального отдела (малая и большая кривизна) и два биоптата из середины тела желудка (малая и большая кривизна), при необходимости также берется дополнительный биоптат из угла желудка. В случае язв и других подозрительных очаговых изменений обязательно нужно проводить дополнительные биопсии. Использование более со–временных эндоскопических методик (NBI, BLI) с увеличением изображения дает возможность улучшения диагностики заболевания [29]. Обычно для идентификации H. pylori в биоптате используют традиционные гистохимические способы (например, окраска гематоксилин-эозином). В сложных диагностических случаях применяются иммуногистохимические способы оценки, которые являются более точными, но и более дорогими.
В случае сложности с подбором эффективной антихеликобактерной терапии используются методы получения культуры и тест антимикробной чувствительности.
Серологические тесты (определение антител к H. pylori в сыворотке крови) применяются как неинвазивная диагностика у части пациентов. В некоторых клинических ситуациях диагностика другими (обычно более информативными) методиками имеет низкую чувствительность из-за невысокого содержания H. pylori в желудке, и лишь серологическая диагностика способна выявить H. pylori. К таким ситуациям относятся желудочно-кишечные кровотечения, атрофический гастрит, MALT-лимфома, рак желудка. Однако важно помнить, что серологическая диагностика выявляет не только настоящую, но и прошлую (успешно вылеченную) инфекцию, поэтому серологический тест не должен применяться для диагностики эффективности эрадикации. Как уже было сказано, лучше использовать серологические тесты, проверенные в данном географическом регионе. Для определения антител используется лишь кровь пациента, не должны для этого применяться слюна или моча пациента.
Для неинвазивной оценки состояния слизистой оболочки желудка (атрофическая или неатрофическая) у части больных может быть использована панель серологических тестов (GastroPanel), которая включает определение пепсиногенов (Pg) І и ІІ, гастрина-17 (G-17) и антител к H. pylori [31].
Для оценки эффективности эрадикационной терапии наиболее информативными являются неинвазивные 13С-уреазный дыхательный тест и определение антигена H. pylori в кале. С этой целью они должны быть проведены как минимум через 4–8 недель после окончания эрадикационной терапии. Необходимо следить, чтобы пациент в это время не принимал препараты, которые могут повлиять на точность диагностики H. pylori (ингибиторы протонной помпы, антибиотики, препараты висмута).
Третий и самый большой раздел Маастрихтского консенсуса рассматривает вопросы лечения хеликобактерной инфекции.
Как известно, на эффективность эрадикации H. pylori влияют различные факторы: комплайенс пациента, повышенная кислотность желудка, высокая обсемененность слизистой хеликобактериями, характеристика штаммов H. pylori, резистентность к антибиотикам. Безусловно, самым важным фактором является резистентность H. pylori к антибиотикам. Общей тенденцией, наблюдаемой сейчас в большинстве стран, является то, что постепенно растет резистентность H. pylori к ключевым антибиотикам и, соответственно, снижается эффективность эрадикационных схем [31].
В прогнозировании эффективности антихеликобактерной терапии у конкретного пациента нужно учитывать, с одной стороны, ситуацию с резистентностью в данном географическом регионе, с другой — анамнез использования ранее антибиотиков. В случае если пациент в недавнем прошлом принимал данный антибиотик для лечения какого-нибудь заболевания, существует риск резистентности H. pylori у данного пациента к данному антибиотику. Все это касается кларитромицина, метронидазола, левофлоксацина и не имеет отношения к амоксициллину и тетрациклину.
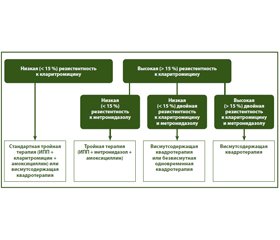
Особенно актуальной является увеличивающаяся во многих странах резистентность к кларитромицину. Маастрихтский консенсус рекомендует не использовать тройную схему с кларитромицином в географических регионах с известной повышенной (> 15 %) резистентностью к кларитромицину без тестов на чувствительность к антибиотику. Важной также является повышенная резистентность к метронидазолу. И особенно сложной является ситуация, если в регионе наблюдается двойная резистентность к антибиотикам (> 15 % — к кларитромицину и > 15 % — к метронидазолу). Как же быть с выбором эрадикационной терапии в подобных ситуациях (рис. 1)?
/61.jpg)
При высокой двойной резистентности к кларитромицину и метронидазолу Маастрихтский консенсус рекомендует использовать висмутсодержащую квадротерапию. При высокой к кларитромицину и низкой двойной резистентности к кларитромицину и метронидазолу рекомендуется применение висмутсодержащей квадротерапии или безвисмутной квадротерапии. В случае если имеются повышенная резистентность к кларитромицину и низкая резистентность к метронидазолу (такая ситуация наблюдается, например, в Китае), рекомендуется применение тройной терапии: ингибитор протонной помпы + амоксициллин + метронидазол. При недоступности препаратов висмута рассматривается возможность использования других средств (левофлоксацин, рифабутин), а также комбинации «ингибитор протонной помпы + амоксициллин в высокой дозе» [32]. При недоступности тетрациклина он в висмутсодержащей квадросхеме может заменяться на амоксициллин или фуразолидон. В некоторых исследованиях также использовалось добавление висмута к тройной схеме (ингибитор протонной помпы + амоксициллин + кларитромицин или левофлоксацин) [33]. При проведении висмутсодержащей квадротерапии отмечается меньше сложностей, связанных с резистентностью: устойчивость к тетрациклину очень низкая и не повышается даже после неудачной терапии, резистентность к метронидазолу не уменьшает эффективность висмутсодержащей квадротерапии [34].
Если говорить о безвисмутной терапии, то, как известно, существует 4 варианта терапии: тройная (ингибитор протонной помпы + 2 антибиотика), последовательная (сначала ингибитор протонной помпы + 1 антибиотик, далее этот антибиотик меняется на 2 других), гибридная (ингибитор протонной помпы + 1 антибиотик, далее он не убирается, а к нему добавляются 2 других антибиотика), одновременная (ингибитор протонной помпы + 3 антибиотика: кларитромицин + амоксициллин + метронидазол). Любой из этих 4 вариантов дает высокую эффективность эрадикации, если H. pylori чувствительна к применяемым антибиотикам. Однако, когда наблюдается резистентность H. pylori к антибиотикам, возникают трудности с эффективной эрадикацией. В различных исследованиях было отмечено, что резистентность к кларитромицину уменьшает эффективность тройной и последовательной схем, метронидазолу — уменьшает эффективность последовательной терапии, кларитромицину и метронидазолу (двойная) — снижает эффективность последовательной, гибридной и одновременной терапии. Какой вариант все же выбрать?
Как уже было сказано, при высокой резистентности к антибиотикам эффективность тройной терапии снижается. Последовательная терапия уступает по эффективности одновременной, кроме того, замена антибиотиков по ходу лечения может запутывать некоторых пациентов. Данных по гибридной терапии очень мало. И на сегодняшний день Маастрихт-5 рекомендует среди безвисмутных схем именно одновременную квадротерапию как наиболее предпочтительную в плане преодоления резистентности.
В регионах, где сохраняется низкая резистентность к кларитромицину, терапией первой линии продолжает оставаться традиционная тройная терапия: ингибитор протонной помпы + кларитромицин + амоксициллин или метронидазол. Альтернативной терапией первой линии является висмутсодержащая квадротерапия. Таким образом, в регионах с низкой резистентностью к кларитромицину антихеликобактерная терапия не претерпела изменений по сравнению с положениями прошлых Маастрихтских консенсусов.
Очень важным элементом эрадикационной терапии является эффективная кислотосупрессия. При повышении рН хеликобактерии становятся чувствительными к антибиотикам (кларитромицину и амоксициллину). Поэтому применение ингибиторов протонной помпы является обязательным в антихеликобактерной терапии, причем, как отмечено в консенсусе, они должны назначаться обязательно дважды в день. В консенсусе также обращается внимание на то, что эффективность более старых ингибиторов протонной помпы (омепразол и лансопразол) может быть ниже из-за полиморфизма цитохрома 2С19. Поэтому предпочтение отдается более новым ингибиторам протонной помпы: рабепразолу и эзомепразолу, причем для эрадикационной терапии рекомендуются высокие дозы препаратов (например, рассмотрен эзомепразол 40 мг 2 раза в сутки) [35].
Следующий вопрос, который поднимался в консенсусе: какова же оптимальная длительность эрадикационной терапии? Для висмутсодержащей квадротерапии в различных исследованиях были получены различные результаты: в одних — 14-дневная терапия не имела преимуществ перед 10-дневной, в других — 14-дневная терапия была эффективней. Рекомендации консенсуса по этому поводу следующие: висмутсодержащая терапия должна назначаться не менее чем на 10 дней, но при высокой резистентности к метронидазолу она должна быть назначена на 14 дней. Считается, что за 2 недели лечения метронидазол может преодолеть резистентность H. pylori к нему. Подобный подход рассматривается и в отношении длительности безвисмутной одновременной терапии. По рекомендации консенсуса, эта терапия должна быть назначена на 14 дней, за исключением ситуаций, когда 10-дневная терапия доказала свою эффективность на локальном уровне. Аналогичная рекомендация для тройной терапии (в странах с низкой резистентностью к кларитромицину): длительность терапии должна быть продлена до 14 дней, если эффективность 10-дневной терапии не была подтверждена локально. В отношении более длительного (14 дней) использования кларитромицина предлагается учитывать кардиологические аспекты. В любом случае вопрос длительности терапии должен решаться врачом в каждой конкретной ситуации на основании анализа различных факторов.
Значительная часть Маастрихтского консенсуса-5 посвящена рассмотрению такого вопроса: а что делать, если неэффективна та или иная схема терапии (рис. 2)?
В случае неэффективности висмутсодержащей квадротерапии рекомендовано использовать тройную или четвертную терапию с левофлоксацином. При известной резистентности к этому антибиотику рассматривается комбинация висмута с рифабутином и другими антибиотиками.
В случае неэффективности традиционной тройной терапии с кларитромицином терапией второй линии рекомендуется либо висмутсодержащая квадротерапия, либо тройная терапия (ингибитор протонной помпы + амоксициллин + левофлоксацин). Эффективность этих схем практически одинакова (76–78 %), однако нужно учитывать возможную левофлоксациновую резистентность. Еще одним вариантом эффективной терапии второй линии в этом случае является 14-дневная квадротерапия: ингибитор протонной помпы + висмут + левофлоксацин + амоксициллин. В отдельных исследованиях была показана эффективность тройной терапии: ингибитор протонной помпы + амоксициллин + метронидазол.
В случае неэффективности безвисмутной одновременной квадротерапии рекомендованными вариантами терапии второй линии являются висмутсодержащая квадротерапия (ингибитор протонной помпы + висмут + тетрациклин + метронидазол) или тройная/четвертная терапия с использованием левофлоксацина. Необходимо учитывать возможную резистентность к фторхинолонам, однако добавление висмута к ингибитору протонной помпы, левофлоксацину, амоксициллину позволяет достичь высоких цифр частоты эрадикации H. pylori.
В случае неэффективности терапии первой (тройная с кларитромицином) и второй линии (висмутсодержащая квадротерапия) рекомендуется терапия, включающая левофлоксацин (при отсутствии резистентности к фторхинолонам).
В случае неэффективности терапии первой (тройная или четвертная с кларитромицином) и второй линии (включающая левофлоксацин) рекомендуется висмутсодержащая квадротерапия.
В случае неэффективности терапии первой (висмутсодержащая квадротерапия) и второй линии (содержащая левофлоксацин) рекомендуется тройная или четвертная терапия с кларитромицином. Как альтернатива рассматривается комбинация, включающая висмут и два антибиотика, которые ранее не были использованы в терапии.
В случае неэффективности терапии второй линии Маастрихт-5 рекомендует терапию, основанную на определении чувствительности к антибиотикам.
При наличии у пациентов аллергии к пенициллинам рекомендуется терапия без амоксициллина: ингибитор протонной помпы + кларитромицин + метронидазол. При неэффективности этой терапии или в случае высокой резистентности к кларитромицину рекомендуется традиционная висмутсодержащая квадротерапия [36]. У части пациентов в качестве терапии второй линии в таких ситуациях могут рассматриваться схемы с левофлоксацином.
Большой раздел Маастрихтского консенсуса посвящен вопросам профилактики рака желудка. В консенсусе четко указывается, что H. pylori — это главный этиологический фактор рака желудка. Считается, что 90 % случаев развития рака желудка связаны с хеликобактерной инфекцией. Доказана взаимосвязь H. рylori-инфекции с раком желудка как интестинального, так и диффузного типа. Ранее H. pylori связывали с дистальным (некардиальным) раком желудка. В настоящее время считают, что существует связь между H. рylori-инфекцией и проксимальным раком желудка [37].
Успешная эрадикация H. pylori способна уменьшить риск развития рака желудка, что доказано в больших международных исследованиях. По средним оценкам, риск развития рака желудка после успешной эрадикации уменьшается на 34 % [38].
H. pylori считается канцерогеном первой группы, вызывающим развитие рака желудка [39]. Однако отмечают возможность влияния и других факторов (курение, избыточное потребление соли и других) на его развитие. В настоящее время роль дополнительных факторов изучается.
Как известно, процесс прогрессирования в сторону развития рака желудка является многошаговым в рамках каскада Корреа. В слизистой желудка происходят следующие этапы: острый гастрит — хронический гастрит — атрофия — кишечная метаплазия — дисплазия — аденокарцинома. Успешная эрадикация H. pylori способна предотвращать развитие предраковых изменений в желудке. После эрадикации в ближайшее время уменьшается активность воспаления в желудке (это подтверждается при морфологическом исследовании как в антральном отделе, так и в теле желудка, а также снижением пепсиногена ІІ). В результате предотвращается прогрессирование процесса в сторону предраковых изменений слизистой желудка. При наличии у пациента атрофических изменений эрадикация H. pylori приводит к восстановлению желез желудка и, соответственно, уменьшению атрофических изменений. Несколько метаанализов показали, что степень атрофии как в антруме, так и в теле желудка уменьшается, то есть происходит обратное развитие атрофии после эрадикации [40]. Обратного развития кишечной метаплазии после эрадикации обычно не происходит, однако у небольшой части пациентов прогрессирование кишечной метаплазии приостанавливается.
В настоящее время точно не установлено, на каком этапе или при какой степени выраженности предраковых изменений проведенная эрадикация будет успешной в плане предотвращения прогрессирования в сторону рака желудка. Однако отмечается, что наиболее эффективным является проведение эрадикации до развития предраковых изменений (атрофии и кишечной метаплазии). Безусловно, эрадикация H. pylori обязательна и при наступлении предраковых изменений.
Учитывая вышесказанное, можно сделать вывод, что у пациентов и в сообществах с повышенным риском рака желудка рекомендуется стратегия screen and treat, в том числе с применением эндоскопической диагностики, с целью выявления H. pylori-инфекции и предраковых изменений слизистой желудка. Повышенный риск рака желудка имеют пациенты с так называемым фенотипом рака желудка — наличие гастрита тела желудка, атрофии и кишечной метаплазии, гипохлоргидрии, хеликобактерной инфекции в прошлом или в настоящее время. Пациенты с такими заболеваниями должны выявляться и лечиться. Пациенты с атрофией и кишечной метаплазией должны быть подвержены эндоскопическому и морфологическому наблюдению, в том числе с учетом критериев классификации OLGA/OLGIM [41]. В консенсусе поднимается вопрос широкого привлечения общественности и улучшения информированности населения относительно факторов риска развития рака желудка и способов скрининга заболевания.
В то же время авторы консенсуса обращают внимание на то, что массовое применение эрадикационной терапии с использованием антибиотиков широкого спектра действия (амоксициллин, кларитромицин, левофлоксацин) может вызывать сложности в виде повышения устойчивости к указанным антибиотикам микроорганизмов, способствующих появлению других нежелудочных инфекций, в том числе и жизнеугрожающих. Исходя из этого, обращается внимание специалистов на другие эффективные антихеликобактерные средства, которые не имеют такого важного значения (препараты висмута, тетрациклин, метронидазол). Наилучшим способом массовой профилактики могла бы быть вакцина против H. pylori, работа над которой продолжается.
Пятый раздел пятого Маастрихтского консенсуса посвящен желудочной микробиоте. Использование новых современных молекулярных способов оценки микробной флоры (в первую очередь 16S rДНК последовательный анализ) показало, что помимо самой известной H. pylori в желудке обитает значительное количество другой микрофлоры разных классов, причем состав этой флоры значительно отличается от микрофлоры ротовой полости и глотки, что указывает на желудок как на место ее обитания, а не на ее транслокацию из других частей организма [42]. Однако полное представление о желудочной флоре на данный момент отсутствует, так же как и о взаимоотношениях между H. pylori и другой желудочной флорой. Недавно появились данные о том, что наличие H. pylori, возможно, уменьшает разнообразие желудочной флоры, что показывает доминирование H. pylori над другой флорой.
Очень интересными являются данные, показывающие различие содержания желудочной флоры при различных состояниях в желудке. Так, состав флоры желудка при раке желудка отличается от состава при хроническом гастрите; при кишечной метаплазии отмечается определенный оверлеп флоры, характерной для хронического гастрита и рака желудка [43]. Наличие атрофических изменений, гипохлоргидрия позволяют усилить флору, рост которой был замедлен при низких рН, характерных для здорового желудка. Таким образом, эти данные свидетельствуют, что H. pylori является важнейшим, но, по-видимому, не единственным микробным триггером в развитии патологии желудка, другие микроорганизмы также могут участвовать в развитии осложнений H. pylori — индуцированного гастрита.
В настоящее время изучается возможная роль других хеликобактерий, помимо H. pylori, в генезе заболеваний желудка. Как известно, некоторые хеликобактерии имеют влияние на развитие энтеропатий и заболеваний печени (в частности, H. bilis и H. hepaticus связаны с развитием холангиокарциномы) [44].
Еще один вопрос, активно обсужденный в Маастрихтском консенсусе, — влияние антихеликобактерной терапии на нормальную кишечную флору. Безусловно, применение антибиотиков для лечения H. рylori-инфекции способно вызывать краткосрочные побочные эффекты, свойственные для антибиотиков. У пациентов с нестабильным кишечником антихеликобактерная терапия должна проводиться с осторожностью. Еще одним негативным моментом антихеликобактерной терапии является возможное развитие резистентности другой кишечной флоры к антибиотикам, присутствующим в эрадикационных схемах.
Возможное негативное действие антибиотиков при эрадикации может быть уменьшено использованием пробиотиков [45]. Маастрихтский консенсус призывает использовать с этой целью те пробиотики, которые доказали свою эффективность в данном вопросе в клинических исследованиях (Lactobacillus, Saccharomyces boulardii, Bacillus clausii). Важным является достаточная длительность пробиотической терапии, которая должна превышать 2 недели [46]. Некоторые пробиотики (Lactobacillus, Bifidobacterium, Saccharomyces boulardii) способны также повышать эффективность эрадикационной терапии, что было показано в исследованиях (возможно, в большей степени за счет уменьшения побочных эффектов антибиотиков, чем за счет прямого антихеликобактерного действия) [47]. Требуются дальнейшие исследования по изучению прямого действия пробиотиков на хеликобактерную инфекцию. На сегодняшний день продолжаются исследования по поводу применения пробиотиков при антихеликобактерной терапии, которые смогут дать четкие рекомендации в отношении пробиотиков в дальнейшем (состав, дозы, длительность и др.).
Подытоживая основные положения Маастрихтского консенсуса, следует обозначить, что хеликобактерный гастрит рассматривается как инфекционное заболевание и подтверждается его тесная взаимосвязь с рядом заболеваний гастродуоденальной зоны. Методы диагностики H. pylori не претерпели существенных изменений: по-прежнему применяются 13С-уреазный дыхательный тест, определение антигена H. pylori в кале, быстрый уреазный тест и морфологический метод остаются приоритетными методами диагностики. Подтверждается важность своевременной диагностики и эрадикации H. pylori для профилактики развития предраковых изменений и рака желудка. Важными являются изучение другой хеликобактерной и нехеликобактерной флоры желудка в развитии его патологии, а также оценка роли пробиотиков в антихеликобактерной терапии.
Что касается лечения, остро стоит проблема, связанная с ростом резистентности отдельных антибиотиков (в первую очередь кларитромицина и метронидазола) и уменьшением эффективности традиционных схем лечения. Обращает на себя внимание повышенное значение терапии, содержащей висмут. Нынешняя антихеликобактерная терапия во многом разнится в зависимости от резистентности к H. pylori в данном географическом регионе.
В Украине данные о резистентности к кларитромицину и метронидазолу являются немногочисленными. Это связано с тем, что имеются объективные сложности с культивированием H. pylori и определением резистентности к H. pylori отдельных антибиотиков из-за особенностей данного микроорганизма. Необходимо учитывать, что по опыту многих исследований даже в пределах одной страны резистентность к данным антибиотикам может различаться в разных регионах. Вот почему очень важным является дальнейшее изучение данного вопроса в микробиологических и клинических исследованиях.
Таким образом, в недавно вышедшем пятом Маастрихтском консенсусе обозначено современное состояние вопроса по поводу хеликобактерной инфекции, даны четкие рекомендации практическим врачам и показаны направления будущих исследований по данной проблеме.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Current European concepts in the management of Helicobacter pylori infection. The Maastricht Consensus Report. European Helicobacter Pylori Study Group // Gut. — 1997. — Vol. 41(1). — P. 8-13.
2. Malfertheiner P. Current concepts in the management of Helicobacter pylori infection — the Maastricht 2-2000 Consensus Report / Malfertheiner P., Mégraud F., O’Morain C. et al. European Helicobacter Pylori Study Group // Aliment. Pharmacol. Ther. — 2002. — Vol. 16(2). — P. 167-80.
3. Malfertheiner P. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report / Malfertheiner P., Mégraud F., O’Morain C. et al. European Helicobacter Pylori Study Group // Gut. — 2007. — Vol. 56(6). — P. 772-81.
4. Malfertheiner P. Management of Helicobacter pylori infection — the Maastricht IV / Florence Consensus Report / Malfertheiner P., Mégraud F., O’Morain C. et al. European Helicobacter Pylori Study Group // Gut. — 2012. — Vol. 61(5). — P. 646-64.
5. Malfertheiner P. Management of Helicobacter pylori infection — the Maastricht V / Florence Consensus Report / Malfertheiner P., Mégraud F., O’Morain C. et al. European Helicobacter and Microbiota Study Group and Consensus panel // Gut. — 2017. — Vol. 66(1). — P. 6-30.
6. Sugano K. Kyoto global consensus report on Helicobacter pylori gastritis / Sugano K., Tack J., Kuipers E.J. et al. // Gut. — 2015. — Vol. 64(9). — P. 1353-67.
7. Helicobacter pylori “test and treat” or endoscopy for managing dyspepsia: an individual patient data meta-analysis / Ford A.C.,Qume M., Moayyedi P. et al. // Gastroenterology. — 2005. — Vol. 128. — P. 1838-44.
8. Niv Y. 13C-urea breath test for diagnosis of Helicobacter pylori infection in the elderly / Niv Y., Niv G., Koren R. // Dig. Dis. Sci. — 2004. — Vol. 49. — P. 1840-4.
9. Malfertheiner P. The intriguing relationship of Helicobacter pylori infection and acid secretion in peptic ulcer disease and gastric cancer / Malfertheiner P. // Dig. Dis — 2011. — Vol. 29. — P. 459-64.
10. Fukuchi T. Influence of cure of Helicobacter pylori infection on gastric acidity and gastroesophageal reflux: study by 24-h pH monitoring in patients with gastric or duodenal ulcer / Fukuchi T.,Ashida K., Yamashita H. et al. // J. Gastroenterol. — 2005. — Vol. 40. — P. 350-60.
11. Changes of gastric mucosal architecture during long-term omeprazole therapy: results of a randomized clinical trial / Lundell L.,Havu N., Miettinen P. et al. // Aliment. Pharmacol. Ther. — 2006. — Vol. 23. — P. 639-47.
12. Effects of Helicobacter pylori eradication on gastroesophageal reflux disease / Qian B., Ma S., Shang L. et al. // Helicobacter. — 2011. — Vol. 16. — P. 255-65.
13. Moayyedi P. Helicobacter pylori eradication does not exacerbate reflux symptoms in gastroesophageal reflux disease / Moayyedi P., Bardhan C., Young L. et al. // Gastroenterology. — 2001. — Vol. 121. — P. 1120-6.
14. Suzuki H. Helicobacter pylori infection in functional dyspepsia / Suzuki H., Moayyedi P. // Nat. Rev. Gastroenterol. Hepatol. — 2013. — Vol. 10. — P. 168-74.
15. Huang J.Q. Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic-ulcer disease: a meta-analysis / Huang J.Q., Sridhar S., Hunt R.H. // Lancet. — 2002. — Vol. 359. — P. 14-22.
16. Sostres C. Peptic ulcer bleeding risk. The role of Helicobacter pylori infection in NSAID/low-dose aspirin users / Sostres C., Carrera-Lasfuentes P., Benito R. et al. // Am. J. Gastroenterol. — 2015. — Vol. 110. — P. 684-9.
17. Qu X.-H. Does Helicobacter pylori infection play a role in iron deficiency anemia? A meta-analysis / Qu X.-H., Huang X.-L., Xiong P. et al. // World J. Gastroenterol. — 2010. — Vol. 16. — P. 886-96.
18. Provan D. International consensus report on the investigation and management of primary immune thrombocytopenia / Provan D., Stasi R., Newland A.C. et al. // Blood. — 2010. — Vol. 115. — P. 168-86.
19. Stabler S.P. Vitamin B12 deficiency / Stabler S.P. // N. Engl. J. Med. — 2013. — Vol. 368. — P. 2041-2.
20. Nakamura S. Long-term clinical outcome of gastric MALT lymphoma after eradication of Helicobacter pylori: a multicenter cohort follow-up study of 420 patients in Japan / Nakamura S., Sugiyama T., Matsumoto T. et al. // Gut. — 2012. — Vol. 61. — P. 507-13.
21. Capelle L.G. Gastric MALT lymphoma: epidemiology and high adenocarcinoma risk in a nation-wide study / Capelle L.G., de Vries A.C., Looman C.W.N. et al. // Eur. J. Cancer. — 2008. — Vol. 44. — P. 2470-6.
22. Bu X.L. A study on the association between infectious burden and Alzheimer’s disease / Bu X.L., Yao X.Q., Jiao S.S. et al. // Eur. J. Neurol. — 2015. — Vol. 22. — P. 1519-25.
23. Bu X.L. The association between infectious burden and Parkinson’s disease: a case-control study / Bu X.L., Wang X., Xiang Y. et al. // Parkinsonism Relat. Disord. — 2015. — Vol. 21. — P. 877-81.
24. Lane J.A. Randomised clinical trial: Helicobacter pylori eradication is associated with a significantly increased body mass index in a placebo-controlled study / Lane J.A., Murray L.J., Harvey I.M. et al. // Aliment. Pharmacol. Ther. — 2011. — Vol. 33. — P. 922-9.
25. Ferwana M. Accuracy of urea breath test in Helicobacter pylori infection: meta-analysis / Ferwana M., Abdulmajeed I., Alhajiahmed A. et al. // World J. Gastroenterol. — 2015. — Vol. 21. — P. 1305-14.
26. Gisbert J.P. Accuracy of monoclonal stool antigen test for the diagnosis of H. pylori infection: a systematic review and meta-analysis / Gisbert J.P., de la Morena F., Abraira V. // Am. J. Gastroenterol. — 2006. — Vol. 101. — P. 1921-30.
27. Duggan A.E. Testing for Helicobacter pylori infection: validation and diagnostic yield of a near patient test in primary care / Duggan A.E., Elliott C., Logan R.F. // BMJ. — 1999. — Vol. 319. — P. 1236-9.
28. Malfertheiner P. Diagnostic methods for H. pylori infection: choices, opportunities and pitfalls / Malfertheiner P. // United European Gastroenterol. J. — 2015. — Vol. 3. — P. 429-31.
29. Tongtawee T. Improved detection of Helicobacter pylori infection and premalignant gastric mucosa using “site specific biopsy”: a randomized control clinical trial / Tongtawee T., Dechsukhum C., Leeanansaksiri W. et al. // Asian Pac. J. Cancer Prev. — 2015. — Vol. 16. — P. 8487-90.
30. Dinis-Ribeiro M. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa / Dinis-Ribeiro M., Areia M., de Vries A.C. et al. // Endoscopy. — 2012. — Vol. 44. — P. 74-94.
31. Thung I. Review article: the global emergence of Helicobacter pylori antibiotic resistance / Thung I., Aramin H., Vavinskaya V. et al. // Aliment. Pharmacol. Ther. — 2016. — Vol. 43. — P. 514-33.
32. Ince A.T. Yields of dual therapy containing high-dose proton pump inhibitor in eradication of H. pylori positive dyspeptic patients / Ince A.T., Tozlu M., Baysal B. et al. // Hepatogastroenterology. — 2014. — Vol. 61. — P. 1454-8.
33. Srinarong C. Improved eradication rate of standard triple therapy by adding bismuth and probiotic supplement for Helicobacter pylori treatment in Thailand / Srinarong C., Siramolpiwat S.,Wongchaum A. et al. // Asian Pac. J. Cancer Prev. — 2014. — Vol. 15. — P. 9909-13.
34. O’Morain C. Efficacy and safety of single-triple capsules of bismuth biskalcitrate, metronidazole and tetracycline, given with omeprazole, for the eradication of Helicobacter pylori: an international multicentre study / O’Morain C., Borody T., Farley A. et al. // Aliment. Pharmacol. Ther. — 2003. — Vol. 17. — P. 415-20.
35. McNicholl A.G. Meta-analysis: esomeprazole or rabeprazole vs. first-generation pump inhibitors in the treatment of Helicobacter pylori infection / McNicholl A.G., Linares P.M., Nyssen O.P. et al. // Aliment. Pharmacol. Ther. — 2012. — Vol. 36. — P. 414-25.
36. Rodríguez-Torres M. High eradication rates of Helicobacter pylori infection with first- and second-line combination of esomeprazole, tetracycline, and metronidazole in patients allergic to penicillin / Rodríguez-Torres M., Salgado-Mercado R., Ríos-Bedoya C.F. et al. // Dig. Dis. Sci. — 2005. — Vol. 50. — P. 634-39.
37. Bornschein J. H. pylori infection is a key risk factor for proximal gastric cancer / Bornschein J., Selgrad M., Warnecke M. et al. // Dig. Dis. Sci. — 2010. — Vol. 55. — P. 3124-31.
38. Lee Y.C. Association between Helicobacter pylori eradication and gastric cancer incidence: a systematic review and meta-analysis / Lee Y.C., Chiang T.H., Chou C.K. et al. // Gastroenterology. — 2016. — Vol. 150. — P. 1113-1124.e5.
39. Bouvard V. A review of human carcinogens — part B: biological agents / Bouvard V., Baan R., Straif K. et al. // Lancet Oncol. — 2009. — Vol. 10. — P. 321-2.
40. Kong Y.J. Histological changes of gastric mucosa after Helicobacter pylori eradication: a systematic review and meta-analysis / Kong Y.J., Yi H.G., Dai J.C. et al. // World J. Gastroenterol. — 2014. — Vol. 20. — P. 5903-11.
41. Isajevs S. Gastritis staging: interobserver agreement by applying OLGA and OLGIM systems / Isajevs S., Liepniece-Karele I., Janciauskas D. et al. // Virchows Arch. — 2014. — Vol. 464. — P. 403-7.
42. Delgado S. Microbiological survey of the human gastric ecosystem using culturing and pyrosequencing methods / Delgado S., Cabrera-Rubio R., Mira A. et al. // Microb. Ecol. — 2013. — Vol. 65. — P. 763-72.
43. Eun C.S. Differences in gastric mucosal microbiota profiling in patients with chronic gastritis, intestinal metaplasia, and gastric cancer using pyrosequencing methods / Eun C.S., Kim B.K., Han D.S. et al. // Helicobacter. — 2014. — Vol. 19. — P. 407-16.
44. Segura-López F.K. Association between Helicobacter spp. infections and hepatobiliary malignancies: a review / Segura-López F.K., Güitrón-Cantú A., Torres J. // World J. Gastroenterol. — 2015. — Vol. 21. — P. 1414-23.
45. Zhang M.-M. Probiotics in Helicobacter pylori eradication therapy: a systematic review and meta-analysis / Zhang M.-M., Qian W., Qin Y.-Y. et al. // World J. Gastroenterol. — 2015. — Vol. 21. — P. 4345-57.
46. Lv Z. Efficacy and safety of probiotics as adjuvant agents for Helicobacter pylori infection: a meta-analysis / Lv Z., Wang B., Zhou X. et al. // Exp. Ther. Med. — 2015. — Vol. 9. — P. 707-16.
47. Szajewska H. Meta-analysis: the effects of Saccharomyces boulardii supplementation on Helicobacter pylori eradication rates and side effects during treatment / Szajewska H., Horvath A., Piwowarczyk A. // Aliment. Pharmacol. Ther. — 2010. — Vol. 32. — P. 1069-79.

/61.jpg)
/62.jpg)