Резюме
Актуальність. Проблема гострого ентероколіту є надзвичайно актуальною внаслідок їх значного поширення й порівняно низької ефективності етіотропного та патогенетичного лікування. Метою дослідження було вивчення таксономічного складу і популяційного рівня мікробіоти вмісту порожнини товстої кишки дітей, хворих на гострий ентероколіт, при природному вигодовуванні молоком, інфікованим Staphylococcus aureus, а також розкрити механізми колонізації досліджуваного біотопу мікроорганізмами. Матеріали та методи. Бактеріологічному й мікологічному дослідженню підлягав вміст порожнини товстої кишки 53 дітей віком від одного до шести місяців, хворих на ентероколіт, які перебували на грудному вигодовуванні інфікованим молоком, контрольну групу становили 35 зразків вмісту порожнини товстої кишки здорових дітей, також досліджувалось грудне молоко матерів-годувальниць обох груп. Результати. Дослідження грудного молока показали, що в 49 (92,45 %) пробах виділено та ідентифіковано Staphylococcus aureus, а в 4 (7,55 %) — Staphylococcus epidermidis (3,0–7,0 lg КУО/мл (М ± m = (4,37 ± 0,38) lg КУО/мл)). S.аureus та S.еpidermidis виділяли зі зразків випорожнень усіх хворих дітей у 2,92 раза частіше, ніж у практично здорових дітей. На фоні вигодовування дитини інфікованим молоком із досліджуваного біотопу елімінують еубактерії, пептокок, а E.coli Hly+, протеї, цитробактер і стафілококи контамінують порожнину товстої кишки. Популяційний рівень Bifidobacterium знижується на 43,03 % (на 3 порядки), Lactobacillus — на 32,24 % (на 2 порядки). Спостерігається заселення товстої кишки E.coli Hly+ у 16,48 %, протеями — у 22,53 %, цитробактерами — у 3,77 %, пептококами — у 15,09 %, пептострептококами — у 55,42 % і стафілококами — у 91,43 %. Висновки. Доведено, що сформований дисбактеріоз товстокишкового мікробіоценозу в дітей грудного віку, хворих на гострий ентероколіт, характеризується зменшенням кількості біфідобактерій і лактобактерій та зростанням кількості й значення в мікробіоценозі грамнегативних умовно-патогенних ентеробактерій, бактероїдів та грампозитивних умовно-патогенних бактерій роду Staphylococcus, Peptostreptococcus і Peptococcus.
Актуальность. Проблема острых энтероколитов является чрезвычайно актуальной из-за их широкого распространения и сравнительно низкой эффективности этиотропного и патогенетического лечения. Целью исследования было изучить таксономический состав и популяционный уровень микробиоты содержимого полости толстой кишки детей, больных острым энтероколитом, на фоне естественного вскармливания молоком, инфицированным Staphylococcus aureus, а также определить механизмы колонизации исследуемого биотопа микроорганизмами. Материалы и методы. Бактериологическому и микологическому исследованиям подлежало содержимое полости толстой кишки 53 детей в возрасте от одного до шести месяцев, больных колиэнтеритом, контрольную группу составили 35 образцов содержимого полости толстой кишки здоровых детей, также исследовалось грудное молоко кормящих матерей обеих групп. Результаты. Исследования грудного молока показали, что в 49 (92,45 %) пробах выделены и идентифицированы Staphylococcus aureus, а в 4 (7,55 %) — Staphylococcus epidermidis (3,0–7,0 lg КОЕ/мл (М ± m = 4,37 ± 0,38 lg КОЕ/мл)). S.аureus, S.еpidermidis выделяли из образцов испражнений у всех больных детей в 2,92 раза чаще, чем у практически здоровых детей. На фоне вскармливания инфицированым молоком из исследуемого биотопа элиминируют эубактерии, пептококки, а E.сoli Hly+, протеи, цитробактер и стафилококки контаминируют полость толстой кишки. Популяционный уровень Bifidobacterium снижается на 43,03 % (на 3 порядка), Lactobacillus — на 32,24 %, (на 2 порядка). Наблюдается заселение толстой кишки E.coli Hly + у 16,48 %, протеями — у 22,53 %, цитробактером — у 3,77 %, пептококками — у 15,09 %, пептострептококками — у 55,42 % и стафилококками — у 91,43 %. Выводы. Доказано, что сформированый дисбактериоз у детей грудного возраста, больных острым энтероколитом, характеризуется уменьшением количества в составе толстокишечного микробиоценоза бифидобактерий и лактобактерий и ростом количества и значения в микробиоценозе грамотрицательных условно-патогенных энтеробактерий, бактероидов и грамположительных условно-патогенных бактерий рода Staphylococcus, Peptostreptococcus и Peptococcus.
Background. Despite the significant progress made in the field of acute enterocolitis in children, many questions of etiology, pathogenesis, microecological relations, formation of intestinal dysbacteriosis/dysbiosis and taxonomic composition and population level of major, additional and accidental microbiota of intestinal microbiocenosis and other issues of enterocolitis require study, taking into account bacteriological and immunological researches of today. This is especially related to the children one to six months of age (who are breastfed) with enterocolitis. Normally, breast milk is sterile, but during the inflammatory process in breast, it can be infected, so the disease have a threat to a child fed with this milk, and there is a threat to the life of the mother. The first reaction to such feeding will be from a side of cavity microbiota of the colon that characterizes the relevance of study of the colon microbiota in infants suffering from enterocolitis. Materials and methods. Contents of colon cavity of 53 children one to six months of age with enterocolitis (control — 35 children), who were breastfed, and, in fact, breast milk, by which the children were fed, underwent bacteriological and mycological examination. Results. To reveal the mechanisms of contamination of the colon in children one to six months of age, in patients with acute enterocolitis there has been used ecological method that revealed the specific characteristics of coexistence of taxons in ecosystem “host-microbiota” and identified the direction of disorders of colon microecology on the background of acute enterocolitis in children, who were fed by breast milk infected with bacteria of the genus Staphylococcus. The results of bacteriological studies have shown that in 49 (92.45 %) patients Staphylococcus aureus was isolated and identified, and in 4 (7.55 %) women — Staphylococcus epidermidis. Population level of the selected strains was 3.0–7.0 lg CFU/ml (M ± m = (4.37 ± 0.38) lg CFU/ml). Breastfeeding with milk infected by Staphylococcus leads to a decrease of population of Bifidobacterium by 43.03 % (3 orders), Lactobacillus — by 32.24 % (2 orders). With the decline of population of Bifidobacteria and Lactobacilli in the intestinal microbiocenosis, the colonization resistance of intestinal mucosa becomes disturbed, which promotes colonization of the intestine, especially the colon, with opportunistic Enterobacteria — hemolytic Escherichia (E.coli Hly+) in 16.48 % of children with acute enterocolitis, Proteus — in 22.53 %, Citrobacter — in 3.77 %, Peptococci — in 15.09 %, Peptostreptococci — in 55.42 % and Staphylococcus — in 91.43 % of cases. In addition, in the colon of children with acute enterocolitis breastfed with the infected milk, there is an increase of population levels of Bacteroides by 32.59 % (2 orders). Furthermore, there is a growth in population levels of Peptostreptococci in the colon by 61.50 % (3 orders), and contamination with Peptococci ((9.13 ± 0.37) lg CFU/g). Reduced concentration of Bifidobacteria and Lactobacilli among other components of ecosystem also leads to an increase of the population level of E.coli by 19.07 % (2 orders) in the colon of children with enterocolitis. In the experimental group of children, Staphylococci were isolated from all sick children in concentration (6.16 ± 0.12) lg CFU/g that is 2.92 times higher than in healthy children fed naturally with uninfected milk. Thus, the growth of the population level of Staphylococci in the colon of infants suffering from enterocolitis may be linked, according to our point of view, on the one hand, with the constant contamination of the gastrointestinal tract due to breastfeeding to milk containing ((4.37 ± 0.38) lg CFU/g) Staphylococci, and, on the other hand, to the changes of colonization resistance of the colon mucosa as a result of decline in population level of the major part of the large intestine microbiota — bacteria of the genera Bifidobacterium and Lactobacillus. The obtained data shows that the acute enterocolitis in infants, who were breastfed with Staphylococci-positive milk, develops on the background of the prevailing dysbiosis in all children. In most affected, there was the second degree dysbiosis, and in 2 patients — the third degree. Conclusions. Breastfeeding with milk infected by Staphylococcus in children aged from one to six months leads to the formation of Staphylococcal dysbacteriosis of the first (up to 43.40 %), second (up to 52.83 %) and third (3.77 % of cases) stages, and on its background — enterocolitis due to the association of pathogenic (E.coli Hly+) and opportunistic Enterobacteriaceae (E.coli, Proteus, Citrobacter), Staphylococci (in population level (6.16 ± 0.12) lg CFU/g), Bacteroides, Peptococci, Peptostreptococci and other bacteria. Enterocolitis in infants breastfed with milk infected by Staphylococci (S.aureus, S.epidermidis) is an infectious process of mixed etiology, provocative factor of which is the association of opportunistic Gram-negative Enterobacteria, Bacteroides and Gram-positive Staphylococci, Peptostreptococci and Peptococci. Dysbacteriosis in infants suffering from acute enterocolitis is characterized by a reduction of a part of Bifidobacteria and Lactobacilli in intestininal microbiota and increasing number and value in microbiocenosis (by a rate of quantitative dominance and significance) of Gram-negative opportunistic Enterobacteriaceae, Bacteroides and Gram-positive opportunistic bacteria of the genera Staphylococcus, Peptostreptococcus and Peptococcus.
Вступ
Проблема гострих ентероколітів є надзвичайно актуальною через значне поширення й порівняно низьку ефективність етіотропного та патогенетичного лікування [1]. Останнє пов’язане більшою мірою зі своєрідною біологічною природою збудників, серед яких особливе місце належить групі ентеропатогенних кишкових паличок та іншим умовно-патогенним ентеробактеріям, що спричиняють ентероколіт у дітей грудного віку. Штами умовно-патогенних ентеробактерій, що викликають коліентерити, мають різні фактори патогенності, що обумовлює особливості клінічного перебігу ентероколітів. Виражений поліморфізм клінічної картини в дітей до одного року пов’язаний з епідеміологічною ситуацією, станом факторів і механізмів неспецифічного й специфічного імунного захисту організму хворого та способом вигодовування. Слід зауважити, що гнійно-запальні ускладнення, які провокуються ешерихіями при зростанні їх популяційного рівня в товстокишковому мікробіоценозі, вже протягом багатьох років є однією із найсерйозніших проблем інфекційної медицини.
Незважаючи на значний успіх, досягнутий у галузі лікування гострих ентероколітів у дітей, багато питань етіології, патогенезу, мікроекологічних відношень,
формування кишкового дисбактеріозу/дисбіозу та таксономічного складу й популяційного рівня головної, додаткової й випадкової мікробіоти товстокишкового мікробіоценозу та інші питання ентероколітів потребують досліджень з урахуванням рівня бактеріологічних та імунологічних досліджень на сучасному етапі [2]. Особливе місце в патогенезі ентероколітів посідає вигодовування дитини [3]. Відомо, що природне вигодовування є, безперечно, найкращим і сприяє фізіологічній еволюції нормальної мікробіоти шлунково-кишкового тракту дитини. Природне вигодовування сприяє формуванню облігатної автохтонної мікробіоти, що є ключовою в мікробіоценозі порожнини товстої кишки дітей до року [4]. Вона на фоні природного вигодовування виконує регуляторну функцію спільно із секреторним імуноглобуліном А (sIg A), що надходить із молоком; протидіє заселенню й підвищенню кількості умовно-патогенних і випадкових мікроорганізмів, інгібує надлишкове зростання популяції умовно-патогенних таксонів нормофлори, формує взаємовигідні відношення з макроорганізмом (хазяїном), активно бере участь у процесах ферментації, синтезу, детоксикації та імуностимуляції, тобто виконує провідні нормофізіологічні функції [5]. Грудне молоко здорової годувальниці стерильне, але при запальних процесах грудної залози воно може бути інфікованим, що становить загрозу здоров’ю матері, а також створює загрозу захворювання для дитини, яка вживає його [6, 7].
Мета дослідження — вивчити таксономічний склад і популяційний рівень мікробіоти вмісту порожнини товстої кишки дітей віком від одного до шести місяців, хворих на гострий ентероколіт, при природному вигодовуванні молоком, інфікованим Staphylococcus aureus, а також розкрити механізми колонізації досліджуваного біотопу мікроорганізмами.
Завдання — встановити ступінь дисбактеріозу (етіологію та провокативні чинники) у дітей віком від одного до шести місяців, хворих на гострий ентероколіт, які перебувають на природному вигодовуванні, при інфікуванні грудного молока стафілококом.
Матеріали та методи
Бактеріологічному й мікологічному обстеженню підлягав вміст порожнини товстої кишки 53 дітей віком від одного до шести місяців, хворих на ентероколіт. Дослідну групи формували на основі відбору пацієнтів з попереднім діагнозом «гострий ентероколіт», які перебували на природному вигодовуванні молоком, інфікованим Staphylococcus aureus, після проведення мікробіологічного дослідження за наявності відповідних змін у досліджуваному мікробіоценозі. Вміст порожнини товстої кишки забирали стерильним шпателем із серединних порцій, поміщали в стерильні флакони (~5 грам) і доставляли в мікробіологічну лабораторію не пізніше ніж через 2 год від часу відбору матеріалу [8]. Після приготування десятикратних розведень дослідного матеріалу проводили висіви на відповідні живильні середовища для виділення культур мікроорганізмів. Для росту й розмноження мікроорганізмів використовували оптимальні для кожного таксона мікроорганізмів живильні середовища та умови культивування посівів. Облігатні анаеробні бактерії вирощували в стаціонарному анаеростаті «СО2-incubator. T-125» фірми ASSAB Medсin (Швеція) протягом 5–7 днів, інколи до 14 діб. Факультативні анаеробні та аеробні мікроорганізми вирощували в термостаті протягом 1–2 діб.
Ідентифікацію одержаних чистих культур ентеробактерій (ешерихій, цитробактера, протеїв та інших ентеробактерій) проводили за методом W. Ewing, використовуючи 30 основних тестів, рекомендованих Міжнародним комітетом з ентеробактерій. В окремих випадках використовували тест-системи АРІ-20Е (Франція). Патогенні варіанти визначали за здатністю продукувати гемолізини на кров’яному МПА та на основі серологічної ідентифікації. Ідентифікацію чистих культур інших виділених штамів проводили за морфологічними, тинкторіальними, культуральними та біохімічними властивостями.
Для визначення популяційного рівня підраховували кількість однотипних колоній. Популяційний рівень таксонів виражали десятинними логарифмами (lg) колонієутворючих одиниць (КУО) — lg КУО/г.
Контрольну групу становили зразки вмісту порожнини товстої кишки 35 практично здорових дітей віком 1–6 місяців, які перебували на природному вигодовуванні й не хворіли на будь-які захворювання.
Інфікованість грудного молока визначали бактеріологічним методом, встановлювали вид мікроорганізму, проводили його біологічну ідентифікацію та визначали антибіотикочутливість штамів [9]. Молоко вважали контамінованим при виявленні мікроорганізмів у концентрації понад 3,0 lg КУО/мл. Визначений популяційний рівень мікроорганізму менше від 2,0 lg КУО/мл вважали забрудненим при заборі матеріалу, а молоко вважалось не інфікованим [10].
Для розкриття механізмів контамінації порожнини товстої кишки дітей віком від одного до шести місяців, хворих на гострий ентероколіт, був використаний екологічний метод, що дозволяє здійснити особливу характеристику співіснування таксонів екосистеми «макроорганізм (хазяїн) — мікробіота» і виявити спрямованість порушень мікроекології біотопу. Для характеристики різноманіття мікробіоценозу порожнини товстої кишки встановлювали індекси видового багатства за Маргалефом та видового різноманіття за Уїттекером. Це своєрідні рейтингові показники біотопу, що характеризують просторово-харчові ресурси та умови середовища для росту й розмноження мікроорганізмів. Ступінь видового домінування певних таксонів у мікробіоценозі порожнини товстої кишки встановлювали за індексом видового домінування таксона в угрупуванні за Сімпсоном та Бергером — Паркером. Провідні таксони мікробіоти порожнини товстої кишки визначали на підставі встановлення індексу постійності. Провідними (домінуючими) таксонами вважали мікроорганізми із значенням індексу постійності 50 % і вище, додатковими — від 25 до 50 %, випадковими — зі значенням показника нижче від 25 %.
Статистичне опрацювання одержаних цифрових результатів здійснювали з використанням універсальних статистичних програм Excel 5.0 для персонального комп’ютера з визначенням середньої величини (М), статистичних відхилень (± m), довірчого інтервалу. Для встановлення вірогідності різниці між групами (хворих дітей і практично здорових) застосовували коефіцієнт Стьюдента. Відмінність між групами вважали вірогідною при P < 0,05.
Результати та обговорення
Результати проведених бактеріологічних досліджень грудного молока показали, що в 49 (92,45 %) пробах виділено та ідентифіковано Staphylococcus aureus, а в 4 (7,55 %) — Staphylococcus epidermidis. Популяційний рівень виділених штамів становив 3,0–7,0 lg КУО/мл (М ± m = (4,37 ± 0,38) lg КУО/мл).
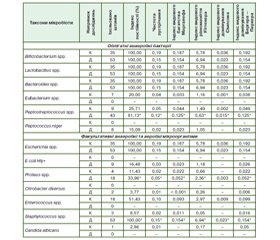
Перша реакція на вигодовування інфікованим молоком виникне з боку мікробіоти порожнини товстої кишки, що підтверджують результати дослідження таксономічного складу мікробіоти досліджуваного біотопу дітей віком 1–6 місяців, які перебували на природному вигодовуванні, хворих на гострий ентероколіт, а також мікроекологічні показники, що характеризують спрямованість дестабілізації мікроекології, наведені в табл. 1. Отже, таксономічний склад головної мікробіоти порожнини товстої кишки дітей, хворих на ентероколіт, відрізнявся незначно від такого практично здорових дітей того ж віку. Контамінація стафілококами, на нашу думку, очевидна при наявності в продуктах харчування (материнському молоці) S.аureus та S.еpidermidis. У хворих на гострий ентероколіт дітей елімінують із порожнини товстої кишки ентерококи, еубактерії, а стафілококи контамінують порожнину товстої кишки. Порушується таксономічний склад додаткової мікробіоти — елімінують із біотопу еубактерії, пептокок, а E.coli Hly+, протеї, цитробактер і стафілококи контамінують порожнину товстої кишки.
/44.jpg)
За індексом постійності, частотою зустрічання, індексом домінування таксонів головна (індигенна, автохтонна облігатна) мікробіота порожнини товстої кишки дітей, які перебували на природному вигодовуванні молоком, інфікованим стафілококами, віком 1–6 місяців, хворих на гострий ентероколіт, представлена анаеробними бактеріями роду Bifidobacterium, Lactobacillus, Bacteroides і Peptostreptococcus, а також факультативними анаеробними та аеробними бактеріями роду Escherichia, Staphylococcus, Enterococcus. Але для більш інформативної характеристики мікробіоти будь-якого біотопу необхідно було визначити популяційний рівень кожного таксона біотопу, а також його роль у мікроекологічних відношеннях мікробних угрупувань. Результати встановлення популяційного рівня кожного таксона головної, додаткової та випадкової мікробіоти вмісту порожнини товстої кишки дітей віком 1–6 місяців, хворих на гострий ентероколіт, на фоні природного вигодовування молоком, інфікованим стафілококом, наведені в табл. 2.
/45.jpg)
Бактерії роду Staphylococcus із випорожнень здорових дітей висіваються в концентрації не більше ніж 2–3 lg КУО/г при нормальному функціонуванні екосистеми «мікробіота — хазяїн» та не викликають в організмі розвитку патологічних процесів [11]. Розмноження ендогенних стафілококів або постійна контамінація ними шлунково-кишкового тракту можлива за умови зниження колонізаційної резистентності слизової оболонки кишечника. У дітей віком від одного до шести місяців, які перебували на природному вигодовуванні, молоко було інфіковане стафілококами (S.аureus, S.еpidermidis), із вмісту порожнини товстої кишки стафілококи ізолювали в усіх хворих дітей у концентраціях (6,16 ± 0,12) lg КУО/г, що у 2,92 раза вище від показника практично здорових дітей, які вигодовувались природним шляхом неінфікованим молоком. Отже, зростання популяційного рівня стафілококів у порожнині товстої кишки дітей раннього віку, хворих на ентероколіт, можна пов’язати, на нашу думку, з одного боку, з постійною контамінацією шлунково-кишкового тракту за рахунок природного вигодовування молоком, що містить стафілококи — (4,37 ± 0,38) lg КУО/г; а з іншого боку, зі змінами колонізаційної резистентності слизової оболонки товстої кишки в результаті зниження популяційного рівня найважливіших у складі товстокишкового мікробіоценозу бактерій родів Bifidobacterium та Lactobacillus.
Фізіологічна значимість біфідобактерій і лактобактерій для організму людини, особливо дітей грудного віку, та їх особливе значення у функціонуванні мікробної екологічної системи доведена численними дослідженнями. Природне вигодовування материнським молоком, інфікованим стафілококом, призводить і до зниження популяційного рівня найважливіших за представництвом у складі товстокишкового мікробіоценозу дітей грудного віку біфідобактерій і лактобактерій, яким властива мультифункціональна роль у підтриманні мікроекологічного гомеостазу в системі «макроорганізм — мікробіота». Популяційний рівень облігатних грампозитивних бактерій роду Bifidobacterium знижується на 43,03 % (на 3 порядки), Lactobacillus — на 32,24 % (на 2 порядки).
Зі зниженням популяційного рівня біфідобактерій і лактобактерій у кишковому мікробіоценозі порушується колонізаційна резистентність слизової оболонки кишечника, що сприяє заселенню кишечника, особливо товстої кишки, умовно-патогенними ентеробактеріями — гемолітичними ешерихіями (E.coli Hly+) у 16,48 % дітей, хворих на гострий ентероколіт, протеями — у 22,53 %, цитробактерами — у 3,77 %, а також пептококами — у 15,09 %, пептострептококами — у 55,42 % і стафілококами — у 91,43 %. Значення останнього показника зумовлене постійним надходженням стафілокока з молоком матері при природному вигодовуванні. Крім цього, у порожнині товстої кишки дітей, хворих на гострий ентероколіт, при природному вигодовуванні у випадку, коли молоко інфіковане стафілококом, зростає популяційний рівень бактероїдів на 32,59 % (на 2 порядки). Обговорюючи питання про значення підвищення концентрації бактероїдів у порожнині товстої кишки дітей, хворих на ентероколіт, слід врахувати, що бактероїди — це умовно-патогенні мікроорганізми і порушення фізіологічного балансу між основними компонентами (біфідобактеріями й лактобактеріями) мікробіоценозу може призводити до різних інфекційно-запальних ускладнень. Вони є потужним джерелом ліпополісахаридного ендотоксину, який є одним із факторів їх патогенності, що часто реалізується при транслокації мікробних клітин у кровотік та внутрішні органи. Ліпополісахариди бактероїдів є сильними ендотоксинами, що здатні призводити до некрозу тканин, внутрішньосудинного згортання крові, але дані ендотоксини також є сильним стимулятором локального імунітету. При збільшенні життєздатних клітин бактероїди часто є учасниками мікст-інфекцій, що відзначаються швидким розвитком ентероколіту.
У дітей, хворих на гострий ентероколіт, у порожнині товстої кишки підвищується популяційний рівень пептострептококів на 61,50 % (на 3 порядки) і відбувається контамінація біотопу пептококами, популяційний рівень яких досягає високих цифр — (9,13 ± 0,37) lg КУО/г. Підвищення концентрації пептококів і пептострептококів може призвести до розвитку інфекційно-запальних захворювань. Ці мікроорганізми належать до одних з найпоширеніших збудників анаеробних інфекцій.
Крім інших компонентів еконіші, зменшення концентрації біфідобактерій і лактобактерій також призводить до підвищення популяційного рівня в порожнині товстої кишки дітей, хворих на ентероколіт, кишкових паличок на 19,07 % (на 2 порядки), які можуть проявляти низку своїх патогенних властивостей — здатність мігрувати в мезентеріальні лімфатичні вузли та кров, що може супроводжуватися інфікуванням E.coli паренхіматозних органів (печінки, селезінки, мозку, нирок, легень) із розвитком численних екстраінтестинальних інфекцій. Це спостерігається при зниженні популяційного рівня біфідобактерій і лактобактерій та формуванні вторинного імунодефіцитного стану. У нормі біфідобактерії й лактобактерії при їх високих концентраціях контролюють популяційний рівень ешерихій. Зменшення популяційного рівня біфідобактерій і лактобактерій у дітей, хворих на ентероколіт, призводить до зростання в порожнині товстої кишки кількості грамнегативних паличок (бактероїдів, ешерихій та інших ентеробактерій) і стафілококів, що проявляють ознаки патогенності та мають природну резистентність щодо антибіотиків, можуть мігрувати із порожнини товстої кишки по всьому організму, поширюючись не тільки черезтканинним (per continuitatum), але й гематогенним і лімфогенним шляхами. Отже, вони стають причиною інфекційно-запальних процесів у різних органах і тканинах, особливо в дітей раннього віку з первинними й вторинними імунодефіциними станами.
Отже, у дітей віком від одного до шести місяців, хворих на ентероколіт, які перебували на природному вигодовуванні молоком, інфікованим стафілококами, формується дисбактеріоз за рахунок зниження концентрації в порожнині товстої кишки найважливіших у складі товстокишкового мікробіоценозу біфідобактерій і лактобактерій та підвищення популяційного рівня умовно-патогенних ентеробактерій, бактероїдів, пептострептококів, стафілококів і відбувається контамінація порожнини товстої кишки патогенними ешерихіями (E.coli Hly+) та умовно-патогенними ентеробактеріями (C.diversus, протеями тощо), пептококом, пептострептококами, при цьому з порожнини товстої кишки елімінують ентерококи та еубактерії. Перераховане вище засвідчує порушення таксономічного складу й популяційного рівня мікробіоти порожнини товстої кишки та формування дисбактеріозу.
У дослідної групи дітей, які ще не мають достатнього рівня імунокомпетентності на фоні порушення природного вигодовування (інфіковане молоко), дисбактеріози характеризуються змінами таксономічного складу й популяційного рівня автохтонних облігатних, факультативних та алохтонних представників мікробіоти порожнини товстої кишки. У цих дітей мікробіота порожнини товстої кишки характеризується зменшенням кількості біфідобактерій і лактобактерій та зростанням кількості бактерій, що проявляють ознаки патогенності й вірулентності. Одержані дані, наведені у табл. 3, показують, що в усіх дітей віком 1–6 місяців, які перебували на природному вигодовуванні інфікованим стафілококами молоком, розвивається гострий ентероколіт на фоні сформованого дисбактеріозу. У більшості хворих дітей формувався дисбактеріоз ІІ ступеня, а у 2 хворих дітей розвивався дисбактеріоз ІІІ ступеня.
/46.jpg)
Наукова новизна. Уперше встановлено екологічні показники мікробіоти вмісту порожнини товстої кишки дітей, хворих на гострий ентероколіт, при природному вигодовуванні молоком, інфікованим Staphylococcus aureus, а також розкрито механізми колонізації досліджуваного біотопу мікроорганізмами.
Практична значимість. Результати екологічного дослідження продемонстрували, що дисбактеріоз у дітей грудного віку, хворих на гострий ентероколіт, які перебувають на природному вигодовуванні молоком, інфікованим Staphylococcus aureus, характеризується зменшенням кількості у складі товстокишкового мікробіоценозу біфідобактерій і лактобактерій та зростанням кількості й значення в мікробіоценозі грамнегативних умовно-патогенних ентеробактерій, бактероїдів та грампозитивних умовно-патогенних бактерій роду Staphylococcus, Peptostreptococcus і Peptococcus, що дає можливість практичному лікарю ефективно проводити етіотропну терапію та корекцію змін біотопу пробіотичними засобами.
Висновки
1. Природне вигодовування дітей віком від одного до шести місяців при інфікуванні грудного молока стафілококом призводить до формування стафілококового дисбактеріозу першого (у 43,40 %), другого (у 52,83 %) і третього (3,77 % випадків) ступенів, і на його фоні розвивається ентероколіт, обумовлений асоціацією патогенних (E.coli Hly+) та умовно-патогенних ентеробактерій (E.coli, Proteus, Citrobacter), стафілококів (популяційний рівень (6,16 ± 0,12) lg КУО/г), бактероїдів, пептококів, пептострептококів та інших бактерій.
2. Ентероколіт у дітей віком від одного до шести місяців, які перебувають на природному вигодовуванні грудним молоком, інфікованим стафілококами (S.аureus, S.еpidermidis), є інфекційним процесом змішаної етіології, провокативним чинником якого є асоціації умовно-патогенних грамнегативних ентеробактерій, бактероїдів і грампозитивних стафілококів, пептострептококів і пептокока.
3. Сформований дисбактеріоз у дітей грудного віку, хворих на гострий ентероколіт, характеризується зменшенням кількості біфідобактерій і лактобактерій та зростанням кількості й значення в мікробіоценозі (за коефіцієнтом кількісного домінування й значущості) грамнегативних умовно-патогенних ентеробактерій, бактероїдів та грампозитивних умовно-патогенних бактерій роду Staphylococcus, Peptostreptococcus і Peptococcus.
Перспективи подальших досліджень. Одержані результати є підставою для встановлення таксономічного складу й популяційного рівня мікробіоти порожнини товстої кишки дітей, хворих на ентероколіт, які перебувають на повноцінному природному та штучному типах вигодовування.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Said M.B. Gut microbiota in preterm infants with gross blood in stools: A prospective, controlled study / M.B. Said, S. Hays, D. Maucort-Boulch et al. // Early Hum. Dev. — 2014. — Vol. 90, № 10. — P. 579-585.
2. González R. Breast milk and gut microbiota in African mothers and infants from an area of high HIV prevalence / R. González, A. Maldonado, V. Martín et al. // PLoS One. — 2013. — Vol. 8, № 11. — e80299.
3. Parm Ü. Gut colonization by aerobic microorganisms is associated with route an type of nutrition in premature neonates / Ü. Parm, T. Metsvaht, M.L. Ilmoja et al. // Nutr. Res. — 2015. — Vol. 35, № 6. — P. 496-503.
4. Tuzun F. Breast milk jaundice: effect of bacteria present in breast milk and infant feces / F. Tuzun, A. Kumral, N. Duman et al. // J. Pediatr. Gastroenterol. Nutr. — 2013. — Vol. 56, № 3. — Р. 328-332.
5. Martín V. Sharing of bacterial strains between breast milk and infant feces / V. Martín, A. Maldonado-Barragán, L. Moles et al. // J. Hum. Lact. — 2012. — Vol. 28, № 1. — P. 36-44.
6. Salminen S. Early gut colonization with Lactobacilli and Staphylococcus in infants: the hygiene hypothesis extended / S. Salminen, A. Endo, E. Isolauri et al. // J. Pediatr. Gastroenterol. Nutr. — 2016. — Vol. 62, № 1. — P. 80-86.
7. Kayıran P.G. Transmission of methicillin-sensitive Staphylococcus aureus to a preterm infant through breast milk / P.G. Kayıran, F. Can, S.M. Kayıran et al. // J. Matern. Fetal. Neonatal. Med. — 2014. — Vol. 27, № 5. — P. 527-529.
8. Chen Z. Identification of infantile diarrhea caused by breast milk-transmitted Staphylococcus aureus infection / Z. Chen, W.G. Pan, W.Y. Xian et al. // Curr. Microbiol. — 2016. — Vol. 73, № 4. — P. 498-502.
9. Jiménez E. Metagenomic analysis of milk of healthy and mastitis-suffering women / E. Jiménez, J. de Andrés, M. Manrique et al. // J. Hum. Lact. — 2015 — Vol. 31, № 3. — P. 406-415.
10. Serra V.V. Comparison of the risk of microbiological contamination between samples of breast milk obtained at home and at a healthcare facility / V.V. Serra, S. Teves, A. López de Volder et al. // Arch. Argent. Pediatr. — 2013. — Vol. 111, № 2. — P.115-119.
11. Benito D. Characterization of Staphylococcus aureus strains isolated from faeces of healthy neonates and potential mother-to-infant microbial transmission through breastfeeding / D. Benito, C. Lozano, E. Jiménez et al. // FEMS Microbiol. Ecol. — 2015. — Vol. 91, № 3. — pii: fiv007.

/44.jpg)
/45.jpg)
/46.jpg)