Cахарный диабет (СД) и его осложнения являются одной из серьезных медико-социальных и экономических проблем современного здравоохранения. Известно, что СД увеличивает общую смертность в 2–3 раза, риск развития ишемической болезни сердца (ИБС) и инфаркта миокарда — в 2 раза, патологии почек — в 17 раз; артериальной гипертензии (АГ) — более чем в 3 раза; гангрены нижних конечностей — в 20 раз. СД на первом месте среди причин слепоты [77, 102].
Выделяют ряд факторов риска, способствующих развитию СД 2-го типа. Лидирующее место занимают избыточный вес и ожирение, прежде всего его абдоминальная форма. Так, при наличии ожирения I ст. риск развития СД увеличивается в 2 раза, II ст. — в 5 раз, III ст. — более чем в 10 раз. Также к классическим факторам риска относят АГ; возраст 45 лет и старше; расовую/этническую принадлежность (латиноамериканцы, афроамериканцы, коренные американцы и азиаты); нарушение показателей уровня глюкозы в крови натощак, нарушение толерантности к глюкозе; повышение уровня триглицеридов в крови (≥ 2,82 ммоль/л) и снижение уровня липопротеинов высокой плотности (≤ 0,9 ммоль/л); перенесенный гестационный диабет (диабет, впервые проявившийся во время беременности) или рождение ребенка массой более 4 кг; привычно низкая физическая активность; синдром поликистозных яичников; хронический стресс; нарушение циркадного ритма или недостаточное количество сна [102].
Учитывая важность проблемы, постоянно идет поиск новых факторов риска СД, которые дали бы возможность выявлять пациентов из группы риска задолго до формирования заболевания. В этом контексте все большее значение приобретают генетические исследования. Так, выявлены гены, связанные с развитием СД.
Известно, что близкие родственники больных СД 2-го типа имеют в 3 раза более высокий риск развития заболевания, чем лица, не имеющие такого родства [7]. Эпидемиологические исследования монозиготных близнецов демонстрируют высокий уровень конкордантности. В работе В. Newman et al. установлено, что в 58 % случаев брат-близнец имел СД 2-го типа, если другой брат в этой паре страдал заболеванием [9]. Еще более убедительными выглядят современные данные, представленные в 2016 году G. Willemsen et al. В рамках проекта DISCOTWIN Consortium было обследовано 35 000 пар близнецов, преимущественно из популяций Дании, Германии, Финляндии, Норвегии, Голландии, Швеции и Великобритании. В целом уровень сахарного диабета в изученной популяции соответствовал 2,6–12,3 % и зависел от возраста, индекса массы тела (ИМТ) и распространенности заболевания в данной национальной популяции. Уровень дискордантности в парах был крайне низким: у монозиготных близнецов составил 5,1 % (варьировал от 2,9 до 11,2 %) и в гетерозиготных парах близнецов — 8 % (варьировал от 4,9 до 13,5 %). Интересным является тот факт, что частота поражения обоих близнецов СД 2-го типа всегда менее 100 %. С одной стороны, эти данные подтверждают важную роль генетической предопределенности в развитии заболевания. В то же время не 100% уровень совпадения свидетельствует о не менее важной роли окружающей среды и индивидуальных особенностей жизни.
Изначально большое количество генетических исследований было проведено для установления причин редкой формы СД — MODY (maturity onset of diabetes of the young) [17]. Выявлено несколько генов-кандидатов, отвечающих за развитие данной формы диабета. В соответствии с носительством тех или иных мутаций и построена классификация диабета MODY. Так, диабет MODY1 связывают с носительством гена HNF4A (hepatocyte nuclear factor 1-a); MODY2 — с мутацией GCK (glucokinase); MODY3 — c мутацией в гене HNF1A (hepatocyte nuclear factor 4-a); MODY4 — с генетическим фактором IPF1 (insulin promoter factor-1); MODY5 — с мутацией гена HNF1B (hepatocyte nuclear factor 1-b) и MODY6 — с фактором NEUROD1 (neurogenic differentiation factor 1) [15]. Диабет MODY является редкой формой заболевания, носительство мутаций, определяющих его развитие, также не является широко распространенным. Требующим объяснения фактом является то, что мутации, которые связывают с развитием диабета MODY, достаточно часто определяют и у здоровых лиц [18]. Тем не менее эти генетические исследования стимулировали ученых к поиску генетических факторов, ответственных за развитие СД 2-го типа. Также было выявлено, что некоторые из приведенных мутаций могут способствовать и развитию СД 2-го типа.
Определение генетической предрасположенности к СД 2-го типа является чрезвычайно трудной задачей, так как существует множество генов, которые потенциально могут быть ответственными за развитие заболевания. Также пребывание в тех или иных условиях окружающей среды может способствовать развитию или предотвращать становление СД 2-го типа. Следует также учитывать, что каждый из генов может иметь достаточно ограниченный вклад в развитие СД. Кроме того, программа Genome-wide association studies (GWAS) показала существование значительных межнациональных различий в распространенности тех или иных полиморфных локусов и их вкладе в формирование заболевания [75]. К генам-кандидатам, связанным с развитием СД 2-го типа, отнесли: CAPN10, PPARG, KCNJ11, ABCC8, HNF1A, HNF4A, GCK, PC-1/ENPPI, IRS, PTPN1, LMNA, TCF7L2 [24]. Проведение GWAS позволило выделить более 38 полиморфных локусов, ассоциированных с СД [77], которые ассоциированы с развитием СД 2-го типа. Наиболее изученными среди них являются: HHEX, CDKN2A/2B, IGF2BP2, SLC30A8, CDKAL1, HMGA2, KCNQ1 и NOTCH-ADAM3 [28]. Следует подчеркнуть, что для большинства этих генов показана прежде всего связь с развитием ожирения, которое, в свою очередь, способствует становлению СД [28].
В целом гены, ассоциированные с СД 2-го типа, могут быть разделены на несколько групп: гены, связанные с дисфункцией бета-клеток, с инсулинорезистентностью (ИР), и гены, у которых выявлена ассоциация с СД 2-го типа, но точные молекулярные механизмы еще не установлены. Данная классификация является условной, следует помнить, что у одного и того же пациента могут отмечаться изменения в разных группах генов.
Установлена связь между полиморфными локусами генов, кодирующих синтез белков KCNJ11 и KCNQ1. Оба протеина участвуют в формировании АТФ-зависимых калиевых каналов. Ген KCNJ11 кодирует белок Kir 6.2, одну из двух субъединиц АТФ-зависимого калиевого канала [103, 104]. Белок Kir 6.2 вместе с рецептором к сульфонилмочевине формируют АТФ-зависимый калиевый канал [1]. Повышение уровня глюкозы в крови приводит к повышению уровня АТФ и к уменьшению проницаемости этого канала, мембранный потенциал снижается, а поступление ионов Са2+ в клетку увеличивается, что, в свою очередь, приводит к увеличению секреции гранул с инсулином [19]. Мутация в гене KCNJ11, которая заключается в замене в 23-м кодоне глутамата на лизин (Gly23Lys), приводит к изменениям в структуре белка Kir 6.2 и нарушениям функционирования канала — канал не закрывается в присутствии АТФ, глюкозы, мембрана остается поляризованной, и секреции инсулина не происходит. Исследования показали, что полиморфный маркер rs5219 (Gly23Lys) этого гена ассоциирован с СД 2-го типа. Показана ассоциация между носительством рецессивной аллели и развитием СД 2-го типа в китайской популяции [45]. В то же время N.M. Phani et al. в своем исследовании доказали наличие связи между развитием СД и носительством полиморфного локуса Gly23Lys для популяции Восточной Азии и общей (глобальной) популяции. При этом исследователи не подтвердили наличие подобных закономерностей для популяции Южной Азии [4]. Приведенные данные демонстрируют наличие межнациональных отличий в роли генетических маркеров и необходимость отдельных исследований в каждой популяции. Достаточно интересной представляется работа S.A. Greeley et al. Ученые выявили при морфологическом исследовании поджелудочной железы ребенка, больного СД и носителя мутации, часть сохраненных, нормально функционирующих бета-клеток. Исследователи делают вывод, что существует механизм, который при наличии мутации позволяет сохранять часть бета-клеток полноценно функционирующими [5]. Известно, что у носителей СС-генотипа полиморфного локуса rs5219 в меньшей степени проявляется протекторный эффект кофе. Эти данные были получены при обследовании корейской популяции [6].
Ген KCNQ1 кодирует α-субъединицу калиевого канала. Возможный механизм действия связан с нарушением деполяризации клеточной мембраны и уменьшением секреции инсулина, однако точный молекулярный механизм не изучен [105, 106]. Установлена ассоциация мутации в этом гене с частотой развития гипертонической болезни у больных СД 2-го типа [21]. Также установлена связь между полиморфизмом в локусе rs2237892, гена, кодирующего KCNQ1, и частотой микроваскулярных осложнений у больных СД 2-го типа [22]. Также показано, что носительство ТТ-варианта полиморфного локуса rs2237892 ассоциировано с развитием ранней ИБС у больных СД 2-го типа [23].
Ген ABCC8 кодирует рецептор к сульфонилмочевине, который представляет из себя белок, относящийся к семейству АТФ-связывающих кассетных транспортеров, и также может быть ответственен за развитие СД 2-го типа. Установлено более 10 мутаций этого гена, которые могут быть ассоциированы с гиперинсулинемией [46]. Доказана связь между риском развития СД 2-го типа и носительством полиморфного локуса S1369A гена ABCC8 [44]. В то же время ряд авторов продемонстрировали сцепленность наследования полиморфных вариантов KCNJ11 и ABCC8, ответственных за наследование СД [7].
Ген PPARG2 кодирует рецептор пролифератора пероксисом гамма 2-го типа (PPARG2), который принадлежит к суперсемейству ядерных рецепторов, входящих в группу факторов транскрипции. Его активация и связывание с ретиноидным рецептором Х формируют гетеродимер, взаимодействующий со специфическими последовательностями ДНК, которые кодируют белки, участвующие в метаболизме липидов и глюкозы. Активация PPARG2 приводит к дифференцировке адипоцитов, способствуя ускорению процессов адипогенеза, участвует в регуляции обмена жирных кислот [29]. Аллель рro12Ala является генетическим маркером, для которого связь с риском развития ИР и СД наиболее доказана для различных популяций [32]. В то же время для камерунцев эта ассоциация не подтверждена [38]. Также не установлена связь между носительством рro12Ala и нарушениями метаболизма глюкозы и липидов в шведской популяции [40]. При этом хотя связь между генетическим полиморфизмом PPARG2 и развитием СД существует, ряд авторов рассматривают ее как вторичную по отношению к изменениям функционирования адипоцитов [33]. Показана также зависимость между эффективностью применения пиоглитазона у больных СД и носительством Pro12Ala [37]. Установлено, что лица, гомозиготные по Pro12Pro, имеют большую резистентность к инсулину, у них также выше риск ожирения и СД 2-го типа. Т. Yates еt al. в своей работе показали, что гомозиготы по Ala12 Ala более чувствительны к физической нагрузке и у них в меньшей степени формируется ИР. Подобная связь установлена также у 18 % лиц — носителей Pro12Ala [30]. Результаты обследования бразильской популяции, представленные V. Tavares et al., также продемонстрировали, что носители аллели Ala12 полиморфного локуса являются более чувствительными к инсулину [31]. Показана связь между полиморфизмом гена PPARG2 и резистентностью к терапии СД 2-го типа [59].
Также с риском развития СД 2-го типа связывают ННЕХ ген [52]. Ген HHEX (hematopoietically expressed homeobox) кодирует фактор транскрипции, отвечая за дифференцировку ряда органов: структур мозга, печени, поджелудочной железы, щитовидной железы и др. [10, 47]. У взрослых селективно экспрессируется в дельта-клетках поджелудочной железы, ответственных за секрецию соматостатина. Сниженный уровень соматостатина может вызвать нарушения функционирования паракринной системы и, как следствие, снижение выброса инсулина бета-клетками поджелудочной железы [49]. А. Jonsson et al. показывают, что носители определенных полиморфных вариантов гена ННЕХ имеют более высокие уровни глюкагона и глюкозы [51]. В то же время A.S. Dimas et al. данный фактор связывают с риском развития СД 2-го типа и полагают, что наличие определенных полиморфизмов нарушает как чувствительность к инсулину, так и его секрецию вне зависимости от уровня глюкозы [50].
CAPN10 рассматривают как один из генов-кандидатов, ответственных за риск развития СД, в том числе гестационного [2]. Метаанализ S.T. Yan et al. позволяет утверждать, что с С-аллелью полиморфного локуса rs2975760 ассоциировано развитие заболевания [63]. Более поздние исследования, проведенные в Южной Америке, позволили выделить 19 полиморфных локусов, с которыми может быть связано развитие заболевания [62]. CAPN10 кодирует синтез кальцийзависимых цистеиновых протеаз, которые принимают участие в реализации апоптоза и могут способствовать развитию СД как 1-го, так и 2-го типа. Помимо апоптоза, каспазная система участвует также в регуляции процессов экзоцитоза, ремоделировании цитоскелета клетки, регуляции функции митохондрий [67]. Повышенная физическая активность и снижение массы тела способствуют снижению активности каспазной системы [66]. Метаанализ, представленный R. Sharma et al., демонстрирует ассоциацию между риском носительства DD-генотипа полиморфного локуса CAPN10 I/D и СД 2-го типа [57]. Носительство определенных полиморфизмов связано также с развитием низкого ответа на терапию СД [Costa V.]. Развитие СД у носителей определенных полиморфизмов гена CAPN10 достаточно значимо определяется влиянием окружающей среды, образа жизни и активностью других генов [61].
Гены CDKN2А/CDKN2B, кодирующие ингибиторы циклинзависимых киназ (CDK4 и CDK6), также могут отвечать за риск развития СД 2-го типа [68]. Ингибиторы циклинзависимых киназ входят в семейство белков, регулируемых циклином, концентрация последнего изменяется в зависимости от фазы клеточного цикла. Эти белки участвуют в регуляции клеточного цикла, пролиферации и дифференциации клеток, включая бета-клетки. Какой именно механизм формирования СД у носителей мутации в гене, не известно, но исследования демонстрируют повышенную секрецию инсулина у мутантных особей [10, 73]. Показана связь между носительством определенных полиморфных локусов (rs2518719) этих генов, СД и раком поджелудочной железы [71].
TCF7L2 является геном-кандидатом, связанным с развитием СД 2-го типа [26]. Данный ген кодирует синтез ядерного рецептора b-катенина. Этот белок является активатором Wnt-сигнального пути. Белки Wnt-сигнального пути играют центральную роль в нормальном эмбриогенезе, делении и дифференцировке клеток. Было показано, что взаимодействие TCF7L2 ядерного рецептора с белками Wnt-сигнального пути регулирует секрецию проглюкагона, что, в свою очередь, определяет глюкозоиндуцированную секрецию инсулина и регулирует созревание бета-клеток поджелудочной железы из полипотентных стволовых клеток. Также взаимодействие TCF7L2 ядерного рецептора с белками Wnt-сигнального пути играет важную роль в адипогенезе и дифференцировке клеток жировой ткани. Ген TCF7L2 экспрессируется практически во всех органах и тканях. Y. Tong et al. в своей работе выделили четыре полиморфных локуса, ассоциированные с возникновением СД 2-го типа, и полагают, что полиморфизм в гене TCF7L2 ответственен за один из пяти случаев развития СД. Установлена связь между носительством ТТ-генотипа полиморфного локуса rs7903146 гена TCF7L2 и развитием СД в китайской популяции [81]. Для этого же полиморфного локуса показана связь с риском развития рака груди у женщин, страдающих СД [83]. Выявлена связь между носительством полиморфизмов TCF7L2 (rs7903146, rs12255372 и rs7901695) и развитием гестационного диабета [80]. Тем не менее ученые настаивают на необходимости дальнейших исследований, которые установят роль данных полиморфизмов и влияние окружающей среды и образа жизни в развитии заболевания [27].
Ген WSF1 — ген вольфрамина — кодирует транс–мембранный белок мембран эндоплазматического ретикулума. Он участвует в регуляции гомеостаза ионов кальция. Нарушения в структуре белка могут приводить к нарушению кальциевого гомеостаза, что, в свою очередь, нарушает секрецию инсулина бета-клетками [106]. Полиморфный маркер rs1801214 гена WSF1 ассоциирован с развитием СД 2-го типа. Подтверждена также связь между данным полиморфизмом и развитием СД у американцев африканского происхождения [79]. Связывают с носительством мутации в этом гене происхождение синдрома Вольфрама: аутосомно-рецессивно наследуемой патологии, включающей СД, прогрессирующую атрофию зрительного нерва, нейросенсорную тугоухость и центральную форму несахарного диабета [78].
Ген ADIPOQ, кодирующий синтез адипонектина, белка, который регулирует чувствительность тканей к инсулину, также связывают с риском развития СД [107–109]. При обследовании шведской популяции выявлена связь между наличием СД и полиморфными локусами гена — 11426(A/G) и 11377(G/C). Также пациенты с CC- и CG-генотипами полиморфного локуса 11377(G/C) имели более высокий ИМТ при сравнении с носителями GG-генотипа [87]. F. Vasseur et al. показали связь между носительством полиморфизмов 11391 и 11377 и уровнем адипонектина. В то же время взаимосвязи с индексами ИР установлено не было [88]. Локус 11426 связывают как с предрасположенностью к СД, так и с уровнем адипонектина [89]. Установлена ассоциация между полиморфизмом в локусе rs266729 и СД в иранской популяции [84]. Полагают, что rs182052 может быть связан с низким уровнем адипонектина и, как следствие, развитием СД 2-го типа [85]. В то же время не было выявлено связи между полиморфными локусами гена и развитием СД при изучении жителей Бахрейна [86].
Наличие полиморфизма или мутаций в гене, кодирующем синтез рецепторов к мелатонину, связывают также с риском развития СД [90]. Рецепторы к мелатонину обнаружены в различных органах, в том числе и в островках поджелудочной железы [92]. Низкий уровень мелатонина может способствовать развитию СД. В основе лежит циркадный характер секреции инсулина. В норме уровень инсулина наиболее низкий ночью, когда повышается уровень мелатонина. Нарушение циркадного ритма может способствовать и нарушению секреции инсулина [91]. Синтез рецептора к мелатонину 1В кодирует ген MTNR1B. V. Lyssenko с соавт. показали, что однонуклеотидный полиморфизм rs10830963 гена MTNR1B достоверно связан с повышением уровня глюкозы натощак и снижением секреции инсулина [102].
В работе R. Hardeland et al. также подтверждается связь между носительстовом полиморфизма в локусе rs10830963 и развитием метаболического синдрома. Авторы также говорят о возможной гиперэкспрессии аллели с возрастом [93]. Прием пищи ночью, когда уровень мелатонина достаточно высокий, а инсулина — низкий, может быть более опасен для носителей полиморфизма в локусе rs10830963 MTNR1B [94].
Ионы цинка являются жизненно необходимыми для обеспечения нормального хранения и секреции инсулина бета-клетками поджелудочной железы [97]. В секреторных гранулах инсулин, соединяясь с ионами цинка, образует кристаллические гексамерные агрегаты. Ген SLC30A8 кодирует трансмембранный белок-транспортер ионов цинка типа 8 (ZnT-8). ZnT-8 выполняет функцию канала, через который ионы Zn2+ поступают в секреторные везикулы [96, 110–113]. По данным метаанализа, включившего 46 исследований, однонуклеотидный полиморфизм rs13266634 гена SLC30A8 ассоциирован с риском развития СД 2-го типа. Данная закономерность показана для африканской, европейской и азиатской популяций [98]. T. Wang et al. продемонстрировали, что набор веса во время беременности может модифицировать экспрессию SLC30A8 и способствовать развитию СД 2-го типа [95].
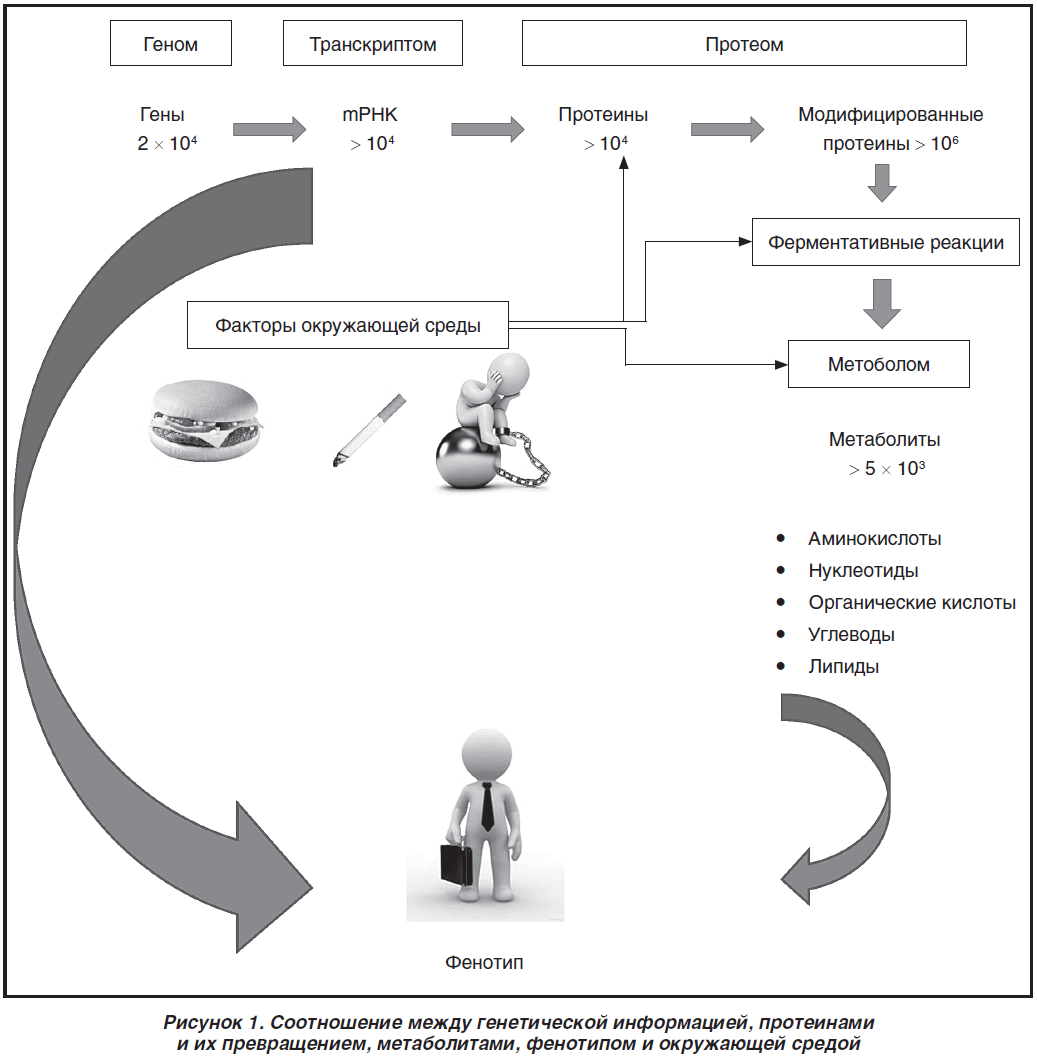
Безусловно, невозможно обсудить все возможные генетические факторы, способствующие развитию СД 2-го типа, в одной статье. Мы привели выше наиболее изученные гены и варианты однонуклеотидных полиморфизмов. База научных данных о генетических факторах, способствующих развитию СД или ассоциированных с ним, постоянно пополняется. Появляется все больше исследований по изучению фармакогеномики противодиабетических препаратов. В то же время в действующих рекомендациях не меньшее по сравнению с наследственностью значение отдается образу жизни и поведенческим факторам риска. При интерпретации результатов генетических исследований с клинической точки зрения и применения их в практике возникает всегда ряд сложностей. Известно, что экспрессия того или иного гена не полностью коррелирует с уровнем белка [99]. При этом следует помнить, что если набор генов у человека постоянный, то набор белков постоянно изменяется и, в свою очередь, значительно зависит от влияния окружающей среды. Например, S. Lee et al. продемонстрировали изменение определенных mRNК под влиянием регулярных физических тренировок [100]. В экспериментальной работе Y.Y. Ren et al. показано изменение уровней транскрипции под влиянием физических нагрузок [101]. Ряд факторов окружающей среды и нашего поведения могут приводить к усилению или подавлению синтеза тех или иных белков. Кроме того, при оценке «энергетического гомеостаза» (важной составляющей которого является метаболизм глюкозы) следует учитывать не только генетические варианты и белки, но также и метаболиты — одиночные аминокислоты, нуклеотиды, уровни сахаров и липидов. Все низкомолекулярные метаболиты с массой менее 1500 Da называют метаболомом. Последняя составляющая является «быстрым снимком» происходящих в организме метаболических процессов. На рис. 1 представлено соотношение между генетической информацией, протеинами и их превращением, метаболитами, фенотипом и окружающей средой.
Поэтому полагаться исключительно на данные генетических исследований при изучении причин возникновения, а следовательно, и профилактики СД является неправомочным. В то же время знание результатов генетических исследований позволит лучше понимать природу заболевания.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. McTaggart J.S. The role of the KATP channel in glucose homeostasis in health and disease: more than meets the islet / J.S. McTaggart, R.H. Clark, F.M. Ashcroft // J. Physiol. — 2010. — Vol. 588(Pt. 17). — P. 3201-9. — doi: 10.1113/jphysiol.2010.191767.
2. Li Y.Y. The KCNJ11 E23K gene polymorphism and type 2 diabetes mellitus in the Chinese Han population: a meta-ana–lysis of 6,109 subjects / Y.Y. Li // Mol. Biol. Rep. — 2013. — Vol. 40(1). — P. 141-6. — doi: 10.1007/s11033-012-2042-9. Epub 2012 Oct 11.
3. The E23K variation in the KCNJ11 gene is associated with type 2 diabetes in Chinese and East Asian population / D. Zhou, D. Zhang, Y. Liu [et al.] // J. Hum. Genet. — 2009. — Vol. 54(7). — P. 433-5. — doi: 10.1038/jhg.2009.54. Epub 2009 Jun 5.
4. Population specific impact of genetic variants in KCNJ11 gene to type 2 diabetes: a case-control and meta-analysis study / N.M. Phani, V. Guddattu, R. Bellampalli [et al.] // PLoS One. — 2014. — Vol. 9(9). — P. e107021. — doi: 10.1371/journal.pone.0107021. eCollection 2014.
5. Case Report: Preservation of Reduced Numbers of Insulin-Positive Cells in Sulfonylurea-Unresponsive KCNJ11-related Diabetes [Электронный ресурс] / S.A. Greeley, M.C. Zielinski, A. Poudel [et al.] // J. Clin. Endocrinol. Metab. — 2016. — Режим доступа: jc20162826. [Epub ahead of print]
6. Habitual coffee intake, genetic polymorphisms, and type 2 diabetes / J.K. Lee, K. Kim, Y. Ahn, M. Yang, J.E. Lee // Eur. J. Endocrinol. — 2015. — Vol. 172(5). — P. 595-601. — doi: 10.1530/EJE-14-0805. Epub 2015 Mar 9.
7. Florez J.C. The inherited basis of diabetes mellitus: implications for the genetic analysis of complex traits / J.C. Florez, J. Hirschhorn, D. Altshuler // Annu Rev. Genomics. Hum. Genet. — 2003. — Vol. 4. — P. 257-91.
8. Genetics, diabetes mellitus heterogeneity, and coronary heart disease / J.I. Rotter, C.M. Vadheim, L.J. Raffel, D.L. Rimoin // Prog. Clin. Biol. Res. — 1984. — Vol. 147. — P. 445-78.
9. Concordance for type 2 (non-insulin-dependent) diabetes mellitus in male twins / B. Newman, J.V. Selby, M.C. King, C. Slemenda, R. Fabsitz, G.D. Friedman // Diabetologia. — 1987. — Vol. 30(10). — P. 763-8.
10. Diabetes genes identified by genome-wide association studies are regulated in mice by nutritional factors in metabolically relevant tissues and by glucose concentrations in islets /
M.M. Ho, P. Yoganathan, K.Y. Chu [et al.] // BMC Genet. — 2013. — Vol. 14. — P. 10. — doi: 10.1186/1471-2156-14-10.
11. The Concordance and Heritability of Type 2 Diabetes in 34,166 Twin Pairs From International Twin Registers: The Discordant Twin (DISCOTWIN) Consortium / G. Willemsen, K.J. Ward, C.G. Bell [et al.] // Twin Res. Hum. Genet. — 2015. — Vol. 18(6). — P. 762-71. — doi: 10.1017/thg.2015.83.
12. Welsh K.M. Maturity-Onset Diabetes of the Young: A Genetic Form of Diabetes in Children / K.M. Welsh // J. Pediatr. Nurs. — 2016. — pii: S0882-5963(16)30396-7. — doi: 10.1016/j.pedn.2016.11.003. [Epub ahead of print]
13. Familial hyperglycemia due to mutations in glucokinase. Definition of a subtype of diabetes mellitus / P. Froguel, H. Zouali, N. Vionnet [et al.] // N. Engl. J. Med. — 1993. — Vol. 328(10). — P. 697-702.
14. An analysis of the sequence of the BAD gene among patients with maturity-onset diabetes of the young (MODY) / K. Antosik, P. Gnyn, P. Jarosz-Chobot [et al.] // J. Pediatr Endocrinol. Metab. — 2016. — pii: /j/jpem.ahead-of-print/jpem-2016-0239/jpem-2016-0239.xml. doi: 10.1515/jpem-2016-0239. [Epub ahead of print]
15. Genetics and Diabetes [Электронный ресурс]. — Режим доступа: http://www.who.int/genomics/about/Diabetis-fin.pdf
16. Genetic testing for monogenic diabetes using targeted next-generation sequencing in patients with maturity-onset diabetes of the young / M. Szopa, A. Ludwig-Gaікzowska, P. Radkowski [et al.] // Pol. Arch. Med. Wewn. — 2015. — Vol. 125(11). — P. 845-51.
17. Genetic Confirmation Rate in Clinically Suspected Maturity-Onset Diabetes of the Young / A.J. Brahm, G. Wang, J. Wang [et al.] // Can. J. Diabetes. — 2016. — Vol. 40(6). — P. 555-560. — doi: 10.1016/j.jcjd.2016.05.010.
18. Althari S. When is it MODY? Challenges in the Interpretation of Sequence Variants in MODY Genes / S. Althari, A.L. Gloyn // Rev. Diabet. Stud. — 2015. — Vol. 12(3–4). — P. 330-48. — doi: 10.1900/RDS.2015.12.330. Epub 2016 Feb 10.
19. ATP-dependent potassium channels and type 2 diabetes mellitus / D.H. Bonfanti, L.P. Alcazar, P.A. Arakaki [et al.] // Clin. Biochem. — 2015. — Vol. 48(7–8). — P. 476-82. — doi: 10.1016/j.clinbiochem.2014.12.026. Epub 2015 Jan 10.
20. Kir6.2 polymorphisms sensitize beta-cell ATP-sensitive potassium channels to activation by acyl CoAs: a possible cellular mechanism for increased susceptibility to type 2 diabetes? / M.J. Riedel, P. Boora, D. Steckley, G. de Vries, P.E. Light // Diabetes. — 2003. — Vol. 52(10). — P. 2630-5.
21. KCNQ1 Variants Associate with Hypertension in Type 2 Diabetes and Affect Smooth Muscle Contractility In Vitro / K.C. Huang, T.M. Li, X. Liu [et al.] // J. Cell. Physiol. — 2017. — doi: 10.1002/jcp.25775. [Epub ahead of print]
22. Variant rs2237892 of KCNQ1 Is Potentially Associated with Hypertension and Macrovascular Complications in Type 2 Diabetes Mellitus in A Chinese Han Population / W. Zhang, H. Wang, X. Guan, Q. Niu, W. Li // Genomics Proteomics Bioinformatics. — 2015. — Vol. 13(6). — P. 364-70. — doi: 10.1016/j.gpb.2015.05.004. Epub 2015 Dec 8.
23. Association study of four variants in KCNQ1 with type 2 diabetes mellitus and premature coronary artery disease in a Chinese population / Z. Chen, X. Zhang, G. Ma, Q. Qian, Y. Yao // Mol. Biol. Rep. — 2010. — Vol. 37(1). — P. 207-12. — doi: 10.1007/s11033-009-9597-0. Epub 2009 Jul 3.
24. Singh S. The geneticsoftype 2 diabetesmellitus: A review / S. Singh // J. Sci. Res. — 2011. — Vol. 55. — P. 35-48.
25. Pranavchand R. Genomics era and complex disorders: Implications of GWAS with special reference to coronary artery disease, type 2 diabetes mellitus, and cancers / R. Pranavchand, B.M. Reddy // J. Postgrad. Med. — 2016. — Vol. 62(3). — P. 188-98. — doi: 10.4103/0022-3859.186390.
26. Variant of transcription factor 7-like 2 (TCF7L2) gene confers risk of type 2 diabetes / S.F. Grant, G. Thorleifsson, I. Reynisdottir [et al.] // Nat. Genet. — 2006. — Vol. 38(3). — P. 320-3.
27. Association between TCF7L2 gene polymorphisms and susceptibility to type 2 diabetes mellitus: a large Human Genome Epidemiology (HuGE) review and meta-analysis / Y. Tong, Y. Lin, Y. Zhang [et al.] // BMC Med. Genet. — 2009. — Vol. 10. — P. 15. — doi: 10.1186/1471-2350-10-15.
28. Ali O. Genetics of type 2 diabetes / O. Ali // World J. Diabetes. — 2013. — Vol. 4(4). — P. 114-23.
29. Adipocyte nuclei captured from VAT and SAT / S. Ambati, P.Yu, E.C. McKinney [et al.] // BMC Obes. — 2016. — Vol. 3. — P. 35. — doi: 10.1186/s40608-016-0112-6. eCollection 2016.
30. Effect of the PPARG2 Pro12Ala Polymorphism on Associations of Physical Activity and Sedentary Time with Markers of Insulin Sensitivity in Those with an Elevated Risk of Type 2 / Yates T., Davies M., Henson J. [et al.] // Diabetes. PLoS One. — 2015. — Vol. 10(5). — P. e0124062. — doi: 10.1371/journal.pone.0124062. eCollection 2015.
31. Association between Pro12Ala polymorphism of the PPAR-gamma2 gene and insulin sensitivity in Brazilian patients with type-2 diabetes mellitus / V. Tavares, R.D. Hirata, A.C. Rodrigues [et al.] // Diabetes Obes. Metab. — 2005. — Vol. 7(5). — P. 605-11.
32. Tönjes A. The role of the Pro12Ala polymorphism in peroxisome proliferator-activated receptor gamma in diabetes risk / A. Tönjes, M. Stumvoll // Curr. Opin. Clin. Nutr. Metab. Care. — 2007. — Vol. 10(4). — P. 410-4.
33. Stumvoll M. The peroxisome proliferator-activated receptor-gamma2 Pro12Ala polymorphism / M. Stumvoll, H. Häring // Diabetes. — 2002. — Vol. 51(8). — P. 2341-7.
34. Celi F.S. The role of peroxisome proliferator-activated receptor gamma in diabetes and obesity / F.S. Celi, A.R. Shuldiner // Curr. Diab. Rep. — 2002. — Vol. 2(2). — P. 179-85.
35. Association of Pro12Ala Polymorphism of Peroxisome Proliferator-Activated Receptor gamma 2 (PPARγ2) Gene with Type 2 Diabetes Mellitus in Ethnic Kashmiri Population / M. Majid, A. Masood, S.A. Kadla, I. Hameed, B.A. Ganai // Biochem. Genet. — 2017. — Vol. 55(1). — P. 10-21. — doi: 10.1007/s10528-016-9765-6.
36. The Pro12Ala polymorphism of PPARgamma2 gene and susceptibility to type 2 diabetes mellitus in a Polish population / M.T. Malecki, J. Frey, T. Klupa [et al.] // Diabetes Res. Clin. Pract. — 2003. — Vol. 62(2). — P. 105-11.
37. Genotype Phenotype Correlation of Genetic Polymorphism of PPAR Gamma Gene and Therapeutic Response to Pioglitazone in Type 2 Diabetes Mellitus — A Pilot Study / S.S. Priya, R. Sankaran, S. Ramalingam, T. Sairam, L.S. Somasundaram // J. Clin. Diagn. Res. — 2016. — Vol. 10(2). — P. FC11-4. — doi: 10.7860/JCDR/2016/16494.7331. Epub 2016 Feb 1.
38. The Pro12Ala polymorphism in the PPAR-γ2 gene is not associated to obesity and type 2 diabetes mellitus in a Came–roonian population / E.P. Mato, P.E. Pokam-Fosso, B. Atogho-Tiedeu [et al.] // BMC Obes. — 2016. — Vol. 3. — P. 26. — doi: 10.1186/s40608-016-0104-6. eCollection 2016.
39. Genetic polymorphisms associated with overweight and obesity in uncontrolled Type 2 diabetes mellitus / N.B. Kasim, H.Z. Huri, S.R. Vethakkan, L. Ibrahim, B.M. Abdullah // Biomark Med. — 2016. — Vol. 10(4). — P. 403-15. — doi: 10.2217/bmm-2015-0037. Epub 2016 Mar 21.
40. The Pro12Ala polymorphism of the PPARG gene is not associated with the metabolic syndrome in an urban population of middle-aged Swedish individuals / M. Montagnana, C. Fava, P.M. Nilsson [et al.] // Diabet. Med. — 2008. — Vol. 25(8). — P. 902-8. — doi: 10.1111/j.1464-5491.2008.02510.x.
41. Pro12Ala polymorphism of the peroxisome proliferator activated receptor-gamma gene is associated with metabolic syndrome and surrogate measures of insulin resistance in healthy men: interaction with smoking status / M.L. Tellechea, F. Aranguren, M.S. Pérez, G.E. Cerrone, G.D. Frechtel, M.J. Taverna // Circ. J. — 2009. — Vol. 73(11). — P. 2118-24. Epub 2009 Sep 10.
42. Replication of KCNJ11 (p.E23K) and ABCC8 (p.S1369A) Association in Russian Diabetes Mellitus 2 Type Cohort and Meta-Analysis / E.A. Sokolova, I.A. Bondar, O.Y. Shabelnikova,
O.V. Pyankova, M.L. Filipenko // PLoS One. — 2015. — Vol. 10(5). — P. e0124662. — doi: 10.1371/journal.pone.0124662. eCollection 2015.
43. Haplotype structure and genotype-phenotype correlations of the sulfonylurea receptor and the islet ATP-sensitive potassium channel gene region / J.C. Florez, N. Burtt, P. de Bakker. [et al.] // Diabetes. — 2004. — Vol. 53(5). — P. 1360-8.
44. Identification of ABCC8 as a contributory gene to impaired early-phase insulin secretion in NZO mice / S. Andrikopoulos, B.C. Fam, A. Holdsworth [et al.] // J. Endocrinol. — 2016. — Vol. 228(1). — P. 61-73. — doi: 10.1530/JOE-15-0290. Epub 2015 Oct 22.
45. KCNJ11: Genetic Polymorphisms and Risk of Diabetes Mellitus / P. Haghvirdizadeh, Z. Mohamed, N.A. Abdullah, P. Haghvirdizadeh, M.S. Haerian, B.S. Haerian // J. Diabetes Res. — 2015. — Vol. 2015. — P. 908152. — doi: 10.1155/2015/908152. Epub 2015 Sep 13.
46. High Incidence of Heterozygous ABCC8 and HNF1A Mutations in Czech Patients With Congenital Hyperinsulinism / K. Rozenkova, J. Malikova, A. Nessa [et al.] // J. Clin. Endocrinol. Metab. — 2015. — Vol. 100(12). — P. E1540-9. — doi: 10.1210/jc.2015-2763. Epub 2015 Oct 2.
47. The homeobox gene Hex is required in definitive endodermal tissues for normal forebrain, liver and thyroid formation / J.P. Martinez Barbera, M. Clements, P. Thomas [et al.] // Development. — 2000. — Vol. 127(11). — P. 2433-45. — PMID 10804184.
48. Differentiation of Mouse Embryonic Stem Cells into Ventral Foregut Precursors / M. Rothova, J.J. Hölzenspies, A. Livigni, S.N. Villegas, J.M. Brickman // Curr. Protoc. Stem. Cell. Biol. — 2016. — Vol. 36. — P. 1G.3.1-12. — doi: 10.1002/9780470151808.sc01g03s36.
49. The diabetes gene Hhex maintains δ-cell differentiation and islet function / J. Zhang, L.B. McKenna, C.W. Bogue, K.H. Kaestner // Genes. Dev. — 2014. — Vol. 28(8). — P. 829-34. — doi: 10.1101/gad.235499.113.
50. Impact of type 2 diabetes susceptibility variants on quantitative glycemic traits reveals mechanistic heterogeneity / A.S. Dimas, V. Lagou, A. Barker [et al.]; MAGIC Investigators // Diabetes. — 2014. — Vol. 63(6). — P. 2158-71. — doi: 10.2337/db13-0949. Epub 2013 Dec 2.
51. Effects of common genetic variants associated with type 2 diabetes and glycemic traits on α- and β-cell function and insulin action in humans / A. Jonsson, C. Ladenvall, T.S. Ahluwalia [et al.] // Diabetes. — 2013. — Vol. 62(8). — P. 2978-83. — doi: 10.2337/db12-1627. Epub 2013 Apr 4.
52. Understanding Genetic Heterogeneity in Type 2 Diabetes by Delineating Physiological Phenotypes: SIRT1 and its Gene Network in Impaired Insulin Secretion / S. Ali, S. Nafis, P. Kalaiarasan, E. Rai, S. Sharma, R.N. Bamezai // Rev. Diabet. Stud. — 2016. — Vol. 13(1). — P. 17-34. — doi: 10.1900/RDS.2016.13.17. Epub 2016 May 10.
53. Several type 2 diabetes-associated variants in genes annotated to WNT signaling interact with dietary fiber in relation to incidence of type 2 diabetes / G. Hindy, I.G. Mollet, G. Rukh, U. Ericson, M. Orho-Melander // Genes. Nutr. — 2016. — Vol. 11. — P. 6. — doi: 10.1186/s12263-016-0524-4. eCollection 2016.
54. Genetic variants associated with lean and obese type 2 diabetes in a Han Chinese population: A case-control study / X. Kong, X. Xing, J. Hong, X. Zhang, W. Yang // Medicine (Baltimore). — 2016. — Vol. 95(23). — P. e3841. — doi: 10.1097/MD.0000000000003841.
55. Meta-analysis of Complex Diseases at Gene Level with Generalized Functional Linear Models / R. Fan, Y. Wang, C.Y. Chiu [et al.] // Genetics. — 2016. — Vol. 202(2). — P. 457-70. — doi: 10.1534/genetics.115.180869. Epub 2015 Dec 29.
56. The HHEX rs1111875A/G gene polymorphism is associated with susceptibility to type 2 diabetes in the Iranian population / Y. Mansoori, A. Daraei, M.M. Naghizadeh, R. Salehi // Mol. Biol. (Mosk.). — 2015. — Vol. 49(4). — P. 601-9. — doi: 10.7868/S0026898415040126.
57. Ethnic differences in CAPN10 SNP-19 in type 2 diabetes: a North-West Indian case control study and evidence from meta-analysis / R. Sharma, K. Matharoo, R. Kapoor, H. Chopra, A.J. Bhanwer // Genet. Res. (Camb.). — 2013. — Vol. 95(5). — P. 146-55. — doi: 10.1017/S0016672313000207.
58. Computational Analysis of Single Nucleotide Polymorphisms Associated with Altered Drug Responsiveness in Type 2 Diabetes / V. Costa, A. Federico, C. Pollastro [et al.] // Int. J. Mol. Sci. — 2016. — Vol. 17(7). — pii: E1008. — doi: 10.3390/ijms17071008.
59. Pharmacogenomics of Drug Response in Type 2 Diabetes: Toward the Definition of Tailored Therapies? / C. Pollastro, C. Ziviello, V. Costa, A. Ciccodicola // PPAR Res. — 2015. — Vol. 2015. — P. 415149. — doi: 10.1155/2015/415149. Epub 2015 Jun 15.
60. Meta-analysis of the association between four CAPN10 gene variants and gestational diabetes mellitus / J. Cui, X. Xu, S. Yin, F. Chen, P. Li, C. Song // Arch. Gynecol. Obstet. — 2016. — Vol. 294(3). — P. 447-53. — doi: 10.1007/s00404-016-4140-8. Epub 2016 Jun 21.
61. Uma Jyothi K. Gene-gene and gene-environment interactions in the etiology of type 2 diabetes mellitus in the population of Hyderabad, India / K. Uma Jyothi, B.M. Reddy // Meta Gene. — 2015. — Vol. 5. — P. 9-20. — doi: 10.1016/j.mgene.2015.05.001. eCollection 2015.
62. SNP-19 genotypic variants of CAPN10 gene and its relation to diabetes mellitus type 2 in a population of Ciudad Juarez, Mexico / Y. Loya Mondez, G. Reyes Leal, A. Sonchez Gonzalez [et al.] // Nutr. Hosp. — 2014. — Vol. 31(2). — P. 744-50. — doi: 10.3305/nh.2015.31.2.7729.
63. Association of calpain-10 rs2975760 polymorphism with type 2 diabetes mellitus: a meta-analysis / S.T. Yan, C.L. Li, H. Tian [et al.] // Int. J. Clin. Exp. Med. — 2014. —
Vol. 7(10). — P. 3800-7. eCollection 2014.
64. CAPN10 SNP43 G>A gene polymorphism and type 2 diabetes mellitus in the Asian population: a meta-analysis of 9353 participants / Li Y.Y., Gong G., Geng H.Y. [et al.] // Endocr. J. — 2015. — Vol. 62(2). — P. 183-94. — doi: 10.1507/endocrj.EJ14-0297. Epub 2014 Nov 8.
65. A case-control study on the association of common variants of CAPN10 gene and the risk of type 2 diabetes in an Iranian population / F. Maleki, K. Haghani, S. Shokouhi [et al.] // Clin. Lab. — 2014. — Vol. 60(4). — P. 663-70.
66. The calpain system and diabetes / M. Pandurangan, I. Hwang, C. Orhirbat, Y. Jieun, S.H. Cho // Pathophysiology. — 2014. — Vol. 21(2). — P. 161-7. — doi: 10.1016/j.pathophys.2014.01.003. Epub 2014 Mar 14.
67. Role of calpain-10 in the development of diabetes mellitus and its complications / P. Panico, A.M. Salazar, A.L. Burns, P. Ostrosky-Wegman // Arch. Med. Res. — 2014. — Vol. 45(2). — P. 103-15. — doi: 10.1016/j.arcmed.2014.01.005. Epub 2014 Feb 4.
68. Investigation of type 2 diabetes risk alleles support CDKN2A/B, CDKAL1, and TCF7L2 as susceptibility genes in a Han Chinese cohort / J. Wen, T. Rönn, A. Olsson [et al.] // PLoS One. — 2010. — Vol. 5(2). — P. e9153. — doi: 10.1371/journal.pone.0009153.
69. Association of the polymorphisms of the FTO, KCNJ11, SLC30A8 and CDKN2B genes with type 2 diabetes] / A.G. Nikitin, V.A. Potapov, A.N. Brovkin [et al.] // Biol. (Mosk.). — 2015. — Vol. 49(1). — P. 119-28.
70. Functional single nucleotide polymorphisms within the cyclin-dependent kinase inhibitor 2A/2B region affect pancreatic cancer risk / D. Campa, M. Pastore, M. Gentiluomo [et al.] // Oncotarget. — 2016. — Vol. 7(35). — P. 57011-57020. — doi: 10.18632/oncotarget.10935.
71. Common germline variants within the CDKN2A/2B region affect risk of pancreatic neuroendocrine tumors / D. Campa, G. Capurso, M. Pastore [et al.] // Sci. Rep. — 2016. — Vol. 6. — P. 39565. — doi: 10.1038/srep39565.
72. Islet biology, the CDKN2A/B locus and type 2 diabetes risk / Y. Kong, R.B. Sharma, B.U. Nwosu, L.C. Alonso // Diabetologia. — 2016. — Vol. 59(8). — P. 1579-93. — doi: 10.1007/s00125-016-3967-7. Epub 2016 May 7.
73. Loss-of-Function Mutations in the Cell-Cycle Control Gene CDKN2A Impact on Glucose Homeostasis in Humans / A. Pal, T.P. Potjer, S.K. Thomsen [et al.] // Diabetes. — 2016. — Vol. 65(2). — P. 527-33. — doi: 10.2337/db15-0602. Epub 2015 Nov 5.
74. Functional genomics of the CDKN2A/B locus in cardiovascular and metabolic disease: what have we learned from GWASs? / S.A. Hannou, K. Wouters, R. Paumelle, B. Staels // Trends Endocrinol. Metab. — 2015. — Vol. 26(4). — P. 176-84. — doi: 10.1016/j.tem.2015.01.008. Epub 2015 Mar 3.
75. A comparison of type 2 diabetes risk allele load between African Americans and European Americans / J.M. Keaton, J.N. Cooke Bailey, N.D. Palmer [et al.] // Hum. Genet. — 2014. — Vol. 133(12). — P. 1487-95. — doi: 10.1007/s00439-014-1486-5.
Epub 2014 Oct 2.
76. Winner’s Curse Correction and Variable Thresholding Improve Performance of Polygenic Risk Modeling Based on Genome-Wide Association Study Summary-Level Data / Shi J., Park J.H., Duan J. [et al.]; MGS (Molecular Genetics of Schizophrenia) GWAS Consortium; GECCO (The Genetics and Epidemiology of Colorectal Cancer Consortium; GAME-ON/TRICL (Transdisciplinary Research in Cancer of the Lung) GWAS Consortium; PRACTICAL (PRostate cancer AssoCiation group To Investigate Cancer Associated aLterations) Consortium; Pan–Scan Consortium; GAME-ON/ELLIPSE Consortium // PLoS Genet. — 2016. — Vol. 12(12). — P. e1006493. — doi: 10.1371/journal.pgen.1006493. eCollection 2016.
77. Billings L.K. The genetics of type 2 diabetes: what have we learned from GWAS? / L.K. Billings, J.C. Florez // Ann. N. Y. Acad. Sci. — 2010. — Vol. 1212. — P. 59-77.
78. Diabetes and neurodegeneration in Wolfram syndrome: a multicenter study of phenotype and genotype / J. Rohayem, C. Ehlers, B. Wiedemann [et al.]; Wolfram Syndrome Diabetes Writing Group // Diabetes Care. — 2011. — Vol. 34(7). — P. 1503-10. — doi: 10.2337/dc10-1937. Epub 2011 May 20.
79. Evaluation of genome-wide association study-identified type 2 diabetes loci in African Americans / J. Long, T. Edwards, L.B. Signorello [et al.] // Am. J. Epidemiol. — 2012. — Vol. 176(11). — P. 995-1001. — doi: 10.1093/aje/kws176. Epub 2012 Nov 9.
80. Association between TCF7L2 Polymorphisms and Gestational Diabetes Mellitus: a Meta-Analysis / S. Chang, Z. Wang, L. Wu [et al.] // J. Diabetes Investig. — 2016. — doi: 10.1111/jdi.12612. [Epub ahead of print]
81. Association of TCF7L2 and GCG Gene Variants with Insulin Secretion, Insulin Resistance, and Obesity in New-onset Diabetes / L. Zhang, M. Zhang, J.J. Wang [et al.] // Biomed. Environ. Sci. — 2016. — Vol. 29(11). — P. 814-817. — doi: 10.3967/bes2016.108.
82. Correlation of the TCF7L2 (rs7903146) polymorphism with an enhanced risk of type 2 diabetes mellitus: a meta-analysis / Y. Guan, L.H. Yan, X.Y. Liu, X.Y. Zhu, S.Z. Wang, L.M. Chen // Genet. Mol. Res. — 2016. — Vol. 15(3). — doi: 10.4238/gmr.15037969.
83. Association of genetic susceptibility variants for type 2 diabetes with breast cancer risk in women of European ancestry / Zhao Z., Wen W., Michailidou K. [et al.] // Cancer Causes Control. — 2016. — Vol. 27(5). — P. 679-93. — doi: 10.1007/s10552-016-0741-6. Epub 2016 Apr 6.
84. Data describing the association between rs266729 polymorphism inadiponectin promoter gene and Type 2 Diabetes Mellitus / S. Erfanian, M. Moradzadeh, K. Solhjoo, A.S. Jahromi // Data Brief. — 2016. — Vol. 9. — P. 1138-1140. eCollection 2016.
85. Interaction between β-hexachlorocyclohexane and ADIPOQ genotypes contributes to the risk of type 2 diabetes mellitus in East Chinese adults / S. Li, X. Wang, L. Yang [et al.] // Sci. Rep. — 2016. — Vol. 6. — P. 37769. — doi: 10.1038/srep37769.
86. Associations between single-nucleotide polymorphisms of ADIPOQ, serum adiponectin and increased type 2 diabetes mellitus risk in Bahraini individuals / F.A. Al Hannan, P.A. O’Farrell, M.P. Morgan, O. Tighe, K.G. Culligan // East Mediterr Health J. — 2016. — Vol. 22(8). — P. 611-618.
87. Single nucleotide polymorphisms in the proximal promoter region of the adiponectin (APM1) gene are associated with type 2 diabetes in Swedish Caucasians / H.F. Gu, A. Abulaiti, C.G. Ostenson [et al.] // Diabetes. — 2004. — Vol. 53(Suppl. 1). — P. S31-5.
88. Single-nucleotide polymorphism haplotypes in the both proximal promoter and exon 3 of the APM1 gene modulate adipocyte-secreted adiponectin hormone levels and contribute to the genetic risk for type 2 diabetes in French Caucasians / F. Vasseur, N. Helbecque, C. Dina [et al.] // Hum. Mol. Genet. — 2002. — Vol. 11(21). — P. 2607-14.
89. Gibson F. Genetics of the APM1 locus and its contribution to type 2 diabetes susceptibility in French Caucasians / F. Gibson, P. Froguel // Diabetes. — 2004. — Vol. 53(11). — P. 2977-83.
90. Chronomedicine and type 2 diabetes: shining some light on melatonin / A.C. Forrestel, S.U. Miedlich, M. Yurcheshen, S.D. Wittlin, M.T. Sellix // Diabetologia. — 2016. [Epub ahead of print]
91. Peschke E. Experimental and clinical aspects of melatonin and clock genes in diabetes / E. Peschke, I. Bähr, E. Mühlbauer // J. Pineal Res. — 2015. — Vol. 59(1). — P. 1-23. — doi: 10.1111/jpi.12240. Epub 2015 Jun 6.
92. Peschke E. Melatonin and pancreatic islets: interrelationships between melatonin, insulin and glucagon / E. Peschke, I. Bähr, E. Mühlbauer // Int. J. Mol. Sci. — 2013. — Vol. 14(4). — P. 6981-7015. — doi: 10.3390/ijms14046981.
93. Hardeland R. Melatonin and the pathologies of weakened or dysregulated circadian oscillators / R. Hardeland // J. Pineal Res. — 2017. — Vol. 62(1). — doi: 10.1111/jpi.12377. Epub 2016 Nov 24.
94. Common type 2 diabetes risk variant in MTNR1B worsens the deleterious effect of melatonin on glucose tolerance in humans / M. Garaulet, P. Gуmez-Abellon, P. Rubio-Sastre, J.A. Madrid, R. Saxena, F.A. Scheer // Metabolism. — 2015. — Vol. 64(12). — P. 1650-7. — doi: 10.1016/j.metabol.2015.08.003. Epub 2015 Aug 14.
95. Zinc-Associated Variant in SLC30A8 Gene Interacts With Gestational Weight Gain on Postpartum Glycemic Changes: A Longitudinal Study in Women With Prior Gestational Diabetes Mellitus / T. Wang, H. Liu, L. Wang [et al.] // Diabetes. — 2016. — Vol. 65(12). — P. 3786-3793. Epub 2016 Sep 6.
96. Chabosseau P. Zinc and diabetes / P. Chabosseau, G.A. Rutter // Arch. Biochem. Biophys. — 2016. — Vol. 611. — P. 79-85. — doi: 10.1016/j.abb.2016.05.022. Epub 2016 Jun 1.
97. Intracellular zinc in insulin secretion and action: a determinant of diabetes risk? / G.A. Rutter, P. Chabosseau, E.A. Bellomo [et al.] // Proc. Nutr. Soc. — 2016. — Vol. 75(1). — P. 61-72.
Epub 2015 Sep 14.
98. Association of SLC30A8 gene polymorphism with type 2 diabetes, evidence from 46 studies: a meta-analysis / M. Fan, W. Li, L. Wang [et al.] // Endocrine. — 2016. — Vol. 53(2). — P. 381-94. — doi: 10.1007/s12020-016-0870-4. Epub 2016 Feb 1.
99. Correlation between protein and mRNA abundance in yeast / S.P. Gygi, Y. Rochon, B.R. Franza, R. Aebersold // Mol. Cell. Biol. — 1999. — Vol. 19(3). — P. 1720-30.
100. Effect of energy restriction and physical exercise intervention on phenotypic flexibility as examined by transcriptomics analyses of mRNA from adipose tissue and whole body magnetic resonance imaging / S. Lee, F. Norheim, T.M. Langleite [et al.]; Nutri Tech Consortium // Physiol. Rep. — 2016. — Vol. 4(21). — pii: e13019.
101. Selection-, age-, and exercise-dependence of skeletal muscle gene expression patterns in a rat model of metabolic fitness / Y.Y. Ren, L.G. Koch, S.L. Britton [et al.] // Physiol. Genomics. — 2016. — Vol. 48(11). — P. 816-825. — doi: 10.1152/physiolgenomics.00118.2015. Epub 2016 Sep 16.
102. Сахарный диабет от ребенка до взрослого / А.С. Сенаторова, Ю.И. Караченцев, Н.А. Кравчун [и др.]. — Харьков: ХНМУ, 2009. — 260 c.
103. Velho G. Missense mutations in the pancreatic islet beta cell inwardly rectifying K+ channel gene (KIR6.2/BIR): a meta-analysis suggests a role in the polygenic basis of Type II diabetes mellitus in Caucasians / G. Velho, P. Froguel // Diabetologia. — 1998. — Vol. 41(12). — P. 1511-1515. — doi: 10.1007/s001250051098.
104. Large-scale association studies of variants in genes encoding the pancreatic beta-cell KATP channel subunits Kir6.2 (KCNJ11) and SUR1 (ABCC8) confirm that the KCNJ11 E23K variant is associated with type 2 diabetes / A.L. Gloyn, M.N. Weedon, K.R. Owen [ et al.] // Diabetes. — 2003. — Vol. 52(2). — P. 568-572. — doi: 10.2337/diabetes.52.2.568.
105. A genome-wide association study of type 2 diabetes in Finns detects multiple susceptibility variants / L.J. Scott, K.L. Mohlke, L.L. Bonnycastle [et al.] // Science. — 2007. — Vol. 316(5829). — P. 1341-1345.
106. Twelve type 2 diabetes susceptibility loci identified through large-scale association analysis / B.F. Voight, L.J. Scott, V. Steinthorsdottir [et al.] // Nat. Genet. — 2010. — Vol. 42(7). — P. 579-589. — doi: 10.1038/ng.609.
107. Genomewide search for type 2 diabetes-susceptibility genes in French whites: evidence for a novel susceptibility locus for early-onset diabetes on chromosome 3q27-qter and independent replication of a type 2-diabetes locus on chromosome1q21–q24 / N. Vionnet, E.H. Hani, S. Dupont [et al.] // Am. J. Hum. Genet. — 2000. — Vol. 67(6). — P. 1470-1480. — doi: 10.1086/316887.
108. Single nucleotide polymorphisms in the proximal promoter region of the adiponectin (APM1) gene are associated with type 2 diabetes in Swedish Caucasians / K. Humphreys, C. Wahlestedt, A.J. Brookes, S. Efendic // Diabetes. — 2004. — Vol. 53(1). — P. 31-35.
109. Genetic variation in the gene encoding adiponectin is associated with an increased risk of type 2 diabetes in the Japanese population / K. Hara, P. Boutin, Y. Mori [et al.] // Diabetes. — 2002. — Vol. 51(2). — P. 536-540. — PMID: 11812766.
110. Зак К.П., Попова В.В. Предсказание развития сахарного диабета 1-го типа и диагностика его асимптомной фазы с помощью аутоантител к островкам Лангерганса поджелудочной железы у человека задолго до возникновения у него заболевания // Международный эндокринологический журнал. — 2016. — № 7(79). — С. 11-21. — DOI: 10.22141/2224-0721.7.79.2016.86414
111. Single nucleotide polymorphisms in the proximal promoter region of the adiponectin (APM1) gene are associated with type 2 diabetes in Swedish Caucasians / K. Humphreys, C. Wahlestedt, A.J. Brookes, S. Efendic // Diabetes. — 2004. — Vol. 53(1). — P. 31-35.
112. Genetic variation in the gene encoding adiponectin is associated with an increased risk of type 2 diabetes in the Japanese population / K. Hara, P. Boutin, Y. Mori [et al.] // Diabetes. — 2002. — Vol. 51(2). — P. 536-540. — PMID: 11812766.
113. Susceptibility genes for insulin resistance and type 2 diabetes / F. Grigorescu, R. Attaoua, E. Ait Mkadem, S. Radian, Cheta D. // Genetics of diabetes. — The Truth Unveiled. Ed Acad Rom, Bucuresti & S. Karger AG, Basel, 2010. — P. 131-192.