Введение
Для нейтрализации перекиси водорода и вторичных радикалов, образующихся во время оксидативного стресса, клетки респираторного тракта, кроме каталазы, располагают глутатионовой, селензависимыми глутаредоксиновой, тиоредоксиновой и селеннезависимой пероксиредоксиновой системами. Глутатионовая система в антиоксидантной защите органов дыхания играет центральную роль. Глутаредоксиновая система участвует в нейтрализации перекиси водорода и вторичных радикалов, образующихся во время оксидативного стресса клетки [1].
Селензависимые антиоксидантные молекулярные системы
Система глутаредоксинов
Семейство глутаредоксинов
Глутаредоксиновая система состоит из глутаредоксинов (GRX), глутатиона и НАДФН-зависимой глутатионредуктазы. Глутаредоксины (GRX, КФ 1.20.4.1) представляют собой глутатионзависимые оксидоредуктазы суперсемейства тиоредоксинов с низкой молекулярной массой (9–14 кДa). В зависимости от количества цистеиновых остатков в активном центре GRX разделены на монотиольные (CGFS) и дитиольные (CP/SYC) глутаредоксины. Каталитический центр монотиольных GRX образован последовательностью Cys–Gly–Phe–Ser, а дитиольных — Cys–Pro (или Ser)–Tyr–Cys. Монотиольные GRX содержат несколько консервативных аминокислотных последовательностей, которые участвуют в связывании глутатиона. Монотиольные GRX в отличие от дитиольных характеризуются высокой степенью идентичности аминокислотных последовательностей и подразделяются на однодоменные и многодоменные протеины. Также монотиольные GRX участвуют в регуляции обмена железа, биогенеза железосерного кластера. Дитиольные GRX являются эффективными катализаторами редукции глутатионом смешанных дисульфидов. Третичная структура молекулы GRX характеризуется наличием четырех β-слоев, которые окружены тремя α-спиралями. Каталитический центр молекул глутаредоксина расположен в N-терминальном регионе на петле β1-слоя и α1-спирали (рис. 1) [10, 17].
/170-1.gif)
Наличие рядом с активным центром пары аминокислотных остатков цистеина и пролина (консенсус: TVP) и GG-мотива (консенсус: GGxdD), а также двух положительно заряженных сайтов и мотива TVP в N-терминальном регионе позволяет молекулам окисленных GRX взаимодействовать с глутатион-дисульфид-редуктазой (GSR). Перенос электронов от НАДФН-зависимой GSR на окисленный GSSG приводит к образованию восстановленного глутатиона GSH, который, в свою очередь, восстанавливает окисленный GRX [10].
Глутаредоксины представлены парой дитиольных и парой монотиольных белков. Дитиольными глутаредоксинами являются GRX1 (12 кДа) с классическим Cys37–Pro–Tyr–Cys40-мотивом активного центра и GRX2 (16 кДа) с Cys37–Ser–Tyr–Cys40-мотивом в активном центре. Замена пролинового остатка на сериновый в активном мотиве GRX2 придает ему некоторые биохимические свойства, которые не отмечаются у GRX1. Во-первых, он более эффективно катализирует деглутатионилирование, во-вторых, не подавляет окисление структурных цистеиновых остатков и, в-третьих, может получать электроны как от глутатиона, так и от тиоредоксинредуктазы [14]. Эффективность катализа GRX2 (kcat/KM) в процессе деглутатионилирования смешанных дисульфидов в 1,5–3 раза выше, чем у GRX1. Кроме того, GRX2 катализирует обратимое глутатионилирование белков внутренней мембраны митохондрий в зависимости от изменения соотношения GSH/GSSG. Изоформа GRX2 обнаружена в двух сплайсинговых формах — GRX2α и GRX2β [2].
Монотиольными глутаредоксинами являются и многодоменный GRX3 (protein kinase C interacting cousin of thioredoxin), и однодоменный GRX5 протеины [10].
Для каждой изоформы глутаредоксинов характерна своя преимущественная локализация. Протеин GRX1, идентифицированный впервые как GSH-зависимый донор для рибонуклеозидредуктазы, локализован преимущественно в цитоплазме, в межмембранном пространстве митохондрии, может транслоцироваться и в ядро клетки. Также GRX1 находится внеклеточно — в сыворотке крови и мокроте. Протеин GRX1 вносит основной вклад в образование дезоксирибонуклеотидов, восстанавливает дегидроаскорбат, участвует в клеточной дифференцировке, регуляции активности факторов транскрипции и апоптоза. Протеин GRX2 локализуется в различных отделах клетки. Его изоформа GRX2a располагается преимущественно в митохондриях, а изоформы GRX2b, GRX2c — в перинуклеарном регионе и ядре клетки. Он является эффективным катализатором обратимого деглутатионилирования белка: его каталитическая эффективность в 1,5–3 раза выше, чем у GRX1. Протеин GRX2 также является субстратом тиоредоксинредуктазы. Глутаредоксин GRX3 находится в цитоплазме, а GRX5 — в митохондриях клетки [13].
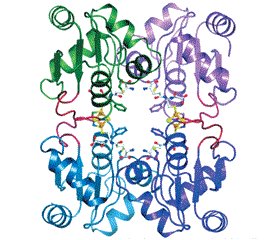
Протеины GRX1–3 являются димерами, GRX5 — тетрамером (рис. 2) [17].
Основными продуцентами внеклеточного GRX в респираторном тракте являются альвеолярные макрофаги и дифференцированные моноциты. Механизмы секреции и функции внеклеточного GRX в настоящее время остаются неизвестными. Предполагается, что внеклеточно расположенные GRX функционируют как хемокины [16].
Глутаредоксинзависимые окислительно-восстановительные реакции
Субстратами для всех GRX являются дисульфиды. В отличие от тиоредоксинов для GRX характерна высокая каталитическая активность по отношению к смешанным дисульфидам. Восстановление дисульфидов, которое катализируется GRX, может проходить монотиольным и дитиольным путем, то есть при участии соответственно одного или двух цистеиновых остатков аминокислотной последовательности активного центра. При монотиольном пути восстановления дисульфидов, который получил название «деглутатионилирование», используется только цистеиновый остаток N-терминального региона GRX. Монотиольным путем происходит восстановление смешанных дисульфидов белков или глутатионилированных белков. Специфическое взаимодействие GRX с остатком GSH смешанного дисульфида — белком-S-SG приводит к образованию интермедиата GRX-S-SG, который восстанавливается с помощью глутатиона (реакция 1). Окисленный глутатион GSSG, образующийся в ходе данной реакции, восстанавливается до GSH глутатионредуктазой (реакция 2). Так как для восстановления глутатионилированных белков требуется распознавание только GS-остатков, а не субстрата в целом, монотиольный путь, обес–печивающий деглутатионилирование, является, по-видимому, наиболее общей функцией GRX [10]. Данные реакции могут быть представлены в следующем виде:
R-S-SG + GRX (SH)2 → R-SH + GRX-S-SG, (1)
GRX-S-SG + GSH → GRX-(SH)2 + GSSG, (2)
где R-S-SG — смешанный дисульфид с глутатионом [18].
При дитиольном механизме восстановления дисульфидов цистеиновый остаток активного центра N-терминального региона молекулы GRX, осуществляя нуклеофильное взаимодействие, иници–ирует образование смешанного дисульфида. Второй свободный цистеиновый остаток С-терминального региона депротонируется и взаимодействует с атомом серы N-терминального региона, обусловливая образование окисленного фермента GRX-S2 и восстановленного субстрата (реакция 3). Окисленная форма фермента восстанавливается при взаимодействии с GSH, образуя смешанный дисульфид (между GSH и N-терминальным цистеиновым остатком активного центра), который, в свою очередь, восстанавливается второй молекулой GSH (реакция 4) [2, 12].
Дитиольный механизм:
R-S2 + GRX-(SH)2 → R-(SH)2 + GRX-S2, (3)
GRX-S2 + 2GSH → GRX-(SH)2 + GSSG [18]. (4)
Монотиольный и дитиольный механизмы GRX представлены на рис. 3 [2, 12].
Глутаредоксины функционируют в тесной связи с глутатионом и тиоредоксинами.
Другие физиологические эффекты системы глутаредоксинов
Глутаредоксины принимают участие во многих процессах жизнедеятельности клетки: защите от активных радикалов, развитии апоптоза, обмене железа. Так, GRX1 участвует в дифференцировке клеток, регуляции активности транскрипционных факторов и процесса апоптоза, оказывает протекторное действие на нейроны, защищая их от апоптоза, индуцированного допамином, путем активации NF-κB, катализируя процесс деглутатионилирования, восстанавливает функциональную активность таких белков, как глицеральдегид-3-фосфатдегидрогеназа, протеинтирозинфосфатаза 1В, креатинкиназа, c-Jun, субъединица р50 NF-kB, каспаза-3. GRX2, предотвращая высвобождение цитохрома C из митохондрий и окисление кардиолипина, ингибирует развитие апоптоза клетки [2, 7].
Глутаредоксины регулируют процесс воспаления в респираторном тракте. Показано, что GRX являются необходимым компонентом в дифференциации макрофагов. Снижение концентрации GRX ассоциировано с высоким уровнем адриамицининдуцированной гибели макрофагов [3]. Протеин GRX1 обладает выраженным провоспалительным свойством. В респираторном тракте GRX1 преимущественно локализуется в эпителиоцитах бронхиального дерева и альвеолярных макрофагах [6]. Протеин GRX1 регулирует активность провоспалительных сигнальных путей, действуя на субъединицы IκB-киназного комплекса (IKK) фактора транскрипции NF-κB. Реализация воспалительной реакции, ассоциированной с возбуждением NF-κB, опосредована преимущественно функционированием субъединицы IKK-β. Основным механизмом действия GRX1, который изменяет функциональную активность протеинов, является деглутатионилирование. Показано, что в условиях дефицита GRX1 в ответ на LPS-возбуждение отмечается слабое повышение активности фактора транскрипции NF-κB в эпителиальных клетках респираторного тракта. И дефицит активности NF-κB обусловлен S-глутатионилированием (Cys179) субъединицы IKK-β [5]. В физиологических условиях GRX1 катализирует деглутатионилирование субъединицы IKK-β. Scott W. Aesif и соавт. [4] cчитают, что активированные кислородсодержащие метаболиты (АКМ), генерация которых ассоциирована с действием РАМР инфекционных агентов, стимулируют экспрессию GRX1 и активность NF-κB в эпителиальных клетках респираторного тракта. Процесс РАМР-ассоциированного возбуждения сопровождается повышением активности S-глутатионилирования IKK-β, что снижает активность фактора транскрипции NF-κB. По достижении определенного уровня концентрации протеина GRX1 активность GRX1-ассоциированного деглутатионилирования начинает преобладать над S-глутатионилированием, что сопровождается усилением активности NF-κB и повышением продукции провоспалительных цитокинов. Процесс S-глутатионилирования IKK-α взаимосвязан с фосфорилированием IKK-α и Glu-киназы, и эта функциональная связь имеет решающее значение в процессе ацетилирования H3-гистона и Lys310-остатка протеина RelA/p65 на промоторах провоспалительных генов [9]. Поэтому S-глутатионилирование IKK-α сопровождается как фосфорилированием IKK-α, так и ацетилированием гистонов H3 и H4, в частности, в регионе промотора гена IL-6, что ведет к усилению продукции провоспалительных цитокинов (рис. 4) [8].
/1712-1.gif)
В целом высокая экспрессия GRX1 в эпителиоцитах и альвеолярных макрофагах снижает активность воспалительного процесса в респираторном тракте, а низкое содержание этого протеина способствует развитию Th1-/Th2-ассоциированного воспаления и фиброза легочной ткани [6, 15].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Abaturov AE, Volosovets AP, Borysova TP. The Antioxidant System of the Respiratory Tract the Intracellular Antioxidant Protection in the Respiratory Tract (Part 2). Zdorov’e rebenka. 2016;6(74):121-7. doi: 10.22141/2224-0551.6.74.2016.82144. (in Russian).
2. Kalinina EV, Chernov NN, Saprin AN. Part tio peroxide and glutaredoxins in cellular redox-dependent processes. Uspehi biologicheskoy himii. 2008;48:319-31. (in Russian).
3. Asmis R, Wang Y, Xu L, Kisgati M, Begley JG, Mieyal JJ. A novel thiol oxidation-based mechanism for adriamycin-induced cell injury in human macrophages. FASEB J. 2005 Nov;19(13):1866-8. doi: 10.1096/fj.04-2991fje. Epub 2005 Sep 13.
4. Aesif SW, Anathy V, Kuipers I, Guala AS, Reiss JN, Ho YS, Janssen-Heininger YM. Ablation of glutaredoxin-1 attenuates lipopolysaccharide-induced lung inflammation and alveolar macrophage activation. Am J Respir Cell Mol Biol. 2011 Apr;44(4):491-9. doi: 10.1165/rcmb.2009-0136OC. Epub 2010 Jun 10.
5. Reynaert NL, van der Vliet A, Guala AS, et al. Dynamic redox control of NF-kappa B through glutaredoxin-regulated S-glutathionylation of inhibitory kappa B kinase beta. Proc Natl Acad Sci USA. 2006 Aug 29;103(35):13086-91. doi: 10.1073/pnas.0603290103. Epub 2006 Aug 17.
6. Peltoniemi M, Kaarteenaho-Wiik R, Säily M, et al. Expression of glutaredoxin is highly cell specific in human lung and is decreased by transforming growth factor-beta in vitro and in interstitial lung diseases in vivo. Hum Pathol. 2004 Aug;35(8):1000-7. PMID: 15297967.
7. Rouhier N, Couturier J, Johnson MK, Jacquot JP. Glutaredoxins: roles in iron homeostasis. Trends Biochem Sci. 2010 Jan;35(1):43-52. doi: 10.1016/j.tibs.2009.08.005. Epub 2009 Oct 5.
8. Chung S, Sundar IK, Yao H, Ho YS, Rahman I. Glutaredoxin 1 regulates cigarette smoke-mediated lung inflammation through differential modulation of I{kappa}B kinases in mice: impact on histone acetylation. Am J Physiol Lung Cell Mol Physiol. 2010 Aug;299(2):192-203. doi: 10.1152/ajplung.00426.2009. Epub 2010 May 14.
9. Yang SR, Valvo S, Yao H, et al. IKK alpha causes chromatin modification on pro-inflammatory genes by cigarette smoke in mouse lung. Am J Respir Cell Mol Biol. 2008 Jun;38(6):689-98. doi: 10.1165/rcmb.2007-0379OC. Epub 2008 Jan 31.
10. Lillig CH, Berndt C, Holmgren A. Glutaredoxin systems. Biochim Biophys Acta. 2008 Nov;1780(11):1304-17. doi: 10.1016/j.bbagen.2008.06.003. Epub 2008 Jun 18.
11. Mieyal JJ, Gallogly MM, Qanungo S, Sabens EA, Shelton MD. Molecular mechanisms and clinical implications of reversible protein S-glutathionylation. Antioxid Redox Signal. 2008 Nov;10(11):1941-88. doi: 10.1089/ars.2008.2089.
12. Prasad VR, Tripathi BN, Sethumadhavan R. Distinct role of non-covalent interactions to the function and structural stability of glutaredoxins: a multifunctional redox protein. Int J Bioinform Res Appl. 2010;6(3):241-59. doi: 10.1504/IJBRA.2010.034073.
13. Ahsan MK, Lekli I, Ray D, Yodoi J, Das DK. Redox regulation of cell survival by the thioredoxin superfamily: an implication of redox gene therapy in the heart. Antioxid Redox Signal. 2009 Nov;11(11):2741-58. doi: 10.1089/ARS.2009.2683.
14. Johansson C, Kavanagh KL, Gileadi O, Oppermann U. Reversible sequestration of active site cysteines in a 2Fe-2S-bridged dimer provides a mechanism for glutaredoxin 2 regulation in human mitochondria. J Biol Chem. 2007 Feb 2;282(5):3077-82. doi: 10.1074/jbc.M608179200. Epub 2006 Nov 22.
15. Reynaert NL, Wouters EF, Janssen-Heininger YM. Modulation of glutaredoxin-1 expression in a mouse model of allergic airway disease. Am J Respir Cell Mol Biol. 2007 Feb;36(2):147-51. doi: 10.1165/rcmb.2006-0259RC. Epub 2006 Sep 15.
16. Shelton MD, Mieyal JJ. Regulation by reversible S-glutathionylation: molecular targets implicated in inflammatory diseases. Mol Cells. 2008 May 31;25(3):332-46. Epub 2008 May 16. PMCID: PMC3367451.
17. Johansson C, Roos AK, Montano SJ, et al. The crystal structure of human GLRX5: iron-sulfur cluster co-ordination, tetrameric assembly and monomer activity. Biochem J. 2011 Jan 15;433(2):303-11. doi: 10.1042/BJ20101286.
18. Holmgren A, Johansson C, Berndt C, Lönn ME, Hudemann C, Lillig CH. Thiol redox control via thioredoxin and glutaredoxin systems. Biochem Soc Trans. 2005 Dec;33(Pt 6):1375-7. doi: 10.1042/BST20051375.

/170-1.gif)
/170-2.gif)
/171-1.gif)
/1712-1.gif)