Вступ
На сучасному етапі розвитку педіатрії не викликає сумнівів той факт, що провідними компонентами неспецифічного захисту респіраторного тракту є антимікробні пептиди, одним із представником яких виступають дефензини. Вони як захищають поверхні слизових оболонок від фіксації патогенних мікроорганізмів, так і беруть участь в регуляції життєдіяльності мікрофлори і імунної системи людини, тим самим запобігаючи розвитку інфекційних, запальних і алергічних захворювань [1]. Дефензини представлені кількома класами, серед яких виділяють дві основні групи: α- і β-дефензини. Найбільш поширеними серед β-дефензинів у секреті дихальних шляхів людини є β1- та β4-дефензини [24, 26]. При цьому молекули β1-дефензинів експресуються в епітеліальних клітинах дихальних шляхів, забезпечуючи постійний рівень захисту (конститутивна експресія), та сприяють вродженому імунітету шляхом прямої антимікробної активності, а їх рівні експресії корелюють з імунним захистом від інфекції при захворюваннях легенів [18, 21]. Окрім прямих бактеріостатичних ефектів відомі і опосередковані механізми включення дефензинів у систему вродженого імунного захисту: β-дефензини є хемоатрактантами нейтрофілів у вогнище запалення, викликають дегрануляцію тучних клітин, забезпечують міграцію і проліферацію кератиноцитів [7, 16, 29].
Поряд із дефензинами ключовим білком природного імунітету, який забезпечує протибактеріальний, противірусний і протигрибковий захист, виступає лактоферин [4]. Лактоферин — це залізозв’язуючий білок, що секретується нейтрофілами та є важливим маркером запального процесу, показником гострої фази запалення [4, 13]. Присутність заліза в макроорганізмі має важливе значення для росту бактерій [19]. Висока афінність лактоферину до заліза, що призводить до зв’язування цим білком вільних іонів заліза, обмежує кількість останнього для бактеріального поглинання, і, таким чином, пригнічується ріст мікроорганізмів [15]. Відомо, що в організмі людини лактоферин взаємодіє також зі специфічними клітинними рецепторами, локалізованими на мембранах епітеліальних та імунних клітин [10, 31]. Численні експерименти підтверджують, що лактоферин може впливати на патогенез інфекційної патології не тільки при безпосередній взаємодії з бактерією або клітиною-мішенню, а й через стимуляцію імунної системи організму [17].
Захворювання респіраторного тракту певною мірою пов’язані з біологічними властивостями бактерицидного білка, що збільшує проникність (BPI) [12]. Цей білок міститься в азурофільних гранулах нейтрофілів людини, зв’язується з ліпідом A та проявляє бактерицидну дію щодо багатьох грамнегативних бактерій. Після поглинання грамнегативних бактерій BPI здатний зв’язуватися з бактеріальними ліпополісахаридами та нейтралізувати їх активність. Завдяки високій афінності BPI до ліпідів А ліпополісахаридів антимікробна активність даного білка у фізіологічних наномолярних концентраціях більшою мірою виражена відносно грамнегативних бактерій. Завдяки своїм антибактеріальним властивостям BPI обмежують бактеріальний ріст, послаблюють формування бактеріальних біоплівок і посилюють опсонізацію бактерій [12]. Захисна дія BPI відносно L-форм грампозитивних бактерій, грибів і Toxoplasma gondii проявляється лише за наявності високих концентрацій даного пептиду [6]. Описано також противірусну дію даного пептиду [12] Механізми, за допомогою яких BPI пригнічує ріст мікроорганізмів, були продемонстровані в дослідженнях in vitro, в яких показаний його прямий бактеріостатичний ефект на Pseudomonas aeruginosa і Mycoplasma pneumoniaе, а також гальмівну дію на реплікацію вірусу Епштейна — Барр [14, 32]. При цьому вважається, що BPI може модулювати секрецію інших антимікробних пептидів у дихальних шляхах. В експерименті було показано, що дефіцит даного пептиду призводить до зниження експресії інших антимікробних пептидів, таких як LL37, лактоферин і лізоцим [20].
Таким чином, антимікробні пептиди відіграють важливу роль в активації процесів запалення, репарації та регуляції імунної відповіді. Порушення експресії антимікробних пептидів супроводжується збільшенням ризику розвитку інфекційних, запальних, алергічних і автоімунних захворювань [2, 8, 27].
Мета дослідження: встановити взаємозв’язок між особливостями бактеріальної колонізації респіраторного тракту у дітей раннього віку, хворих на гострий бронхіт, та активністю ендогенних антимікробних пептидів.
Матеріали та методи
Для досягнення поставленої мети проведено комплексне обстеження 46 хворих віком від 1 міс. до 3 років (середній вік — 1,6 ± 0,1 року) з гострим бронхітом. Верифікація діагнозу проводилась згідно з критеріями діагностики гострого бронхіту (Наказ Міністерства охорони здоров’я України № 18 від 31 грудня 2005 року «Протокол лікування дітей з гострими бронхітами») [9].
Критеріями включення виступали вік дитини — від 1 місяця до 2 років 11 місяців 29 днів, встановлений діагноз «гострий бронхіт», інформована згода батьків на проведення дослідження. Критеріями виключення були вік дитини — молодше 1 місяця та старше 3 років, наявність вроджених вад розвитку бронхолегеневої системи та інших вад розвитку в стадії декомпенсації, відсутність згоди батьків на проведення дослідження.
Тяжкість перебігу гострого бронхіту у дітей досліджуваної групи визначали згідно зі шкалою ABSS (табл. 1) у перші 24 години з моменту надходження до стаціонару [23]. При отриманні оцінки менше 5 балів за шкалою АBSS, що відповідало легкому перебігу гострого бронхіту, пацієнти не включалися в дослідження. Контрольну групу становили 17 умовно здорових дітей, репрезентативних за віком.
/18-1.gif)
Обов’язковий комплекс обстеження включав рентгенографію органів грудної клітки, дослідження загального аналізу крові, загального аналізу сечі, бактеріологічне дослідження мазків зі слизової ротоглотки. Дослідження мікробного спектра біоматеріалу зі слизових оболонок ротоглотки проводилося до призначення антибактеріальної терапії на 2–3-й день захворювання на бактеріологічному аналізаторі VITEK 2 COMPACT (ВioMérieux, Франція) з використанням програмного забезпечення AES: Global CLSI-based + Phenotypic. Вміст b1-дефензинів в сироватці крові досліджували за допомогою імуноферментного аналізу (ІФА) з використанням комерційного набору Defensin Beta 1 (Elisa, Німеччина). Дослідження рівня лактоферину проводилося з використанням комерційного набору Human Lactoferrin виробництва Hyculbiotech (Нідерланди). Рівень бактерицидного білка, що підвищує проникність клітин (hBPI), вивчався методом ІФА з використанням тест-наборів Human BPI (Hyculbiotech, Нідерланди).
Отримані результати опрацьовано методом варіаційної статистики з використанням пакета аналізу програми Statisticа for Windows 6.0 з обчисленням середнього арифметичного (М), середнього квадратичного відхилення (σ) і середніх помилок (m), коефіцієнта парної лінійної кореляції Пірсона (r). Для оцінки відмінностей показників у порівнюваних крупах використовувався t-критерій Стьюдента. Відмінності вважали вірогідними при р < 0,05.
Результати та обговорення
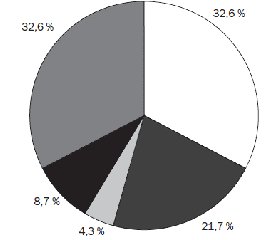
Проведене мікробіологічне обстеження матеріалу мазків з ротоглотки дітей, хворих на гострий бронхіт, виявило у 31 дитини (74,3 %) діагностично значущу колонізацію верхніх дихальних шляхів патогенною мікрофлорою (рис. 1). Мікрофлорою, що домінувала у дітей, хворих на гострий бронхіт, виявилися Haemophilus influenzaе — 15 (32,6 %) дітей та Streptococcus pneumoniae — 10 (21,7 %) дітей. В поодиноких випадках виявлялися грамнегативні Klebsiella pneumoniae (2 пацієнти — 4,3 %). У 4 (8,7 %) хворих, у яких було виділено Streptococcus pyogenes (2 пацієнти — 4,3 %), Enterococcus faecalis (1 хворий — 2,2 %) та Proteus mirabilis (1 хворий — 2,2 %), спостерігалася мікробна асоціація з дріжджоподібними грибами Candida albicans. У 15 (32,6 %) пацієнтів ми не змогли виявити провідний патогенетичний чинник.
/19-1.gif)
Враховуючи наявність у цієї когорти дітей ознак бактеріального запалення (відсутність катаральних проявів, наявність фебрильної лихоманки понад 3 доби, нейтрофільний лейкоцитоз із зсувом лейкоцитарної формули вліво), виділені мікроорганізми в діагностично значущих титрах (> 105) були розцінені нами як етіологічний збудник гострого бронхіту.
Для подальшого спостереження нами було відібрано 25 дітей, хворих на гострий бронхіт, у яких при бактеріологічному дослідженні було виділено Haemophilus influenzaе або Streptococcus pneumoniae, та 15 дітей з бронхітом вірусної етіології.
Оцінка тяжкості перебігу гострого бронхіту у дітей раннього віку за шкалою ABSS показала, що найбільш тяжкий перебіг захворювання спостерігався серед пацієнтів, у яких інфекційний процес був викликаний бактеріальною флорою. Так, середня оцінка за шкалою ABSS в групі хворих, у яких етіологічним збудником виступали бактерії Haemophilus influenzaе, становила 15,0 ± 1,3 бала, а при бронхітах, викликаних Streptococcus pneumoniae, — 13,0 ± 1,4 бала. У той же час за наявності вірусної етіології захворювання оцінка за шкалою ABSS не перевищувала 10 балів і в середньому по групі становила 7,2 ± 1,4 бала.
Наступним етапом роботи було дослідження вмісту антимікробних пептидів у сироватці крові дітей, хворих на гострий бронхіт, залежно від етіологічного чинника. Результати проведених досліджень наведено в табл. 2.
Відомо, що β1-дефензини (hBD-1) є основними факторами вродженого імунітету і, відповідно, антимікробного бар’єру системи MALT. Антимікробні властивості дефензинів обумовлені їх електростатичною взаємодією з бактеріями, що призводить до лізису мікробних клітин [2, 5].
За результатами дослідження було встановлено, що в групі хворих на вірусний бронхіт та у дітей, в яких було виділено Streptococcus pneumoniae, вміст β1-дефензинів статистично не відрізнявся від показників контрольної групи. Отримані результати виглядають логічними, враховуючи, що за допомогою β1-дефензинів забезпечується активність щодо тільки грамнегативних бактерій та грибів [8].
Беручи до уваги той факт, що одним із стимулюючих факторів продукції β1-дефензинів виступають ліпополісахариди грамнегативних бактерій, ми очікували підвищення означеного антимікробного пептиду в групі дітей, у яких бронхіт був викликаний Haemophilus influenzaе. Проте в даній групі хворих спостерігалося зниження вмісту β1-дефензинів у сироватці крові в 2 рази порівняно з показниками контрольної групи. На нашу думку, це пов’язано зі зниженням конститутивної ендогенної експресії β1-дефензинів, що і призвело до контамінації дихальних шляхів грамнегативною мікрофлорою. Отримані нами дані узгоджуються з проведеним C. Moser еt al. (2002) експериментальним дослідженням на щурах, в якому було встановлено, що за наявності у тварин дефіциту β1-дефензинів спостерігався уповільнений кліренс Haemophilus influenzae з дихальних шляхів [22].
Розуміючи, що поряд із зв’язуванням і транспортом іонів заліза основними біологічними функціями лактоферину є також антибактеріальна, противірусна і протигрибкова активність [28, 30], ми дослідили вміст даного антимікробного пептиду в сироватці крові дітей з груп спостереження. Проведений аналіз одержаних результатів показав його вірогідне підвищення (в 1,7 раза) у групі дітей з вірусною етіо–логією захворювання порівняно з групою здорових дітей (табл. 2). Можливо, це пов’язано з тим, що лактоферин пригнічує початкові стадії розвитку вірусної інфекції, зв’язуючись з вірусною частинкою або з рецепторами клітини-господаря [10].
У той же час у групах дітей, хворих на бронхіт, –зумовлений бактеріальною етіологією, було відмічено лише тенденцію до підвищення означеного антимікробного білка відносно показників контрольної групи, але без статистичної вірогідності. Недостатня активація синтезу лактоферину при бактеріальній респіраторній інфекції може бути обумовлена декількома причинами. З одного боку, відомо, що антимікробна дія лактоферину реалізується прямою взаємодією білкової молекули з поверхнею бактерії. При цьому при інфікуванні Streptococcus pneumoniae відбувається зв’язування позитивно зарядженого лактоферину з аніонними молекулами бактеріальної поверхні, такими як ліпотейхоєва кислота, в результаті чого негативний заряд стінки бактеріальної клітини зменшується й обумовлює бактеріостатичний ефект, що призводить до пригнічення росту мікроорганізмів та експресії їх вірулентних факторів [3]. У той же час в іншому дослідженні показано, що штами Streptococcus рneumoniae здатні до зв’язування і нейтралізації лактоферину через свій спеціальний мембранний білок А, що оберігає їх від шкідливої дії антимікробного пептиду [25].
/20-1.gif)
При бактеріальній колонізації грамнегативною флорою антимікробні властивості лактоферину разом із відомим бактеріостатичним ефектом за рахунок зв’язуванням заліза пов’язані з його протеолітичною активністю. При цьому лактоферин гидролізує та інактивує мікробні білки, які відіграють ключову роль при бактеріальній колонізації грамнегативною флорою, зокрема Haemophilus influenzae [4]. У дослідженнях R. Ellison III et al. (2012) [15] було показано, що Haemophilus influenzaе еволюційно змінила свої властивості та почала використовувати лактоферин як джерело заліза для свого росту. Здатність цих грамнегативних бактерій використовувати залізо з залізозв’язуючих білків може виступати одним з основних факторів, який визначає вірулентність означених патогенів, що надає їм перевагу в розвитку захворювання. У зв’язку з цим можливо припустити, що при бактеріальній колонізації дихальних шляхів як Streptococcus pneumoniae, так і Haemophilus influenzae у дітей, хворих на гострий бронхіт, відбувається недостатній синтез лактоферину внаслідок його нейтралізації бактеріальною клітиною, що призводить до зниження запальної імунореактивності організму та більш тяжкого перебігу захворювання.
У процесі подальшої роботи ми дослідили вміст в сироватці крові дітей, які знаходилися під спостереженням, бактерицидного білка, що підвищує проникність клітин (hBPI). Проведений аналіз, дані якого наведено в табл. 2, показав, що у випадку бактеріальної етіології гострого бронхіту у дітей раннього віку відбувалося зниження hBPI в сироватці крові порівняно зі значеннями контрольної групи (p < 0,05). При цьому найменші значення означеного пептиду були встановлені в групі хворих, у яких бронхіт був викликаний грамнегативними бактеріями Haemophilus influenzaе. За наявності вірусної етіології гострого бронхіту спостерігалася лише тенденція до зниження hBPI, але без статистичної значущості. Зниження hBPI в сироватці крові при гострому бронхіті у дітей раннього віку, на нашу думку, може бути пов’язано з підвищеною утилізацією означеного антимікробного пептиду в умовах значної колонізації бактеріальною флорою. За даними C.D. Bingle et al. (2004), найбільш високі базальні рівні BPI виявлені в проксимальних відділах дихальних шляхів. На думку авторів, це є найбільш потужним бар’єром, що запобігає вторгненню патогенів у дистальні відділи респіраторного тракту. У той же час якщо інфікування відбулося, вміст BPI може знижуватися, що в подальшому призводить до активації інших захисних функцій дихальної системи для усунення бактеріальної респіраторної інфекції [11]. При колонізації дихальних шляхів грамнегативними бактеріями Haemophilus influenzaе ми спостерігали зниження активності іншого антимікробного пептиду першої лінії захисту — β1-дефензину, що, очевидно, у поєднанні з недостатньою активацією синтезу лактоферину виступало одним із факторів формування тяжкого перебігу гострого бронхіту у дітей раннього віку.
Таким чином, розвиток гострих бронхітів у дітей раннього віку супроводжувався різноспрямованими змінами активності антимікробних пептидів (рис. 2). Встановлено, що найбільш низькі значення β1-дефензинів та hBPI реєструвалися при бронхіті, викликаному грамнегативними бактеріями Haemophilus influenzaе, а також при тяжкому перебігу гострого бронхіту, про що свідчили отримані зворотні кореляційні зв’язки між означеними антимікробними пептидами та бальною оцінкою за шкалою ABSS (r = –0,41, p < 0,05 та r = –0,44, p < 0,05 відповідно).
Висновки
1. У дітей раннього віку тяжкий перебіг гострого бронхіту в 74,3 % обумовлений бактеріальною етіологією захворювання. Провідним етіологічним фактором у розвитку бактеріального гострого бронхіту виступають грамнегативні бактерії Haemophilus influenzaе (32,6 %).
2. Розвиток гострого бронхіту у дітей раннього віку незалежно від етіологічного чинника відбувається на фоні зниження активності антимікробного пептиду hBPI.
3. Колонізація дихальних шляхів грамнегативними бактеріями Haemophilus influenzaе призводить до порушення регуляції експресії антимікробних пептидів першої лінії захисту β1-дефензинів та hBPI, що в сукупності з недостатньою активацією синтезу лактоферину може виступати одним із патогенетичних факторів тяжкого перебігу захворювання.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Abaturov AY. Cationic Antimicrobial Peptides of Non-Specific Respiratory Protection: Defensins and Cathelicidins. Defensins — Molecules Undergoing Renaissance (Part 1). Zdorov’e rebenka. 2012;3:116-122. (in Russian).
2. Andreeva II. Obshchie i otlichitel’nye zakonomernosti formirovaniia immunnogo otveta pri immunooposredovannykh zabolevaniiakh. Dokt diss [General and distinctive patterns of formation of the immune response in immune-mediated diseases. Doct diss]. Rostov-na-Donu; 2016. 266p. (in Russian).
3. Borzenkova NV, Balabushevich NG, Larionova NI. Lactoferrin: physical and chemical properties, biological functions, delivery systems, pharmaceutical and nutraceutical preparations (Review). Biofarmatsevticheskiy zhurnal. 2010;2(3):3-19. (in Russian).
4. Brodskiy IB, Bondarenko VM, Tomashevskaya NN. Antimicrobial, immunomodulatory and prebiotic properties of lactoferrin. Byulleten Orenburgskogo nauchnogo tsentra UrO RAN. 2013;4:3-15. (in Russian).
5. Ilyashenko MG, Tarasova GN, Guseva AI. Endogenous antimicrobial peptides and their clinical and pathogenetic significance of inflammatory bowel diseases. Sovremennyie problemyi nauki i obrazovaniya: elektronnyiy nauchnyiy zhurnal. 2012;2:57-61. (in Russian).
6. Lipskaya AD. Faktory protivoinfektsionnoi zashchity slizistoi obolochki polosti rta lits, ispol’zuiushchikh s’emnye stomatologicheskie ortopedicheskie konstruktsii. Dokt diss [The mucosal anti-infection protection factors of the oral cavity of individuals using removable dental orthopedic constructions Doct diss]. Chelyabinsk; 2016. 147p. (in Russian).
7. Martynov AI, Pinegin VV, Pashenkov MV. Vrozhdennyi immunitet kak sistema zashchity ot vozdeistviia na organizm cheloveka antropogennykh faktorov [Innate immunity as a system of protection from the effects on the human body human factors]. Moscow: Mittil press; 2014. 271p. (in Russian).
8. Mishlanov VY. Defensins and other antimicrobial peptides and a role of neutrophil protein-synthesing function disorders for pathogenesis of respiratory diseases. Pulmonologiya. 2014;3:104-112. doi: 10.18093/0869-0189-2014-0-3-104-112. (in Russian).
9. Order of the Ministry of Health of Ukraine N 18 from 31.01.2005. Protocols of the treatment of children with acute bronchitis.
10. Chernousov AD, Nikonova MF, Sharova NI. Neolactoferrin as a stimulator of innate and adaptive immunity. Acta Naturae. 2013;3(18):67-73. (in Russian).
11. Bingle CD, LeClair ЕЕ, Havard S, et al. Phylogenetic and evolutionary analysis of the plunc gene family. Protein Sci. 2004;13:422-430. doi: 10.1110/ps.03332704.
12. Britto CJ, Cohn L. Bactericidal/Permeability-Increasing Protein Fold-Containing Family Member A1 in Airway Host Protection and Respiratory Disease. American journal of respiratory cell and molecular biology. 2015;52(5):525-534. doi: http://dx.doi.org/10.1165/rcmb.2014-0297RT.
13. Caccavo D, Pellegrino NM, Altamura M, et al. Antimicrobial and immunoregulatory functions of lactoferrin and its potential therapeutic application. J Endotoxin Res. 2002;8(6):403-417. doi: 10.1179/096805102125001000.
14. Chu HW, Thaikoottathil J, Rino JG, et al. Function and regulation of SPLUNC1 protein in Mycoplasma infection and allergic inflammation. J Immunol. 2007;179:3995-4002. doi: https://doi.org/10.4049/jimmunol.179.6.3995.
15. Ellison III RT. The effects of lactoferrin on gram-negative. Lactoferrin: Structure and Function. 2012;357:71-72.
16. Guaní-Guerra E, Santos-Mendoza Т, Lugo-Reyes SO, Terán LM. Antimicrobial peptides: general overview and clinical implications in human health and disease. Clin Immunol. 2010;135(1):1-11. doi: 10.1016/j.clim.2009.12.004.
17. Guillen C, McInnes IB, Vaughan DM, et al. Enhanced Th1 response to Staphylococcus aureus infection in human lactoferrin-transgenic mice. J Immunol. 2002;168:3950-3957. doi:10.4049/jimmunol.168.8.3950.
18. Herr C, Shaykhiev R, Bals R. The role of cathelicidin and defensins in pulmonary inflammatory diseases. Expert Opin Biol Ther. 2007;7:1449-1461. doi: 10.1517/14712598.7.9.1449.
19. Jahani S, Shakiba А, Jahani L. The Antimicrobial Effect of Lactoferrin on Gram-Negative and Gram-Positive Bacteria. International Journal of Infection. 2015;2(3):e27954. doi: 10.17795/iji27594.
20. Liu Y, Di ME, Chu HW, et al. Increased susceptibility to pulmonary Pseudomonas infection in Splunc1 knockout mice. J Immunol. 2013;191:4259-4268. doi: 10.4049/jimmunol.1202340.
21. Mathews M, Jia HP, Guthmiller JM, et al. Production of β-defensin antimicrobial peptides by the oral mucosa and salivary glands. Infect end Immun. 1999:67(6):2740-2745.
22. Moser C, Weiner DJ, Lysenko E, et al. β-Defensin 1 contributes to pulmonary innate immunity in mice. Infection and immunity. 2002;70(6):3068-3072. doi: 10.1128/IAI.70.6.3068-3072.2002.
23. Mwachari C, Nduba V, Nguti R, et al. Validation of a new clinical scoring system for acute bronchitis. Int J Tuberc Lung Dis. 2007;11(11):1253-1259.
24. Selsted ME, Ouellette AJ. Mammalian defensins in the antimicrobial immune response. Nat Immunol. 2005;6:551-557. doi: 10.1038/ni1206.
25. Shaper M, Hollingshead SK, Benjamin WH Jr, Briles DE. PspA protects Streptococcus pneumoniae from killing by apolactoferrin, and antibody to PspA enhances killing of pneumococci by apolactoferrin. Infect Immun. 2004;72:5031-5040. doi: 10.1128/IAI.72.9.5031-5040.2004.
26. Singh PK, Jia HP, Wiles K, et al. Production of beta-defensins by human airway epithelia. Proc Natl Acad Sci. 1998;95:14961-14966.
27. Smith SA, Derdeyn СА. A pathway to HIV-1 neutralization breadth. Nat Med. 2015;21(11):1246-1247. doi: 10.1038/nm.3989.
28. Steijns JM, van Hooijdonk AC. Occurrence, structure, biochemical properties and technological characteristics of lactoferrin. Brit J Nutr. 2000;84(1):11-17. doi: https://doi.org/10.1017/S0007114500002191.
29. Steinstraesser L, Kraneburg U, Jacobsen F, AlBenna S. Host defense peptides and their antimicrobial immunomodulatory duality. Immunobiol. 2011;216(3):322-333. doi: http://dx.doi.org/10.1016/j.imbio.2010.07.003.
30. Teng CT. Lactoferrin gene expression and regulation: an overview. Biochem Cell Biol. 2002;80:7-16. doi: 10.1139/o01-215.
31. Ward PP, Uribe-Luna S, Conneely OM. Lactoferrin and host defense. Biochem Cell Biol. 2002;80:95-102. doi: 10.1139/o01-214.
32. Zhou HD, Li XL, Li GY, et al. Effect of SPLUNC1 protein on the pseudomonas aeruginosa and epstein-barr virus. Mol Cell Biochem. 2008;309:191-197. doi: 10.1007/s11010-007-9659-3.

/18-1.gif)
/19-1.gif)
/20-1.gif)
/21-1.gif)