Резюме
У 34 дітей із різним ступенем стеатозу печінки був досліджений за допомогою водневого дихального тесту стан мікробіоти тонкого кишечника. Виявлений у третини дітей із стеатозом печінки (переважно третього ступеня) синдром надмірного бактеріального росту сприяв розвитку інсулінорезистентності, дисліпідемії, зокрема, ІІа типу (у 34,0 % дітей), ІІb типу (34,0 %), IV типу (17,0 %) та ізольованого зниження рівня холестерину ліпопротеїнів високої щільності (17,0 %).
У 34 детей с разной степенью стеатоза печени с помощью водородного дыхательного теста исследовано состояние микробиоты тонкого кишечника. Обнаруженный у трети больных стеатозом печени детей (преимущественно третьей степени) синдром избыточного бактериального роста способствовал развитию инсулинорезистентности, дислипидемии, в частности, ІІа типа (у 34,0 % детей), ІІb типа (34,0 %), IV типа (17,0 %) и изолированного снижения уровня холестерина липопротеинов высокой плотности (17,0 %).
Background. Nonalcoholic fatty liver disease (NAFLD) is associated with insulin resistance, dyslipidemia and obesity. Recent evidence supports a role of the gut microbiota in the pathogenesis of NAFLD. Changes in the microbiota can lead to intestinal bile acids content modification and different signal pathways activation that can promote NAFLD progression. The aim of the study was to investigate carbohydrate and lipid spectrum of the blood in children with hepatic steatosis, depending on the degree of steatosis and the presence of bacterial overgrowth syndrome. Materials and methods. Study participants included 34 children aged 5 to 17 years. Determining the presence and degree of hepatic steatosis was conducted using FibroScan® 502 Touch with controlled attenuation parameter (CAP) measurement. According to the presence and degree of steatosis, patients were divided into 4 groups: group S0 was presented by 21 patients without hepatic steatosis (61.8 %), group S1 — 4 patients with degree 1 of steatosis (11.7 %), group S2 — 4 patients with degree 2 of steatosis (11.7 %), group S3 — 5 patients with degree 3 of steatosis (14.8 %). To diagnose the functional state of intestinal microbiota, we performed a hydrogen breath test with a load of lactose or glucose using gas analyzer Gastrolyzer. According to the hydrogen breath test results, patients were divided into 2 groups: the first group consisted of 7 patients with the presence of small intestine bacterial overgrowth (SIBO), the second group included 22 children without SIBO. Serum samples were tested for total cholesterol, triglycerides, high density lipoprotein cholesterol (HDL cholesterol). Serum insulin and glucose levels were defined and HOMA-IR was calculated. Results. Frequency of SIBO detection was higher and amounted to 33.3 % in patients with hepatic steatosis, 23.5 % — in patients without steatosis. SIBO has been mainly detected in the S3 group (75.0 %) (p < 0.05). In 50 % of patients with degree 3 of steatosis we detected SIBO in contrast to patients without SIBO, which had degree 1 and 2 of steatosis. Patients with SIBO had different types of dyslipidemia: dyslipidemia IIa type (34.0 %), type IIb (34.0 %), type IV (17.0 %) and an isolated lowering HDL cholesterol (17.0 %). Patients with SIBO also were characterized by higher level of HOMA-IR, which showed the development of insulin resistance. Conclusions. SIBO can be the possible cause of persistent dyslipidemia and insulin resistance in children with hepatic steatosis.
Статтю опубліковано на с. 41-44
Вступ
Провідною нозологічною формою, морфологічним підґрунтям якої є жирова дистрофія печінки, в структурі хронічних дифузних захворювань печінки в дітей і підлітків є неалкогольна жирова хвороба печінки (НАЖХП) [1]. НАЖХП асоційована з абдомінальним ожирінням, інсулінорезистентністю, порушенням толерантності до вуглеводів та дисліпідемією, тобто має тісний зв’язок та є проявом метаболічного синдрому [2]. Нещодавні дослідження показали, що кишкова мікробіота бере активну участь у розвитку та прогресуванні патології печінки ще й завдяки модифікації жовчно-кислотного профілю [3, 4]. Схильність до прогресування структурних змін печінки з розвитком термінальних стадій захворювання — цирозу і гепатоцелюлярної карциноми, висока ймовірність розвитку кардіоваскулярних ускладнень, можливість запобігання прогредієнтному перебігу за умов своєчасного терапевтичного втручання обумовлює необхідність ранньої діагностики НАЖХП у дітей [5].
Мета роботи — вивчення особливостей ліпідного та вуглеводного спектра крові у дітей при стеатозі печінки залежно від ступеня стеатозу та наявності синдрому надмірного бактеріального росту.
Матеріали та методи
В обстеження включено 34 пацієнти віком від 5 до 17 років, серед них хлопчиків — 15 (44,1 %), дівчаток — 19 (55,9 %). Середній вік пацієнтів становив 11,73 ± 2,89 року. Визначення наявності й ступеня стеатозу печінки проводилось за допомогою апарату FibroScan® 502 Touch F60156 (Echosens, Франція) з дослідженням САР. Згідно з наявністю та ступенем стеатозу, що визначались за показником САР, пацієнти були розподілені на 4 групи: група S0 — 21 пацієнт без стеатозу печінки (61,8 %), група S1 — 4 пацієнти з 1-м ступенем стеатозу (11,7 %), група S2 — 4 пацієнти з 2-м ступенем стеатозу (11,7 %), група S3 — 5 пацієнтів із 3-м ступенем стеатозу (14,8 %).
Для діагностики стану тонкокишкової мікробіоти (визначення синдрому надмірного бактеріального росту (СНБР)) проводили водневий дихальний тест із навантаженням глюкозою або лактозою та використанням газоаналізатора Gastro Gastrolyzer компанії Bedfont Scientific Ltd (Великобританія) [6]. За даними водневого дихального тесту (ВДТ) пацієнтів розподілено на 2 групи: першу групу становили 7 пацієнтів із СНБР (СНБР+), другу групу — 22 дитини без СНБР (СНБР–). У сироватці крові визначали вміст загального холестерину (ХС), вміст тригліцеридів (ТГ), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) з використанням наборів реактивів Cormey (Польша) за допомогою біохімічного аналізатора Stat Fax 1904 Plus, Awareness Technology (США). Вміст холестерину ліпопротеїнів низької (ХС ЛПНЩ), дуже низької щільності (ХС ЛПДНЩ) та коефіцієнт атерогенності (КА) підраховували на основі емпіричних результатів. Вміст інсуліну в сироватці крові визначали імуноферментним методом і тест-набором фірми DRG International, Inc. (Німеччина) за допомогою імуноферментного аналізатора Stat Fax 303 Plus (США). Розрахунок HOMA-IR проводився за формулою:
/42.jpg)
Результати та обговорення
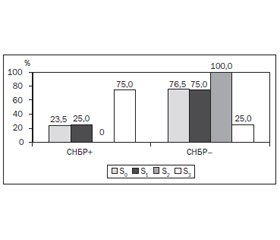
З метою визначення наявності СНБР у 12 обстежених хворих був виконаний ВДТ із навантаженням глюкозою, у 17 хворих — ВДТ із навантаженням лактозою. Аналіз частоти виявлення СНБР показав, що зміни у стані мікрофлори тонкої кишки спостерігались загалом у 27,6 % обстежених хворих. Частота виявлення СНБР була вищою й становила 33,3 % у групі хворих на стеатоз печінки порівняно з цим показником (23,5 %) у групі хворих без стеатозу печінки та без вірогідної значущості відмінностей між групами S+ і S–. Аналіз частоти виявлення СНБР за ступенем стеатозу продемонстрував переважання позитивних випадків ВДТ у групі S3 (75,0 %), що вірогідно відрізняло її від груп S0 (23,5 %) та S1 (25,0 %) (рис. 1).
/42_2.jpg)
Згідно із середніми показниками концентрації Н2 у видихуваному повітрі хворих залежно від ступеня стеатозу, середній рівень виділення Н2 у хворих із S3 перевищував порогове значення на 30, 45 та 180-й хв дослідження, становивши 15,0 ± 1,1 ppm, 14,0 ± 1,2 ppm, 12,7 ± 3,2 ppm відповідно, що вірогідно відрізняло хворих цієї групи від групи S0 та свідчило про наявність СНБР (табл. 1).
Внутрішньогруповий аналіз ліпідного профілю у хворих із позитивним результатом ВДТ показав наявність тенденції до збільшення концентрації ХС у сироватці крові у 29,0 % дітей до 5,00 ± 0,50 ммоль/л (табл. 2).
У третини хворих виявлено збільшення показника ТГ і зниження ХС ЛПВЩ в 1,8 раза на фоні збільшення рівня ХС ЛПДНЩ майже втричі порівняно з контролем (р < 0,05). Також у більшості хворих виявлено збільшення вмісту ХС ЛПНЩ в 1,3 раза порівняно з контролем. Майже в усіх дітей, які мали позитивний результат ВДТ, виявлено збільшення атерогенності крові, на що вказує зростання КА в 1,8 раза порівняно з нормою у 83,0 % хворих.
У дітей із негативним результатом ВДТ гіперхолестеринемія спостерігалась у 33,0 % випадків. Концентрація ХС у сироватці крові цих хворих в 1,4 раза (р < 0,05) перевищувала норму (табл. 3). При порівнянні з результатами ліпідного комплексу між хворими з різними результатами ВДТ слід визначити, що у 22,0 % дітей із відсутністю СНБР спостерігалось збільшення вмісту ТГ у сироватці крові в 2,5 раза порівняно з нормою (р < 0,05). У понад половини хворих (61,0 % пацієнтів) виявлено збільшення рівня ХС ЛПНЩ в сироватці крові в 1,4 раза (р < 0,01), а у 59,0 % пацієнтів — зниження вмісту ХС ЛПДНЩ в 1,6 раза (р < 0,01) порівняно з нормою.
Отже, в дітей з СНБР у 83,0 % випадків визначено дисліпідемію. За фенотипом виявлено дисліпідемії ІІа типу (34,0 % пацієнтів), ІІb типу (34,0 % пацієнтів), IV типу (17,0 % пацієнтів) та ізольоване зниження ХС ЛПВЩ (17,0 % пацієнтів).
Рівень інсуліну був підвищеним у групі хворих на СНБР порівняно з пацієнтами без СНБР, але значущість відмінностей між групами не була достатньою (табл. 4).
Індекс HOMA перевищував нормативні значення й свідчив про розвиток інсулінорезистентності у хворих на СНБР.
Отже, можливими причинами персистенції дисліпідемії та інсулінорезистентності у дітей із стеатозом печінки є надмірний рост бактерій у тонкому кишечнику, що метаболізують солі жовчних кислот у некон’юговані сполуки, при цьому декон’югація жовчних кислот призводить до токсичного ушкоджуючого ефекту щодо ентероцитів, утруднення роботи яких порушує асиміляцію жирів, вуглеводів і білків.
Висновки
1. Перебіг стеатозу печінки супроводжується розвитком СНБР у тонкому кишечнику практично у третини хворих, причому зростання ступеня жирової інфільтрації печінки асоціюється зі збільшенням питомої ваги СНБР.
2. Зміни ліпідного спектра переважної більшості дітей із СНБР характеризуються зростанням атерогенних властивостей крові з розвитком дисліпідемії ІІа, ІІb і IV типу та ізольованого зниження рівня ХС ЛПВЩ.
3. Характерною ознакою змін вуглеводного обміну хворих на СНБР є гіперінсулінемія, поєднана зі збільшенням HOMA-IR, що є свідченням формування інсулінорезистентності.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Березенко В.С., Михайлюк Х.З., Диба М.Б., Ткалик О.М. Причини розвитку, діагностика та підходи до лікування стеатозу печінки та неалкогольного стеатогепатиту у дітей // Современная педиатрия. — 2014. — № 4(60). — С. 119-125.
2. Kursawe R., Santoro N. Metabolic syndrome in pediatrics // Adv. Clin. Chem. — 2014. — Vol. 65. — Р. 91-142.
3. Courtney B. Ferrebee, Paul A. Dawson. Metabolic effects of intestinal absorption and enterohepatic cycling of bile acids // Acta Pharm. Sin. B. — 2015. — Vol. 5, № 2. — Р. 129-134. doi: 10.1016/j.apsb.2015.01.001.
4. Hannah Jones. Bile acid signaling and biliary functions / Hannah Jones, Gianfranco Alpini, Heather Francis // Acta Pharm. Sin. B. — 2015. — Vol. 5, № 2. — Р. 123-128. doi: 10.1016/j.apsb.2015.01.009.
5. Tauer M., Claudel T., Fickert P., Moustafa T., Wagner M. Bile Acid as Regulators of Hepatic Lipid and Glucose Metabolism // Digestive Disease. — 2010. — Vol. 28. — P. 220-224. doi: 10.1159/000282091.
6. Ledochowski М. Hydrogen Breath tests / M. Ledochowski. — Innsbruck: Akademie, 2008. — 20 р.
/42.jpg)
/42_2.jpg)

/42_3.jpg)
/43.jpg)