Журнал «» 5 (49) 2016
Вернуться к номеру
Дайджест Конгресу Європейського товариства кардіологів — 2016, м. Рим (Італія). Частина 1
Рубрики: Кардиология
Разделы: Медицинские форумы
Версия для печати
Статтю опубліковано на с. 85-99
Вступне слово Genevieve Derumeaux, голови Програмного комітету Конгресу Європейського товариства кардіологів — 2016
/85.jpg) Дорогі колеги!
Дорогі колеги!
Ми раді поділитися цими відібраними експертами моментами з Конгресу Європейського товариства кардіологів (ESC), який відбувся в Римі, Італія. Це був дуже цікавий конгрес! Рекордна кількість учасників, понад 33 000, приєдналися до нас у Римі, масштаб події знайшов своє відображення в науковому змісті, представленому на конгресі. Його Святість Франциск спеціальним візитом вшанував Конгрес ESC 2016 року на знак визнання значних зусиль з боку ESC і медичних працівників у всьому світу, спрямованих на просування профілактики, діагностики та лікування серцево-судинних захворювань. Цього року на конгресі увагу було зосереджено на важливості роботи так званої «команди серця» й міждисциплінарного підходу до ведення хворих із серцево-судинними захворюваннями. Цього року цікаві нові напрямки включають в себе хірургію, боротьбу з інсультом та електронну кардіологію. Протягом 5 днів конгресу були представлені 26 гарячих ліній, 25 сесій клінічних випробувань, 23 презентації реєстрів, 4 нових керівництва з клінічної практики ESC, документ з викладом позиції з кардіоонкології й 4594 тези. Конгрес ESC являє собою безперервний освітній продукт, що надає відео, слайди, реферати, звіти та презентацій через веб-сайт ESC. Ми розглядаємо це як важливий ресурс для лікарів по всьому світу, і ми націлені на цей ресурс для проведення інтерактивних дискусій серед колег про те, які нововведення можливо застосовувати в конкретних умовах. Обсяг і якість тез, поданих тут, продовжують робити Конгрес ESC захоплюючим та інноваційним форумом, у якому досягнення з галузі досліджень можуть бути переведені в практичне застосування для клініцистів. Статті, вибрані для цього дайджесту Конгресу ESC 2016, є офіційним висвітленням основних моментів Конгресу ESC 2016 року і являють собою найновіші та найбільш передові елементи, що мають значення для широкого кола фахівців-практиків. Деякі з досліджень і нових керівництв з клінічної практики ESC, поданих у прямому ефірі на Конгресі ESC 2016 року і на сторінках дайджесту Конгресу ESC 2016 року, на нашу думку, вплинуть на клінічну практику й дозволять нам краще зрозуміти, як нам діяти у важливих умовах і як розробити нові методи лікування. Результати дослідження ODYSSEY-ESCAPE показали, що інгібітор PCSK9 алірокумаб може значно зменшити або навіть усунути необхідність у дорогих і витратних за часом процедурах аферезу для лікування пацієнтів з гетерозиготною формою сімейної гіперхолестеринемії. До кінця дослідження в пацієнтів, які отримували алірокумаб, потреба в проведенні процедур аферезу порівняно з групою плацебо була на 75 % меншою. Дослідженням REVERSE II проспективно підтверджено правило HERDOO2 (у назві відображені 4 фактори, які необхідно враховувати при визначенні ризику в пацієнта венозної тромбоемболії (ВТЕ)), що робить його єдиним у даний час підтвердженим клінічним правилом прийняття рішення, яке допомагає лікарям, пацієнтам і організаторам охорони здоров’я вирішити, хто може припинити прийом антикоагулянтів після неспровокованої ВТЕ. Отримані дані особливо важливі тому, що в даний час на основі консенсусу поточних настанов припускають, що прийом антикоагулянтів слід продовжувати невизначено довго в усіх пацієнтів з неспровокованою ВТЕ і без високого ризику кровотечі. У дослідженні PRAGUE-18 проводили пряме порівняльне дослідження прасугрелю й тикагрелору у хворих з гострим інфарктом міокарда з підйомом сегмента ST, яким було виконане черезшкірне коронарне втручання, показало, що вони однаково безпечні та ефективні в запобіганні первинній кінцевій точці смерті, повторному інфаркту, терміновій реваскуляризації судин, інсульту, кровотечі, що вимагає переливання крові або подовження госпіталізації протягом 7 днів. На додаток до даних про результати кращих останніх клінічних випробувань, що висвітлюються в цьому дайджесті в першу чергу, ви також знайдете нову інформацію щодо окремих складних моментів серцево-судинної медицини.
Ми сподіваємося, що статті й практичні перспективи, що містяться на сторінках цього видання про Конгрес ESC 2016, будуть корисними у вашій клінічній практиці. Для того щоб отримати доступ до матеріалів Конгресу ESC (відео, слайди, реферати і звіти) протягом усього року, завітайте на сайт www.escardio.org/365.
Ми бажаємо всім вам успішного року і з нетерпінням чекаємо на зустріч в Барселоні на Конгресі ESC 2017. Для отримання більш детальної інформації, будь ласка, відвідайте www.escardio.org/ESC2017.
Огляд керівництв із клінічної практики ESC 2016
Європейське товариство кардіологів випустило чотири нових керівництва (настанови), розроблених цільовими експертними групами та рецензентами, що охоплюють фібриляцію передсердь, профілактику серцево-судинних захворювань (ССЗ), дисліпідемії та серцеву недостатність. Ці керівництва є оновленням версій 2012 року й підсумовують усі наявні дані за темами, забезпечуючи важливий ресурс для практикуючих лікарів.
Керівництво з лікування фібриляції передсердь
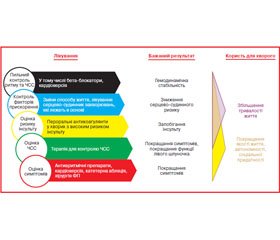
Керівництво з лікування фібриляції передсердь (ФП) 2016 ESC, створене у співпраці з Європейською асоціацією з кардіоторакальної хірургії (Kirchhof P. et al. // Eur. Heart J. 2016; Europace 2016), було розроблене цільовою групою експертів ESC з лікування ФП на чолі з Paulus Kirchhof, MD, University of Birmingham, Birmingham, United Kingdom, і Stefano Benussi, MD, University Hospital Zurich, Zurich, Switzerland. За останні кілька років значний прогрес був досягнутий у лікуванні пацієнтів із ФП. Незважаючи на цей прогрес, ФП, як і раніше, є основною причиною раптової смерті, інсульту, серцевої недостатності (СН) і серцево-судинної (СС) захворюваності. Рекомендації 2016 року підкреслюють важливість скринінгу груп підвищеного ризику за допомогою електрокардіографії (ЕКГ) для «німої» та недіагностованої ФП. При підозрі на ФП вона повинна бути документально підтверджена ЕКГ до початку лікування. Після того як був встановлений діагноз ФП, настанови рекомендують комплексний підхід до лікування, що охоплює п’ять галузей лікування: пильний контроль частоти та ритму; лікування провокуючих чинників; оцінка ризику розвитку інсульту; оцінка частоти серцевих скорочень (ЧСС) і оцінка симптомів (рис. 1).
Для досягнення бажаних результатів лікування ESC рекомендує комплексний підхід зі структурованою організацією медичної допомоги та подальшої діяльності для більш точного дотримання інструкцій і зниження числа госпіталізацій і смертності. Усі пацієнти з ФП повинні пройти клінічне обстеження, ЕКГ і ехокардіографію для оцінки початкового стану серцево-судинної системи, і ці дані повинні бути відповідним чином оброблені. Пацієнтам необхідно надати індивідуалізовану інформацію та навчання, щоб вони мали можливість підтримувати лікування ФП. Керівництво рекомендує пропонувати зміни способу життя для всіх пацієнтів, щоб зробити їх лікування більш ефективним.
Для більшості пацієнтів з ФП прийом пероральних антикоагулянтів буде корисним. Алгоритм ESC для початку призначення антикоагулянтів для профілактики інсульту заснований на наявності або відсутності ураження клапанів серця або мітрального стенозу, оцінці ризику, клінічній оцінці ризику інсульту з використанням шкали CHA2DS2-Vasc і оцінці реальних протипоказань до антикоагуляції. Нові пероральні антикоагулянти рекомендуються як перша лінія терапії в пацієнтів на основі оцінки їх безпечності. Керівництво рекомендує в пацієнтів, які отримують антикоагулянти, зниження модифікуючих факторів ризику кровотеч. Активна кровотеча має лікуватися відповідно до тяжкості, із затримкою прийому антикоагулянтів, відповідною симптоматичною терапією і можливістю реверсії антикоагулянтів у тяжких або загрозливих для життя випадках. Ці рекомендації за підтримки комплексного підходу до догляду мають допомогти зменшити кількість пацієнтів з ФП, у яких прийом пероральних антикоагулянтів припиняють, незважаючи на високий ризик розвитку інсульту. Довгостроковий контроль серцевого ритму зберігає функцію лівого шлуночка (ЛШ) і покращує симптоми ФП. Рис. 2 показує рекомендації з контролю частоти серцевих скорочень. Керівництво ESC рекомендує таку терапію контролю ритму для покращання симптомів у пацієнтів із ФП (табл. 1, 2).
Довгостроковий контроль ритму може бути досягнуто за допомогою ААТ або катетерної абляції. Рекомендації з ААТ включають: дронадерон, флекаїнід, пропафенон або соталол для пацієнтів з відсутністю або мінімальними ознаками структурної хвороби серця; дронадерон, соталол або аміодарон для пацієнтів з ішемічною хворобою серця (ІХС), значимим ураженням клапанів серця або значною гіпертрофією ЛШ; і аміодарон для пацієнтів із СН. Рекомендації з катетерної абляції ФП наведені в табл. 2.
Рекомендації з профілактики серцево-судинних захворювань у клінічній практиці
У 2016 році Європейське керівництво з профілактики серцево-судинних захворювань у клінічній практиці (Piepoli M.F. et al. // Eur. Heart J. 2016; Eur. J. Prev. Cardiol. 2016) було розроблене Шостою спільною цільової групою ESC та інших товариств на чолі з Massimo F. Piepoli, MD, Polichirurgico Hospital, G. DaSaliceto, Piacenza, Emilia Romagna, Italy, і Arno W. Hoes, MD, University Medical Center Utrecht, The Netherlands. Незважаючи на те що смертність і захворюваність, викликані серцево-судинними захворюваннями, знизилися завдяки превентивним заходам, багато факторів ризику зростає, а імплементація превентивних заходів залишається недостатньою. Потенціал усунення поведінкових факторів ризику ССЗ достатній для того, щоб запобігти до 80 % серцево-судинних захворювань і навіть 40 % ракових захворювань. На додаток до профілактики на індивідуальному рівні нове керівництво підкреслює популяційний підхід, зосередивши увагу на відмові від паління, здоровому харчуванні, фізичній активності, профілактиці зловживання алкоголем і здоровому довкіллі. Специфічні превентивні заходи, направлені на хворобу, повинні бути адресними. Крім того, у новому керівництві 2016 року визначені профілактичні заходи, спрямовані на конкретні групи — молодих людей; осіб віком > 60 років; жінок у цілому; жінок з анамнезом прееклампсії або гіпертензії, що викликані вагітністю, синдромом полікістозних яєчників або гестаційним цукровим діабетом (ЦД); етнічні меншини і хворих із станами, які підвищують ризик СС-захворювань (такі, як при запальних захворюваннях або при терапії раку).
Керівництво рекомендує систематичну оцінку загального ризику серцево-судинних захворювань, тому що прогресування атеросклерозу є підсумком впливу декількох факторів ризику (табл. 3). СС-ризик визначають наступним чином:
— дуже високий ризик: задокументоване СС-захворювання, клінічні або однозначні дані візуалізації, цукровий діабет з ураженням органів-мішеней або в поєднанні з основним фактором ризику, тяжка форма хронічної хвороби нирок, які при обчисленні за шкалою Systematic Coronary Risk Evaluation (SCORE) дають рівень ризику ≥ 10 %;
— високий ступінь ризику: значно підвищений рівень одного фактора ризику, цукровий діабет (за винятком молодих людей з низьким ризиком з діабетом 1-го типу), помірно виражене хронічне захворювання нирок, обчислений рівень за шкалою SCORE ≥ 5 % і < 10 %;
— помірний ризик: рівень за шкалою SCORE ≥ 1 % і < 5 % на 10 років;
— з низьким рівнем ризику: SCORE < 1 %.
Шкала для оцінки ризику SCORE призначена для використання в пацієнтів без ЦД, задокументованого СС-захворювання або значно підвищеного одного фактора ризику (наприклад, сімейна гіперліпідемія або тяжка артеріальна гіпертензія) і включає в себе стать, статус паління, вік, систолічний артеріальний тиск, рівень ліпідів і регіон проживання (http://www.escardio.org/Education/Practice-Tools/CVD-prevention-toolbox/SCORE-Risk-Charts).
Керівництво рекомендує поради щодо зміни способу життя для осіб із низьким та помірним ризиком; поради щодо інтенсивних змін способу життя й можливого медикаментозного лікування для осіб із високим ризиком і медикаментозне лікування для осіб із дуже високим ризиком. Цільові ризик-фактори і цільові рівні для них наведені в табл. 4.
Інші основні нові положення в настанові 2016 року включають в себе рекомендації щодо серцевої реабілітації у хворих з гострим коронарним синдромом (ГКС), після реваскуляризації та при серцевій недостатності. На додаток до традиційних положень у новій настанові дані рекомендації щодо втручань та допомоги вдома, сестринського нагляду та телемоніторингу. Також у настанові рекомендують систематичний моніторинг реалізації заходів із профілактики серцево-судинних захворювань і їх результативності з використанням стандартних показників ефективності.
Рекомендації з лікування дисліпідемій
Ми плануємо надати більш детальний переклад цих рекомендацій у наступному номері журналу.
Лікування раку та серцево-судинна токсичність
Ми плануємо надати більш детальний переклад цих положень Європейського товариства кардіологів у наступних номерах журналу.
Лікування серцевої недостатності
Більш детальний переклад цих рекомендацій викладено в тематичному журналі «Серцева недостатність».
Огляд результатів найбільш важливих клінічних досліджень
Профілактичне застосування ІКД у пацієнтів з неішемічною серцевою недостатністю: результати дослідження DANISH
Автор: Maria Vinall
У дослідженні DANISH (Køber L. et al. // N. Engl. J. Med. 2016), результати якого презентував Lars Køber, MD, Rigshospitalet, співробітник госпіталю Копенгагенського університету, Копенгаген, Данія, не вдалося довести достовірне зниження смертності від усіх причин при імплантації кардіовертерів-дефібриляторів (ІКД) із профілактичною метою в пацієнтів із симптоматичною систолічною серцевою недостатністю, яка не пов’язана з ураженнями коронарних артерій.
DANISH — рандомізоване контрольоване багатоцентрове дослідження, яке проводили з метою визначити, чи допомагає ІКД знизити рівень смертності від усіх причин у пацієнтів із симптомною систолічною СН неішемічної етіології. У дослідження включали пацієнтів з СН II–III функціонального класу за NYHA (або з IV класом для осіб із запланованою ресинхронізуючою терапією (РСТ)), фракцією викиду лівого шлуночка ≤ 35 % та рівнем NT-proBNP > 200 пг/мл (23,6 пмоль/л), які приймали оптимальну медикаментозну терапію. Усіх учасників розподілили в групи ІКД (n = 556) із профілактичною метою або звичайної терапії (n = 560). Первинною кінцевою точкою дослідження була смертність від усіх причин. Вторинними кінцевими точками були серцево-судинна смерть та раптова серцева смерть.
Середній вік пацієнтів становив 64 роки (діапазон 56–72 роки), середня фракція викиду лівого шлуночка — 25 %, а середня тривалість СН — близько 19 місяців; 28 % популяції становили жінки. Приблизно 92 % пацієнтів приймали β-адреноблокатори, 97 % — інгібітори ангіотензинперетворюючого ферменту або блокатори рецепторів ангіотензину, 58 % приймали антагоністи рецепторів мінералокортикоїдів; РСТ була призначена 58 % пацієнтів. Середній період спостереження становив 67,6 місяця.
Первинна кінцева точка, тобто смерть від усіх причин, відбулася у 120 пацієнтів у групі ІКД і 131 пацієнта в контрольній групі (ВР = 0,87; 95% ДІ від 0,68 до 1,12; P = 0,28; рис. 1).
При оцінці частоти вторинних подій було виявлено недостовірне зниження на 23 % рівня серцево-судинної смертності (ВР = 0,77; 95% ДІ від 0,57 до 1,05; P = 0,10; рис. 2), у той час як рівень раптової серцевої смерті вдалося знизити на 50% (ВР = 0,50; 95% ДІ від 0,31 до 0,82; P = 0,005; рис. 3).
/92.jpg)
Після аналізу попередньо визначених підгруп єдиний достовірний взаємозв’язок залишався в лікування з віком (P для взаємодії = 0,009), що й обумовило у першу чергу зниження рівня смертності від усіх причин у пацієнтів віком < 68 років (ВР = 0,64; 95% ДІ від 0,45 до 0,90; P = 0,01).
Жодної різниці у кількості випадків інфікування пристрою (4,9 % у групі ІКД проти 3,6 % у контрольній групі; P = 0,29) не було виявлено. Частота серйозного інфікування внаслідок імплантації пристрою (тобто всі випадки, при яких потрібно було проводити екстракцію пристрою або призначати довічний прийом антибіотикотерапії) виявилася низькою й достовірно не відрізнялася між групами пацієнтів з ІКД і контрольною групою (2,7 проти 2,3 %, ІКД проти контролю; P = 0,65). Кровотеча, що потребувала хірургічного втручання, трапилася в одного пацієнта в групі ІКД. Також зареєстрували 17 випадків пневмотораксу: 11 у групі ІКД (2 %) і 6 у контрольній групі (1,1 %). Хибні дефібриляції сталися в 33 пацієнтів (5,9 %).
І на завершення. Це остаточне дослідження, що не довело ніяких переваг для виживання імплантації ІКД з метою первинної профілактики в пацієнтів із симптомною кардіоміопатією неішемічної етіології на фоні використання від помірної до інтенсивної оптимальної медикаментозної терапії та РСТ. Ці дані контрастують з наявними рекомендаціями з СН, які було розроблено на основі результатів попередніх досліджень малого та середнього розміру або із використанням результатів аналізу підгруп. Результати дослідження DANISH вплинуть на рекомендації з СН, а це очікувано призведе до зменшення ентузіазму щодо імплантації ІКД у таких хворих, за винятком, можливо, молодих осіб. Але спершу ця гіпотеза повинна бути перевірена в ще одному спеціально проведеному з цією метою дослідженні.
Дослідження MORE CARE: дистанційний моніторинг пацієнтів з імплантованими бівентрикулярними дефібриляторами зменшує витрати на охорону здоров’я без шкоди для безпеки
Автор: Maria Vinall
Giuseppe Boriani, працівник кардіологічного відділення Університету Модена & Реджо-Емілія, Модена, Італія, навів результати дослідження MORE-CARE (Boriani G. еt al. // Eur. J. Heart Fail. 2016), які продемонстрували, що дистанційний моніторинг у пацієнтів із систолічною серцевою недостатністю та імплантованим бівентрикулярним дефібрилятором з метою кардіоресинхронізуючої терапії за допомогою імплантованого кардіовертера-дефібрилятора (РСТ-Д) не знижує ні смертність, ні ризик серцево-судинних захворювань, ні частоту госпіталізації, пов’язану із роботою пристрою, але дозволяє зменшити витрати в галузі охорони здоров’я.
Дослідження MORE-CARE — міжнародне проспективне багатоцентрове рандомізоване контрольоване дослідження в пацієнтів із вираженою систолічною СН. Мета дослідження полягала в тому, щоб оцінити клінічне та економічне значення дистанційного моніторингу пацієнтів порівняно зі стандартною стратегією спостереження. Первинну комбіновану кінцеву точку становили смерть від усіх причин та СС-смерть, а також госпіталізація, пов’язана з пристроєм (≥ 48 годин перебування), первинну подію розраховували як час до появи першої події протягом 2-річного періоду спостереження. Вторинною кінцевою точкою дослідження була частота використання ресурсів медико-санітарної допомоги протягом 2 років (СС-госпіталізація, звернення до відділу кардіореанімації (КР), а також візити до лікаря). Щоб відповідати критеріям включення в дослідження, пацієнт повинен був мати показання до імплантації РСТ-Д згідно з рекомендаціями Європейського товариства кардіології за 2009 рік (тобто функціональний клас III–IV за NYHA; фракція викиду лівого шлуночка ≤ 35 %; QRS ≥ 120 мс та регулярний прийом оптимально підібраної медикаментозної терапії), у нього відсутня постійна форма фібриляції передсердь або суправентрикулярна тахікардія, а також не було попередньо імплантованого РСТ-Д (Boriani H. et al. // Am. Heart J. 2010).
/93.jpg)
Протягом 8 тижнів пацієнти з імплантованим РСТ-Д de novo були рандомізовані в групу дистанційного спостереження проти візитів до лікаря (група дистанційного спостереження; n = 437) або в групу лише візитів до лікаря (стандартне спостереження; n = 428). Тривалість віддаленого спостереження і/або стандартного спостереження на візитах до лікаря становила 4 місяці для обох груп, при чому автоматизоване оповіщення про набряк легень та появу передсердних аритмій використовували лише в групі віддаленого спостереження.
Середній вік учасників дослідження становив 66 років; 76 % з них були чоловіки. Середнє значення фракції викиду лівого шлуночка становило 27 %. Середній період спостереження був 24 місяці. Жодних достовірних відмінностей для комбінованої первинної кінцевої точки або її компонентів не встановили (табл. 1).
При оцінці вторинної кінцевої точки виявили достовірне зниження на 38 % від комбінованої кінцевої точки використання ресурсів охорони здоров’я внаслідок СС-причин або витрат, пов’язаних з роботою віддаленого моніторування (відношення зниження рівня 0,62; 95% ДІ від 0,58 до 0,66; P < 0,001; рис. 1). Рівні комбінованої СС-госпіталізації, СС КР госпіталізацій та візити до лікаря протягом двох років становили 3,7 на 100 пацієнтів (95% ДІ від 3,5 до 3,9) порівняно з 6,0 на 100 пацієнтів (95% ДІ від 5,7 до 6,2) для груп віддаленого та стандартного спостереження відповідно.
У пацієнтів у групі дистанційного моніторингу було достовірно менше амбулаторних відвідувань, а також значно менше викликів швидкої допомоги, пов’язаних з роботою приладу (для обох показників р < 0,001). Показники госпіталізації істотно не відрізнялися також і для викликів швидкої допомоги, що не були пов’язані з роботою приладу. Отже, результати MORE-CARE не продемонстрували більше виживання серед симптоматичних пацієнтів з СН, яким було імплантовано РСТ-Д пристрій. Проте дистанційне моніторування може бути корисним варіантом для проведення подальших досліджень, враховуючи сприятливий вплив на економію коштів без шкоди для безпеки пацієнта.
REM-HF: вплив дистанційного моніторування в пацієнтів із серцевою недостатністю
Автор: Maria Vinall
Результати дистанційного моніторування стану пацієнтів із серцевою недостатністю [REM-HF; ISRCTN 96536028], які представив Мартін Р. Кові, Імперський Коледж Лондона, Королівський Госпіталь Бромтона, Лондон, Сполучене Королівство, дозволяють припустити, що в країнах із розвиненою системою охорони здоров’я та високою якістю надання медичних послуг пацієнтам із серцевою недостатністю, скоріше за все, дистанційний моніторинг щотижня в пацієнтів із імплантованими пристроями (ІП) (тобто імплантований кардіовертер-дефібрилятор (ІДК); ресинхронізуюча терапія за допомогою імплантованого кардіовертера-дефібрилятора (РСТ-Д), ресинхронізуюча терапія за допомогою водія ритму (РСТ-В)) не зможе значно поліпшити результати лікування пацієнтів.
Незважаючи на досягнення сучасної терапії, у пацієнтів з СН залишається високий ризик смерті та висока частота госпіталізації. Багатьом із цих пацієнтів імплантовано ІП, які здатні надавати дані про стан пацієнта шляхом віддаленого моніторування. Метою дослідження REM-HF було оцінити клінічну та економічну цінність щотижневого дистанційного моніторингу даних, зібраних за допомогою ІП порівняно зі звичайним спостереженням.
Це було багатоцентрове рандомізоване (1 : 1) незасліплене паралельне дослідження, що проводилося в 9 кардіологічних центрах у Сполученому Королівстві в період з вересня 2011 року по березень 2014 р. У дослідження включали дорослих осіб зі стабільною СН, які приймали оптимальну медикаментозну терапію протягом ≥ 6 тижнів до включення та з ІП протягом ≥ 6 місяців, роботу яких було функціонально оптимізовано і які дозволяли проводити віддалений моніторинг (Morgan J.M. et al. // Eur J Heart Fail. 2014). Усіх учасників дослідження було рандомізовано в групи щотижневого дистанційного моніторингу фізіологічної інформації, наданої ІП (табл. 1) плюс звичайне спостереження (n = 826), або в групу лише стандартного надання медичних послуг (n = 824), період спостереження становив у середньому 2,8 року.
Первинною кінцевою точкою дослідження був час до першої події смерті від усіх причин або незапланованої госпіталізації з приводу серцево-судинних причин. Вторинні кінцеві точки включали окремі компоненти первинних точок, смерть від СС-причин, незаплановані госпіталізації від всіх причин, сукупність смертей від СС-причин або незапланованої СС-госпіталізації.
Середній вік учасників дослідження становив 69 років, 86 % були чоловіки, фракція викиду лівого шлуночка становила близько 30 %, у більшості учасників (70 %) була ішемічна хвороба серця в анамнезі, а також функціональний клас II за NYHA, типи ІП включали у себе ІКД (33 %), РСТ-Д (близько 54 %) і РСТ-В (близько 13 %). Понад 90 % пацієнтів приймали інгібітори ангіотензинперетворюючого ферменту або блокатори рецепторів ангіотензину, а також β-блокатори, близько 53 % приймали антагоністи альдостерону.
На підставі моніторингу ІП встановлено 3534 клінічні заходи у 599 824 пацієнтів (72,5 %; табл. 2). Незважаючи на ці заходи, показники первинної кінцевої точки смертності від усіх причин або СС-госпіталізації достовірно не відрізняються від таких у пацієнтів, яким проводилося стандартне спостереження (ВР = 1,01; 95% ДІ від 0,87 до 1,18; Р = 0,87). Не було жодних достовірних відмінностей у компонентах первинної кінцевої точки, у тому числі смертності (ВР = 0,83; 95% ДІ від 0,66 до 1,05; P = 0,12) і позапланових СС-госпіталізаціях (ВР = 1,07; 95% ДІ від 0,91 до 1,25; Р = 0,42). Ніяких достовірних відмінностей між двома групами за жодною вторинною кінцевою точку не було, а також не встановлено жодної тенденції того, що в будь-якій підгрупі була перевага від спрямованої терапії на основі даних щотижневого дистанційного моніторингу.
Незважаючи на технічні можливості цих пристроїв, що здатні забезпечити майже безперервний потік інформації до лікарів, яким для оцінки цієї інформації потрібно витратити більше зусиль та часу для навчання, це не призвело до значного поліпшення прогнозу для пацієнтів.
Регенеративна терапія кардіо-поетином у пацієнтів із серцевою недостатністю ішемічної етіології
Автор: Phil Vinall
Багатоцентрове/багатонаціональне клінічне дослідження CHART-I показало, що кардіопоетичні стовбурові клітини не знижують рівень смертності в пацієнтів із вираженою серцевою недостатністю ішемічної етіології (ІСН).
Дослідження CHART-I — третя фаза, рандомізоване подвійне сліпе контрольоване дослідження, що проводилося в 39 центрах у Європі та Ізраїлі, метою якого було оцінити ефективність і безпеку використання кардіопоетичних стовбурових клітин (C3BS-CQR-1, Celyad, Mont St Guibert, BE) порівняно з плацебо-процедурою в пацієнтів із симптоматичною ІСН, незважаючи на оптимально підібрану медикаментозну терапію. Результати дослідження CHART-I представив Джозеф Бартунек, к.м.н., співробітник серцево-судинного центру OLV лікарні Аалсті, Аалст, Бельгія [NCT01768702].
У дослідження включали чоловіків та жінок віком ≥ 18 і < 80 років із симптомною ІСН (≥ II функціонального класу за NYHA на момент включення, а також III/IV функціональний клас за NYHA або ≥ 4 функціонального класу за INTERMACS протягом останніх 12 місяців) і зниженням фракції викиду лівого шлуночка (ФВ ЛШ < 35 %), яких було госпіталізовано з приводу СН або в яких відбулося погіршення стану протягом останніх 12 місяців, та які відповідали критеріям включення у дослідження. Усі пацієнти на момент включення повинні були приймати оптимальну медикаментозну терапію. Учасників дослідження рандомізували в групи або однократного введення 600 мільйонів кардіопоетичних стовбурових клітин ендоміокардіально (n = 120), або в групу «фіктивної» процедури (n = 151). Кардіопоетичні стовбурові клітини вводили за допомогою трансендокардіального катетера, розробленого спеціально для збільшення доставки клітин (C-Cathez, Celyad, Mont St Guibert, BE).
Первинною кінцевою точкою ефективності була комбінація смертності від усіх причин, частота погіршень стану при СН, динаміка будь-якого з таких показників: оцінка за шкалою Minnesota Living with HF Questionnaire Score, тест 6-хвилинної ходьби, зміна кінцево-систолічного об’єму ЛШ та фракції його викиду за даними ехокардіографії. Безпеку оцінювали за допомогою визначення рівня смертності від усіх причин, перерваної раптової смерті, трансплантації серця, інфаркту міокарда, інсульту, госпіталізацій, а також частоти побічних реакцій.
Середній вік учасників дослідження становив 62 роки, середнє значення ФВ становило 28 %; більшість пацієнтів (> 89 %) були чоловіки, у більшості з них був II функціональний клас СН за NYHA, середня тривалість від постановки діагнозу СН до включення становила 45 місяців. Більшість пацієнтів (89 %) вже приймали інгібітори ангіотензинперетворюючого ферменту (іАПФ) або блокатори рецепторів ангіотензину (БРА), а також β-блокатори; 89 % також приймали діуретики.
Дослідники не виявили жодних переваг від введення кардіопоетичних стовбурових клітин щодо первинних кінцевих точок через 39 тижнів (шкала Манна — Уїтні — 0,54, 95% ДІ 0,47–0,61; P = 0,27). Аналогічні результаті були виявлені й для кожного компонента первинної кінцевої точки окремо. Число смертей в обох групах було однаковим (10 у групі активного лікування порівняно з 14 у контрольній групі). У групі контролю спостерігалися вищі рівні раптової серцевої смерті й перерваної раптової серцевої смерті порівняно з групою активної терапії (ВР = 0,16; 95% ДІ 0,02–1,23, Р = 0,04).
Попередній аналіз дозволяє припустити потенційну перевагу лікування стовбуровими клітинами в підгрупі пацієнтів із вихідним кінцево-діастолічним об’ємом між 200 і 370 мл (шкала Манна — Уїтні — 0,61; 95% ДІ 0,52–0,70, Р = 0,015), а також у осіб, яким проведено ≤ 19 ін’єкцій. Ключовим фактором доведення ефективності такої терапії в майбутніх дослідженнях Dr Bartunek називає оптимізовану інтенсивну терапію разом з цільовим відбором пацієнтів залежно від ступеня тяжкості захворювання.
Додаткова інформація: Bartunek J., Davison B., Sherman W. et al. Congestive Heart Failure Cardiopoietic Regenerative Therapy (CHART-1) trial design // Eur. J. Heart Fail. 2016; 18(2): 160-168.
Шість місяців подвійної антитромбоцитарної терапії за ефективністю не гірші, ніж 18 місяців такого лікування
Автор: Phil Vinall
Результати дослідження NIPPON, які представив доктор Масато Накамура, к.м.н., Університет Тохо, Медичний центр Охаші, Токіо, Японія, дозволяють припустити, що 6 місяців подвійної антитромбоцитарної терапії (ПАТТ) за ефективністю не поступаються 18 місяцям ПАТТ з точки зору впливу на частоту несприятливих клінічних і цереброваскулярних подій.
Через те, що попередні дослідження надали суперечливі дані відносно оптимальної тривалості ПАТТ, вважалося, що призначення ПАТТ пов’язане з більш високим ризиком кровотечі, але при тому з більш низьким ризиком розвитку серйозних несприятливих серцево-судинних подій (НССП). Дослідження NIPPON [NCT01514227] — проспективне багатоцентрове рандомізоване дослідження порівняння чистих клінічних переваг між коротким курсом ПАТТ (6 місяців) і тривалим прийомом ПАТТ (18 місяців) після встановлення стента NOBORI. NOBORI належить до групи покритих стентів, виготовлений із біодеградуючого полімеру з аблюмінальним покриттям.
У дослідження увійшли пацієнти віком > 20 до < 80 років, які перенесли черезшкірне втручання, із фракцією викиду лівого шлуночка ≥ 30 % та без активних кровотеч або наявності кровотеч в анамнезі. Учасникам було призначено або 18 місяців ПАТТ (n = 1391), або 6 місяців ПАТТ (n = 1381). Первинною кінцевою точкою була відсутність несприятливих клінічних та цереброваскулярних подій (НКЦВП), що визначалася як поєднання частоти смерті від усіх причин, інфаркту міокарда (ІМ), інсультів або тяжких кровотеч (взято із модифікаціями із дослідження REPLACE-2 або відповідно до критеріїв BARC), що реєструвалися протягом терміну від 6 до 18 місяців після імплантації покритого стента. Границею для не гіршого ефекту для первинної кінцевої точки була абсолютна різниця ризику –2,0 %. До основних вторинних кінцевих точок належали випадки встановленого або ймовірного тромбозу стента через 18 місяців після його імплантації, частота смерті, інфаркту міокарда й порушень мозкового кровообігу, а також частота тяжких кровотеч через 18 місяців після імплантації.
Достовірних відмінностей вихідних показників між групами не було. Близько 80 % учасників — чоловіки; середній вік усіх пацієнтів становив 67 років. Найчастіше реєструвалося ураження лівої передньої низхідної артерії — близько 60 % хворих; односудинне ураження було в ≥ 85 % хворих; приблизно 30 % пацієнтів пройшли курс лікування з приводу гострого коронарного синдрому.
З точки зору впливу на частоту первинної кінцевої точки ПАТТ протягом 6 місяців виявилася не менш ефективною (1,45 % у групі 18-місячної ПАТТ проти 1,92 % у групі 6-місячної ПАТТ: різниця абсолютного ризику становила –0,46 %; 95% ДІ від –1,48 до 0,51; P = 0,002; рис. 1). Після аналізу часу до настання події протягом усього 18-місячного періоду спостереження та протягом періоду від 6 до 18 місяців не було виявлено жодного достовірного збільшення частоти первинних подій НКЦВП на фоні короткострокової порівняно з тривалою ПАТТ; хоча рівні чисельно відрізнялися в групі короткострокової ПАТТ.
Автори описали статистично достовірну тенденцію до зниження рівня смертності (0,51 проти 0,74 %, Р = 0,48) та інфаркту міокарда (0,07 проти 0,22 %; P = 0,37) на фоні 18 місяців ПАТТ порівняно з 6 місяцями ПАТТ відповідно. Частота кровотечі достовірно не відрізнялася в обох групах. Результати були послідовними для НКЦВП в усіх підгрупах.
З погляду впливу на НКЦВП треба було довести те, що 6 місяців ПАТТ не гірші, ніж 18 місяців ПАТТ. Ці результати слід інтерпретувати обережно, враховуючи передчасне припинення набору пацієнтів, відкритий за торговою маркою дизайн дослідження з частим перехрещенням та широкі межі, встановленні для доведення того, що терапія не була гіршою.
Моніторинг функції тромбоцитів не покращує прогнозу літніх пацієнтів після стентування: дослідження ANTARCTIC
Автор: Toni Rizzo
Висока реакційна здатність тромбоцитів у пацієнтів зі встановленими покритими стентами, яким було також призначено клопідогрель, пов’язана зі збільшенням частоти інфаркту міокарда (ІМ) та більш низькою частотою кровотеч (Stone G. Wetal // Lancet. 2013). У попередніх дослідженнях не вдалося довести перевагу корекції медикаментозної терапії на основі даних моніторування функції тромбоцитів у пацієнтів низького ризику після черезшкірних коронарних втручань (ЧКВ), які приймали клопідогрель (Price M.J. et al. // JAMA. 2011; Collet J.P. et al. // N. Engl. J. Med. 2012). Проте дослідження ARCTIC (Collet J.P. et al. // N. Engl. J Med. 2012) продемонструвало тенденцію до зменшення частоти кровотеч у групі моніторування функції тромбоцитів. Усі ці дані привели до необхідності проведення дослідження ANTARCTIC (Cayla G. et al. // Lancet. 2016), результати якого представив професор Жіль Монталеско, співробітник лікарні Університету Пітьє-Сальпетрієр, Париж, Франція.
Метою багатоцентрового рандомізованого дослідження ANTARCTIC було оцінити вплив корекції терапії на основі даних моніторування функції тромбоцитів у пацієнтів похилого віку після стентування з приводу гострого коронарного синдрому (ГКС). Дослідники припускали, що підбір терапії відповідно до реакції тромбоцитів може поліпшити результати у цих пацієнтів.
Пацієнтів віком ≥ 75 років, які перенесли коронарне стентування з приводу ГКС (n = 877), рандомізували в групи прийому прасугрелю 5 мг без моніторування функції тромбоцитів (звичайна група, n = 442) або прийому прасугрелю 5 мг з контролем функції тромбоцитів і корекцією дози препарату (група моніторування; n = 435). Аналіз функції тромбоцитів (Verify Now P2Y12) виконували через 14 днів після рандомізації. Дозу прасугрелю збільшували до 10 мг/добу у хворих з реакцією P2Y12 блоку (БРБ) ≥ 208 і залишали 5 мг/добу у хворих з БРБ > 85 і < 208. Пацієнти з БРБ ≤ 85 були переведені на клопідогрель 75 мг/добу. Другий аналіз з метою корекції дози проводили через 14 днів після першого.
Первинною кінцевою точкою була клінічна перевага, коли протягом 12 місяців не було зафіксовано таких подій, як наявність кровотечі 2, 3 або 5-го типу за BARC, серцево-судинна смерть, інфаркт міокарда, невідкладна реваскуляризація, тромбоз стента або інсульт. Ключовою вторинною кінцевою точкою були СС-смерть, інфаркт міокарда, ургентна реваскуляризація, тромбоз стента або інсульт.
Достовірної різниці між групами за частотою первинної кінцевої точки не спостерігалася: первинна кінцева точка відбулася у 120 пацієнтів (28 %) у групі моніторингу порівняно із 123 (28 %) пацієнтами у звичайній групі (ВР = 1,003; 95% ДІ від 0,78 до 1,29; P = 0,98). У аналізі субгруп, які було попередньо виділено, жодної достовірної різниці також не відмічалося. Також не було ніяких істотних відмінностей між групами за рівнем ключової вторинної кінцевої точки (ВР = 1,06; 95% ДІ від 0,69 до 1,62; P = 0,80).
Частота кровотеч 2, 3 або 5-го типу за BARC була однаковою в обох групах (ВР = 1,04; 95% ДІ від 0,78 до 1,40; P = 0,77).
Також не було виявлено жодних достовірних відмінностей у частоті вторинних кінцевих точок, зокрема смерті (P = 0,22); СС-смерті, інфаркту міокарда або інсульту (P = 0,70); тромбозів стента (P = 0,98); сильних кровотеч за TIMI (P = 0,70); тяжкої або середньої тяжкості кровотечі за GUSTO (P = 0,51) або сильної кровотечі за STEEPLE (P = 0,82).
Професор Монталеско дійшов висновку, що контроль функції тромбоцитів з метою корекції антиагрегантної терапії в пацієнтів похилого віку після стентування при ГКС не покращує клінічні результати. Ці дані підтверджують результати дослідження ARCTIC, у якому було показано, що моніторинг функції тромбоцитів з метою індивідуалізації антиагрегантної терапії незалежно від рівня ризику населення або типу використання антагоністів P2Y12 не покращує прогноз.
Дослідження SAVE: на фоні додавання СPAP-терапії до стандартного лікування якість життя покращилася, але без зниження частоти серцево-судинних подій
Автор: Phil Vinall
Р. Дуг Мак-Евой, доктор медичних наук, Університет Фліндерс, Інститут здоров’я сну Аделаїди, Аделаїда, Австралія, презентуючи результати дослідження SAVE (McEvoy R. Detal // N. Engl. J. Med. 2016), зазначив, що додавання терапії постійного позитивного тиску в дихальних шляхах (CPAP) до звичайного лікування не призвело до зниження частоти ускладнень з боку серцево-судинної системи в пацієнтів із серцево-судинними захворюваннями та синдромом обструктивного апное сну (СОАС).
Метою дослідження SAVE було визначити, чи дозволить використання CPAP-терапії (REMstar Auto M or PR series devices, Philips Respironics) при додаванні до стандартної терапії в пацієнтів зі встановленим ураженням коронарних артерій або цереброваскулярними захворюваннями й діагнозом СОАС від помірного до тяжкого ступеню знизити частоту основних і менш важливих кардіоваскулярних подій. Діагноз СОАС помірного та тяжкого ступеня виставляли при індексі десатурації кисню (ІДК) ≥ 12 подій/год (Ganter D. et al. // Respirology. 2010). Потенційні учасники дослідження повинні були продемонструвати принаймні мінімальну прихильність до CPAP-терапії протягом 1-тижневого ввідного періоду, під час якого використовували фіктивну CPAP-терапію.
Первинна кінцева точка дослідження була комбінована, до її складу входили інфаркт міокарда, інсульт, госпіталізації з приводу нестабільної стенокардії, серцевої недостатності або транзиторної ішемічної атаки (ТІА), а також серцево-судинна смерть. Вторинні кінцеві точки включали в себе СС-події ішемічної етіології, основні СС-події, серцеві й церебральні події, а також окремі компоненти первинної кінцевої точки, вперше зареєстровану фібриляцію передсердь або вперше виявлений цукровий діабет, а також смертність від усіх причин плюс, серед інших, оцінку симптоматики СОАС і якості життя. Через проблеми в досягненні попередньо визначеного розміру вибірки — 5000 пацієнтів, оновлення літературних даних, а також попередні проміжні дані, що було отримано під час даного дослідження, дослідники переглянули необхідний розмір вибірки, скоротивши її до 2500 учасників і 533 кінцевих точок, завдяки чому за оцінками дане дослідження мало б 90 % потужності для виявлення зниження на 25 % рівня первинної кінцевої точки на фоні CPAP-терапії протягом у середньому 4,5 року спостереження.
Це було міжнародне (89 центрів в 7 країнах) проспективне відкрите за торговою маркою рандомізоване контрольоване дослідження, що порівнювало результати в пацієнтів з СОАС при додаванні CPAP до звичайної терапії (n = 1346) або лише при звичайній медичній допомозі (n = 1341). Ці 2687 учасників становили остаточну популяцію дослідження після того, як у кожного з них було встановлено принаймні мінімальну прихильність до CPAP-терапії протягом ввідного періоду (рівень неприхильності становив 16 %), для яких не було виявлено значних відхилень від протоколу дослідження після рандомізації, порушення процедури контролю або відкликання інформованої згоди. Початкові демографічні/клінічні характеристики були подібними в обох групах: середній вік становив 61 рік; 81 % чоловіків; 63 % азіатів; середній індекс маси тіла становив 29 кг/м2, середній ІДК — 28 подій/год, а середній бал за шкалою сонливості Epworth Sleepiness Scale (ESS) — 7,4 бала. Близько половини пацієнтів мали ураження коронарних артерій, а інша половина — цереброваскулярні захворювання в анамнезі; більше половини пацієнтів популяції на той момент або в минулому були курцями (56 %), у той час як у 78 % була артеріальна гіпертензія, у третини пацієнтів — цукровий діабет.
Середня тривалість спостереження становила 3,7 року, після яких було зареєстровано в цілому 436 первинних кінцевих точок. Між групами терапії не було жодної достовірної різниці в рівнях первинної кінцевої точки (17 % у групі CPAP-лікування проти 15,4 % у групі звичайної терапії, ВР = 1,10; 95% ДІ від 0,91 до 1,32; P = 0,34). Цей результат узгоджується в усіх основних підгрупах пацієнтів, стратифікованих за регіонами (Китай проти всіх поза межами Китаю), за віком, статтю, тяжкістю СОАС, наявність ожиріння, серцево-судинних захворювань або цукрового діабету на початку дослідження (P для всіх ≥ +0,09).
Жодної достовірної різниці не існувало для жодної вторинної кінцевої точки, окрім більш високих рівнів усіх госпіталізації з приводу ТІА в групі CPAP-терапії (відносний ризик 2,29; 95% ДІ від 1,05 до 4,99; P = 0,04), але це значення не було скореговане шляхом багатократного тестування. Використання CPAP-терапії привело до достовірного покращання показників за шкалою ESS (P < 0,001), за шкалою тривоги (P = 0,002), шкалою депресії (Р < 0,001), шкалою SF-36 Health Survey physical (P = 0,002) та покращило ментальні функції (P < 0,001), а також привело до значного зниження кількості днів втрати працездатності (Р < 0,001). Ніяких тяжких побічних ефектів або нещасних випадків через сонливість не було. Субаналіз, у який увійшли лише пацієнти з високою прихильністю до CPAP-терапії (> 4 год/добу), які за характеристиками відповідали пацієнтам контрольної групи (n = 561 у кожній групі), виявив тенденцію до зниження ризику інсульту (Р = 0,05) і всіх церебральних подій (P = 0,02), хоча автори попереджають, що це попередній висновок, який необхідно підтвердити в майбутніх рандомізованих дослідження, спеціально розроблених з метою дослідження впливу лікування СОАС на цереброваскулярний ризик.
І на завершення. Використання CPAP-терапії з метою вторинної профілактики серцево-судинних захворювань у пацієнтів з СОАС помірного та тяжкого ступеня може бути даремним у запобіганні повторним серцево-судинним подіям. На жаль, через численні матеріально-технічні та супутні проблеми дослідження SAVE у кінцевому рахунку виявилося занадто слабким для того, щоб остаточно перевірити ефективність призначення CPAP-терапії з метою вторинної профілактики.
Дослідження NACIAM: N-ацетилцистеїн разом із нітрогліцерином зменшують розмір інфаркту при інфаркті міокарда з підйомом сегмента ST
Автор: Toni Rizzo
Розмір інфаркту міокарда у пацієнтів з гострим інфарктом міокарда з підйомом сегмента ST є основним чинником, що визначає результати лікування після перенесеної події. Розмір інфаркту залежить від тривалості ішемії, розміру міокарда, що кровопостачається на території ураженої судини, а також ступеня реперфузійної травми. Раніше невеликі клінічні дослідження показали, що n-ацетилцистеїн (NAЦ), донор сульфгідрильної групи, має антиоксидантні властивості й може зменшити розмір інфаркту при додаванні його для нітрогліцерину (НГ), що має вазодилатуючі властивості й може знижувати агрегацію тромбоцитів.
Дане рандомізоване контрольоване дослідження NACIAM, результати якого були представлені доктором Sivabaskari Pasupathy, Університет Аделаїда, Аделаїда, Австралія, було створено як пілотне дослідження з метою оцінки ефективності додавання високих доз NAЦ внутрішньовенного до низької дози внутрішньовенного НГ у пацієнтів з гострим інфарктом міокарда з підйомом сегмента ST, які підлягали проведенню черезшкірного втручання (ЧКВ). У дослідження включили 112 пацієнтів, госпіталізованих протягом 12 годин з моменту появи симптомів, яким було призначено НГ внутрішньовенно 2,5 мкг/хв і яких згодом було рандомізовано в групи додавання NAЦ (n = 53) або плацебо (n = 59). NAЦ призначали в дозі 20 мг/хв протягом першої години, а далі — 10 мг/хв протягом наступних 47 годин. Як плацебо використовували фізіологічний розчин, який вводили протягом 48 годин. Первинною кінцевою точкою ефективності був розмір інфаркту за даними магнітно-резонансної томографії в кардіальному режимі (кМРТ). Інші кінцеві точки включали ділянки відновлення міокарда за даними МРТ, фракцію викиду лівого шлуночка (ФВ ЛШ) за даними МРТ, площу під кривою (AUC) креатинкінази і безпечність лікування. МРТ виконували на 5-й день (у середньому) і повторно, у середньому через 3 місяці. Пацієнтів спостерігали протягом 2 років.
МРТ виконано на 5-й день у 37 пацієнтів у групі NAЦ і 38 пацієнтів у групі плацебо. Повторне МРТ-дослідження виконали через 3 місяці 26 пацієнтам у групі NAЦ і 29 пацієнтам у групі плацебо. Результати показали, що розмір зони інфаркту міокарда зменшився на 5,5 % від загальної маси лівого шлуночка в групі NAЦ порівняно з групою плацебо (95% ДІ від 1 до 10 %, Р = 0,02).
/99.jpg)
У пацієнтів, яким вводили NAЦ, порівняно з групою плацебо достовірно збільшилася зона відновленого міокарда (Р = 0,001), зменшилась ділянка трансмурального інфаркту (P = 0,02), а також зменшився розмір інфаркту за результатами останнього МРТ-дослідження (P = 0,02) (табл. 1). Більш сприятливий вплив NAЦ на ділянку відновленого міокарда нівелювався при більш тривалому періоді ішемії, отже, вплив NAЦ на відновлення міокарда виявився вищим у пацієнтів із більш короткою тривалістю ішемії. ФВ ЛШ і AUC креатинкінази достовірно не відрізнялися між групами NAЦ і плацебо. AUC креатинкінази становила 22 000 МО/л/год у групі NAЦ порівняно з 40 000 МО/л/год у групі плацебо (Р = 0,08).
Між групами NAЦ і плацебо не було жодних достовірних відмінностей за частотою смерті (P = 0,49), гіпотензії (P = 1,00), кровотечі (P = 1,00) або порушення функції нирок (P = 0,72). Смертність і повторні СС-госпіталізації протягом 2 років були значно нижче в групі NAЦ (6 %) порівняно з групою плацебо (27 %; Р = 0,02).
Автори відзначають, що необхідно й надалі проводити дослідження, які б встановили оптимальну дозу NAЦ і пояснили механізм його дії. Крім того, вони відзначили, що розмір вибірки в цьому дослідженні був невеликим, а отже, існує потреба у проведенні більшого та потужнішого за доказовою силою дослідження впливу NAЦ на клінічні результати. Дослідники дійшли висновку, що додавання NAЦ до НГ є безпечним та дозволяє зменшити розмір інфаркту й збільшити відновлення міокарда.
Продовження в наступному номері
Переклад О. Торбас
Науковий редактор перекладу
проф. Ю.М. Сіренко

/86.jpg)
/87.jpg)
/87_2.jpg)
/88.jpg)
/89.jpg)
/90.jpg)
/91.jpg)
/93_2.jpg)
/94.jpg)
/96.jpg)