Журнал «» 5 (49) 2016
Вернуться к номеру
Факторы риска фибрилляции предсердий и нерешенные проблемы ее профилактики
Авторы: Коваль С.Н., Снегурская И.А.
ГУ «Национальный институт терапии имени Л.Т. Малой НАМН Украины», г. Харьков, Украина
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
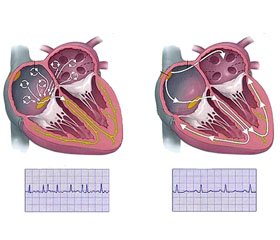
Подано основні патогенетичні механізми виникнення та прогресування фібриляції передсердь (ФП). Проаналізовано найбільш поширені та значимі фактори ризику її розвитку. На сьогодні проблема профілактики ФП залишається невирішеною. Насамперед йдеться про первинну профілактику ФП. Саме первинна профілактика ФП є найбільш ефективним методом боротьби з цією патологією, що дозволить значно знизити захворюваність на ФП, а завдяки цьому — ризик розвитку ускладнень і смертність. Невирішеність проблеми первинної профілактики ФП пов’язана зі значною складністю її реалізації. Це обумовлено дуже великою поширеністю та численністю модифікованих факторів ризику, а також наявністю таких немодифікованих факторів ризику, як вік і генетична схильність.
Представлены основные патогенетические механизмы возникновения и прогрессирования фибрилляции предсердий (ФП). Проанализированы наиболее распространенные и значимые факторы риска ее развития. В настоящее время проблема профилактики ФП остается нерешенной. Прежде всего речь идет о первичной профилактике ФП. Именно первичная ФП предсердий является наиболее эффективным методом борьбы с данной патологией, который позволит значительно снизить заболеваемость ФП, а благодаря этому — риск развития осложнений и смертность.
Нерешенность проблемы первичной профилактики ФП связана со значительной сложностью ее реализации. Это обусловлено очень большой распространенностью и многочисленностью модифицируемых факторов риска, а также наличием таких немодифицируемых факторов риска, как возраст и генетическая предрасположенность.
The article presents the main pathogenetic mechanisms of onset and progression of atrial fibrillation (AF). We analyzed the most common and important risk factors for its development. At the moment, the problem of AF prevention remains unsolved. First of all, we are talking about the primary prevention of AF. Primary prevention of AF is the most effective method for the control of this pathology, which will significantly reduce the incidence of AF, and because of this — the risk of complications and mortality. Unresolved problem of primary prevention of AF is associated with considerable complexity of its implementation. This is due to a very high prevalence and the large number of modifiable risk factors, as well as the presence of such non-modifiable risk factors, such as age and genetic predisposition.
фібриляція передсердь; фактори ризику; первинна профілактика; огляд
фибрилляция предсердий; факторы риска; первичная профилактика; обзор
atrial fibrillation; risk factors; primary prevention; review
Статья опубликована на с. 61-69
Согласно современным данным фибрилляция предсердий (ФП) является одним из наиболее опасных и распространенных нарушений сердечного ритма. ФП встречается у 1–2 % населения. Заболеваемость ФП постоянно возрастает во всем мире и, как ожидается, удвоится в течение следующих 50 лет. В наибольшей степени это обусловлено общим постепенным старением населения в целом. Наличие у лиц ФП примерно в 5 раз повышает риск развития инсульта, а также значительно увеличивает вероятность его рецидива, утраивает риск развития сердечной недостаточности (СН), в два раза увеличивает вероятность развития деменции и резко снижает качество жизни. Поэтому проблема профилактики ФП имеет не только медицинский, но и социальный характер [4, 10, 23, 50].
1. Голицын С.П. Диагностика и лечение фибрилляции предсердий. Рекомендации РКО, ВНОА и АССХ / Голицын С.П., Панченко Е.П., Попов С.В. [ и др.] // Рос. кардиол. журн. — 2012. — № 4(102), прил. 3. — С. 1-100.
2. Сычев О.С. Фибрилляция предсердий неклапанного генеза у пациентов в возрасте меньше 65 лет с сохраненной систолической функцией левого желудочка: клинические характеристики и ремоделирование миокарда / Сычев О.С., Михалева Т.В. // Український кардіологічний журнал. — 2014. — № 3. — С. 53-60
3. Сичов О.С. Діагностика та лікування фібриляції передсердь. Рекомендації Робочої групи з порушень ритму серця Асоціації кардіологів України / Сичов О.С., Коваленко В.М., Дзяк Г.В. [та ін.]. — К., 2014. — 167 с.
4. Сиволап В.Д. Особенности ремоделирования сердца у больных с разными клиническими формами неклапанной фибрилляции предсердий / Сиволап В.Д., Лашкул Д.А., Марченко В.В. // Science Rise. — 2016. — № 4(3). — С. 32-38.
5. Татарский Б.А. Фибрилляция предсердий: патофизиологические подходы к выбору антиаритмической терапии / Татарский Б.А., Баталов Р.Е., Попов С.В. — Томск: STT, 2013. — 484 с.
6. Abed H.S. Obesity results in progressive atrial structural and electrical remodeling: implications for atrial fibrillation / Abed H.S., Samuel C.S., Lau D.H. [et al.] // Heart Rhythm. — 2013. — Vol. 10. — P. 90-100.
7. Aizer A. Relation of vigorous exercise to risk of atrial fibrillation / Aizer A., Gaziano J.M., Cook N.R. [et al.] // Am. J. Cardiol. — 2009. — Vol. 103. — P. 572-577.
8. Arnar D.O. Familial aggregation of atrial fibrillation in Iceland / Arnar D.O., Thorvaldsson S., Manolio T.A. [et al.] // Eur. Heart J. — 2006. — Vol. 27. — P. 708-712.
9. Benjamin E.J. Prevention of atrial fibrillation report from a National Heart, Lung, and Blood Institute workshop / Benjamin E.J., Chen P.S., Bild D.E., Mascette A.M. // Circulation. — 2009. — Vol. 119(4). — P. 606-618.
10. Berti D. Prevalence and antithrombotic management of atrial fibrillation in hospitalised patients / Berti D., Moors E., Moons Ph., Heidbuche H. // Heart. — 2015. — Vol. 101. — P. 884-893.
11. Bettoni M. Autonomic tone variations before the onset of paroxysmal atrial fibrillation / Bettoni M., Zimmermann M. // Circulation. — 2002. — Vol. 105. — P. 2753-2759.
12. Borzecki A.M. Racial differences in the prevalence of atrial fibrillation among males / Borzecki A.M., Bridgers D.K., Liebschutz J.M. [et al.] // Natl Med. Assoc. — 2008. — Vol. 100. — P. 237-245.
13. Burstein B. Atrial cardiomyocyte tachycardia alters cardiac fibroblast function: a novel consideration in atrial remodeling / Burstein B., Qi X.Y., Yeh Y.H. [et al.] // Cardiovasc. Res. — 2007. — Vol. 76. — P. 442-452.
14. Burstein B. Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation / Burstein B., Nattel S. // J. Am. Coll. Cardiol. — 2008. — Vol. 51. — P. 802-809.
15. Calloe K. Characterizations of a loss-of-function mutation in the Kir3.4 channel subunit / Calloe K., Ravn L.S., Schmitt N. [et al.] // Biochem. Biophys Res. Commun. — 2007. — Vol. 364. — P. 889-895.
16. Cappola A.R. Thyroid status, cardiovascular risk, and mortality in older adults / Cappola A.R., Fried L.P., Arnold A.M. [et al.] // JAMA. — 2006. — Vol. 295. — P. 1033-1041.
17. Chen Y.C. Effects of thyroid hormone on the arrhythmogenic activity of pulmonary vein cardiomyocytes / Chen Y.C., Chen S.A., Chen Y.J. [et al.] // J. Am. Coll. Cardiol. — 2002. — Vol. 39. — P. 366-372.
18. Chen W.J. Molecular characterization of thyroid hormone-inhibited atrial L-type calcium channel expression: implication for atrial fibrillation in hyperthyroidism / Chen W.J., Yeh Y.H., Lin K.H. [et al.] // Basic. Res. Cardiol. — 2011. — Vol. 106. — P. 163-174.
19. Chou C.C. Intracellular calcium dynamics and anisotropic reentry in isolated canine pulmonary veins and left atrium / Chou C.C., Nihei M., Zhou S. [et al.] // Circulation. — 2005. — Vol. 111. — P. 2889-2897.
20. Chung M.K. C-reactive protein elevation in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation / Chung M.K., Martin D.O., Sprecher D. [et al.] // Circulation. — 2001. — Vol. 104. — P. 2886-2891.
21. Clauss S. Does Atrial Fibrillation Follow Function?: Ion Channel Mutations and Lone Atrial Fibrillation / Clauss S., Ellinor P.T. // Circ. Arrhythm. Electrophysiol. — 2015. — Vol. 8. — P. 1005-1006.
22. Conen D. Influence of systolic and diastolic blood pressure on the risk of incident atrial fibrillation in women / Conen D., Tedrow U.B., Koplan B.A. [et al.] // Circulation. — 2009. — Vol. 119. — P. 2146-2152.
23. Copley D.J. Atrial Fibrillation: A Review of Treatments and Current Guidelines / Copley D.J., Hill K.M. // AACN Adv. Crit. Care. — 2016. — Vol. 27. — P. 120-128.
24. Darbar D. Cardiac sodium channel (SCN5A) variants associated with atrial fibrillation / Darbar D., Kannankeril P.J., Donahue B.S. [et al.] // Circulation. — 2008. — Vol. 117. — P. 1927-1935.
25. Djoussé L. Long-term alcohol consumption and the risk of atrial fibrillation in the Framingham Study / Djoussé L., Levy D., Benjamin E.J. [et al.] // Am. J. Cardiol. — 2004. — Vol. 93. — P. 710-713.
26. Ellinor P.T. Familial aggregation in lone atrial fibrillation / Ellinor P.T., Yoerger D.M., Ruskin J.N., MacRae C.A. // Hum. Genet. — 2005. — Vol. 118. — P. 179-184.
27. Ellinor P.T. Ion channel mutations in AF: signal or noise? / Ellinor P.T., MacRae C.A. // Heart Rhythm. — 2008. — Vol. 5. — P. 436-437.
28. Ellinor P.T. Genetics and molecular biology of AF // Circ. Res. — 2014. — Vol. 114. — P. 1453-1468.
29. Everett T.H. Left atrial dilatation resulting from chronic mitral regurgitation decreases spatiotemporal organization of atrial fibrillation in left atrium / Everett T.H., Verheule S., Wilson E.E. [et al.] // Am. J. Physiol. — 2004. — Vol. 286. — P. 2452-2460.
30. Everett T.H. Atrial fibrosis and the mechanisms of atrial fibrillation / Everett T.H., Olgin J.E. // Heart Rhythm. — 2007. — Vol. 4. — P. 24-27.
31. Fox C.S. Parental atrial fibrillation as a risk factor for atrial fibrillation in offspring / Fox C.S., Parise H., D’Agostino R.B. [et al.] // JAMA. — 2004. — Vol. 291. — P. 2851-2855.
32. Frost L. Alcohol and risk of atrial fibrillation or flutter: a cohort study / Frost L., Vestergaard P. // Arch. Intern. Med. — 2004. — Vol. 164. — P. 1993-1998.
33. Frost L. Work related physical activity and risk of a hospital discharge diagnosis of atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study / Frost L., Frost P., Vestergaard P. // Occup. Environ. Med. — 2005. — Vol. 62. — P. 49-53.
34. Gaborit N. Gender-related differences in ion-channel and transporter subunit expression in non-diseased human hearts / Gaborit N., Varro A., Le Bouter S. [et al.] // J. Mol. Cell. Cardiol. — 2010. — Vol. 49. — P. 639-646.
35. Gami A.S. Obstructive sleep apnea, obesity, and the risk of incident atrial fibrillation / Gami A.S., Hodge D.O., Herges R.M. [et al.] // J. Am. Coll. Cardiol. — 2007. — Vol. 49. — P. 565-571.
36. Ghezelbash S. Altered Atrial Metabolism: An Underappreciated Contributor to the Initiation and Progression of Atrial Fibrillation / Ghezelbash S., Molina C.E., Dobrev D. // JAHA. — 2015. — Vol. 4. — e001808.
37. Gollob M.H. Somatic mutations in the connexin 40 gene (GJA5) in atrial fibrillation / Gollob M.H., Jones D.L., Krahn A.D. [et al.] // N. Engl. J. Med. — 2006. — Vol. 354. — P. 2677-2688.
38. Grundvold I. Upper normal blood pressures predict incident atrial fibrillation in healthy middle-aged men: a 35-year follow-up study / Grundvold I., Skretteberg P.T., Liestøl K. [et al.] // Hypertension. — 2012. — Vol. 59. — P. 198-204.
39. Guasch E. Atrial fibrillation promotion by endurance exercise: demonstration and mechanistic exploration in an animal model / Guasch E., Benito B., Qi X. [et al.] // J. Am. Coll. Cardiol. — 2013. — Vol. 62. — P. 68-77.
40. Gudbjartsson D.F. Variants conferring risk of atrial fibrillation on chromosome 4q25 / Gudbjartsson D.F., Arnar D.O., Helgadottir A. [et al.] // Nature. — 2007. — Vol. 448. — P. 353-357.
41. Hayashi H. Aging-related increase to inducible atrial fibrillation in the rat model / Hayashi H., Wang C., Miyauchi Y. [et al.] // J. Cardiovasc. Electrophysiol. — 2002. — Vol. 13. — P. 801-808.
42. Healey J.S. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis / Healey J.S., Baranchuk A., Crystal E. [et al.] // Journal of the American College of Cardiology. — 2005. — Vol. 45(11). — P. 1832-1839.
43. Heeringa J. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam Study / Heeringa J., Van Der Kuip D.A., Hofman A. [et al.] // Eur. Heart J. — 2006. — Vol. 27. — P. 949-953.
44. Heijman J. Cellular and Molecular Electrophysiology of Atrial Fibrillation Initiation, Maintenance, and Progression / Heijman J., Voigt N., Nattel S., Dobrev D. // Circ. Res. — 2014. — Vol. 114. — P. 1483-1499.
45. Heijman J. The value of basic research insights into atrial fibrillation mechanisms as a guide to therapeutic innovation: a critical analysis / Heijman J., Algalarrondo V., Voigt N. [et al.] // Cardiovasc. Res. — 2016. — Vol. 109. — P. 467-479.
46. Hong K. Genetic basis of atrial fibrillation / Hong K., Xiong Q. // Curr. Opin. Cardiol. — 2014. — Vol. 29. — P. 220-226.
47. Issac T.T. Role of inflammation in initiation and perpetuation of atrial fibrillation: a systematic review of the published data / Issac T.T., Dokainish H., Lakkis N.M. // J. Am. Coll. Cardiol. — 2007. — Vol. 50. — P. 2021-2028.
48. Iwasaki Y.K. Determinants of atrial fibrillation in an animal model of obesity and acute obstructive sleep apnea / Iwasaki Y.K., Shi Y., Benito B. [et al.] // Heart Rhythm. — 2012. — Vol. 9. — P. 1409-1416.
49. Iwasaki Y.K. Repetitive obstructive sleep apnea produces cardiac remodeling and a substrate for atrial fibrillation / Iwasaki Y.K., Shi Y.F., Kato T. // Heart Rhythm. — 2012. — Vol. 9. — P. 189-196.
50. January C. 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society / January C., Wann L., Alpert J. [et al.] // Circulation. — 2014. — Vol. 129.
51. Kalifa J. Intra-atrial pressure increases rate and organization of waves emanating from the superior pulmonary veins during atrial fibrillation / Kalifa J., Jalife J., Zaitsev A.V. [et al.] // Circulation. — 2003. — Vol. 108. — P. 668-671.
52. Kirchhof P. Personalized management of atrial fibrillation: Proceedings from the fourth Atrial Fibrillation competence NETwork. European Heart Rhythm Association consensus conference / Kirchhof P., Breithardt G., Aliot E. [et al.] // Europace. — 2013. — Vol. 15. — P. 1540-1556.
53. Kodama S. Alcohol consumption and risk of atrial fibrillation: a meta-analysis / Kodama S., Saito K., Tanaka S. // J. Am. Coll. Cardiol. — 2011. — Vol. 57. — P. 427-436.
54. Koektuerk B. Role of diabetes in heart rhythm disorders / Koektuerk B., Aksoy M., Horlitz M. // World J. Diabetes. — 2016, Feb 10. — Vol. 7(3). — P. 45-49.
55. Koura T. Anisotropic conduction properties in canine atria analyzed by high-resolution optical mapping: preferential direction of conduction block changes from longitudinal to transverse with increasing age / Koura T., Hara M., Takeuchi S. [et al.] // Circulation. — 2002. — Vol. 105. — P. 2092-2098.
56. Lau D.H. Hypertension and atrial fibrillation: evidence of progressive atrial remodeling with electrostructural correlate in a conscious chronically instrumented ovine model / Lau D.H., Mackenzie L., Kelly D.J. // Heart Rhythm. — 2010. — Vol. 7. — P. 1282-1290.
57. Lemoine M.D. Arrhythmogenic left atrial cellular electrophysiology in a murine genetic long QT syndrome model / Lemoine M.D., Duverger J.E., Naud P. [et al.] // Cardiovasc. Res. — 2011. — Vol. 92. — P. 67-74.
58. Leong-Sit P. Efficacy and risk of atrial fibrillation ablation before 45 years of age / Leong-Sit P., Zado E., Callans D.J. [et al.] // Circ. Arrhythm. Electrophysiol. — 2010. — Vol. 3(5). — P. 452-457.
59. Liew R. Almanac 2013: cardiac arrhythmias and pacing // Heart. — 2013. — Vol. 99(19). — P. 1398-1407.
60. Li D. Promotion of atrial fibrillation by heart failure in dogs: atrial remodeling of a different sort / Li D., Fareh S., Leung T.K., Nattel S. // Circulation. — 1999. — Vol. 100. — P. 87-95.
61. Li N. PITX2: a master regulator of cardiac channelopathy in atrial fibrillation? / Li N., Dobrev D., Wehrens X.H. // Cardiovasc. Res. — 2016. — Vol. 109. — P. 345-347.
62. Liu X.K. Age- and sex-related atrial electrophysiologic and structural changes / Liu X.K., Jahangir A., Terzic A. [et al.] // Am. J. Cardiol. — 2004. — Vol. 94. — P. 373-375.
63. Liu T. Mineralocorticoid receptor antagonists and atrial fibrillation: a meta-analysis / Liu T., Korantzopoulos P., Shao Q. [et al.] // Europace. — 2016. — Vol. 18(5). — P. 672-680.
64. Lloyd-Jones D.M., Wang T.J., Leip E.P. Lifetime risk for development of atrial fibrillation: the Framingham Heart Study / Lloyd-Jones D.M., Wang T.J., Leip E.P. [et al.] // Circulation. — 2004. — Vol. 110. — P. 1042-1046.
65. London B. Omega-3 fatty acids and cardiac arrhythmias: prior studies and recommendations for future research: a report from the National Heart, Lung, and Blood Institute and Office of Dietary Supplements Omega-3 Fatty Acids and Their Role in Cardiac Arrhythmogenesis Workshop / London B., Albert C., Anderson M.E. [et al.] // Circulation. — 2007. — Vol. 116. — P. 320-335.
66. Lubitz S.A. Genetics of atrial fibrillation: implications for future research directions and personalized medicine / Lubitz S.A., Ozcan C., Magnani J.W. // Circ. Arrhythm. Electrophysiol. — 2010. — Vol. 3. — P. 291-299.
67. Lundby A. KCNE3 mutation V17M identified in a patient with lone atrial fibrillation / Lundby A., Ravn L.S., Svendsen J.H. [et al.] // Cell. Physiol. Biochem. — 2008. — Vol. 21. — P. 47-54.
68. Macheret F. Higher circulating adiponectin levels are associated with increased risk of atrial fibrillation in older adults / Macheret F., Bartz T.M., Djousse L. [et al.] // Heart. — 2015. — Vol. 101. — P. 1368-1374.
69. Mathew J.P. A multicenter risk index for atrial fibrillation after cardiac surgery / Mathew J.P., Fontes M.L., Tudor I.C. [et al.] // JAMA. — 2004. — Vol. 291. — P. 1720-1729.
70. Mont L. Long-lasting sport practice and lone atrial fibrillation / Mont L., Sambola A., Brugada J. [et al.] // Eur. Heart. — 2002. — Vol. 23. — P. 477-482.
71. Nattel S. Mechanisms of atrial fibrillation: lessons from animal models / Nattel S., Shiroshita-Takeshita A., Brundel B.J., Rivard L. // Prog. Cardiovasc. Dis. — 2005. — Vol. 48. — P. 9-28.
72. Nattel S. Arrhythmogenic ion-channel remodeling in the heart: heart failure, myocardial infarction, and atrial fibrillation / Nattel S., Maguy A., Le Bouter S., Yeh Y.H. // Physiol. Rev. — 2007. — Vol. 87. — P. 425-456.
73. Nattel S. Deciphering the fundamental mechanisms of atrial fibrillation: a quest for over a century / Nattel S., Dobrev D. // Cardiovasc. Res. — 2016. — Vol. 109. — P. 465-466.
74. Naruse Y. Concomitant obstructive sleep apnea increases the recurrence of atrial fibrillation following radiofrequency catheter ablation of atrial fibrillation: clinical impact of continuous positive airway pressure therapy / Naruse Y., Tada H., Satoh M. [et al.] // Heart Rhythm. — 2013. — Vol. 10. — P. 331-337.
75. Nishida K. Mechanisms of atrial tachyarrhythmias associated with coronary artery occlusion in a chronic canine model / Nishida K., Qi X.Y., Wakili R. [et al.] // Circulation. — 2011. — Vol. 123. — P. 137-146.
76. Novaro G.M. Meta-analysis comparing reported frequency of atrial fibrillation after acute coronary syndromes in Asians versus whites / Novaro G.M., Asher C.R., Bhatt D.L. [et al.] // Am. J. Cardiol. — 2008. — Vol. 101. — P. 506-509.
77. Ogawa M. Left stellate ganglion and vagal nerve activity and cardiac arrhythmias in ambulatory dogs with pacing-induced congestive heart failure / Ogawa M., Zhou S., Tan A.Y. [et al.] // J. Am. Coll. Cardiol. — 2007. — Vol. 50. — P. 335-343.
78. Okin P.M. Regression of electrocardiographic left ventricular hypertrophy and decreased incidence of new-onset atrial fibrillation in patients with hypertension / Okin P.M., Wachtell K., Devereux R.B. [et al.] // JAMA. — 2006. — Vol. 296. — P. 1242-1248.
79. Olson T.M. Sodium channel mutations and susceptibility to heart failure and atrial fibrillation / Olson T.M., Michels V.V., Ballew J.D. [et al.] // JAMA. — 2005. — Vol. 293. — P. 447-454.
80. Olson T.M. Kv1.5 channelopathy due to KCNA5 loss-of-function mutation causes human atrial fibrillation / Olson T.M., Alekseev A.E., Liu X.K. [et al.] // Hum. Mol. Genet. — 2006. — Vol. 15. — P. 2185-2191.
81. Ono N. Spontaneous atrial fibrillation initiated by triggered activity near the pulmonary veins in aged rats subjected to glycolytic inhibition / Ono N., Hayashi H., Kawase A. [et al.] // Am. J. Physiol. — 2007. — Vol. 292. — P. 639-648.
82. Otake H. Influences of autonomic nervous system on atrial arrhythmogenic substrates and the incidence of atrial fibrillation in diabetic heart / Otake H., Suzuki H., Honda T., Maruyama Y. // Int. Heart J. — 2009. — Vol. 50. — P. 627-641.
83. Ravn L.S. Gain of function in IKs secondary to a mutation in KCNE5 associated with atrial fibrillation / Ravn L.S., Aizawa Y., Pollevick G.D. [et al.] // Heart Rhythm. — 2008. — Vol. 5. — P. 427-435.
84. Samokhvalov A.V. Alcohol Consumption as a Risk Factor for Atrial Fibrillation: a Systematic Review and Meta-Analysis / Samokhvalov A.V., Irving H.M., Rehm J. // Eur. J. Cardiovasc. Prev. Rehabil. — 2010 Dec. — Vol. 17(6). — P. 706-712.
85. Shan H. Downregulation of miR-133 and miR-590 contributes to nicotine-induced atrial remodelling in canines / Shan H., Zhang Y., Lu Y. [et al.] // Cardiovasc. Res. — 2009. — Vol. 83. — P. 465-472.
86. Shan J. Calcium leak through ryanodine receptors leads to atrial fibrillation in 3 mouse models of catecholaminergic polymorphic ventricular tachycardia / Shan J., Xie W., Betzenhauser M. [et al.] // Circ. Res. — 2012. — Vol. 111. — P. 708-717.
87. Sinno H. Atrial ischemia promotes atrial fibrillation in dogs / Sinno H., Derakhchan K., Libersan D. [et al.] // Circulation. — 2003. — Vol. 107. — P. 1930-1936.
88. Tan A.Y. Neural mechanisms of paroxysmal atrial fibrillation and paroxysmal atrial tachycardia in ambulatory canines / Tan A.Y., Zhou S., Ogawa M. [et al.] // Circulation. — 2008. — Vol. 118. — P. 916-925.
89. Tanaka K. Spatial distribution of fibrosis governs fibrillation wave dynamics in the posterior left atrium during heart failure / Tanaka K., Zlochiver S., Vikstrom K.L. [et al.] // Circ. Res. — 2007, Oct 12. — Vol. 101(8). — P. 839-847.
90. Tran D.T.T. Predicting new-onset postoperative atrial fibrillation in cardiac surgery patients / Tran D.T.T., Perry J.J., Dupuis J.Y. [et al.] // Journal of cardiothoracic and vascular anesthesia. — 2015. — Vol. 29(5). — P. 1117-1126.
91. Tucker N.R. Common variation in atrial fibrillation: navigating the path from genetic association to mechanism / Tucker N.R., Clauss S., Ellinor P.T. // Cardiovascular Research. — 2016. — Vol. 109. — P. 493-501.
92. Vaquero M. Cardiac fibrillation: from ion channels to rotors in the human heart / Vaquero M., Calvo D., Jalife J. // Heart Rhythm. — 2008. — Vol. 5. — P. 872-879.
93. Verheule S. Increased vulnerability to atrial fibrillation in transgenic mice with selective atrial fibrosis caused by overexpression of TGF-beta1 / Verheule S., Sato T., Everett T. [et al.] // Circ. Res. — 2004. — Vol. 94. — P. 1458-1465.
94. Verheule S. Alterations in atrial electrophysiology and tissue structure in a canine model of chronic atrial dilatation due to mitral regurgitation / Verheule S., Wilson E., Everett T. [et al.] // Circulation. — 2003. — Vol. 107. — P. 2615-2622.
95. Verheule S. Direction-dependent conduction abnormalities in a canine model of atrial fibrillation due to chronic atrial dilatation / Verheule S., Wilson E., Banthia S. [et al.] // Am. J. Physiol. — 2004. — Vol. 287. — P. 634-644.
96. Wakili R. Recent advances in the molecular pathophysiology of atrial fibrillation / Wakili R., Voigt N., Kääb S. [et al.] // J. Clin. Invest. — 2011. — Vol. 121. — P. 2955-2968.
97. Workman A.J. The contribution of ionic currents to changes in refractoriness of human atrial myocytes associated with chronic atrial fibrillation / Workman A.J., Kane K.A., Rankin A.C. // Cardiovasc. Res. — 2001. — Vol. 52. — P. 226-235.
98. Workman A.J. Characterisation of the Na, K pump current in atrial cells from patients with and without chronic atrial fibrillation / Workman A.J., Kane K.A., Rankin A.C. // Cardiovasc. Res. — 2003. — Vol. 59. — P. 593-602.
99. Xia M. A Kir2.1 gain-of-function mutation underlies familial atrial fibrillation / Xia M., Jin Q., Bendahhou S. [et al.] // Biochem. Biophys. Res. Commun. — 2005. — Vol. 332. — P. 1012-1019.
100. Xiao P. Blockade of angiotensin II improves hyperthyroid induced abnormal atrial electrophysiological properties / Xiao P., Gao C., Fan J. [et al.] // Regul. Pept. — 2011. — Vol. 169. — P. 31-38.
101. Yang Y. Identification of a KCNE2 gain-of-function mutation in patients with familial atrial fibrillation / Yang Y., Xia M., Jin Q. [et al.] // Am. J. Hum. Genet. — 2004. — Vol. 75. — P. 899-905.
102. Yeh Y.H. Calcium-handling abnormalities underlying atrial arrhythmogenesis and contractile dysfunction in dogs with congestive heart failure / Yeh Y.H., Wakili R., Qi X.Y. [et al.] // Circ. Arrhythm. Electrophysiol. — 2008. — Vol. 1. — P. 93-102.
103. Zhabyeyev P. S4153R is a gain-of-function mutation in the cardiac Ca(2+) release channel ryanodine receptor associated with catecholaminergic polymorphic ventricular tachycardia and paroxysmal atrial fibrillation / Zhabyeyev P., Hiess F., Wang R. [et al.] // Can. J. Cardiol. — 2013. — Vol. 29. — P. 993-996.