Статтю опубліковано на с. 7-13
Вступ
Дослідження, спрямовані на пошук генів, що визначають схильність до розвитку, тяжкість перебігу та відповідь на лікування бронхіальної астми, є ключовими для впровадження основних постулатів концепції персоналізованої медицини [6, 17]. Виявлення факторів ризику розвитку хвороби дозволить своєчасно провести профілактичні заходи запобігання їй — адекватне лікування респіраторних інфекцій, елімінацію алергенів, раннє застосування препаратів для терапії астми тощо. Вивчення генів, що впливають на тяжкість перебігу, дозволить виділити групи пацієнтів із ризиком швидкого прогресування та тяжкого перебігу бронхіальної астми. Дослідження генетичних факторів, що визначають відповідь на лікування в майбутньому, сприятиме підбору препарату та його дозування відповідно до індивідуальних особливостей хворого [11, 17, 21].
Терапевтична ефективність препаратів, що найчастіше застосовуються для лікування бронхіальної астми, визначається великою кількістю генетичних варіантів [19]. На сьогодні фармакогенетичні дослідження показали залежність ефективності застосування β2-агоністів швидкої дії від генетичних варіантів рецептора (ADRB2), інгаляційних глюкокортикостероїдів (ІГКС) — від різних алельних варіантах генів, що беруть участь у метаболізмі препаратів (STIP1, T ген, GLCCI1), антагоністів лейкотрієнових рецепторів — від поліморфізму в промотері гена ALOX5 [11]. Однак, незважаючи на досягнуті результати, прогнозування ймовірності розвитку терапевтичної резистентності при лікуванні бронхіальної астми в пацієнта наразі неможливе [19]. Актуальним залишається пошук генів-кандидатів для доповнення генетичних профілів розвитку, перебігу та відповіді на лікування бронхіальної астми.
Автофагічно-лізосомна система та протеасомальний протеоліз являють собою головні шляхи деградації білків у клітині. Окрім забезпечення контролю якості протеїнів, протеолітичні системи забезпечують розщеплення короткоживучих регуляторних протеїнів та посттрансляційну обробку функціональних протеїнів, які беруть участь у патогенезі атопічних захворювань. Наприклад, убіквітин-протеасомна система являє собою механізм регуляції транскрипції медіаторів алергійного запалення шляхом активації інгібіторів кодуючих генів — ІκB, Itch, МРК-1 тощо [7, 18, 20].
Взаємозв’язок систем представлений на багатьох рівнях. Насамперед обидві системи мають спільні субстрати деградації [9], спільні молекули ко-шаперони — СНІР (C-terminus of Hsp70-interacting protein) та BAG (Bcl-2-associated athanogene) та адапторні й регуляторні молекули, наприклад р62, р53, що забезпечують компенсаторне підвищення активності однієї системи у відповідь на інгібування іншої [12, 22].
Цікаво, що обидві протеолітичні системи беруть участь у розщепленні структурних одиниць одна одної. Так, деградація протеасом може відбуватися шляхом автофагії, особливо виражений цей процес при голодуванні [8]. У свою чергу, убіквітин-подібні молекули LC3, що відіграють ключову роль у біогенезі автофагосоми, підлягають деградації шляхом протеасомного протеолізу [10].
Таким чином, взаємодія представлених протео–літичних систем є синергічною, скоординованою та вкрай важливою для життєдіяльності клітини та виконання нею специфічних функцій. Патологічно змінена активність однієї із систем, імовірно, призводить до компенсаторних змін функціонування іншої [12]. Саме тому вивчення одразу обох найголовніших систем деградації протеїнів є важливим, у тому числі в контексті їх значення в етіології, патогенезі та клінічних особливостях бронхіальної астми.
Раніше були опубліковані результати дослідження щодо впливу поліморфізмів генів лізосомного та протеасомного протеолізу на розвиток атопічних захворювань, у тому числі бронхіальної астми [4]. Так, згідно з результатами, мінорний генотип ТТ rs510432 гена автофагії 5 (ATG5) асоціюється із підвищеним ризиком розвитку атопічних захворювань (р < 0,05 за χ2-тестом; ОR 2,17; 95% ДІ 1,09–4,46). Мінорний генотип GG rs4769628 гена дозрівання протеасоми (POMP), навпаки, має протективний ефект щодо розвитку атопічного маршу й зустрічається вірогідно частіше у здорових дітей (р < 0,05 за χ2-тестом; OR 0,73; 95% ДІ 0,41–1,36) [4]. Очевидно, що ці поліморфізми чинять антагоністичний вплив, тому для визначення ризику реалізації атопічної патології необхідно визначати комбінації генотипів високого та низького ризику.
У проведених дослідженнях з’ясовано, що мінорний генотип rs510432 гена ATG5 вірогідно частіше зустрічається в дітей із маніфестацією бронхіальної астми до 3 років життя, ніж у пацієнтів із більш пізнім початком хвороби (р < 0,05) [3]. Впливу алельних варіантів rs4769628 гена POMP на особливості перебігу атопічних захворювань нами не виявлено [5].
Враховуючи асоціацію поліморфізмів зазначених генів із розвитком атопічних захворювань, роль у патогенезі та взаємозв’язок між протеолітичними системами, було сформульовано припущення, що однонуклеотидні поліморфізми rs510432 гена ATG5 та rs4769628 гена POMP впливають на ефективність терапії бронхіальної астми.
Матеріали та методи
У дослідження включені 98 дітей віком від 5 до 18 років, хворих на бронхіальну астму, які перебували на стаціонарному лікуванні в алергологічному відділенні Київської міської дитячої клінічної лікарні № 2. Діагноз бронхіальної астми верифікований згідно з протоколом діагностики й лікування бронхіальної астми у дітей (наказ МОЗ № 868 від 08.10.2013 р.). У всіх пацієнтів діагностовано супутню алергологічну патологію: атопічний дерматит — у 98 дітей, алергічний риніт — у 31 хворого. До групи контролю увійшли 98 здорових дітей віком 5–18 років без обтяженого алергологічного сімейного анамнезу. Методи дослідження включали загальноклінічне та лабораторне обстеження (загальний аналіз крові, загальний аналіз сечі, копрограма, загальний IgE, пікфлоуметрія, спірометрія, шкірні прик-тести, визначення поліморфізму rs510432 гена ATG5 та rs4769628 гена POMP).
Лікування бронхіальної астми проводилось відповідно до наказу МОЗ України від 08.10.2013 р. № 868 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при бронхіальній астмі».
Елімінація причинних алергенів та іритантів проводилась відповідно до результатів шкірних прик-тестів. У сім’ях дітей, хворих на бронхіальну астму, активно пропагувалися відмова від тютюнопаління, зменшення експозиції дитини до побутових аерополютантів. З раціону харчування хворих виключали причинні продукти (кава, какао, шоколад, цитрусові, полуниця, суниця, яйця, мед, риба, ікра, краби, раки тощо).
Обсяг базисної терапії визначався рівнем конт–ролю бронхіальної астми. У 13 дітей (13,27 %) основної групи з інтермітуючою та легкою персистуючою бронхіальною астмою контроль над захворюванням був досягнутий призначенням терапії, що відповідала кроку 1: β2-агоніст короткої дії за необхідності (сальбутамол) 100 мкг інгаляційно 3–4 рази на добу з інтервалом не менше 3 годин.
44 дітям (44,89 %) для досягнення контролю над бронхіальною астмою призначена базисна підтримуюча терапія в обсязі кроку 2: препарати невідкладної допомоги (сальбутамол 100 мкг інгаляційно 3–4 рази на добу з інтервалом не менше 3 годин) та низькі дози ІГКС. 28 хворих (28,57 %) отримували флутиказону пропіонат 100 мкг /добу, 16 пацієнтів (16, 33 %) — 200 мкг/добу.
30 дітей (30,61 %), у яких не вдалося досягти контролю над бронхіальною астмою засобами попереднього кроку, вимагали призначення терапії, що відповідає кроку 3. 16 хворих (16,32 %) отримували низькі дози ІГКС (флутиказону пропіонат
200 мкг/добу) та антагоніст рецепторів лейкотрієнів (монтелукаст натрію 5 мг/добу для дітей віком до 14 років та 10 мг/добу — для дітей віком понад 14 років) протягом 3 місяців. 9 пацієнтів (9,18 %) застосовували низькі дози ІГКС у комбінації із β2-агоністами пролонгованої дії: флутиказону пропіонат
200 мкг/добу та сальметерол (сальметеролу ксинафоат) 25 мкг/добу. 5 особам (5,10 %) призначені середні дози ІГКС (флутиказону пропіонат
300 мкг/добу для дітей віком до 12 років та
500 мкг/добу — для дітей віком понад 12 років) протягом 3 місяців.
11 дітям (11,22 %) призначена терапія, що відповідала кроку 4. 9 пацієнтів (9,18 %) отримували середні дози ІГКС у комбінації із β2-агоністами пролонгованої дії: флутиказону пропіонат 300 мкг/добу для дітей віком до 12 років та 500 мкг/добу — для дітей віком понад 12 років і сальметерол (сальметеролу ксинафоат) 25 мкг/добу протягом 3 місяців. 2 особам (2,04 %) призначені високі дози ІГКС (флутиказону пропіонат 1000 мкг/добу). Показань для призначення базисної терапії в обсязі кроку 5 хворим основної групи не було.
Для оцінки ефективності терапії бронхіальної астми використовувалася п’ятибальна шкала, запропонована в тесті контролю астми (ACT) (www.asthmacontrol.com) [2]. АСТ включає 5 запитань, що відображають критерії контрольованості бронхіальної астми, а саме: обмеження активності дитини, частота виникнення денних і нічних симптомів, частота застосування β2-агоністів швидкої дії та самооцінка контролю. Результати опитування виражалися в балах від 0 до 5 та підтверджувалися за допомогою клінічного обстеження хворих. Оцінювалася динаміка середнього бала сумарної оцінки контрольованості бронхіальної астми через 12 тижнів після призначення лікування.
Проведення дослідження погоджено з комісією з питань етики Національного медичного університету імені О.О. Богомольця. Батьки підписали інформовану згоду на включення дітей в дослідження.
Статистичний аналіз
Отримані в дослідженні результати були опрацьовані за допомогою програми SPSS (версії 22.0) та програмного середовища R (версії 3.0). Для визначення та підтвердження взаємодії між однонуклеотидними поліморфізмами генів ATG5 та РОМР, визначення типу цієї взаємодії використовувався метод багатофакторного зменшення просторовості (MDR). Для опрацювання даних, отриманих при обстеженні хворих дітей, використаний статистичний пакет Medstat.
Результати
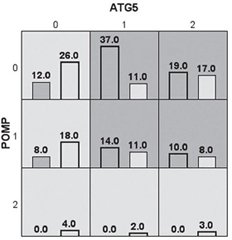
У дослідженні вивчений тип взаємодії між досліджуваними генами за методом MDR, у результаті отримана модель із потенціалом предикції 65 %. Результати щодо взаємодії поліморфізмів rs510432 гена ATG5 та rs4769628 гена РОМР продемонстрували антагоністичну взаємодію значної сили –4,38 % (рис. 1).
Протягом 12 тижнів після призначення лікування в основній групі спостерігалось покращення контрольованості бронхіальної астми: зменшилися частота виникнення симптомів у денний і нічний час, потреба в β2-агоністах короткої дії, обмеження активності, поліпшилася самооцінка контролю захворювання (р < 0,05) (рис. 2).
Наступним етапом дослідження було визначення впливу алельних варіантів поліморфізму rs510432 гена ATG5 на сумарну оцінку контрольованості бронхіальної астми через 12 тижнів лікування. Для цього 60 дітей (61,22 %) основної групи з частковим контролем та неконтрольованою бронхіальною астмою поділені на 2 підгрупи. До 1-ї підгрупи увійшло 18 хворих (30,00 %) з мінорним генотипом ТТ rs510432 гена ATG5, до 2-ї підгрупи — 42 особи (70,00 %) з мажорним (СС) та гетерозиготним (СТ) алельними варіантами.
Знайдено статистично значущі відмінності при порівнянні сумарної оцінки контрольованості бронхіальної астми через 12 тижнів після лікування залежно від генотипу: при мажорному та гетерозиготному варіантах поліморфізму rs510432 гена ATG5 показники контрольованості вищі, ніж у носіїв мінорного генотипу (19,68 бала (Ме = 20) проти 18,71 бала (Ме = 18,5), (р < 0,05) (рис. 3).
В 1-й підгрупі зменшення об’єму форсованого видиху за 1 с (ОФВ1) < 80 % від належного виявлено у 13 хворих (72,22 %) на момент включення в дослідження, у 10 (55,56 %) — через 4 тижні після лікування та в 9 осіб (50,00 %) — через 12 тижнів після лікування. У 2-й підгрупі зменшення ОФВ1 < 80 % від належного визначено в 35 дітей (83,33 %) на момент включення в дослідження, у 22 (52,38 %) — через 4 тижні та в 13 (30,96 %) — через 12 тижнів після лікування (рис. 4).
/7-13/10-3.jpg)
Таким чином, на момент включення в дослідження частка хворих з ОФВ1 < 80 % від належного рівня була вірогідно вищою серед дітей із гетерозиготним та мажорним генотипом поліморфізму rs510432 гена ATG5, ніж серед осіб із мінорним генотипом (83,33 проти 72,22 %, р < 0,05). Через 12 тижнів після лікування в групі хворих з генотипом СТ та СС частка дітей з ОФВ1 < 80 % від належного рівня була нижчою порівняно з носіями мінорної алелі (30,96 проти 50,00 %, р > 0,05). Таким чином, отримані дані підтверджують негативний вплив мінорної алелі T на показники зовнішнього дихання в дітей, хворих на бронхіальну астму.
Для визначення зв’язку алельних варіантів поліморфізму rs4769628 гена РОМР та динаміки конт–рольованості бронхіальної астми через 12 тижнів після лікування 60 дітей (61,22 %) основної групи з частковим контролем та неконтрольованою бронхіальною астмою було поділено на 2 підгрупи. 39 хворих (65,00 %) з мажорним генотипом АА увійшли в 1-шу підгрупу, 19 осіб (31, 67 %) із гетерозиготним АG — у 2-гу. Середній бал сумарної оцінки конт–рольованості бронхіальної астми через 12 тижнів після лікування в дітей із генотипом АG rs4769628 гена РОМР був вірогідно вищий, ніж в осіб із мажорними гомозиготами (р < 0,05) (рис. 5).
У 1-й підгрупі зменшення ОФВ1 < 80 % від належного рівня на момент включення в дослідження виявлено у 33 хворих (84,62 %), через 12 тижнів після лікування — у 16 пацієнтів (41,02 %). У 2-й підгрупі — у 14 (73,68 %) та 5 хворих (26,32 %) відповідно (рис. 6).
На момент включення в дослідження частка хворих з ОФВ1 < 80 % від належного рівня була вірогідно вищою серед дітей із мажорним генотипом rs4769628 гена РОМР, ніж серед осіб із гетерозиготним генотипом (84,62 проти 73,68 %, р < 0,05). Через 12 тижнів після лікування в групі хворих із генотипом АG кількість дітей з ОФВ1 < 80 % від належного рівня була нижчою, ніж в групі з генотипом АА (41,02 проти 26,32 %, р > 0,05).
Обговорення та висновки
Проведене дослідження підтверджує попередні результати щодо негативного впливу на розвиток атопічних захворювань у дітей мінорної алелі Т поліморфізму rs510432 гена ATG5 [3, 16] та протективного ефекту мінорної алелі G rs4769628 гена РОМР [5]. Одночасне визначення зазначених поліморфізмів сприяє підвищенню ефективності ранньої діагностики атопічних захворювань у дітей. Виявлення комбінацій алельних варіантів зазначених поліморфізмів, що асоціюються із високим ризиком розвитку «атопічного маршу» в дітей, має важливе прогностичне значення і вимагає своєчасного проведення профілактичних заходів для запобігання розвитку бронхіальної астми.
З іншого боку, персоналізація лікувальної тактики шляхом визначення генетичних профілів у дітей із бронхіальною астмою є важливою проблемою сьогодення [1]. Отримані нами результати свідчать, що в пацієнтів із генотипом ТТ поліморфізму rs510432 гена ATG5 сумарний бал контрольованості бронхіальної астми через 12 тижнів лікування вірогідно нижчий, ніж у мажорних гомозигот та гетерозигот. Відомо, що мінорний алель поліморфізму rs510432 ATG5 підвищує активність промотера гена та, впливаючи на активацію транскрипційних факторів STAT1 та C-Fos, імовірно, відіграє роль у патогенезі бронхіальної астми. Окрім того, у дітей із бронхіальною астмою значно збільшується експресія гена ATG5 порівняно зі здоровими дітьми [16]. Інгібування автофагії шляхом виключення гена ATG5, у свою чергу, призводить до зменшення гіперреактивності бронхів, зниження рівня інтерлейкіну-5, еозинофілів, нейтрофілів бронхоальвеолярного лаважу в дослідженнях на мишах [14]. Таким чином, мінорний генотип ТТ гена ATG5, імовірно, збільшує активність автофагії і спричиняє зниження ефективності стандартної терапії бронхіальної астми.
Слід зазначити, що застосування монтелукасту знижує інтенсивність формування автофагосом, а отже, й інтенсивність автофагії [14]. В іншому дослідженні доведено залежність активності автофагії в хондроцитах від тривалості застосування дексаметазону: при короткочасному прийомі активність зростає, а в подальшому знижується [15]. Подальші дослідження щодо ефективності застосування глюкокортикостероїдів та інших груп препаратів при різних алельних варіантах поліморфізму rs510432 гена ATG5 є необхідними. Аналіз власних результатів та попередніх досліджень свідчить про можливість застосування інгібіторів автофагії для терапії бронхіальної астми.
Протеасомальний протеоліз, за літературними даними, бере участь у розвитку десенситизації β2-адренорецепторів шляхом їх деградації. Пригнічення протеасомального протеолізу шляхом застосування глюкокортикостероїдів призводить до ресенситизації рецепторів [13]. Очевидно, що існує взаємозв’язок між терапевтичною ефективністю препаратів для лікування бронхіальної астми та активністю протеасом. У дослідженні виявлено, що ефективність терапії бронхіальної астми, а саме сумарна оцінка контрольованості у хворих із гетерозиготним генотипом АG rs4769628 гена РОМР, вірогідно вища, ніж у дітей із мажорним варіантом генотипу АА. На нашу думку, отримані результати свідчать про знижену активність протеолізу в гетерозигот, що потребує подальшого підтвердження. Залишається також актуальним питання щодо можливого застосування інгібіторів протеасом для лікування бронхіальної астми [23].
Висновок
Виявлені комбінації алельних варіантів rs510432 гена ATG5 та rs4769628 гена РОМР, асоційовані з високим ризиком розвитку атопічних захворювань у дітей. Середній бал сумарної оцінки контрольованості бронхіальної астми залежить від поліморфізмів rs510432 гена ATG5 та rs4769628 гена РОМР.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів.
Список литературы
1. Банадига Н.В. Генетичні маркери, що визначають виникнення та перебіг бронхіальної астми у дітей / Н.В. Банадига, С.Б. Волошин // Современная педиатрия. — 2016. — № 2(74). — С. 100-104.
2. Бeш Л.В. Вивчення ефективності застосування покрокового алгоритму лікарської тактики у дітей з неконтрольованою бронхіальною астмою / Л.В. Беш, В.О. Бондарчук // Здоровье ребенка. — 2010. — № 3(24). — С. 8-13.
3. Волосовець О.П. Значення однонуклеотидних поліморфізмів в генах mTOR (rs11121704) та ATG5 (rs510432) в розвитку алергічних захворювань у дітей [Текст] / О.П. Волосовець, В.Є. Досенко, С.П. Кривопустов, О.В. Павлик, О.В. Ємець, Д.О. Строй // Здоровье ребенка. — 2015. — № 3(63). —
С. 5-11.
4. Волосовець О.П. Асоціація варіацій генів POMP, FLG, MTOR, ATG5 із ризиком розвитку бронхіальної астми в дітей [Текст] / О.П. Волосовець, С.П. Кривопустов, О.В. Павлик, О.В. Ємець, Д.О. Строй, В.Є. Досенко // Здоровье ребенка. — 2016. — № 1. — С. 18-24.
5. Ємець О.В. Значення однонуклеотидного поліморфізму rs4769628 гена РОМР в розвитку атопічних захворювань у дітей / О.В. Ємець // Здоровье ребенка. — 2016. — № 4(72). — С. 7-12.
6. Петров В.И. Персонализированная медицина: эволюция методологии и проблемы практического внедрения / В.И. Петров, И.Н. Шишиморов, О.В. Магницкая, Б.Е. Толкачев // Вестник ВолГМУ. — 2016. — 1(57). http://cyberleninka.ru/article/n/personalizirovannaya-meditsina-evolyutsiya-metodologii-i-problemy-prakticheskogo-vnedreniya
7. Adcock I.M. Cross-talk between pro-inflammatory transcription factors and glucocorticoids / Adcock I.M., Caramori G. // Immunol. Cell. Biol. — 2001. — Vol. 79, № 4. — P. 376-84.
8. Cuervo A.M. Chaperone-mediated autophagy: selectivity pays / Cuervo A.M. // Trends of Endocrinol. Metab. — 2010. — Vol. 21, № 3. — P. 142-150.
9. Ding W.X. Sorting, recognition and activation of the misfolded protein degradation pathways through macroautophagy and the proteasome / Ding W.X., Yin X.M. // Autophagy. — 2008. — Vol. 4, № 2. — P. 141-50.
10. Gao Z. Processing of autophagic protein LC3 by the 20S proteasome / Gao Z., Gammoh N., Wong P.M., Erdjument-Bro–mage H., Tempst P., Jiang X. // Autophagy. — 2010. — Vol. 6, № 1. —
P. 126-37.
11. Haughney J. et al. Achieving asthma control in practice: understanding the reasons for poor control // Respir. Med. — 2008. — Vol. 102, № 12. — P. 1681-93.
12. Lilienbaum A. Relationship between the proteasomal system and autophagy / Lilienbaum A. // Int. J. Biochem. Mol. Biol. — 2013. — Vol. 4, № 1. — P. 1-26.
13. Liu H. Identification of proteasome subunit beta type 3 involved in the potential mechanism of corticosteroid protective effectiveness on beta‑2 adrenoceptor desensitization by a proteomics approach / Liu H., Ni S., Zhang Y., Ding L., Zhang Y. // J. Thorac. Dis. — 2013. — Vol. 5, № 6. — P. 797-805.
14. Liu J.N. et al. The role of autophagy in allergic inflammation: a new target for severe asthma // Exp. Mol. Med. — 2016. — Vol. 48, № 4. — e243. doi: 10.1038/emm.2016.38.
15. Liu N. Autophagy in human articular chondrocytes is cytoprotective following glucocorticoid stimulation / Liu N., Wang W., Zhao Z., Zhang T., Song Y. // Mol. Med. Rep. — 2014. — Vol. 9, № 6. — P. 2166-72.
16. Martin L.J. et al. Functional variant in the autophagy-related 5 gene promotor is associated with childhood asthma // PLoS One. — 2012. — Vol. 7, № 4. — e33454.
17. Meyers D.A. Asthma genetics and personalised medicine / Meyers D.A., Bleecker E.R., Holloway J.W., Holgate S.T. // Lancet Respir. Med. — 2014. — Vol. 2, № 5. — P. 405-15.
18. Moutzouris J.P. et al. Proteasomal inhibition upregulates the endogenous MAPK deactivator MKP‑1 in human airway smooth muscle: mechanism of action and effect on cytokine secretion // Biochim. Biophys. Acta. — 2010. — Vol. 1803, № 3. — P. 416-23.
19. Ortega V.E. Asthma pharmacogenetics and the development of genetic profiles for personalized medicine / Ortega V.E., Meyers D.A., Bleecker E.R. // Pharmgenomics Pers. Med. — 2015. — Vol. 16, № 8. — P. 9-22.
20. Pelaia G. et al. Mitogen-activated protein kinases and asthma // J. Cell Physiol. — 2005. — № 202. — P. 642-653.
21. Savenije O.E. Predicting who will have asthma at school age among preschool children / Savenije O.E., Kerkhof M., Koppelman G.H., Postma D.S. // J. Allergy Clin. Immunol. — 2012. — Vol. 130, № 2. — P. 325-31.
22. Shin Y. The co-chaperone carboxyl terminus of Hsp70-interacting protein (CHIP) mediates alpha-synuclein degradation decisions between proteasomal and lysosomal pathways / Shin Y., Klucken J., Patterson C., Hyman B.T., McLean P.J. // J. Biol. Chem. — 2005. — Vol. 280, № 25. — P. 23727-34.
23. Wegmann M. Long-term bortezomib treatment reduces allergen-specific IgE but fails to ameliorate chronic asthma in mice // Int. Arch. Allergy. — 2012. — Vol. 158, № 1. — P. 43-53.

/7-13/9-1.jpg)
/7-13/10-1.jpg)
/7-13/10-2.jpg)
/7-13/10-3.jpg)
/7-13/11-1.jpg)
/7-13/11-2.jpg)