Статья опубликована на с. 95-100
Распространенность пищевой аллергии у детей младших возрастных групп в последнее время приобретает все более масштабный характер (согласно данным официальной статистики аллергической патологией страдает до 50 % населения различных регионов мира), при этом пищевая аллергия, занимая лидирующие позиции в перечне факторов возникновения тяжелых форм аллергических реакций, может быть причиной как острых состояний (анафилактический шок, тяжелые формы бронхиальной обструкции, аллергические васкулиты), так и ряда хронических патологий, поддерживая рецидивирующие поражения лор-органов, желудочно-кишечного тракта, почек, нервной и сердечно-сосудистой систем [3].
По данным литературы, при пищевой аллергии возможно развитие как острого, так и хронического воспалительного процесса в ткани поджелудочной железы, причем, как указывают авторы [4, 5], частота поражения поджелудочной железы растет с возрастом больного и длительностью заболевания.
На сегодняшний день вторичная недостаточность поджелудочной железы, проявляющаяся относительной панкреатической недостаточностью, занимает второе место среди патологии, вызываемой пищевыми аллергенами [1], а поражения поджелудочной железы на фоне наличия пищевой аллергии, представленные дисфункцией сфинктера Одди (ДСО) по панкреатическому типу, составляют около 80 % [3].
В последние годы как в отечественной, так и в зарубежной литературе появляется все больше исследований, посвященных роли микрофлоры в развитии аллергических заболеваний у детей [8, 13, 14]. Взаимосвязи аллергических заболеваний с дисфункцией желудочно-кишечного тракта посвящено достаточно много исследований, проводимых не только отечественными (что традиционно), но и зарубежными учеными [7, 9, 11, 12].
Обсуждая вопрос целесообразности дополнительного назначения пробиотиков для профилактики и лечения аллергических заболеваний, можно отметить, что при выборе пробиотика большое значение имеет прежде всего соответствие между возрастом ребенка и видом бифидо- и лактобактерий.
Lactobacillus Rhamnosus GG (LGG), эталон для микроорганизмов — пробиотиков, — наиболее изученный штамм пробиотических организмов с доказанными полезными эффектами на здоровье человека [10].
Большинство детских гастроэнтерологов для сочетанной коррекции панкреатической недостаточности в комплексе с патогенетической терапией ферментными препаратами рекомендуют использование определенных штаммов лактобактерий, в частности LGG, которые способствуют расщеплению углеводов с образованием молочной кислоты. А созданная ими кислая среда, в свою очередь, положительно влияет на развитие бифидобактерий, которые составляют от 85 до 95 % микрофлоры кишечника здорового ребенка.
Целью нашего исследования являлось усовершенствование терапевтических подходов к коррекции сочетанной функциональной патологии поджелудочной железы у детей (ДСО по панкреатическому типу), страдающих пищевой аллергией, с использованием в основных схемах лечения LGG.
Настоящее исследование проводилось в гастроэнтерологическом отделении Харьковской городской детской клинической больницы № 19 (главный врач Ковалевская С.А.), которое является базой кафедры педиатрической гастроэнтерологии и нутрициологии (зав. кафедрой д.м.н., проф. Белоусова О.Ю.) Харьковской медицинской академии последипломного образования.
В соответствии с избранной целью и поставленными задачами нами было обследовано 54 ребенка. Основным критерием включения детей в группу являлось наличие клинически и лабораторно подтвержденной IgE-опосредованной пищевой аллергии у детей младшего возраста (от 1 года до 5 лет), имеющих клинические признаки поражения поджелудочной железы, характерные для вторичной панкреатической недостаточности.
Согласие родителей на участие в исследовании было получено во всех случаях.
Пациенты были распределены на две группы: первую (основную) составили 30 детей, которые наряду с традиционными схемами лечения получали в качестве сопутствующей терапии LGG, во вторую (сравнения) вошли 24 ребенка, которые получали традиционную терапию.
Все больные были тщательно обследованы по единой схеме, которая включала проведение как рутинных общеклинических исследований (клинический анализ крови, клинический анализ мочи, расширенное копрологическое исследование, анализы кала на яйца гельминтов, соскоб на энтеробиоз, биохимическое исследование крови и т.д.), так и других лабораторных и инструментальных исследований (определение в сыворотке крови общего IgE, проведение ультразвукового исследования с определением постпрандиальной гиперемии, панкреатоспецифических ферментов крови (α-амилаза, трипсин, липаза)), обеспечивающих решение поставленной цели и задач настоящей работы.
У всех обследованных детей были проанализированы анамнестические данные, жалобы и результаты физикального исследования с акцентом на симптомы, характерные для пищевой аллергии.
Верификация диагноза «пищевая аллергия» проводилась путем определения общего IgE в сыворотке крови (метод иммуноферментного анализа); функциональное состояние поджелудочной железы оценивалось по уровню панкреатоспецифических ферментов крови (α-амилаза, трипсин, липаза), расширенной копроцитограмме, а также путем определения постпрандиальной гиперемии поджелудочной железы по методу С.И. Поляковой с модификацией пищевой нагрузки при ультразвуковом исследовании (УЗИ) [2]. Изучение структуры поджелудочной железы проводилось по данным УЗИ органов брюшной полости [1].
Всего было обследовано 23 (42 ± 7 %) ребенка 1–3 лет и 31 (61 ± 7 %) ребенок 3–5 лет. В целом среди обследованных детей отмечалось незначительное преобладание мальчиков над девочками, несколько более выраженное в группе детей 3–5 лет. Статистически значимых различий полового состава в различных возрастных группах не выявлено (р > 0,05 в соответствии с критерием Фишера).
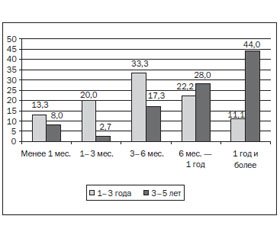
В более старшей возрастной группе отмечалось увеличение удельного веса больных детей с длительностью заболевания свыше одного года, что связано с хронизацией патологического процесса, развившегося в более раннем возрасте (данные представлены на рис. 1).
При анализе сопутствующей патологии получены данные, отражающие преобладание сопутствующей патологии у детей в возрасте 3–5 лет, причем в основной группе (табл. 1).
Данные табл. 2 отражают индикацию выявляемых этиологических факторов риска при развитии у детей относительной панкреатической недостаточности и пищевой аллергии.
Наиболее распространенные жалобы у детей при поступлении в стационар отражены в табл. 3.
При объективном обследовании в основной группе у 16 (53 ± 9 %) детей пальпаторно отмечалась болезненность в точках проекции поджелудочной железы (при пальпации по Гроту в 3-й позиции на правом боку, в т. Кача), в группе сравнения — у 10 (42 ± 10 %) детей выявлялась болезненность.
При лабораторном обследовании у 54 (100 %) больных был повышен уровень общего IgE. Уровень амилазы мочи оставался в пределах допустимых значений, что объясняется отсутствием синдрома «уклонения» ферментов и свидетельствует о функциональных изменениях в поджелудочной железе обследованных детей. Однако у 7 (24 ± 8 %) детей в основной группе при поступлении отмечалась индикация повышенных цифровых значений амилазы крови на несколько единиц, а в группе сравнения — у 3 (12 ± 6 %) детей.
При копрологическом исследовании в основной группе стеаторея 1-го типа (наличие в кале нейтрального жира) была выявлена у 13 (44 ± 9 %) детей, креаторея — у 5 (17 ± 7 %), непереваренная клетчатка — у 2 (7 ± 5 %), амилорея — у 16 (53 ± 9 %). В группе сравнения стеаторея 1-го типа была выявлена у 9 (38 ± 10 %) детей, креаторея — у 3 (12 ± 6 %), непереваренная клетчатка — у 2 (8 ± 6 %), амилорея — у 10 (42 ± 10 %).
При проведении УЗИ-исследования поджелудочной железы в основной группе у 17 (56 ± 9 %) обследуемых детей отмечалась повышенная (с тенденцией) эхогенность поджелудочной железы, преимущественно в области «хвоста»; у 6 (20 ± 7 %) детей эхогенность поджелудочной железы сохранена в переделах физиологической нормы, у 7 (24 ± 8 %) — была зафиксирована тенденция к снижению эхогенности поджелудочной железы, в то время как в группе сравнения эти показатели составили соответственно 11 (47 ± 10 %), 8 (33 ± 10 %), 5 (21 ± 9 %) детей. После физиологического (пробного) завтрака проведена оценка размера поджелудочной железы в первой группе детей: у 1 ребенка (3 ± 3 %) ее размеры увеличились на 8 %, что характерно для реактивного панкреатита, у 29 (97 ± 3 %) обследуемых детей искомые ее размеры увеличились более чем на 16 %, что соответствует физиологической норме и подтверждает отсутствие структурной патологии поджелудочной железы.
В группе сравнения у всех 24 детей искомые размеры увеличились более чем на 16 %.
При назначении схем комплексного лечения руководствовались существующими на сегодняшний день рекомендациями и нормативными документами [5].
На фоне элиминационного диетического питания проводилось комплексное лечение (ферментные препараты (действующее вещество — панкреатин); сорбенты: энтеросорбенты 4-го поколения, сорбенты с дискоидно-кристаллической структурой, сорбенты, содержащие биополимерные вещества в активированном состоянии; антигистаминные препараты: селективный блокатор периферических Н1-гистаминовых рецепторов (действующее вещество — дезлоратадин, цетиризина дигидрохлорид, диметинден); препараты группы пеногасителей; при необходимости — местная терапия в виде мазей, эмульсий (действующее вещество — мометазона фуроат) на основе овса, на основе мочевины и глицерина).
Обязательной являлась санация очагов хронической инфекции. При наличии эмоциональной напряженности, выраженной вегетативной дисфункции назначались седативные препараты в течение двух недель.
С первого дня проводимой терапии, согласно плану лечения, в схему терапии 1-й группы детей был добавлен препарат, содержащий LGG, по 10 кап., содержащих 1 млрд жизнеспособных бактерий, 1 раз в сутки, независимо от приема пищи, с предварительным растворением в теплой питьевой воде, в течение 1 мес.
Для изучения клинической эффективности проводимой терапии оценивались сроки изменения следующих показателей: боль в области живота, тошнота, метеоризм, флатуленция, нормализация аппетита; изменений со стороны кожного покрова: интенсивность кожного зуда, исчезновение эритемы, отсутствие появления свежих элементов; нормализации показателей уровня общего IgE.
На фоне проведения элиминационной диеты, медикаментозной терапии, дополненной LGG начиная с 3-го дня, у обследованных детей отмечалась положительная динамика: постепенное уменьшение гиперемии и сухости кожного покрова, снижение частоты диспептических симптомов в случае их наличия на момент начала лечения, нормализация основных показателей копрограммы.
Анализируя полученные результаты, выявили, что интенсивность проявления болевого синдрома у обследуемых детей в 1-й группе уменьшилась в три раза уже через 7 дней после начала терапии, а после 14 дней беспокоила только 1 ребенка (р < 0,01), в то время как во 2-й группе положительная динамика клинического течения имеет тенденцию к более длительному появлению (на 11-е сутки).
Положительная динамика отмечалась и в уменьшении диспептических проявлений: метеоризм и флатуленция уже через неделю после начала лечения достоверно снижались (р < 0,05) и к концу лечения исчезли у всех детей (р < 0,01).
Выраженная яркая эритема в основной группе детей исчезала на 7–9-е сутки (7,3 ± 1,8 дня). Сухость кожи, сохраняющаяся почти на всем протяжении патологического процесса, значительно уменьшалась к 13–15-му дню. В группе сравнения отмечалось нивелирование аналогичной симптоматики значительно позже (на 13-й и 19-й день соответственно).
Полное разрешение клинических признаков кожных проявлений пищевой аллергии у пациентов, получавших в составе комплексной терапии LGG, происходило к 15–22-му дню, а во 2-й группе — к 27-му дню.
Исследование на наличие специфических IgE-AT проводилось у всех обследуемых при поступлении в отделение (показатели превышали в той или иной степени нормативные пределы) в обеих группах. Через 1 мес. у всех детей было проведено повторное исследование данного показателя. В основной (1-й) группе у 5 (17 ± 7 %) из 30 обследуемых этот показатель не достиг нормативных границ: у ребенка 2 лет уровень IgE-AT при поступлении составил 105 МЕ/мл (до 45 МЕ/мл), после проведенных комплексных терапевтических мероприятий — 50 МЕ/мл (до 45 МЕ/мл); 4,5 года — 220 (до 70) и 80 МЕ/мл (до 70) соответственно; 4,9 года — 150,7 (до 70) и 74 МЕ/мл (до 70) соответственно; 4 лет — 1009,1 (до 70) и 457 МЕ/мл (до 70) соответственно; у ребенка 6 лет — 320,2 (до 70) и 125 МЕ/мл (до 70) соответственно. В группе сравнения у 8 (33 ± 10 %) детей из 24 обследуемых этот показатель не достиг нормативных границ.
Отдаленные результаты лечения были изучены у 11 пациентов из 1-й группы. Сроки наблюдения составляли от 3 до 6 мес. Длительность периодов ремиссии после сочетанной терапии увеличилась на 2,9 ± 1,4 месяца. При этом частота обострений в течение 6 месяцев не превышала 2,1 ± 0,8.
При применении LGG не было зарегистрировано ни одного случая проявления побочных эффектов и развития нежелательных явлений. Больные хорошо переносили назначенную терапию, побочных эффектов в виде появления или усиления диспептических проявлений, усиления эритемы, появления патологических изменений со стороны основных показателей копрограмм зафиксировано не было. Необходимости в отмене терапии, приостановке лечения, усилении патогенетической терапии или назначении наружных гормоносодержащих препаратов не возникало.
У детей, страдающих пищевой аллергией и имеющих изменения структуры поджелудочной железы, обусловленные влиянием общеаллергического процесса, включение в терапию LGG приводило к достаточно выраженному клиническому эффекту.
Полученные в ходе исследования данные служат доказательством благоприятного влияния пробиотика LGG при включении его в схему коррекции сочетанной функциональной патологии поджелудочной железы (ДСО по панкреатическому типу), имеющей признаки относительной панкреатической недостаточности, у детей, страдающих пищевой аллергией, что позволяет улучшить клиническую симптоматику и увеличить длительность периодов ремиссии пищевой аллергии. Это прогностически весьма важно для сокращения частоты рецидивов основного заболевания и является обоснованием для применения данного препарата в педиатрической практике в комплексных коррекционных схемах терапии.
Список литературы
1. Белоусов Ю.В. Панкреатит и панкреатопатия: классификационные характеристики, принципы диагностики и лечения у детей / Ю.В. Белоусов // Здоровье ребенка. — 2012. — № 8(43). — С. 25-27.
2. Белоусова О.Ю., Карпушенко Ю.В. Алгоритм діагностики захворювань підшлункової залози в дітей із харчовою сенсибілізацією // Перинатологія і педіатрія. — 2013. — № 4(56). — С. 47-50.
3. Бєлоусова О.Ю. Роль харчової сенсибілізації у розвитку патології підшлункової залози в дітей / О.Ю. Бєлоусова, Ю.В. Карпушенко // Клінічна імунологія. Алергологія. Інфектологія. Спецвипуск № 2. — 2013. — С. 81-86.
4. Казначеева Л.Ф. Гастроинтестинальная форма пищевой аллергии у детей / Л.Ф. Казначеева, Н.С. Ишкова, К.С. Казначеев // Практическая медицина. — 2010. — № 6(10). — С. 34-37.
5. Клиническая аллергология и иммунология: Руководство для практикующих врачей / Под ред. Л.А. Горячкиной и К.П. Кашкина. — М.: Практика, 2009. — 432 с.
6. Приказ МЗ Украины № 59 от 29.01.2013 г. «Про затвердження уніфікованих клінічних протоколів медичної допомоги дітям із захворюваннями органів травлення». — Киев, 2013. — 300 с.
7. Согласительный документ Ассоциации детских аллергологов и иммунологов России. Первичная профилактика аллергии у детей. — Москва, 2010. — 72 с.
8. Boyle R.J., Robins-Browne R.M., Tang M.L. Probiotic use in clinical practice: what are the risks? // Am. J. Clin. Nutr. — 2006. — 83. — 1256-1264.
9. Penders J., Stobberingh Е.Е., van den Brandt Р.А., Thijs С. The role of the intestinal microbiota in the development of atopic disorders. — Article first published online: 17 AUG 2007. — DOI: 10.1111/j.1398-9995.2007.01462.x.
10. Salminen S., Benno Y., de Vos W. Intestinal colonisation, microbiota and future probiotics? // Asia Pac. J. Clin. Nutr. — 2006. — 15(4). — 558-62.
11. Singh V., Singh K., Amdekar S. et al. Innate and specific gut-associated immunity and microbial interference // FEMS Immunol. Med. Microbiol. — 2009. — 55(1). — 6-12.
12. Smehilová M., Vlková E., Nevoral J., Flajsmanová K., Killer J., Rada V. Comparison of intestinal microfora in healthy infants and infants with allergic colitis // Folia Microbiol. (Praha). — 2008. — 53(3). — 255-8.
13. Van der Aa L.B., Heymans H.S., van Aalderen W.M., Sprikkelman A.B. Probiotics and prebiotics in atopic dermatitis: review of the theoretical background and clinical evidence // Pediatr. Allergy Immunol. — 2010 Mar. — 21(Pt. 2). — e355-67. — doi: 10.1111/j.1399-3038.2009.00915.x. [Epub. 2009 Jul 2]
14. Verhulst S.L. et al. A longitudinal analysis on the association between antibiotic use, intestinal microflora, and wheezing during the first year of life // J. Asthma. — 2008 Nov. — 45(9). — 828-32.
/97.jpg)

/97_2.jpg)
/98.jpg)