Журнал «Здоровье ребенка» 5 (73) 2016
Вернуться к номеру
Коррекция нарушений кишечного микробиоценоза у детей с синдромом раздраженного кишечника
Авторы: Ярошевская Т.В., Ильченко С.И. - ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина; Сапа Н.Б., Крамаренко Л.Н. - КУ «Днепропетровская детская городская клиническая больница № 2 ДОС», г. Днепр, Украина
Рубрики: Гастроэнтерология, Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Стаття присвячена актуальній проблемі лікування дітей з функціональними захворюваннями кишечника з клінічними ознаками дисбактеріозу. Мета дослідження: вивчення ефективності при синдромі подразненого кишечника у дітей сучасного симбіотика, що містить штами Lactobacollus rhamnosus GG і фруктоолігосахариди, у складі комплексної терапії. Матеріали і методи. У дослідженні брали участь 35 дітей з синдромом подразненого кишечника і клінічними проявами кишкового дисбіозу на підставі суб’єктивних і об’єктивних симптомів, характеру випорожнення, даних копрограми і мікробіологічного дослідження калу. Ефективність лікування оцінювалася з урахуванням динаміки основних симптомів захворювання (порушення випорожнення, метеоризм, зниження апетиту, абдомінальний біль), нормалізації показників копрограми, результатів контрольного мікробіологічного дослідження калу. Об’єктивізація клінічних проявів захворювання проводилася на початку лікування і перед випискою дитини. Результати. В результаті застосування розроблених схем лікування больовий абдомінальний синдром і симптоми кишкової диспепсії швидко купірувалися. У дітей зі шкірними проявами алергії зменшилася їх вираженість. Клінічні прояви синдрому порушення травлення зменшилися, покращилися показники копрограми. Відмічена виражена позитивна динаміка мікробіологічного складу калу. Більш ніж у половини хворих вдалося досягти нормалізації кількісного складу біфідо- і лактобактерій, різко зменшилася кількість кишкової палички з порушеними ферментативними властивостями, умовно-патогенна і грибкова флора була елімінована. Переносимість призначених комплексів терапії у всіх пацієнтів була доброю. Висновки. В терапії синдрому подразненого кишечника у дітей важливе місце займає корекція кишкового біоценозу. Це дослідження свідчить про високу ефективність і безпеку поєднання Lactobacollus rhamnosus GG і фруктоолігосахаридів у комплексній терапії захворювання, що дозволяє рекомендувати його практичне застосування.
Статья посвящена актуальной проблеме лечения детей с функциональными заболеваниями кишечника с клиническими признаками дисбактериоза. Цель исследования: изучение эффективности при синдроме раздраженного кишечника у детей современного симбиотика, содержащего штаммы Lactobacollus rhamnosus GG и фруктоолигосахариды, в составе комплексной терапии. Материалы и методы. В исследовании приняли участие 35 детей с синдромом раздраженного кишечника и клиническими проявлениями кишечного дисбиоза на основании субъективных и объективных симптомов, характера стула, данных копрограммы и микробиологического исследования кала. Эффективность лечения оценивалась с учетом динамики основных симптомов заболевания (нарушение стула, метеоризм, снижение аппетита, абдоминальная боль), нормализации показателей копрограммы, результатов контрольного микробиологического исследования кала. Объективизация клинических проявлений заболевания проводилась в начале лечения и перед выпиской ребенка. Результаты. В результате применения разработанных схем лечения болевой абдоминальный синдром и симптомы кишечной диспепсии быстро купировались. У детей с кожными проявлениями аллергии уменьшилась их выраженность. Клинические проявления синдрома нарушения пищеварения уменьшились, улучшились показатели копрограммы. Отмечена выраженная позитивная динамика микробиологического состава кала. Более чем у половины больных удалось достигнуть нормализации количественного состава бифидо- и лактобактерий, резко уменьшилось количество кишечной палочки с нарушенными ферментативными свойствами, условно-патогенная и грибковая флора была элиминирована. Переносимость назначенных комплексов терапии у всех пациентов была хорошей. Выводы. В терапии синдрома раздраженного кишечника у детей важное место занимает коррекция кишечного биоценоза. Данные исследования свидетельствуют о высокой эффективности и безопасности сочетания Lactobacollus rhamnosus GG и фруктоолигосахаридов в комплексной терапии заболевания, что позволяет рекомендовать его практическое применение.
The article focuses on an actual problem of treating functional bowel diseases with clinical signs of dysbiosis in children. Objective of the study is assessment of effectiveness of comprehensive therapy with modern symbiotic containing strains Lactobacollus rhamnosus GG and fructooligosaccharides in irritable bowel syndrome children. Materials and methods. The study involves 35 children with irritable bowel syndrome and clinical manifestations of intestinal dysbiosis on the basis of subjective and objective symptoms, character of stool, coprogram and microbiological analysis of feces. Treatment efficacy is assessed taking into account the dynamics of the main symptoms of the disease (impaired stool, flatulence, loss of appetite, abdominal pain), normalization of coprogram indicators, results of the control microbiological analysis of feces. Objectification of the clinical manifestations of the disease is performed at baseline and before discharge of the child from hospital. Results. As a result of the developed schemes of treatment, the abdominal pain syndrome and symptoms of intestinal dyspepsia were quickly stopped. In children with skin manifestation of allergy, their severity has decreased. The clinical manifestations of the digestive disorders syndrome decreased, indicators of coprogram improved. A significant positive dynamics of fecal microbial composition is marked. More than a half of the patients achieve normalization of the quantitative composition of bifid bacteria and lactobacilli; the number of E.coli with altered enzymatic properties reduced, opportunistic and fungal flora was eliminated. The tolerability of prescribed treatment in all patients is good. Conclusions. Correction of intestinal biocenosis occupies an important place in the treatment of irritable bowel syndrome children. The study shows a high efficacy and safety of the combination of Lactobacollus rhamnosus GG and fructooligosaccharides in the comprehensive treatment of the disease that allows to recommend its practical application.
синдром подразненого кишечника, дисбактеріоз, діти, лікування, Lactobacillus rhamnosus GG, фруктоолігосахариди.
синдром раздраженного кишечника, дисбактериоз, дети, лечение, Lactobacillus rhamnosus GG, фруктоолигосахариды.
irritable bowel syndrome, dysbacteriosis, children, treatment, Lactobacillus rhamnosus GG, fructooligosaccharides.
Статья опубликована на с. 69-73
Распространенность синдрома раздраженного кишечника (СРК) у детей высокая и составляет 19,4–21,2 % [1]. В последние годы достигнуты значительные успехи в раскрытии патогенетических механизмов данного заболевания, его диагностике и терапии. Вместе с тем существует целый ряд нерешенных вопросов, и усовершенствование существующих дифференцированных схем лечения остается актуальным. В основе патогенеза этого функционального заболевания наряду с нарушениями моторики, висцеральной чувствительности кишечника, иммунного ответа макроорганизма лежат изменения состава микрофлоры, которые требуют коррекции [1–4]. Дисбиоз кишечника сопровождается развитием симптомов кишечной диспепсии (запоры, поносы, метеоризм, боль, дискомфорт, ощущение переполнения или тяжести в животе), которые присутствуют при СРК. Закономерными являются проявления синдрома нарушения пищеварения (стеаторея, амилорея, креаторея), возможно формирование астеновегетативного синдрома [2, 4].
Материал и методы исследования
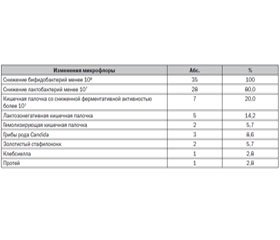
Результаты исследования
Обсуждение
Выводы
1. Белоусова О.Ю. Дисбактериоз кишечника как фактор риска развития хронических заболеваний кишечника у детей / О.Ю. Белоусова // Здоровье ребенка. — 2011. — № 1(28). — С. 73-75.
2. Копанев Ю.А. Дисбактериоз кишечника: микробиологические, иммунологические аспекты микробиологических нарушений у детей / Ю.А. Копанев, А.Л. Соколов. — М., 2002. — 147 с.
3. Диагностика и тактика ведения детей с функциональными запорами / А.И. Хавкин, Р.А. Файзуллина, С.В. Бельмер [и др.] // Вопросы практической педиатрии. — 2014. — Т. 9, № 5. — С. 62-76.
4. Белоусова О.Ю. Алгоритм назначения пробиотиков у детей / О.Ю. Белоусова // Здоровье Украины. — 2015. — № 3(34). — С. 10-11.
5. Майданник В.Г. Антибиотико-ассоциированная диарея у детей / В.Г. Майданник. — К., 2013. — 38 с.
6. Recommendations for probiotic use — 2011 update / M.H. Floch, W.A. Walker, K. Madsen [et al.] // J. Clin. Gastroenterol. — 2011. — № 45. — Р. 168-171.
7. Ringel Y., Quigley E.M.M., Lin H.C. Using probiotics in gastrointestinal disorders / Y. Ringel, E.M.M. Quigley, H.C. Lin // Am. J. Gastroenterol. Suppl. — 2012. — № 1(1). — Р. 34-40.
8. Guide to designing, conducting, publishing and communicating results of clinical studies involving probiotic applications in human participants // A.L. Shane, M.D. Cabana, S. Vidry [et al.] // Gut Microbes. — 2010. — № 1(4). — Р. 243-253.
9. Whelan K., Myers C.E. Safety of probiotics in patients receiving nutritional support: a systematic review of case reports, randomized controlled trials, and nonrandomized trials / K. Whelan, C.E. Myers // Am. J. Clinc. Nutr. — 2010. — № 91(3). — Р. 687-703.
10. Horvath A., Dziechciarz P., Szajewska H. Meta-analysis: Lactobacillus rhamnosus GG for abdominal pain-related functional gastrointestinal disorders in childhood / A. Horvath, P. Dziechciarz, H. Szajewska // Aliment. Pharmacol. Ther. — 2011. — № 33(12). — Р. 1302-1310.

/71.jpg)
/72.jpg)