Журнал «Здоровье ребенка» 5 (73) 2016
Вернуться к номеру
Влияние экзогенных факторов на геномный импринтинг 1. Влияние диеты и обеспеченности микронутриентами матери на геномный импринтинг потомков
Авторы: Абатуров А.Е., Мороз М.С. - ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У статті проведено аналіз впливу раціону матері під час вагітності на становлення геномного імпринтингу плода. Показано, що зміни метилювання ДНК імпринтованих генів, індуковані порушенням забезпечення протеїнами і мікронутрієнтами, супроводжуються відхиленнями фізичного розвитку і підвищеним ризиком розвитку хронічних запальних захворювань, хвороб серцево-судинної системи, метаболічного синдрому в дитини в постнатальному періоді життя. Підкреслюється, що для запобігання розвитку імпринтинг-асоційованої патології у дитини при формуванні раціону вагітних жінок особлива увага повинна бути приділена достатності вмісту в їх дієті протеїнів, фолієвої кислоти, метіоніну й вітамінів групи B.
В статье проведен анализ влияния рациона матери во время беременности на становление геномного импринтинга у плода. Показано, что изменения метилирования ДНК импринтированных генов, индуцированные нарушением обеспечения протеинами и микронутриентами, сопровождаются отклонениями физического развития и повышенным риском возникновения хронических воспалительных заболеваний, болезней сердечно-сосудистой системы, метаболического синдрома у ребенка в постнатальном периоде. Подчеркивается, что для предотвращения развития импринтинг-ассоциированной патологии у ребенка при формировании рациона беременных женщин особое внимание должно быть уделено достаточности содержания в их диете протеинов, фолиевой кислоты, метионина и витаминов группы B.
The article analyzes the impact of maternal nutrition during pregnancy on the forming of genomic imprinting in the fetus. It was shown that changes in DNA methylation of imprinted genes, induced by infringement of providing protein and micronutrients, are accompanied by abnormalities of physical development and increased risk of chronic inflammatory diseases, diseases of the cardiovascular system, the metabolic syndrome in the child’s postnatal life. It is emphasized that in order to prevent the development of imprinting-associated disease in a child special attention should be paid to the adequate content of protein, folic acid, methionine and group B vitamins in diet of pregnant women while forming their diet.
раціон матері, геномний імпринтинг, діти.
рацион матери, геномный импринтинг, дети.
maternal nutrition, genomic imprinting, children.
Статья опубликована на с. 170-176
Введение
Голод и низкокалорийная диета
Белковый дефицит
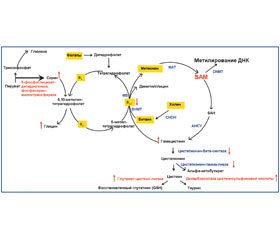
Микронутриенты
Фолаты
Заключение
1. Anderson O.S., Sant K.E., Dolinoy D.C. Nutrition and epigenetics: an interplay of dietary methyl donors, one-carbon metabolism and DNA methylation // J. Nutr. Biochem. — 2012 Aug. — 23(8). — 853-9. doi: 10.1016/j.jnutbio.2012.03.003.
2. Azzi S. Degree of methylation of ZAC1 (PLAGL1) is associated with prenatal and post-natal growth in healthy infants of the EDEN mother child cohort / S. Azzi, T.C. Sas, Y. Koudou et al. // Epigenetics. — 2014. — 9(3). — 338-45. doi: 10.4161/epi.27387.
3. Ba Y. Relationship of folate, vitamin B12 and methylation of insulin-like growth factor-II in maternal and cord blood / Y. Ba, H. Yu, F. Liu et al. // Eur. J. Clin. Nutr. — 2011 Apr. — 65(4). — 480-5. doi: 10.1038/ejcn.2010.294.
4. Bailey L.B. Biomarkers of Nutrition for Development-Folate Review / Bailey L.B., Stover P.J., McNulty H. et al. // J. Nutr. — 2015 Jul. — 145(7). — 1636S‑1680S. doi: 10.3945/jn.114.206599.
5. Barker D.J. Growth and living conditions in childhood and hypertension in adult life: A longitudinal study / D.J. Barker, T. Forsen, J.G. Eriksson, C. Osmond // J. Hypertens. — 2002 Oct. — 20(10). — 1951-6. doi: 10.1097/00004872-200210000-00013.
6. Chango A., Pogribny I.P. Considering maternal dietary modulators for epigenetic regulation and programming of the fetal epigenome // Nutrients. — 2015 Apr 14. — 7(4). — 2748-70. doi: 10.3390/nu7042748.
7. Choi S.H. Poor nutrition and alcohol consumption are related to high serum homocysteine level at post-stroke / S.H. Choi, S. Choi-Kwon, M.S. Kim, J.S. Kim // Nutr. Res. Pract. — 2015 Oct. — 9(5). — 503-10. doi: 10.4162/nrp.2015.9.5.503.
8. Dai Z., Koh W.P. B-vitamins and bone health a review of the current evidence // Nutrients. — 2015 May 7. — 7(5). — 3322-46. doi: 10.3390/nu7053322.
9. Fall C.H. Fetal programming and the risk of noncommunicable disease // Indian J. Pediatr. — 2013 Mar. — 80 Suppl 1. — S13-20. doi: 10.1007/s12098-012-0834-5.
10. Finkelstein J.L., Layden A.J., Stover P.J. Vitamin B12 and Perinatal Health // Adv Nutr. — 2015 Sep 15. — 6(5). — 552-63. doi: 10.3945/an.115.008201.
11. Fratoni V., Brandi M.L. B vitamins, homocysteine and bone health // Nutrients. — 2015 Mar 30. — 7(4). — 2176-92. doi: 10.3390/nu7042176.
12. Gat-Yablonski G., Phillip M. Nutritionally-induced catch-up growth // Nutrients. — 2015 Jan 14. — 7(1). — 517-51. doi: 10.3390/nu7010517.
13. Glier M.B., Green T.J., Devlin A.M. Methyl nutrients, DNA methylation, and cardiovascular disease // Mol. Nutr. Food Res. — 2014 Jan. — 58(1). — 172-82. doi: 10.1002/mnfr.201200636.
14. Gluckman P.D. Effect of in utero and early-life conditions on adult health and disease / P.D. Gluckman, M.A. Hanson, C. Cooper, K.L. Thornburg // N. Engl. J. Med. — 2008 Jul 3. — 359(1). — 61-73. doi: 10.1056/NEJMra0708473.
15. Gong L., Pan Y.X., Chen H. Gestational low protein diet in the rat mediates IGF2 gene expression in male offspring via altered hepatic DNA methylation // Epigenetics. — 2010 Oct 1. — 5(7). — 619-26. doi: 10.4161/epi.5.7.12882.
16. Guéant J.L. Folate and fetal programming: a play in epigenomics? / J.L. Guéant, F. Namour, R.M. Guéant-Rodriguez, J.L. Daval // Trends Endocrinol Metab. — 2013 Jun. — 24(6). — 279-89. doi: 10.1016/j.tem.2013.01.010.
17. Haggarty P. Folate in pregnancy and imprinted gene and repeat element methylation in the offspring / P. Haggarty, G. Hoad, D.M. Campbell et al. // Am. J. Clin. Nutr. — 2013 Jan. — 97(1). — 94-9. doi: 10.3945/ajcn.112.042572.
18. Heijmans B.T. Persistent epigenetic differences associated with prenatal exposure to famine in humans / B.T. Heijmans, E.W. Tobi, A.D. Stein et al. // Proc. Natl. Acad. Sci USA. — 2008 Nov 4. — 105(44). — 17046-9. doi: 10.1073/pnas.0806560105.
19. Hernandez-Valero M.A. Interplay between polymorphisms and methylation in the H19/IGF2 gene region may contribute to obesity in mexican-american children M.A. Hernandez-Valero, J. Rother, I. Gorlov, M. Frazier, O. Gorlova // J. Dev. Orig. Health Dis. — 2013 Dec. — 4(6). — 499-506. doi: 10.1017/S204017441300041X.
20. Hoyo C. Erythrocyte folate concentrations, CpG methylation at genomically imprinted domains, and birth weight in a multiethnic newborn cohort / C. Hoyo, A.K. Daltveit, E. Iversen et al. // Epigenetics. — 2014 Aug. — 9(8). — 1120-30. doi: 10.4161/epi.29332.
21. Ingenbleek Y., Hardillier E., Jung L. Subclinical protein malnutrition is a determinant of hyperhomocysteinemia // Nutrition. — 2002 Jan. — 18(1). — 40-6. doi: 10.1016/S0899-9007(01)00783-3.
22. Ingenbleek Y., McCully K.S. Vegetarianism produces subclinical malnutrition, hyperhomocysteinemia and atherogenesis // Nutrition. — 2012 Feb. — 28(2). — 148-53. doi: 10.1016/j.nut.2011.04.009.
23. Ji Y. Nutritional epigenetics with a focus on amino acids: implications for the development and treatment of metabolic syndrome / Y. Ji, Z. Wu, Z. Dai et al. // J. Nutr. Biochem. — 2016 Jan. — 27. — 1-8. doi: 10.1016/j.jnutbio.2015.08.003.
24. Kalhan S.C. Metabolic and genomic response to dietary isocaloric protein restriction in the rat / S.C. Kalhan, S.O. Uppal, J.L. Moorman et al. // J. Biol. Chem. — 2011 Feb 18. — 286(7). — 5266-77. doi: 10.1074/jbc.M110.185991.
25. Kalhan S.C. One-carbon metabolism, fetal growth and long-term consequences // Nestle Nutr. Inst. Workshop Ser. — 2013. — 74. — 127-38. doi: 10.1159/000348459.
26. Kalhan S.C., Marczewski S.E. Methionine, homocysteine, one carbon metabolism and fetal growth // Rev. Endocr. Metab. Disord. — 2012 Jun. — 13(2). — 109-19. doi: 10.1007/s11154-012-9215-7.
27. Kandi V., Vadakedath S. Effect of DNA Methylation in Various Diseases and the Probable Protective Role of Nutrition: A Mini-Review // Cureus. — 2015 Aug 24. — 7(8). — e309. doi: 10.7759/cureus.309.
28. Kappil M., Lambertini L., Chen J. Environmental Influences on Genomic Imprinting // Curr Environ Health Rep. — 2015 Jun. — 2(2). — 155-62. doi: 10.1007/s40572-015-0046-z.
29. Kennedy D.O. B Vitamins and the Brain: Mechanisms, Dose and Efficacy-A Review // Nutrients. — 2016 Jan 27. — 8(2). pii. — E68. doi: 10.3390/nu8020068.
30. Lecoutre S., Breton C. Maternal nutritional manipulations program adipose tissue dysfunction in offspring // Front Physiol. — 2015 May 13. — 6. — 158. doi: 10.3389/fphys.2015.00158.
31. Lee H.S. Impact of Maternal Diet on the Epigenome during In Utero Life and the Developmental Programming of Diseases in Childhood and Adulthood // Nutrients. — 2015 Nov 17. — 7(11). — 9492-507. doi: 10.3390/nu7115467.
32. Loke Y.J. Association of maternal and nutrient supply line factors with DNA methylation at the imprinted IGF2/H19 locus in multiple tissues of newborn twins / Y.J. Loke, J.C. Galati, R. Morley et al. // Epigenetics. — 2013 Oct. — 8(10). — 1069-79. doi: 10.4161/epi.25908.
33. Masuyama H., Hiramatsu Y. Effects of a high-fat diet exposure in utero on the metabolic syndrome-like phenomenon in mouse offspring through epigenetic changes in adipocytokine gene expression // Endocrinology. — 2012 Jun. — 153(6). — 2823-30. doi: 10.1210/en.2011-2161.
34. McCullough L.E. Maternal B vitamins: effects on offspring weight and DNA methylation at genomically imprinted domains / L.E. McCullough, E.E. Miller, M.A. Mendez et al. // Clin Epigenetics. — 2016 Jan 22. — 8. — 8. doi: 10.1186/s13148-016-0174-9.
35. McKay J.A. Blood as a surrogate marker for tissue-specific DNA methylation and changes due to folate depletion in post-partum female mice / J.A. McKay, L. Xie, S. Harris et al // Mol. Nutr. Food Res. — 2011 Jul. — 55(7). — 1026-35. doi: 10.1002/mnfr.201100008.
36. Morrison C.D., Laeger T. Protein-dependent regulation of feeding and metabolism // Trends Endocrinol. Metab. — 2015 May. — 26(5). — 256-62. doi: 10.1016/j.tem.2015.02.008.
37. Muthayya S. Low maternal vitamin B12 status is associated with intrauterine growth retardation in urban South Indians / S. Muthayya, A.V. Kurpad, C.P. Duggan et al. // Eur. J. Clin. Nutr. — 2006 Jun. — 60(6). — 791-801. doi: 10.1038/sj.ejcn.1602383.
38. Parimi P.S., Cripe-Mamie C., Kalhan S.C. Metabolic responses to protein restriction during pregnancy in rat and translation initiation factors in the mother and fetus // Pediatr. Res. — 2004 Sep. — 56(3). — 423-31. doi: 10.1203/01.PDR.0000136277.10365.84.
39. Salih M.A., Murshid W.R., Seidahmed M.Z. Epidemiology, prenatal management, and prevention of neural tube defects // Saudi Med. J. — 2014 Dec. — 35 Suppl. 1. — S15-28. PMID. — 25551106.
40. Slieker R.C. DNA Methylation Landscapes of Human Fetal Development / R.C. Slieker, M.S. Roost, L. van Iperen et al. // PLoS Genet. — 2015 Oct 22. — 11(10). — e1005583. doi: 10.1371/journal.pgen.1005583.
41. Solé-Navais P. Early pregnancy B vitamin status, one carbon metabolism, pregnancy outcome and child development / P. Solé-Navais, P. Cavallé-Busquets, J.D. Fernandez-Ballart, M.M. Murphy // Biochimie. — 2015 Dec 15. pii. — S0300-9084(15)00414-9. doi: 10.1016/j.biochi.2015.12.003.
42. Thornburg K.L. In utero life and epigenetic predisposition for disease / K.L. Thornburg, J. Shannon, P. Thuillier, M.S. Turker // Adv. Genet. — 2010. — 71. — 57-78. doi: 10.1016/B978-0-12-380864-6.00003-1.
43. Tobi E.W. DNA methylation differences after exposure to prenatal famine are common and timing- and sex-specific / E.W. Tobi, L.H. Lumey, R.P. Talens et al. // Hum. Mol. Genet. 2009 Nov 1. — 18(21). — 4046-53. doi: 10.1093/hmg/ddp353.
44. Tobi E.W. DNA methylation of IGF2, GNASAS, INSIGF and LEP and being born small for gestational age / E.W. Tobi, B.T. Heijmans, D. Kremer et al. // Epigenetics. — 2011 Feb. — 6(2). — 171-6. doi: 10.4161/epi.6.2.13516.
45. Tobi E.W. Prenatal famine and genetic variation are independently and additively associated with DNA methylation at regulatory loci within IGF2/H19 / E.W. Tobi, P.E. Slagboom, J. van Dongen et al. // PLoS One. — 2012. — 7(5). — e37933. doi: 10.1371/journal.pone.0037933.
46. Vucetic Z. Early life protein restriction alters dopamine circuitry / Z. Vucetic, K. Totoki, H. Schoch et al. // Neuroscience. 2010 Jun 30. — 168(2). — 359-70. doi: 10.1016/j.neuroscience. — 2010.04.010.
47. Williams-Wyss O. Embryo number and periconceptional undernutrition in the sheep have differential effects on adrenal epigenotype, growth, and development / O. Williams-Wyss, S. Zhang, S.M. MacLaughlin et al. // Am. J. Physiol. Endocrinol. Metab. — 2014 Jul 15. — 307(2). — E141-50. doi: 10.1152/ajpendo.00051.2012.
48. Wu G. Amino acids: metabolism, functions, and nutrition // Amino Acids. — 2009 May. — 37(1). — 1-17. doi: 10.1007/s00726-009-0269-0.
49. Zheng S., Rollet M., Pan Y.X. Maternal protein restriction during pregnancy induces CCAAT/enhancer-binding protein (C/EBPβ) expression through the regulation of histone modification at its promoter region in female offspring rat skeletal muscle // Epigenetics. — 2011 Feb. — 6(2). — 161-70. doi: 10.4161/epi.6.2.13472.

/171.jpg)
/172.jpg)
/173.jpg)