Резюме
Вступ. Гідронефроз у дітей — це обструкція пієлоуретрального сегмента, який, як правило, діагностується антенатально при ультразвуковому скринінгу близько в 1,5 % випадків вагітностей. Патофізіологія гідронефрозу все ще невідома. Найбільш патогенетично обґрунтованим та поширеним методом лікування вродженої обструкції пієлоуретрального сегмента (гідронефрозу) у дітей є хірургічне лікування. Як правило, використовуються відкриті методи (пластика пієлоуретрального сегмента за Хайнсом — Андерсеном та інші способи пластики). Останнім часом обговорюються ендоскопічні методи лікування. Усе частіше з’являються повідомлення про застосування роботизованого обладнання. Частота успішного застосування методики пластики пієлоуретрального сегмента за Хайнсом — Андерсеном досягає, за даними різних авторів, 95 %. Дискутабельним залишається питання дренування верхніх сечових шляхів. Вибір на користь установлення стента, як правило, залежить від хірурга, хоча аналіз літературних даних свідчить про зниження процента ускладнень після пієлопластики з використанням стентування сечоводу. Мета дослідження. Проаналізувати методи та способи відведення сечі при хірургічному лікуванні вродженого гідронефрозу в дітей. Матеріали і методи. На базі хірургічного відділення № 2 Житомирської обласної дитячої клінічної лікарні (ЖОДКЛ) за період із 2000 по 2015 р. прооперовано 108 дітей. Середній вік хворого становив 3,8 року. Хлопчиків було 38 (35,2 %), дівчаток 70 (64,8 %). У клініці за золотий стандарт прийняте виконання пластики пієлоуретрального сегмента за Хайнсом — Андерсеном. До 2006 року застосовувалось в основному зовнішнє дренування сечових шляхів при операції (переважно пієлостомія з інтубуванням сечоводу, рідше нефростомія), тоді як із 2006 року впроваджено пластику пієлоуретрального сегмента закритим способом, а із 2009 року — застосування внутрішнього стентування (JJ-стент) сечоводу. Із 2010 року впроваджено відеоасистовану пластику пієлоуретрального сегмента (лапароскопічний етап — мобілізація пієлоуретрального сегмента із подальшим накладанням анастомозу через міні-лапаротомний доступ). У 2016 р. вперше на базі ЖОДКЛ виконано лапароскопічну пластику пієлоуретрального сегмента у хлопчика 6 років. Середня тривалість операцій — 106 ± 32 хв. Висновки. Питання дренування сечовидільних шляхів після пластики пієлоуретрального сегмента в дітей з приводу вродженого гідронефрозу повинно розглядатись строго індивідуально. Дискутабельним залишається питання способу встановлення стента. При визначенні показань до хірургічного лікування вродженого гідронефрозу в дітей необхідно враховувати функцію нижніх сечових шляхів для забезпечення ефективної деривації сечі в післяопераційному періоді (наявність супутньої нервово-м’язової дисфункції сечового міхура).
Введение. Гидронефроз у детей — обструкция пиелоуретрального сегмента, который, как правило, диагностируется антенатально при ультразвуковом скрининге приблизительно в 1,5 % случаев беременности. Патофизиология гидронефроза все еще неизвестна. Наиболее патогенетически обоснованным и распространенным методом лечения врожденной обструкции пиелоуретрального сегмента (гидронефроза) у детей является хирургическое лечение. Как правило, используются открытые методы (пластика пиелоуретрального сегмента по Хайнсу — Андерсену и другие способы пластики). В последнее время обсуждаются эндоскопические методы лечения. Все чаще появляются сообщения о применении роботизированного оборудования. Частота успешного применения методики пластики пиелоуретрального сегмента по Хайнсу — Андерсену достигает, по данным разных авторов, 95 %. Дискутабельним остается вопрос дренирования верхних мочевых путей. Выбор в пользу установления стента, как правило, зависит от хирурга, хотя анализ литературных данных свидетельствует о снижении процента осложнений после пиелопластики с использованием стентирования мочеточника. Цель исследования. Проанализировать методы и способы отведения мочи при хирургическом лечении врожденного гидронефроза у детей. Материалы и методы. На базе хирургического отделения № 2 Житомирской областной детской клинической больницы (ЖОДКЛ) за период с 2000 по 2015 г. прооперировано 108 детей. Средний возраст больного составлял 3,8 года. Мальчиков было 38 (35,2 %), девочек 70 (64,8 %). В клинике в качестве золотого стандарта принято выполнение пластики пиелоуретрального сегмента по Хайнсу — Андерсену. До 2006 года применялось в основном наружное дренирование мочевых путей при операции (преимущественно пиелостомия с интубацией мочеточника, реже нефростомия); с 2006 года внедрена пластика пиелоуретрального сегмента закрытым способом, а с 2009 года — применение внутреннего стентирования (JJ-стент) мочеточника. С 2010 года внедрена видеоассистированная пластика пиелоуретрального сегмента (лапароскопический этап — мобилизация пиелоуретрального сегмента с последующим наложением анастомоза через минилапаротомный доступ). В 2016 г. впервые на базе ЖОДКЛ выполнена лапароскопическая пластика пиелоуретрального сегмента у мальчика 6 лет. Средняя продолжительность операции — 106 ± 32 мин. Выводы. Вопрос относительно дренирования мочевыводящих путей после пластики пиелоуретрального сегмента у детей по поводу врожденного гидронефроза должен рассматриваться исключительно индивидуально. Дискутабельним остается вопрос о способе установки стента. При установлении показаний к хирургическому лечению врожденного гидронефроза у детей необходимо учитывать функцию нижних мочевых путей для обеспечения эффективной деривации мочи в послеоперационном периоде (наличие сопутствующей нервно-мышечной дисфункции мочевого пузыря).
Introduction. Hydronephrosis in children is an obstruction of pyeloureteral segment, which is usually diagnosed antenatal by ultrasound screening in 1.5 % of pregnancies. Pathophysiology is still unknown. The most common pathogenetic reasonable treatment of congenital obstruction pelvicoureteral segment (hydronephrosis) in children is a surgical treatment. As a rule, open methods are applied (by Hynes-Anderson and other methods). Recently endoscopic treatment has being discussed. Increasingly there are reports of the use of robotic equipment. According to the data of different authors successful results of Hynes — Anderson techniques reach 95 %. The question on the upper urinary tract drainage is still discussed. The choice of stent placement usually depends on the surgeon, although the analysis of literature data indicates a decrease in percentage of complications after stent using. The aim of the study. To analyze the methods and ways of urinary diversion in the surgical treatment of congenital hydronephrosis in children. Materials and methods. On the basis of the surgical department № 2 Zhytomyr Regional Children’s Hospital (ZhRCH) for the period from 2000 to 2015 108 children were operated. The average age of patients was 3.8 years old. There were 38 (35.2 %) boys and 70 girls (64.8 %). The gold standard is Hynes — Anderson technique. Until 2006, external drainage of urinary tract surgery was mainly performed, while from 2006 close way was implemented, and from 2009 — the use of JJ-stent. Since 2010, videoassistant metnod was introduced (laparoscopic stage — mobilization of pelvicoureteral segment with further anastomosis through minilaparotomy access). In 2016 at the ZhRCH laparoscopic plastic was firstly performed for a boy aged 6 years old. The average duration of the intervention was 106 ± 32 min. Conclusions. The question on urinary tract drainage after pelvicoureteral segment plastic in children with congenital hydronephrosis should be considered individually only. The question on stent installation method remains unclear. After the indications for surgical treatment of congenital hydronephrosis in children are determined the function of the lower urinary tract must be considered to ensure the efficient derivation of urine in the postoperative period (the presence of concomitant neuromuscular dysfunction of the bladder).
Статтю опубліковано на с. 147-153
Вступ
Гідронефроз у дітей — це обструкція пієлоуретрального сегмента (ПУС), який, як правило, діагностується антенатально при ультразвуковому скринінгу близько в 1,5 % вагітностей. До народження майже половина випадків діагностованого гідронефрозу минають спонтанно. Серед решти новонароджених близько в 40 % розширення збиральної системи пов’язане з міхурово-сечовідним рефлюксом і в 60 % — із порушенням відтоку сечі від нирки до сечового міхура [4].
Патофізіологія гідронефрозу все ще невідома, але є мультифакторною. Імовірно, лише подальше молекулярне дослідження дасть можливість відповісти на питання про причину гідронефрозу та шляхи запобігання йому [16]. Серед причин гідронефрозу найчастішою вважається внутрішня обструкція. Близько у 18,5 % відмічається зовнішня обструкція судинами, які йдуть до нижнього полюса нирки. У 30–40 % хворих із симптомами ниркової коліки при гідронефрозі діагностується додаткова судина. Існує гіпотеза, що діагностований антенатально та прогресуючий після народження гідронефроз спричинений внутрішньою обструкцією, тоді як гідронефроз у дітей старшого віку, який супроводжується болем у попереку, блювотою чи гематурією, викликається наявністю додаткових судин [14].
Важливе значення в діагностиці гідронефрозу має ретроградна пієлограма, однак показання до неї повинні бути встановлені індивідуально [4]. Окрім того, для проведення ретроградної пієлографії необхідне високотехнологічне обладнання (наприклад, рентгенопераційний стіл з ЕОП).
Із 1955 року в урологічній практиці почали використовувати метод радіоізотопного дослідження нирок, однак із часом, при появі ультразвукової діагностики (УЗД), комп’ютерної томографії (КТ) та інших методик показання до застосування радіоізотопної реносцинтиграфії звузились переважно до встановлення показань до нефректомії [1].
Найбільш патогенетично обґрунтованим та поширеним методом лікування вродженої обструкції пієлоуретрального сегмента (гідронефрозу) у дітей є хірургічне лікування. Згідно з Протоколами з дитячої урології Європейської асоціації урологів (2009), показаннями до хірургічного лікування гідронефрозу в дітей є зниження функції нирки на 40 % (за даними радіоізотопного сканування нирок) або зниження функції на 10 % за 1 рік (за даними радіоізотопного обстеження), збільшення передньо-заднього розміру миски або ІІІ–ІV ступінь гідронефрозу (ІІ–ІІІ ступінь відповідно до Протоколів лікування дітей зі спеціальності «Дитяча урологія» МОЗ України) [2, 6]. Як правило, використовуються відкриті методи (пластика пієлоуретрального сегмента за Хайнсом — Андерсеном та інші способи пластики). Останнім часом обговорюються ендоскопічні методи лікування, такі як антеградна та ретроградна ендопієлотомія, балонна дилатація та лапароскопічні операції [2, 3]. Усе частіше з’являються повідомлення про застосування роботизованого обладнання для пієлопластики в дітей. Так, L.H. Olsen et al. (2007 р.) опублікували результати 5-річного досвіду ретроперитонеоскопічної роботизованої (система да Вінчі) пієлопластики у 67 дітей. Середня тривалість операції становила 143 хвилини, частота ускладнень сягала 17,9 %. Такі результати дали можливість авторам стверджувати, що дана методика порівнянна з трансперитонеальними роботизованими та суто лапароскопічними методиками, а також із відкритими методами [7]. Однак надзвичайно висока вартість указаного обладнання зводить до мінімуму можливість його широкого застосування [5].
Короткий досвід застосування не дає можливості оцінити віддалені результати таких методів лікування, що обмежує їх використання. Тривале спостереження за результатами хірургічного лікування гідронефрозу за методикою Хайнса — Андерсена дає можливість назвати його золотим стандартом у хірургії вродженої обструкції пієлоуретрального сегмента в дітей. Успішні результати застосування вказаної методики досягають, за даними різних авторів, 95 %. У той же час за наявності зовнішньої обструкції (додаткові судини) ендоскопічні (ендоуретральні) методики не показані взагалі, лише пластика ПУС за Хайнсом — Андерсеном (реанастомозування) спереду від судинного пучка [9, 12, 13, 16]. Ряд авторів указують на відсутність необхідності в стентуванні чи нефростомії при пієлопластиці в дітей [2]. Лише у випадку труднощів з анастомозом, при запальних змінах у ділянці анастомозу чи при операції на єдиній нирці існує необхідність у стентуванні сечоводу JJ-стентом. [8]. Інші ж автори відмічають переваги внутрішнього стентування сечоводу при пієлопластиці. Беззаперечною умовою для стентування є операція на єдиній нирці чи повторні операції [10, 11].
Вибір на користь встановлення стента, як правило, залежить від хірурга, хоча аналіз літературних даних свідчить про зниження процента ускладнень після пієлопластики з використанням стентування сечоводу [12].
Окрім того, слід мати на увазі можливі ускладнення від стентування, до яких відноситься інкрустування стента [15], міграція стента тощо.
Мета дослідження. Проаналізувати методи та способи відведення сечі при хірургічному лікуванні вродженого гідронефрозу в дітей.
Матеріали і методи
На базі хірургічного відділення № 2 Житомирської обласної дитячої клінічної лікарні (ЖОДКЛ) за період із 2000 по 2015 р. прооперовано 108 дітей (табл. 1). Середній вік хворого становив 3,8 року. Хлопчиків було 38 (35,2 %), дівчаток 70 (64,8 %). До 2006 року застосовувалось в основному зовнішнє дренування сечових шляхів при операції (переважно пієлостомія з інтубуванням сечоводу, рідше нефростомія); із 2006 року впроваджено пластику пієлоуретерального сегмента закритим способом, а з 2009 року — застосування внутрішнього стентування (JJ-стент) сечоводу. З 2010 року впроваджено відеоасистовану пластику пієлоуретрального сегмента (лапароскопічний етап — мобілізація пієлоуретерального сегмента з подальшим накладанням анастомозу через міні-лапаротомний доступ). У 2016 р. вперше на базі ЖОДКЛ виконано лапароскопічну пластику пієлоуретрального сегмента у хлопчика 6 років. Середня тривалість операції — 106 ± 32 хв.
Результати
У клініці за золотий стандарт прийняте виконання пластики пієлоуретрального сегмента за Хайнсом — Андерсеном. При відкритій операції застосовується люмботомічний доступ із застосуванням методу біозварювання живих м’яких тканин, що дало змогу звести до мінімуму травматичність (відсутність крововтрати при виконанні доступу) та час (у середньому до 5–7 хвилин) доступу до нирки.
Як видно з табл. 1, із роками відмічається деякий ріст кількості оперативних утручань на базі нашої клініки. Така ситуація, очевидно, пов’язана зі зростанням кількості вроджених вад сечовидільної системи, появою нових та вдосконаленням існуючих методів діагностики тощо.
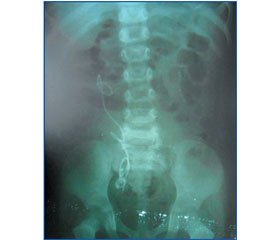
Питання внутрішнього стентування гостро виникло у зв’язку з появою такого ускладнення, як порушення прохідності пієлоуретрального сегмента в післяопераційному періоді (у 5 хворих; 4,6 %) (рис. 1). У 2 (1,9 %) випадках адекватна антибіотикотерапія дала можливість відновити прохідність, ще у 2 (1,9 %) виникла необхідність у пункції заочеревинного простору та евакуації вмісту паранефральної клітковини (усі діти дошкільного віку, застосовувалась пластика ПУС закритим способом), тоді як 1 (0,9 %) дитина потребувала ретроградного (цистоскопічного) стентування сечоводу JJ-стентом (дитина старшого шкільного віку).
Спробу стентування сечоводу JJ-стентом (рис. 2) проведено у 18 (16,7 %) хворих, із них у 15 (83,3 %) воно виконане антеградно (відкрито), тоді як у 3 (16,7 %) — ретроградно (цистоскопічно). У 2 (13,3 %) дітей антеградне стентування сечоводу було утруднене (в 1 (5,6 %) хворого замість стентування сечоводу виконане зовнішнє дренування (пієлостома + інтубація сечоводу) (рис. 3)).
Висновок про правильність положення стента можна прийняти за результатами оглядової рентгенографії органів черевної порожнини (рис. 4). В 1 (5,6 %) дитини внутрішнє антеградне стентування виявилось хибним, що проявилося через 4 тижні при спробі цистоскопічного видалення стента (при рентгенологічному обстеженні стент виявився скрученим у сечоводі, що потребувало проведення уретроскопії уретрореноскопом із подальшим бужуванням сечоводу у зв’язку із його стенозом та одночасним видаленням стента) (рис. 5).
/150_2.jpg)
Одній (0,9 %) дитині ретроградне стентування збиральної системи нирки виконано за 4 тижні до проведення оперативного втручання з метою верифікації збереження скоротливої здатності збиральної системи (дівчинка 14 років з уперше діагностованим гідронефрозом ІІІ–ІV ст.). На контрольному ультразвуковому дослідженні через 4 тижні після стентування збиральної системи нирки діагностовано регрес пієлокалікоектазії, потовщення ниркової паренхіми. У зв’язку з відносним покращанням функціональних показників прийняте рішення про виконання органозберігаючої операції — пластики пієлоуретрального сегмента за Хайнсом — Андерсеном, однак із застосуванням зовнішнього дренування у зв’язку з наявністю контактних змін слизової сечовивідних шляхів унаслідок попереднього стояння уретрального стента.
Особливої ретельності потребує проведення антеградного стентування сечоводу при лапароскопічній пієлопластиці (рис. 6).
Для видалення уретрального стента застосовується маніпуляційний цистоскоп вікового діаметра з щипцями будь-якої конфігурації для ефективного захоплення стента (рис. 7).
Вибір тривалості стояння стента повинен проводитись строго індивідуально, ураховуючи виникнення контактного запального процесу в слизовій сечових шляхів (за типом бульозного циститу) (рис. 8). У нашій клініці прийнято видалення на 4–6-му тижні після оперативного втручання (максимум 12 тижнів), однак під постійним прикриттям антибактеріальними препаратами.
У 2 ( %) хворих після зовнішнього дренування збиральної системи нирки після оперативного втручання гідронефрозу відмічалось пролонговане підтікання сечі після видалення пієлостоми. Курс антибактеріальної терапії виявився неефективним без адекватного дренування сечового міхура (в одному випадку проведення уродинамічного дослідження підтвердило наявність помірної інфравезикальної обструкції, якої вдалось позбутись шляхом розсічення мінімальних клапанів задньої уретри оптичним уретротомом у хлопчика 6 років).
Обговорення
Попри добрі результати застосування такого методу хірургічного лікування гідронефрозу, як пластика пієлоуретрального сегмента за Хайнсом — Андерсеном, останніми роками триває активний пошук оптимального методу відведення сечі, особливо з урахуванням такого показника, як якість життя. Безумовно, внутрішнє дренування значно полегшує післяопераційний догляд за хворим, мінімізує можливість передчасного самовільного видалення пієло-/нефростоми без остаточного відновлення прохідності новоутвореного пієлоуретрального сегмента, зменшує ймовірність інфікування сечових шляхів та операційної рани тощо. Тому правильне внутрішнє дренування верхніх сечових шляхів при реконструктивних оперативних утручаннях, а особливо з урахуванням накопичувально-евакуаторної функції сечового міхура, має добру перспективу для широкого застосування.
Однак слід відмітити, що для застосування внутрішнього дренування повинен бути весь арсенал ендоскопічного обладнання не лише для встановлення стента (наприклад, ретроградного) а й видалення (операційний цистоскоп та навіть уретрореноскоп у випадку міграції стента чи неправильному інтраопераційному встановленні). Також у випадку наявності ознак інфравезикальної обструкції різного ступеня бажана наявність оптичного уретротома для її ліквідації.
Крім того, кожне стентування сечоводу бажано супроводжувати інтраопераційним рентгенологічним контролем його стояння.
Висновки
Золотим стандартом хірургічного лікування гідронефрозу в дітей є пластика пієлоуретрального сегмента за Хайнсом — Андерсеном.
Питання дренування сечовидільних шляхів після пластики пієлоуретрального сегмента в дітей з приводу вродженого гідронефрозу повинно розглядатись виключно індивідуально, ґрунтуючись на таких орієнтовних тезах (за наявності навичок та відповідного матеріально-технічного забезпечення): діти раннього віку (до 2 років) — можливий закритий (бездренажний) спосіб, 2–7 років — закритий спосіб або внутрішнє стентування сечоводу (JJ-стент), діти віком понад 7 років — внутрішнє або зовнішнє дренування, але за умови відсутності супутньої патології міхурово-сечовідного сегмента чи вродженого звуження сечоводу.
Дискутабельним залишається питання щодо встановлення стента — встановлювати інтраопераційно цистоскопічно (ретроградно), чи інтраопераційно відкрито (антеградно), чи за деякий час до операції (з метою покращання функції нирки та зменшення запального процесу в нирці та принирковій клітковині). З огляду на ймовірність супутнього порушення прохідності сечоводу в його нижніх відділах рекомендується ретроградне цистоскопічне інтраопераційне встановлення стента, а за наявності діагностованого звуження сечоводу (труднощі проходження стента) — виконання супутнього бужування сечоводу під оптичним контролем по провіднику.
При встановленні показань до хірургічного лікування вродженого гідронефрозу в дітей необхідно враховувати функцію нижніх сечових шляхів для забезпечення ефективної деривації сечі в післяопераційному періоді (наявність супутньої нервово-м’язової дисфункції сечового міхура).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів.
Список литературы
1. Паникратов К.Д. Радиоизотопные методы в оценке стадии нарушения уродинамики верхних мочевых путей в детском возрасте / К.Д. Паникратов, А.И. Стрельникова, Д.Г. Почерников // Мат-лы научно-практической конференции «Детская урология и перспективы ее развития». — М., 1999. — С. 95-96.
2. Протоколи лікування дітей зі спеціальності «Дитяча урологія» (Наказ МОЗ України № 624 від 29.12.2003 р.).
3. Advanced Endourology: The Complete Clinical Guide / Ed. by Stephen Y. Nakada and Margaret S. Pearle. — 2006. — 357 р.
4. Hensle T.W. Surgery illustrated pyeloplasty (Anderson-Hynes) / T.W. Hensle, A. Shabsigh // BJU International. — 2004. — 94. — P. 1123-1134.
5. Gallo F. Ureteropelvic junction obstruction: which is the best treatment today? / F. Gallo, M. Schenone, C. Giberti // J. Laparoendosc. Adv. Surg. Tech. A. — 2009. — 19 (5). — P. 657-62.
6. Guidelines on Paediatric Urology / Ed. by S. Tekgül, H. Riedmiller, E. Gerharz, P. Hoebeke, R. Kocvara, R. Nijman, Chr. Radmayr, R. Stein, European Society for Paediatric Urology — European Association of Urology. — 2009. — 43 p.
7. Olsen L.H. Pediatric robot assisted retroperitoneoscopic pyeloplasty: a 5-year experience / L.H. Olsen, Y.F. Rawashdeh, T.M. Jorgensen // J. Urol. — 2007. — 178 (5). — P. 2137-41.
8. Operative pediatric urology/ Ed. by J. David Frank et al. — 2002. — 292 р.
9. O’Reilly P.H. The Long-Term Results of Anderson-Hynes Pyeloplasty / P.H. O’Reilly, P.J.C. Brooman, S. Mak, M. Jones, C. Pickup, C. Atkinson аnd A.J. Pollard // BJU International. — 2001. — 87. — P. 287-289.
10. Pediatric Surgery and Urology: Long-term Outcomes / Ed. by Mark Stringer, Keith Oldham, Pierre Mouriquand. — Cambridge University Press, 2006. — 1071 р.
11. Pediatric urology / Ed. by J.P. Gearhart, R.C. Rink, P.D.E. Mouriqand. — 2nd ed. — 2009. — 818 p.
12. Pediatric Urology: Surgical Complications and Management / Edited by D.T. Wilcox, P.P. Godbole and M.A. Koyle. — Blackwell Publishing Ltd, 2008. — 354 р.
13. Pediatric Urology: A General Urologist’s Guide / Ed. by J.S. Palmer. — 2011. — 392 р.
14. Rigas A. Pelvi-ureteric junction obstruction by crossing renal vessels: clinical and imaging features / A. Rigas et al. // BJU International. — 2003. — 93. — P. 101-103.
15. Vanderbrink B.A. Encrusted urinary stents: evaluation and endourologic management / B.A Vanderbrink, A.R. Rastinehad, M.C. Ost, A.D. Smith // J. Endourol. — 2008. — 22 (5). — P. 905-12.
16. Williams B. Pathophysiology and treatment of ureteropelvic junction obstruction / B. Williams, B. Tareen, M.I. Resnick // Curr. Urol. Rep. — 2007. — 8 (2). — P. 111-7.
/150.jpg)
/151_2.jpg)

/149_2.jpg)
/149_3.jpg)
/150_2.jpg)
/151.jpg)
/152.jpg)