Статья опубликована на с. 121-127
Значительная распространенность аллергических заболеваний является одной из глобальных проблем мирового здравоохранения. Согласно данным международных эпидемиологических исследований, аллергическими заболеваниями страдает до 40 % детского населения. Данные исследований среди 6–14-летних детей показали, что распространенность аллергических ринитов (АР) удвоилась за последние два десятилетия [30]. Хроническую аллергическую патологию регистрируют у 10 % детей, из них 5–10 % составляют больные бронхиальной астмой, 1–3 % — атопическим дерматитом, 20–30 % — аллергическим ринитом, 2–7 % — пищевой аллергией, 0,3–0,8 % — инсект-аллергией [21].
В реализации патогенеза аллергических заболеваний одну из основных ролей играет гистамин, который продуцируется тучными клетками и базофилами. Действие гистамина реализуется через взаимодействие с трансмембранными гистаминовыми рецепторами (HR) — HRH1, HRH2, HRH3 и HRH4. Многочисленные исследования показали, что гистамин, воздействуя на HRH1 респираторной системы, глаз и кожи, вызывает характерные симптомы аллергии, а антигистаминные препараты способны их предотвращать [1, 14].
До недавнего времени считалось, что гистамин является прямым агонистом HRH1. Однако установлено, что HRH1 существует в двух изоформах — активной и неактивной — и характеризуется агонистнезависимой трансдукцией сигнала возбуждения. Даже при отсутствии гистамина система HRH1 конститутивно возбуждена [23]. Антигистаминные лекарственные средства не конкурируют с молекулой гистамина, а стабилизируют неактивную изоформу HRH1 [32], тем самым обусловливая превалирование их представительства на мембранах эндотелиоцитов, эпителиоцитов, миоцитов гладких мышц респираторного тракта, и способствуют снижению сосудистой проницаемости, вазодилатации посткапилляров, подавлению активности секреции желез слизистой оболочки дыхательных путей, а также вызывают бронходилатацию, уменьшают раздражение слизистых носовой полости и зуд кожи [1].
Антигистаминные препараты по одной из наиболее популярных классификаций подразделяют по времени их создания на препараты первого и второго поколения. Препараты первого поколения называют также седативными (по доминирующему побочному эффекту) в отличие от неседативных препаратов второй генерации [6]. В настоящее время принято выделять и третье поколение — активные метаболиты антигистаминных препаратов второго поколения, характеризующиеся максимальной антигистаминной активностью, отсутствием седативного эффекта и кардиотоксического действия [16].
Благодаря широкому кругу антигистаминных препаратов педиатр имеет возможность выбирать лекарственное средство в зависимости от возраста пациента и конкретной клинической ситуации [4, 18]. Проведенные исследования показали несоответствие реальной клинической практики назначения антигистаминных средств существующим рекомендациям, основанным на сведениях доказательной медицины. Установлено преобладание в структуре назначений педиатра антигистаминных средств первого поколения, в частности диметиндена [5].
Требования к современным антигистаминным препаратам, которые сформулированы Европейской академией аллергологии и клинической иммунологии (EAACI/ARIA, 2006), следующие:
— способность селективно блокировать Н1-рецепторы;
— наличие противовоспалительного действия в виде стабилизации мембран тучных клеток, ингибирования высвобождения биологически активных веществ, угнетения миграции и адгезии эозинофилов;
— отсутствие взаимодействия с другими лекарственными веществами, продуктами питания, а также влияния на кишечный транспорт белков;
— высокая степень безопасности, отсутствие взаимодействия с цитохромом Р450 печени;
— отсутствие седативного эффекта и токсических реакций, возможность назначать препарат при наличии сопутствующих заболеваний;
— быстрота развития клинического эффекта и длительное действие (на протяжении 24 ч), что позволяет принимать препарат один раз в сутки;
— низкая вероятность развития тахифилаксии (привыкание к действию препарата).
Этим требованиям в полной мере отвечает препарат левоцетиризин [7].
Исходя из вышеизложенного, целесообразно провести сопоставление фармакодинамических, фармакокинетических особенностей и нежелательных реакций антигистаминных препаратов диметиндена и левоцетиризина, доказательной базы по их применению.
Диметиндена малеат (препарат фенистил) используется в клинической практике более 40 лет [8]. Он наиболее близок к антигистаминным средствам первого поколения.
Действие диметиндена развивается через 30–60 минут после приема внутрь. Биодоступность при приеме внутрь — около 70 %. Максимальная концентрация в плазме крови достигается через 2 часа. Продолжительность действия составляет 6–8 часов, что требует применения препарата 2–3 раза в сутки.
В организме диметинден метаболизируется посредством метоксилирования и гидроксилирования, что объясняет возможность его взаимодействия с лекарственными препаратами. Так, ингибиторы МАО могут вызывать усиление антихолинергического действия. При одновременном назначении диметиндена и средств, угнетающих ЦНС (транквилизаторы, снотворные, седативные средства), действие последних усиливается. При одновременном применении со средствами, оказывающими –угнетающее влияние на миокард, возможно усиление действия последних.
Диметинден и его метаболиты выводятся с желчью и мочой (5–10 % в неизмененном виде).
У диметиндена наблюдается неселективное и неполное связывание HRH1. Его молекула проникает через гематоэнцефалический барьер, связываясь с церебральными HRH1, вызывая основной побочный эффект — седативный (возможны нарушение внимания, координации, вялость). У некоторых пациентов может возникать повышение возбудимости нервной системы. Следует подчеркнуть, что в отличие от антигистаминных препаратов первого поколения диметинден обладает слабым седативным эффектом, который встречается в 7,8 % случаев. Необходимо также учитывать возможное неблагоприятное влияние антигистаминных препаратов первого поколения на когнитивную сферу, а именно: способность к восприятию информации, внимание, память, психомоторную деятельность, мелкую моторику. Любое изменение этих параметров снижает способность к обучению, проявляется социальной дезадаптацией и снижением качества жизни [11].
Диметинден обладает слабым антихолинергическим эффектом и способен вызывать такие отрицательные явления, как сухость во рту, нарушение мочеиспускания и др.
К недостаткам большинства антигистаминных препаратов первого поколения, в том числе и диметиндена, относится феномен тахифилаксии (постепенное снижение их эффективности при длительном применении), требующий смены препарата каждые 7–10 дней [2, 3].
Алкиламины, к которым по химической структуре относится диметинден, отличаются от антигистаминных препаратов первого поколения более высокой противоаллергической активностью. Эффективность лечения диметинденом 65 пациентов с разными формами кожной и респираторной аллергии составила 83 % [43].
Обзор проведенных клинических исследований применения диметиндена малеата при рецидивирующем ложном крупе, аллергическом рините, кожном зуде, ассоциированном с ветряной оспой и дерматозами различного генеза, представлен в публикации [8]. Показано, что использование диметиндена при рецидивирующем ложном крупе у детей с высоким уровнем IgE в крови привело к положительной динамике по тяжести симптомов крупа и срокам госпитализации по сравнению с плацебо. При этом не выявлено улучшения у детей с нормальным содержанием IgE в крови. Это позволило сделать вывод, что антигистаминный эффект диметиндена является основанием для его применения при лечении рецидивирующего крупа аллергической этиологии.
Диметинден обладает выраженным противозудным действием при ветряной оспе [25]. Эффективность диметиндена в лечении кожного зуда неаллергического генеза составила 87 % [20].
Таким образом, спектр действия диметиндена (антиаллергическое, противозудное) и быстрое его начало являются основанием для назначения препарата прежде всего при острых аллергических реакциях на пищевые продукты, лекарственные препараты, укусы насекомых, для купирования кожного зуда различного происхождения, при аллергических заболеваниях с длительностью симптомов не более двух недель. Диметинден является единственным антигистаминным препаратом, разрешенным к применению у детей до 6-месячного возраста, кроме детей в возрасте до 1 месяца [12]. Следует отметить, что диметинден (препарат фенистил) с осторожностью следует назначать детям в возрасте до 1 года (т.к. у них седативный эффект может сопровождаться эпизодами ночного апноэ).
Левоцетиризин — антигистаминный препарат третьего поколения, активный R-энантиомер цетиризина. Фармакодинамика и фармакокинетика левоцетиризина хорошо изучены [22]. У 50 % больных действие левоцетиризина развивается через 12 мин после приема однократной дозы, а у 95 % — через 0,5–1 час. Максимальная концентрация в плазме крови достигается через 50 мин после однократного приема внутрь терапевтической дозы и сохраняется в течение 2 дней. Более длительный период полураспада левоцетиризина обеспечивает его длительный эффект и дает основание для применения 1–2 раза в сутки [7, 10].
N. Cranswick et al. [34] впервые исследовал фармакокинетический и фармакодинамический профиль левоцетиризина у 15 детей (возраст 12–24 месяца), страдающих рецидивирующим кашлем и другими симптомами, связанными с аллергией, которые в течение 90 дней получали препарат. Показано, что левоцетиризин в дозе 0,125 мг/кг два раза в день на 3–6-й день полностью ингибирует индуцируемый гистамином волдырь и гиперемию (100% ингибирование) и > 98 % на 90-й день. Тем самым доказана высокая антигистаминная активность этого препарата. Кроме того, показано отсутствие каких-либо клинических и лабораторных побочных эффектов.
Фармакологический профиль левоцетиризина был также исследован у детей в возрасте 6–11 лет. Оценка индуцированного гистамином ответа в виде волдыря и гиперемии и последующего применения левоцетиризина показала, что 97% ингибирование волдырей происходит в течение 2–10 ч, 93% ингибирование гиперемии — через 2–24 ч после приема препарата [39].
Поскольку левоцетиризин — конечный метаболит, он не взаимодействует с печеночными изоферментами системы цитохрома P450 [7]. В связи с этим при выборе антигистаминного препарата у детей с нарушениями функции печени целесообразно его назначение.
Биодоступность препарата составляет 100 %. В связи с низким объемом распределения (0,4 л/кг) препарат обнаруживается на клеточной мембране и не проникает внутрь клетки, что определяет очень важные свойства — высокую эффективность действия и отсутствие лекарственного взаимодействия [3]. Это дает возможность сочетать его с антибиотиками, противогрибковыми и другими препаратами.
Выведение левоцетиризина и его метаболитов из организма происходит с мочой (в среднем 85,4 % принятой дозы препарата) за счет клубочковой фильтрации и активной канальцевой секреции и требует коррекции дозы при хронической почечной недостаточности.
Отличительными свойствами левоцетиризина являются его высокое сродство с HRH1, избирательность подавления их активности, занятость рецепторов. Сродство левоцетиризина с HRH1 в два раза выше, чем у цетиризина и в 600 раз выше в отношении других рецепторов. Через 4 и 24 часа после приема занятость составляет 94 и 60 %, что значительно выше, чем у других антигистаминных препаратов. Следует подчеркнуть, что эти свойства левоцетиризина обеспечивают его лучший терапевтический эффект, практическое отсутствие антихолинергического и антисеротонинового действия [37].
В другом ретроспективном исследовании фармакокинетики левоцетиризина подтверждено, что у детей в возрасте 1–4 лет (весом 8–20 кг) доза левоцетиризина 0,125 мг/кг дважды в день подобна воздействию левоцетиризина у взрослых в терапевтической дозе 5 мг один раз в день [36].
Левоцетиризин дополнительно к влиянию на HRH1 проявляет также противоаллергические и противовоспалительные свойства, что может повышать лечебные преимущества препарата. Установлено, что левоцетиризин, подавляя эффекты возбуждения HRH1, ингибирует аллергическое воспаление [24, 44]. Полагают, что противовоспалительное действие препарата реализуется за счет: 1) HRH1-независимой стабилизации мембран тучных клеток и базофилов (подавляет высвобождение гистамина тучными клетками), в основе которой лежит супрессия трансмембранного транспорта ионов Ca2+ [38]; 2) ингибирования процессов возбуждения фактора транскрипции NF-kB [32]. Снижение активности NF-kB сопровождается ингибированием продукции гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), IL-1, IL-6, IL-8, IL-10, IL-11, эотаксина, RANTES (regulated upon activation, normal T-cell expressed and secreted), TNF-α и NO эндотелиоцитами, дендритными клетками, макрофагами и мононуклеарами периферической крови [28]. Доказаны такие противовоспалительные эффекты левоцетиризина, как снижение экспрессии молекул адгезии (ICAM-1 и VCAM-1), которые являются маркерами аллергического воспаления и, в частности, способствуют миграции эозинофилов в очаг воспаления. Препарат, вызывая торможение миграции эозинофилов, нейтрофилов и базофилов в органы-мишени, уменьшает проницаемость капилляров и спазм гладкой мускулатуры, предупреждает развитие отека тканей. Левоцетиризин оказывает влияние как на Th1-, так и на Th2-зависимые процессы воспаления — он ингибирует экспрессию IFN-γ, индуцированную IL-12, а также экспрессию IL-5, индуцированную IL-4 [31].
Левоцетиризин обладает высоким профилем безопасности и комплайенса. Из-за низкой способности проникать через гематоэнцефалический барьер он лишен седативного эффекта. У препарата нет кардиотоксического действия. Оценка электрокардиограммы параметров не показала каких-либо существенных изменений длительности интервала QT [29].
Отсутствие тахифилаксии дает возможность долгосрочной терапии хронических аллергических заболеваний [13].
Таким образом, к достоинствам левоцетиризина относятся высокое сродство к HRH1, наличие дополнительных противоаллергических эффектов, отсутствие влияния на холинорецепторы и серотониновые рецепторы, быстрое наступление и большая продолжительность действия, отсутствие лекарственного взаимодействия, отсутствие тахифилаксии при длительном приеме [7, 10].
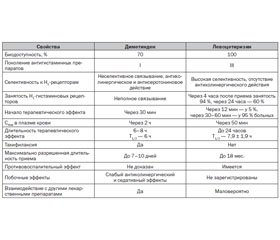
Сравнительная характеристика фармакокинетических и фармакодинамических свойств диметиндена и левоцетиризина представлена в табл. 1.
В настоящее время только три антигистаминных препарата — цетиризин, левоцетиризин и лоратадин — были исследованы на предмет долгосрочной безопасности в педиатрической популяции. Левоцетиризин имеет полный и исчерпывающий набор данных о безопасности применения в течение 18-месячного периода лечения у детей в возрасте 1–3 лет с атопией. Ни одного случая сонливости, раздражительности или тревоги не отмечено. Кроме того, нет существенных различий в группе левоцетиризина и плацебо относительно физического и психомоторного развития детей, гематологических и биохимических тестов в период 18-месячного лечения препаратом [41].
Несколько рандомизированных клинических исследований продемонстрировали эффективность левоцетиризина для лечения аллергического ринита у детей. Установлено, что пероральный прием левоцетиризина два раза в день в течение 12 недель является способом эффективного контроля симптомов круглогодичного аллергического ринита у детей в возрасте от 6 до 12 лет [42].
Безопасность и эффективность левоцетиризина 5 мг один раз в день при лечении аллергического ринита была исследована в двух рандомизированных двойных слепых плацебо-контролируемых многоцентровых исследованиях. В первом исследовании изучали эффективность левоцетиризина в течение 6 недель у 177 детей с сезонным аллергическим ринитом [33]. Исследование показало, что левоцетиризин значительно эффективнее, чем плацебо, уменьшает симптомы заболевания в течение всего периода наблюдения (р < 0,001) и почти в два раза — в течение первых 2 недель лечения. В первые 2 недели лечения 80–85 % родителей, врачей и детей были удовлетворены улучшением состояния на фоне лечения левоцетиризином по сравнению лишь с 53–61 % родителей, врачей и детей, находящихся в группе плацебо. Обе группы (левоцетиризина и плацебо) существенно не различались по частоте нежелательных явлений.
В другом исследовании у детей с круглогодичным аллергическим ринитом исследовали влияние левоцетиризина в дозе 5 мг в день в течение 4 недель у 306 детей в возрасте 6–12 лет (154 ребенка включили в группу левоцетиризина и 152 — в группу плацебо) [35]. В группе левоцетиризина через 2 и 4 недели наблюдалось значительное улучшение общей оценки симптомов в сравнении с плацебо (р = 0,001 и р = 0,008 соответственно). Частота 50% ответа в первые 2 недели составила 12,3 % в группе левоцетиризина против 3,9 % в группе плацебо (р = 0,01). Общая оценка также показала превосходство левоцетиризина, т.к. в группе левоцетиризина состояние 57,1 % детей было расценено как значительное или умеренное улучшение в сравнении с 44,7 % в группе плацебо. Левоцетиризин после 2 недель терапии также обеспечивал значительное улучшение качества жизни, связанного со здоровьем, по сравнению с плацебо (р = 0,01).
Клинические исследования показали, что левоцетиризин также является безопасным и эффективным средством лечения хронической идиопатической крапивницы. Рандомизированное двойное слепое, с параллельными группами, многонациональное, долгосрочное исследование показало, что левоцетиризин в дозе 0,125 мг/кг два раза в день эффективен в лечении и/или профилактике хронической крапивницы у детей в возрасте 1–2 лет [40]. В течение 18 месяцев лечения значительно меньше детей, получавших левоцетиризин (27,5 %), развили рецидив крапивницы по сравнению с детьми, получавших плацебо (41,6 %; р < 0,001). Среднее число эпизодов крапивницы было значительно ниже в группе левоцетиризина, чем в группе плацебо. Эти данные позволяют предположить, что левоцетиризин может быть эффективен в профилактике не только крапивницы, но и атопического дерматита.
Данные по клинической безопасности, эффективности и оценке родителями и врачом лечения левоцетиризином детей с аллергическими заболеваниями представлены в обзоре [27].
На основании проведенного анализа авторы пришли к заключению, что использование антигистаминных препаратов первого поколения должно быть ограничено или прекращено у детей, страдающих аллергическим ринитом и хронической идиопатической крапивницей. Врачи должны назначать детям только новые антигистаминные препараты. С учетом данных, имеющихся в настоящее время по фармакокинетике, клинической безопасности/переносимости, эффективности и оценке родителями и врачами, левоцетиризин является лучшим вариантом лечения аллергического ринита и хронической крапивницы у детей в возрасте от 6 месяцев до 12 лет.
Оценка эффективности и безопасности левоцетиризина, а также удовлетворенности лечением врача и родителей проведена в двух возрастных группах: дети 2–6 лет и 7–12 лет. Левоцетиризин вне зависимости от возраста пациентов получил более высокие оценки, чем другие антигистаминные препараты нового поколения [26].
Одним из препаратов левоцетиризина является L-цет сироп, в Украине зарегистрированный компанией «Кусум Фарм», являющейся его украинским производителем. Опыт применения препарата L-цет сироп в лечении 22 детей с острым бронхитом и пневмонией на фоне атопического дерматита представил Ю.В. Марушко [15]. Положительная динамика клинических симптомов основного заболевания, аллергических проявлений и гематологических показателей на фоне проводимой комплексной терапии бронхолегочной патологии с использованием препарата L-цет сироп отмечена у всех детей. Согласно полученным результатам у пациентов улучшалось общее состояние на 3-й день лечения. К 3–5-му дню терапии снижалась интенсивность кашля, улучшался характер мокроты с облегчением ее отхождения и ликвидацией кашля до 10-го дня лечения. Несмотря на массивную антибактериальную терапию, ухудшение проявлений аллергических заболеваний у детей на фоне приема препарата L-цет сироп не отмечено ни в одном случае, наоборот, проявления уменьшались.
Л.С. Овчаренко с соавт. [17] представили результаты изучения клинической эффективности и безопасности использования препарата L-цет сироп при проявлениях пищевой аллергии у 30 детей в возрасте от 2 до 6 лет. Показано, что препарат L-цет сироп обладает выраженным и быстрым терапевтическим эффектом в отношении купирования симптомов пищевой аллергии у детей. Это проявлялось значимой регрессией как отечно-экссудативных проявлений пищевой сенсибилизации, так и дополнительных симптомов, связанных со вторичными функциональными расстройствами (нарушение сна, диспептические жалобы). Принципиальным отличием и существенным преимуществом препарата L-цет сироп является его способность быстрее оказывать терапевтический эффект, что отмечалось на третьи сутки терапии. Лечение препаратом на 7-е сутки максимально купировало зуд кожи и нарушения сна. Показана более высокая эффективность препарата L-цет сироп, чем цетиризина. Клинический эффект препарата L-цет сироп связан с его значительным влиянием на патогенез аллергии, что проявлялось позитивной динамикой лабораторных маркеров сенсибилизации. Это касается как непосредственных маркеров эозинофильного воспалительного процесса при ПА (количества эозинофилов в крови, эозинофильного катионного протеина), так и гуморальных факторов адаптивного иммунного ответа, характеризующих наличие сенсибилизации к пищевым аллергенам (специфические IgE). Препарат L-цет сироп продемонстрировал хорошую переносимость пациентами и высокий профиль безопасности, в том числе со стороны сердечно-сосудистой системы, по данным контроля величины интервала QT.
Н.Л. Аряевым и соавт. [19] проведено сравнительное контролируемое исследование в параллельных группах 26 детей в возрасте 2–8 лет с атопическим дерматитом. 14 пациентов основной группы в качестве антигистаминного средства получали препарат L-цет сироп в течение 8–10 дней. 12 пациентов контрольной группы получали антигистаминные препараты других групп. При использовании препарата L-цет сироп характер изменений на коже начал меняться к концу третьих суток от начала лечения: уменьшились зуд, сухость, покраснение кожи, дети стали более спокойными, у них улучшился аппетит. У 12 пациентов (46,15 %, 95% ДИ 26,84–65,15) к седьмому дню от начала приема препарата клинические проявления АД отсутствовали. На десятый день от начала приема препарата левоцетиризина у 22 пациентов (84,61 %, 95% ДИ 71,27–98,72) констатирована клиническая ремиссия. У детей контрольной группы, которые получали другие антигистаминные препараты, динамика кожного синдрома была менее выражена. Эффективность препарата L-цет сироп расценена как высокая у 24 пациентов (92,3 %, 95% ДИ 81,57–102,42), как умеренная — у 2 детей (7,7 %, 95% ДИ 2,42–18,42).
Применение препарата L-цет сироп на протяжении 4 недель для лечения сезонного аллергического ринита у 30 детей в возрасте 5–12 лет способствовало регрессу основных клинических симптомов заболевания, что сопровождалось уменьшением интенсивности назальных и глазных симптомов, воспалительных изменений в слизистой верхних дыхательных путей, улучшением показателей качества жизни больных [9].
Побочных эффектов, случаев индивидуальной непереносимости ни в одном из представленных клинических исследований препарата L-цет сироп не было зарегистрировано.
Таким образом, особенности фармакокинетики, хороший профиль безопасности и высокая клиническая эффективность делают левоцетиризин L-цет сироп наиболее перспективным антигистаминным средством для лечения аллергических заболеваний в детском возрасте. В дополнение к лечению непосредственных краткосрочных проявлений аллергических заболеваний применение левоцетиризина L-цет сироп более оправданно при проведении долговременной терапии аллергических заболеваний, в генезе которых значительную роль играют медиаторы поздней фазы аллергического воспаления: круглогодичного аллергического ринита, сезонного аллергического ринита с продолжительностью сезонных обострений более 2 недель, хронической крапивницы, атопического дерматита, аллергического контактного дерматита, раннего атопического синдрома у детей.
Список литературы
1. Абатуров А.Е. Значение антигистаминных препаратов при лечении аллергических заболеваний у детей / А.Е. Абатуров, И.Л. Высочина // Здоровье ребенка. — 2011. — № 6. — С. 100-102.
2. Антигистаминные препараты первого поколения в педиатрической практике / Е.Г. Кондюрина, Т.Н. Елкина, О.А. Грибанова, Ю.А.Татаренко // Русский медицинский журнал. — 2011. — № 22 (19). — С. 1357-1360.
3. Борисова Т.П. Подход к выбору антигистаминного препарата в лечении аллергических заболеваний и состояний в детской практике // Здоровье ребенка. — 2015. — 8 (68). — С. 33-44.
4 Вдовиченко В.П. Проблема выбора Н1-блокатора в клинической практике / В.П. Вдовиченко, Г.М. Бронская, Т.А. Коршак и др. // Медицинские новости. — 2012. — № 3. — С. 60-63.
5. Гиниятова Л.Р. Фармакоэпидемиология антигистаминных лекарственных средств в педиатрической практике: Автореферат дис… канд. мед. наук. — Казань, 2012. — 21 с.
6. Горячкина Л.А. Современные антигистаминные препараты в лечении аллергических заболеваний // Русский медицинский журнал. — 2001. — № 21 (9). — С. 945-950.
7. Гущин И.С. Полифункциональные противоаллергические возможности антагониста Н1-рецепторов — левоцетиризина // Российский аллергологический журнал. — 2014. — № 2. — С. 11-24.
8. Добмейер Т. Актуальность и опыт более чем 40-летнего применения диметиндена малеата // Врач. — 2012. — № 4. — С. 51-54.
9. Ефективність застосування препарату L-цет у дітей із сезонним алергічним ринітом / Ю.Г. Антипкін, В.Ф. Лапшин, Т.Р. Уманець, Т.В. Кондратенкова // Здоровье ребенка. — 2013. — № 8. — С. 21-26.
10. Комплексный поход к лечению аллергического ринита и бронхиальной астмы / Ю.И. Фещенко, Л.А. Яшина, М.А. Полянская, В.И. Игнатьева // Астма та алергія. — 2015. — № 1. — С. 13-21.
11. Коррекция нарушений когнитивной сферы у детей с аллергическим ринитом / А.Ю. Томилова, Л.С. Намазова, Л.Н. Кузенкова, О.И. Маслова // Вопросы современной педиатрии. — 2007. — № 2. — С. 123-127.
12. Косенко И.М. Антигистаминные препараты: рациональное применение в педиатрической практике // Педиатрия. — 2013. — № 2. — С. 67-71.
13. Левоцетиризин: современные аспекты применения при аллергических заболеваниях с точки зрения доказательной медицины / Н.Г. Астафьева, И.В. Гамова, Е.Н. Удовиченко, И.А. Перфилова // Лечащий врач. — 2010. — № 5. — С. 62-68.
14. Малахов А.Б. Антигистаминные препараты и их место в терапии аллергических заболеваний / А.Б. Малахов, И.К. Волков, М.А. Малахова-Капанадзе // Справочник поликлинического врача. — 2007. — № 1. — С. 23-28.
15. Марушко Ю.В. Опыт применения левоцетиризина в педиатрической практике // Здоровье ребенка. — 2014. — № 8 (59). — С. 43-48.
16. Полосьянц О.Б. Антигистаминные препараты / О.Б. Полосьянц, Е.Г. Силина, Л.С. Намазова // Медицина неотложных состояний. — 2007. — № 4. — С. 88-92.
17. Рациональное использование антигистаминных препаратов в программе терапии клинических проявлений пищевой аллергии у детей / Л.С. Овчаренко, А.А. Вертегел, Т.Г. Андриенко и др. // Современная педиатрия. — 2012. — № 4 (44). — С. 46-49.
18. Ревякина В.А. Антигистаминные препараты в клинической практике. Дискуссионные вопросы. Взгляд врача на привычные препараты // Лечащий врач. — 2010. — № 7. — С. 71-73.
19. Результаты терапии атопического дерматита у детей с использованием препарата левоцетиризина гидрохлорида / Н.Л. Аряев, Н.Ю. Горностаева, И.М. Шевченко, Л.Л. Поплавская // Здоровье ребенка. — 2012. — № 7. — С. 41-44.
20. Терек Е. Применение диметиндена малеата при различных зудящих заболеваниях кожи в детском возрасте / Е. Терек, М. Катона // Лечащий врач. — 2011. — № 4 — С. 86-87.
21. Уманец Т.Р. Бронхиальная астма и аллергический ринит: пути оптимизации комплайенса и эффективности лечения // Астма та алергія. — 2015. — № 1. — С. 61-64.
22. Absorption, distribution, metabolism and excretion of levocetirizine, the R enantiomer of cetirizine, in healthy volunteers / M.S. Benedetti, M. Plisnier, J. Kaise et al. // Eur J Clin Pharmacol. — 2001. — Vol. 57. — P. 571-582. PMID: 11758635.
23. Constitutive activity of the histamine H(1) receptor reveals inverse agonism of histamine H(1) receptor antagonists / R.A. Bakker, K. Wieland, H. Timmerman, R. Leurs // Eur. J. Pharmacol. — 2000. — Vol. 387. — P. R5-R7. PMID: 10633171.
24. Church M.K. Pharmacology of Antihistamines / M.K. Church, D.S. Church // Indian J. Dermatol. — 2013. — 58 (3). — Р. 219-224. doi:10.4103/0019-5154.110832.
25. Englisch W. Dimethindene maleate in the treatment of pruritus caused by varizella zoster virus infection in children / W. Englisch, C.P. Bauer // Arzneimittelforschung. — 1997. — 47 (11). — Р. 1233-1235. PMID: 9428981.
26. Evaluation of treatment satisfaction in children with allergic disease treated with an antihistamine / M Ferrer, M. Morais-Almeida, M. Guizova, R. Khanferyan // Clin. Drug Invest. — 2010. — Vol. 30. — Р. 15-34. doi: 10.2165/11530910-000000000-00000.
27. Evidence for Clinical Safety, Efficacy, and Parent and Physician Perceptions of Levocetirizine for the Treatment of Children with Allergic Disease / A.N. Pampura, N.G. Papadopoulos, V. Spičák, R. Kurzawa // Int Arch Allergy Immunol. — 2011. — Vol. 155. — Р. 367-378. doi: 10.1159/000321181. Epub 2011 Feb 22.
28. Graziano F.M. Antihistamines and epithelial cells / F.M. Graziano, E.B. Cook, J.L. Stahl // Allergy Asthma Proc. — 2000. — Vol. 21. — P. 129-140. PMID: 10892513.
29. Hampel F. Safety and tolerability of levocetirizine dihydrochloride in infants and children with allergic rhinitis or chronic urticaria / F. Hampel, P. Ratner, J.M. Haeusler // Allergy Asthma Proc. — 2010. — Vol. 31. — Р. 290-295. doi: 10.2500/aap.2010.31.3349.
30. High prevalence of asthma and allergic diseases in children aged 6 and 7 years from the Canary Islands: the International Study of Asthma and Allergies in Childhood / B. Sánchez-Lerma, F.J. Morales-Chirivella, I. Peñuelas et al. // J. Investig. Allergol. Clin. Immunol. — 2009. — Vol. 19. — Р. 383-390. PMID: 19862938.
31. Inhibition of cytokine-induced expression of T-cell cytokines by antihistamines / M.S. Ashenager, T. Grgela, Y. Aragane, A. Kawada // J. Investig. Allergol. Clin. Immunol. — 2007. — № 1 (17). — P. 20-26. PMID: 17323859.
32. Leurs R. H1-antihistamines: inverse agonism, anti-inflammatory actions and cardiac effects / R. Leurs, M.K. Church, M. Taglia–latela // Clin. Exp. Allergy. — 2002. — Vol. 32. — P. 489-498. PMID: 11972592.
33. Levocetirizine in children: evidenced efficacy and safety in a 6 week randomized seasonal allergic rhinitis trial / J. de Blic, U. Wahn, E. Billard еt al. // Pediatric Allergy and Immunology. — 2005. — Vol. 16. — P. 267-275. doi: 10.1111/j.1399-3038.2005.00216.x.
34. Levocetirizine in one-to two-year-old children: pharmacokinetic and pharmacokinetic profile / N. Cranswick, J. Turzikova, M. Fuchs, R. Hulhoven // Int. J. Clin. Pharmacol. Therap. — 2005. — Vol. 43. — Р. 172-177. PMID: 15966463.
35. Potter P.C. Efficacy and safety of levocetirizine on symptoms and health-related quality of life of children with perennial allergic rhinitis: a double-blind, placebo-controlled randomized clinical trail // Ann. Allergy Asthma Immunol. — 2005. — Vol. 95. — P. 175-180. doi: 10.1016/S1081-1206(10)61208-2.
36. Retrospectivepopulation pharmacokinetics of levocetirizinein atopic children receiving cetirizine: the ETAC — study / Z. Hussein, M. Pitsiu, O. Majid et al. // Br. J. Pharmacol. — 2005. — Vol. 59. — Р. 28-37. doi: 10.1111/j.1365-2125.2005.02242.
37. Relevancy of H1-receptor occupancy to H1 antihistamine dosing in children / K.J. Simons, M.S. Benedetti, F.E. Simons et al. // J. Allergy Clin. Immunol. — 2007. — Vol. 119. — Р. 1551-1554. doi: 10.1016/j.jaci.2007.02.048.
38. Simons F.E. Advances in H1-Antihistamines // N. Eng. J. Med. — 2004. — Vol. 351. — P. 2203-2217. doi: 10.1056/NEJMra033121
39. Simons F.E. Levocetirizine: pharmacokinetics and pharmacokinetics in children age 6 to 11 years / F.E. Simons, K.J. Simons // J. Allergy Clin. Immunol. — 2005. — Vol. 116. — Р. 355-361. doi: 10.1016/j.jaci.2005.04.010.
40. Simons F.E. Early Prevention of Asthma in Atopic Children Study Group. H1-antihistamine treatment in young atopic children: effect on urticaria // Ann. Allergy Asthma Immunol. — 2007. — Vol. 99. — Р. 261-266. doi: 10.1016/S1081-1206(10)60662-X.
41. Simons F.E. Early Prevention of Asthma in Atopic Children (EPAAC) Study Group: Safety of levocetirizine treatment in young atopic children: an 18-month study // Pediatr Allergy Immunol. — 2007. — Vol. 18. — Р. 535-542. doi: 10.1111/j.1399-3038.2007.00558.x.
42. The comparison of cetirizine, levocetirizine and placebo for the treatment of childhood perennial allergic rhinitis / C.F. Lee, H. Sun, K.H. Lu et al. // Pediatr. Allergy Immunol. — 2009. — Vol. 20. — P. 493-499. doi: 10.1111/j.1399-3038.2008.00816.x. Epub 2008 Oct 6.
43. Thomas J.W. Клиническое исследование антигистаминного препарата диметиндена (фенистил) при лечении различных аллергических реакций / J.W. Thomas, F.R. Kelly // Перинатология и педиатрия. — 2012. — № 4. — С. 77-79.
44. Walsh G.M. The anti-inflammatory effects of levocetirizine — are they clinically relevant or just an interesting additional effect? // Allergy Asthma Clin. Immunol. — 2009. — 5 (1). — Р. 14. doi: 10.1186/1710-1492-5-14.

/124.jpg)