Статтю опубліковано на с. 114-118
Вступ
За останнє десятиріччя відзначається неухильне зростання алергічної патології, від якої нині страждає близько 15–25 % дитячої популяції [1, 4–6]. Спостерігається значне її омолодження і тенденція до почастішання тяжких клінічних форм, резистентних до традиційних методів лікування.
У дітей раннього віку найчастіше зустрічається атопічний дерматит (АД) як прояв харчової алергії. З віком спектр сенсибілізації розширюється за рахунок побутових, пилкових, грибкових та епідермальних алергенів, що клінічно проявляється ураженням респіраторного тракту.
Зростання захворюваності на АД в усьому світі пов’язано із несприятливим впливом багатьох факторів сучасної цивілізації. Поширеність патології у розвинутих країнах Західної Європи серед дітей віком до 14 років становить 10–20 %. Серед дітей, які мешкають у європейських країнах і народились до 1960 р., поширеність АД становила від 1,4 до 3,1 %; у період 1960–1970 рр. — 3,8–8,8 %, а після 1970 р. — зросла до 20,4 % [7, 13].
Дебют захворювання найчастіше має місце в ранньому дитячому віці. У дітей АД вперше проявляється до 6 місяців у 45 % випадків, протягом першого року життя — у 60 % і до 5 років — у 85 % випадків [2, 4, 13].
За даними офіційної статистики, частота АД в Україні становить 3–10 на 1000 дітей, однак результати досліджень за стандартизованою міжнародною програмою ISAAC (International Study of Asthma and Allergies in Childhood) перевищують зазначені вище показники у 5–10 разів [1].
Зважаючи на той факт, що АД і сенсибілізація до харчових продуктів є невід’ємною частиною та стартом «атопічного маршу», до клінічних ознак якого зараховують також алергічний риніт і бронхіальну астму, адекватне лікування даної патології заслуговує на особливу увагу.
Мультифакторний патогенез, варіабельність перебігу АД вимагають комплексного підходу до лікування.
АД характеризується клінічними проявами з боку багатьох органів і систем: зокрема, ураження шлунково-кишкового тракту (ШКТ) спостерігається у 52 % хворих, респіраторні симптоми — у 32 % [2, 4].
Маніфестація клінічних проявів ураження ШКТ відбувається вже на першому році життя у вигляді кишкових кольок, зригувань, блювоти, метеоризму, неоформлених випорожнень [6].
Велике значення мають патологічні зміни гепатобіліарної системи, які призводять до порушення розщеплення харчових компонентів у процесі травлення, що додатково сприяє сенсибілізації [3, 8].
Урсодеоксихолева кислота (УДК) — це третинна гідрофільна нетоксична жовчна кислота, частка якої становить приблизно 3 % загального пулу жовчних кислот людини, має надзвичайно широкий спектр лікувальних ефектів. У разі призначення УДК у дозі 13–15 мг/кг/добу вона стає основним складовим компонентом жовчі (48 %), викликає не тільки кількісні, а й якісні її зміни, зумовлюючи реалізацію низки лікувальних властивостей препарату. Накопичені на сьогодні дані дають змогу згрупувати ефекти препарату таким чином: антихолестатичний (пригнічення надходження токсичних жовчних кислот у жовч за рахунок конкурентного захвату рецепторами у здухвинній кишці та стимуляції екзоцитозу в гепатоцитах); холеретичний (індукція бікарбонатного холерезу, що підсилює виведення гідрофобних жовчних кислот до кишечника); цитопротекторний (відновлення структури гепатоцитів за рахунок вбудовування УДК у фосфоліпідний шар клітинної мембрани, що забезпечує її стабілізацію і підвищує стійкість до ушкоджуючого впливу токсинів); гіпохолестеринемічний (зниження всмоктування холестерину в кишечнику, його синтезу в печінці та екскреції у жовч); літолітичний (зниження літогенності жовчі внаслідок формування рідких кристалів з молекулами холестерину, запобігання утворенню та розщепленню холестеринових каменів); імуномодулюючий, антиапоптотичний; антифібротичний та антиоксидантний [8, 9, 11].
Тому застосування препарату з гепатопротекторною, холеретичною, дезінтоксикаційною дією у комплексній терапії АД є патогенетично обґрунтованим.
Метою роботи було вивчення ефективності комплексної терапії поширеної форми АД у дітей раннього віку із включенням суспензії УДК –(Укрлів).
Матеріали та методи
Вивчення ефективності удосконаленої терапії проводилось у формі відкритого дослідження із включенням 45 пацієнтів віком від 6 місяців до 3 років, які перебували на обстеженні та лікуванні у відділенні проблем харчування та соматичних захворювань дітей раннього віку ДУ «ІПАГ НАМН України» або були виписані з клініки та знаходились під амбулаторним спостереженням.
Пацієнти взяли участь у дослідженні після отримання письмової інформованої згоди обох батьків.
Методом простої рандомізації діти були розподілені на дві групи. Пацієнти основної та контрольної груп були ідентичні за статтю, віком і тяжкістю захворювання та отримували базисну терапію, що включала елімінаційну дієту (суміш з екстенсивним гідролізом білка у разі алергії до білка коров’ячого молока), антигістамінний препарат L-цет сироп (у дозі 2,5 мл/добу дітям із 6 до 12 місяців, 5 мл/добу — з 1–3 років), замісну ферментотерапію (лактаза) при грудному вигодовуванні у разі недостатності лактози, топічні глюкокортикоїди, зволожуючі засоби.
Основну групу становили 25 дітей, які у складі комплексної терапії АД приймали препарат УДК (Укрлів) у дозі 10 мг/кг 1 раз на добу (5 мл суспензії містить 250 мг УДК) протягом 21 дня. Контрольну групу становили 20 дітей, які отримували стандартну терапію без включення у схему лікування препарату УДК або інших засобів з гепатопротекторною дією.
З метою вивчення ефективності лікування АД на фоні включення в схеми терапії суспензії УДК була проведена комплексна оцінка основних клінічних і параклінічних показників у динаміці — на початку та наприкінці прийому препаратів.
Клінічну ефективність комплексу із застосуванням суспензії УДК оцінювали у динаміці за інтенсивністю клінічних проявів з боку шкіри (площа ураження, інтенсивність свербіння), гастроінтестинальних проявів (кишкових кольок, метеоризму, зригувань), за показниками ультразвукового дослідження (УЗД) гепатобіліарної системи.
Комплексне обстеження хворих включало:
— загальноклінічне обстеження з оцінкою алергологічного (сімейного та індивідуального) анамнезу, визначення наявності зв’язку між вживанням продукту харчування та виникненням гастроінтестинальних, шкірних і респіраторних симптомів анкетним методом;
— визначення рівнів загального імуноглобуліну Е (IgE) та алергенспецифічних IgE до харчових алергенів методом імуноферментного аналізу (ІФА);
— ультразвукове дослідження органів черевної порожнини.
Для оцінки тяжкості шкірних алергічних реакцій застосовували систему бального оцінювання ступеня тяжкості АД — SCORAD (Scoring of Atopic Dermatitis) [2].
Отримані дані обробляли статистично. Вірогідність різниць оцінювали за допомогою t-критерію Стьюдента та методом кутового перетворення Фішера. Різницю вважали вірогідною при р < 0,05.
Обробку отриманих результатів проводили загальноприйнятими математичними методами варіаційної статистики.
Всі пацієнти основної групи отримали повний курс лікування. Випадків дострокового вибування пацієнтів із дослідження не було.
Результати
Відповідно до критеріїв залучення у дослідження всі 45 дітей (24 хлопчики та 21 дівчинка) народились доношеними, з нормальними масо-ростовими показниками. Більшість із них (32 — 71,1 %) були прикладені до грудей матері в першу годину життя. П’ятеро дітей (11,1 %) народились від ускладнених вагітностей, перебіг пологів був обтяженим у 4 випадках (8,9 %), 9 (20,0 %) дітей народились шляхом кесаревого розтину.
Обтяжений сімейний алергологічний анамнез відмічений у 2/3 дітей з АД, у 20 (44,4 %) — по материнській лінії, у 9 (20,0 %) — по лінії батька, у 6 (13,3 %) — обидва батьки мали алергічні захворювання.
Дебют АД у дітей обох груп спостереження виникав у перші 3 місяці життя на фоні вживання сумішей на основі коров’ячого молока або після введення прикорму. У дітей на грудному вигодовуванні поява клінічних симптомів АД стартувала на фоні вживання матір’ю-годувальницею продуктів харчування з алергенними властивостями (коров’ячого молока, яєць, курятини, червоних і помаранчевих овочів та фруктів).
Всі обстежені діти мали середньотяжку та тяжку форму АД, що характеризувалась хронічним рецидивним перебігом, з переважанням еритематозно-сквамозних середньотяжких і тяжких форм (сухість, лущення, еритема, екскоріації) та вираженим свербінням у 100 % малюків, у 11 (24,4 %) з ділянками мокнуття.
Середній показник тяжкості АД за шкалою SCORAD на момент початку дослідження — 78,77 ± 3,19 бала.
У 37 (82,2 %) дітей мали місце гастроінтестинальні прояви: зригування — 22 (48,8 %), абдомінальний больовий синдром — 36 (80,0 %), метеоризм — 11 (24,4 %), неоформлені випорожнення — 29 (64,4 %), запори — 5 (11,1 %).
З метою визначення причинних факторів розвитку захворювання всім дітям із гастроінтестинальними та шкірними проявами харчової алергії було проведене імунологічне дослідження, що включало визначення рівнів загального IgE, алергенспецифічних IgE-антитіл до харчових, побутових, пилкових алергенів методом ІФА.
У 38 (84,4 %) малюків з АД виявлена сенсибілізація до харчових алергенів — у 22 (48,8 %) до білків коров’ячого молока, 11 (24,4 %) дітей мали сенсибілізацію до яєчного білка, у 12 (26,7 %) виявлена сенсибілізація до алергену пшеничного борошна, 16 (35,5 %) обстежених мали сенсибілізацію до двох та більше алергенів.
Рівень загального IgE сироватки крові визначали у 38 (84,4 %) пацієнтів, підвищення його концентрації понад 2–3 норм виявлено лише у 25 (55,5 %) обстежених, 13 (28,8 %) дітей мали нормальні його показники, середнє значення загального IgE становило 68,6 IU/ml при референтних значеннях < 45 IU/ml.
Аналіз параклінічних даних дітей з АД показав зміни з боку червоної крові у вигляді гіпохромної анемії та незначної еозинофілії у 34 (75 %) обсте–жених.
При інструментальному УЗД органів черевної порожнини в усіх обстежених дітей виявлено функціональні зміни з боку гепатобіліарної системи і підшлункової залози — дифузне підвищення ехогенності паренхіми печінки, помірне ущільнення стінок внутрішньопечінкових жовчних ходів і судин системи портальної вени; збільшення розмірів підшлункової залози, зниження ехогенності паренхіми; збільшення розмірів селезінки та помірне ущільнення стінок судин.
Обстеження дітей у динаміці лікування показало, що призначення пацієнтам препарату УДК у суспензії у складі комплексної терапії АД (основна група) сприяє більш значному та швидкому зменшенню клінічних симптомів, як шкірних, так і гастроінтестинальних, порівняно з групою дітей, які його не отримували (контрольна група), що свідчить про виражений терапевтичний ефект даного лікувального засобу.
У процесі спостереження за дітьми основної групи на фоні лікування виявлено регресію шкірних висипань та значне зменшення інтенсивності свербіння, що підтверджено зниженням середнього показника індексу SCORAD у 2,3 раза (з 80,27 ± 2,97 бала до 35,27 ± 2,54 бала). У 20 пацієнтів групи контролю, які отримували традиційну терапію, індекс SCORAD до лікування становив 77,27 ± 3,41 бала, після курсу терапії він знизився лише до 49,6 ± 4,50 бала (в 1,56 раза) (табл. 1). Отже, в основній групі спостереження відмічено вірогідне зниження індексу SCORAD порівняно з контрольною групою в динаміці лікування (p = 0,01).
/116.jpg)
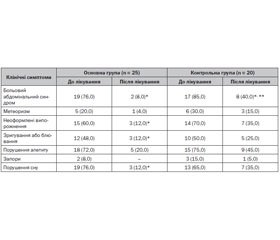
У дітей обох груп спостереження відмічена позитивна динаміка гастроінтестинальних симптомів, однак в основній групі наприкінці дослідження вірогідно нижчим був відсоток дітей з абдомінальним больовим синдромом, зригуваннями або блюванням, неоформленими випорожненнями, порушенням сну на відміну від пацієнтів групи контролю, де спостерігалось вірогідне зменшення лише абдомінального больового синдрому (табл. 2).
У всіх обстежених дітей середньодобове збільшення маси тіла відповідало віковій нормі.
В основній групі відзначено також покращення сну. При опитуванні матерів основної групи 19 (76,0 %) із них на початку дослідження відмічали порушення характеру сну дітей через виражений свербіж шкіри. Після проведеного лікування у більшості дітей основної групи сон нормалізувався, а дітей із порушеннями сну було тільки троє (12,2 %), у той час як у групі контролю порушення сну зберігались у 35,0 % дітей.
За результатами УЗД органів черевної порожнини виявлені позитивні зміни на фоні проведеної терапії у вигляді зменшення розмірів печінки та нормалізації ехогенності її паренхіми.
Індивідуальна переносимість суспензії УДК була хорошою в усіх пацієнтів основної групи спостереження.
У процесі виконання дослідження не було відзначено алергічних або інших негативних реакцій на прийом суспензії УДК, у тому числі не виявлено алергічних реакцій або посилення клінічної симптоматики захворювання у дітей з АД, що свідчить про безпеку застосування суспензії УДК у цієї категорії дітей.
Висновки
1. Прийом суспензії УДК (Укрлів) у складі комплексної терапії середньотяжкої та тяжкої форм АД у дітей раннього віку сприяв позитивній клінічній динаміці як шкірних, так і гастроінтестинальних проявів, що виявлялось зменшенням площі ураження шкіри, інтенсивності свербіння, нормалізацією сну та регресією больового абдомінального синдрому, зригувань.
2. Призначення суспензії УДК (Укрлів) дітям раннього віку з АД у дозі 10 мг/кг/добу протягом 21 дня не викликало розвитку побічних реакцій, що свідчить про безпеку застосування суспензії УДК у цієї категорії дітей.
3. Проведене клінічне дослідження дозволяє рекомендувати включення суспензії УДК у комплексну терапію АД у дітей перших років життя.

/116.jpg)
/117.jpg)