Статтю опубліковано на с. 79-84
У 2017 р. виповниться 60 років із дня відкриття інтерферону — події, яку справедливо віднесено до найвидатніших у галузі біологічної науки ХХ століття. За ці майже шість десятиліть вченими були відкриті різні типи інтерферонів, зібрана надзвичайно важлива інформація щодо природи та фундаментальних аспектів функціонування родини інтерферонів, визначені роль і місце інтерферонів у нормі та при різних видах патології людини, розпочато широке клінічне застосування інтерферонів і їх індукторів.
Історія відкриття інтерферону
Історія відкриття інтерферону пов’язана з іменами англійця Аліка Айзекса (Alick Isaacs) і швейцарця Жана Лінденманна (Jean Lindenmann), які у 1956–1957 рр. працювали в Національному інституті медичних досліджень (National Institute for Medical Research — NIMR) у Мілл-Хіллі та проводили дослідження механізмів вірусної інтерференції, тобто здатності клітин, інфікованих одним вірусом, протистояти інфікуванню іншими вірусами.
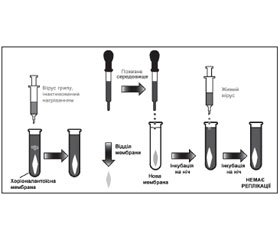
Для вивчення цього питання дослідники розробили просту і одночасно вишукану на той час схему експерименту: шматочки хоріоалантоїсної оболонки (ХАО) курячого ембріона поміщали у пробірку з живильним середовищем і вносили інактивований прогріванням вірус грипу А. В умовах in vitro вірус і клітини ХАО інкубували при температурі 37 °С упродовж ночі, потім клітини видаляли, а живильне середовище вносили в іншу пробірку з новими клітинами ХАО, знову інкубували впродовж ночі та інфікували живим гомологічним вірусом грипу А (рис. 1).
Контроль за репродукцією вірусу грипу здійснювали з допомогою реакції гемаглютинації (РГА).
Аналізуючи результати експерименту, А. Айзекс писав, що йому було дивно, що через 24 години значна інтерферуюча активність щодо другого вірусу залишалася в живильному середовищі, після того як клітини разом з адсорбованими на них частками першого вірусу були видалені. Відтак існувала висока ймовірність, що не вірусні частки, як це вважали раніше, а невідомий розчинний інгібітор спричинював інтерференцію вірусів. Цей новий розчинний інгібітор авторами було названо «інтерферон» (термін утворено від слова «інтерференція» за допомогою суфікса «он», що часто використовувся в той час). Перша стаття Аліка Айзекса і Жана Лінденманна про відкриття інтерферону була надрукована в збірнику робіт Королівського товариства (1957) [2].
У 1963 р. А. Айзекс дав перше достатньо повне визначення інтерферону як «противірусній речовині, що утворюється в клітинах багатьох хребетних у відповідь на вірусну інфекцію. Можливо, вона має білкову або поліпептидну природу, відрізняється за антигенними властивостями від вірусу і формує в клітині резистентність до репродукції в ній різних вірусів» [3].
Минув час. Були проведені тисячі досліджень, які дозволили розширити уявлення про інтерферон та його природу.
Природа інтерферонів
За сучасними уявленнями, інтерферон не один, інтерферонів багато і вони являють собою родину протеїнів і глікопротеїнів невеликої молекулярної маси (від 15 до 27 кДа), які продукуються клітинами головним чином у відповідь на вірусну інфекцію, але також і у відповідь на синтетичні та природні індуктори [4–6, 8]. Родина інтерферонів входить до численної групи важливих у біологічному плані білкових молекул, які одержали назву «цитокіни» (медіатори імунітету). Для інтерферонів описано не тільки противірусний ефект, а й понад 300 інших біологічних ефектів. Серед них: антипроліферативна активність; протипухлинний ефект; антитоксична дія; радіопротективний ефект; пригнічення або стимуляція продукції антитіл; стимуляція макрофагів; посилення фагоцитозу; стимуляція продукції факторів та молекул адгезії; посилення експресії головного комплексу гістосумісності; пригнічення репродукції хламідій, рикетсій, найпростіших, бактерій і багато іншого. Зважаючи на противірусні та численні імуномодуляторні ефекти, інтерферони розглядають як інтегральну частину захисної системи організму, функції якої не обмежуються лише захистом проти вірусних інфекцій. Інтерферони — це перша лінія захисту від вірусних інфекцій, а також важливий компонент імунологічного нагляду за злоякісними клітинами [6–9, 12, 18].
/80_2.jpg)
Всі відомі науці інтерферони характеризуються видоспецифічністю. Це означає, що інтерферони людини проявляють свою активність тільки в організмі людини і не працюють в організмах інших біологічних видів. Наприклад, мишачий інтерферон захищає від вірусів тільки клітини мишей, бичачий — тільки клітини корів тощо. Проте бар’єри видоспецифічності інтерферонів за певних умов не абсолютні: інтерферони людини виявляють певну активність і частково захищають клітини людиноподібних мавп, а курячий інтерферон — клітини близьких видів інших курячих. Важливо підкреслити, що в гетерогенних організмах активність інтерферонів різко зменшується.
Інтерферони не виявляють специфічності щодо вірусів. Вони пригнічують репродукцію практично всіх відомих вірусів людини і тварин, діючи на етапах проникнення вірусів у клітину, блокуючи синтез нуклеїнових кислот, трансляцію, збирання і вихід вірусу з клітини. В організмі інтерферони починають діяти набагато раніше за механізми специфічного імунітету.
Як правило, в нормі в умовах in vivo або in vitro клітини не продукують помітної кількості інтерферону, аж доки не відбудеться його індукція. В природних умовах індукторами інтерферону найчастіше виступають віруси. Відомо чимало природних і синтетичних індукторів інтерферону, серед яких чільне місце посідають двонитчасті молекули РНК. Проте навіть за умов індукції інтерферон не продукується постійно. Відповідь на стимуляцію тими чи іншими чинниками індукції є завжди короткочасною та підпорядковується певній кінетиці. Тому в цілому можна вважати, що за нормальних умов постійної продукції інтерферонів не спостерігається.
Встановлено, що функціонування членів родини інтерферонів завжди відбувається в суворому порядку за схемою: «індукція — продукція — дія — ефекти». Ця «ланцюгова реакція» здійснюється тільки у відповідь на вторгнення чужорідної генетичної інформації або використання індукторів інтерферону.
Родина інтерферонів представлена трьома типами: інтерферонами першого типу (ІФН I), другого типу (ІФН II) і третього типу (ІФН III). Для людини описано 5 ІФН I типу: ІФН-α (розрізняють 14 субтипів), -β (5 субтипів), -ε, -κ, -ω. До ІФН II віднесено тільки одного представника — це інтерферон гамма (ІФН-γ), або «імунний» ІФН. Основними, найбільш вивченими є ІФН I та ІФН II (табл. 1).
ІФН І типу виробляються лейкоцитами та фібробластами, ІФН II типу синтезуються переважно Т-лімфоцитами у відповідь на антигени, мітогени та лектини. ІФН І та ІІ типів споріднені лише за головною функціональною ознакою, а саме за противірусним ефектом. Важливо підкреслити, що противірусна активність ІФН І типу може бути різною для різних субтипів, проте завжди перевищує в десятки разів і більше активність ІФН II. Для ІФН ІІ типу більш притаманні функції регуляторів імунної системи. Існує думка, що ІФН ІІ типу взагалі б не отримали родинної назви, якщо б були відкриті за інших обставин.
Активність інтерферонів вимірюється в міжнародних одиницях (МО). Одна МО відповідає такій кількості інтерферону, що здатна пригнічувати репродукцію вірусу на 50 %.
ІФН І типу практично не руйнуються при кислих значеннях рН середовища (рН 2,2–2,0), що у виробництві препаратів ІФН широко використовується на етапах виділення та очищення.
Антигенні властивості в усіх ІФН I та II типів виражені слабо, у зв’язку з чим антитіла виробляються в організмі тільки після багаторазової імунізації та за особливих умов.
Інтерферони III типу представлені трьома цитокінами — ІФН-λ1, ІФН-λ2, ІФН-λ3, більш відомими як інтерлейкін 28А (IL-28A), інтерлейкін 28В –(IL-28A/B) та інтерлейкін 29 (IL-29). ІФН III були відкриті в 2003 р. двома незалежними групами вчених — Kotenko S.V., Gallagher G.B. та Sheppard G. et al. Філогенетично гени для ІФН-λ знаходяться поміж генами ІФН I типу та інтерлейкіну-10 –(IL-10), при цьому ІФН-λ1–3 кодуються трьома різними генами, що розташовані в 19-й хромосомі. Геномна структура ІФН-λ1–3 дуже схожа на геномну структуру IL-10, проте за кількістю амінокислотних залишків і функціональною активністю вони більше нагадують ІФН I типу. Всі ІФН III типу, як і ІФН I типу, виявляють противірусну, протипухлинну та імуномодулюючу активність. ІФН I і III типів продукуються різними типами клітин. Основними клітинами — продуцентами ІФН-λ1–3 в організмі людини є дендритні клітини. ІФН-λ1–3 виявляється в крові людини, в легенях, підшлунковій залозі, плаценті, яєчниках, простаті, тестикулярній тканині [11].
Таким чином, інтерферони різних типів характеризуються певними відмінностями в структурі, клітинами-продуцентами, чутливістю до дії різних фізико-хімічних чинників і за функціональною активністю. Важливо також підкреслити, що в природних умовах при вірусній інфекції синтезуються одночасно два і більше типи інтерферонів. Поміж трьома типами інтерферонів можуть існувати синергічні відношення.
Механізми противірусної дії інтерферонів
Останню чверть ХХ століття, без сумнівів, можна охарактеризувати як одну з найбільш захоплюючих сторінок в історії біологічної науки, повністю присвячену вивченню механізмів противірусної дії інтерферонів. Розв’язання цієї наукової проблеми здавалось ученим надзвичайно перспективним і важливим у плані лікування та профілактики вірусних інфекційних захворювань людини і викликало особливу зацікавленість не тільки у вірусологів, але й у широкого кола клініцистів.
Численними дослідженнями було встановлено, що самі по собі молекули інтерферону не впливають на внутрішньоклітинні процеси безпосередньо. Подібно до гормонів, факторів росту та інших медіаторів міжклітинної взаємодії інтерферони лише взаємодіють з певними рецепторами, розташованими на поверхні клітини. Після зв’язування інтерферону з рецепторами ініціюється ланцюг складних внутрішньоклітинних подій, що розпочинається передачею сигналу до ядра та активацією транскрипції генів, які відповідають за синтез інтерферону. Транскрипція відповідних генів і синтез відповідних білкових продуктів призводять до спрацювання ефекторних внутрішньоклітинних механізмів, що є специфічними для дії інтерферону. В кінцевому підсумку проявляється низка численних ефектів як на клітинному рівні, так і на рівні організму, головним з яких є пригнічення репродукції вірусу в інфікованих клітинах. Чимало ефектів після дії інтерферону на клітини можна спостерігати і в разі відсутності вірусної інфекції. Це, зокрема, стимулювання продукції інших цитокінів, індукція специфічних ферментів, пригнічення проліферації клітин, посилення фагоцитарної активності макрофагів, специфічної цитотоксичності лімфоцитів щодо клітин-мішеней тощо [12–17].
Останніми роками з відкриттям патерн-розпізнавальних рецепторів (pattern recognition receptors — PRRs) були отримані надзвичайно вагомі наукові дані щодо того, як клітина впізнає віруси та чужі нуклеїнові кислоти. Саме за це відкриття в 2011 р. Брюс Бойтлер і Жуль Хоффманн (Bruce Beutler and Jules Hoffmann) отримали Нобелівську премію з фізіології та медицини. До встановлених PRRs наразі віднесені: 1) родина Toll-like-рецепторів із 10 субтипів, що локалізуються на поверхні клітини або на ендосомах і які впізнають вірус та вірусні структури (TLRs); 2) родина RIG-I-подібних рецепторів, що здатні зв’язуватись з РНК-лігандами і розпізнавати віруси різних родин (RLRs); 3) родина NOD-подібних (nucleotide-binding oligomerization domain) рецепторів (NLRs); 4) родина рецепторів, до якої входить рецептор DNA (dependent activator of IFN — regulatory factors (DAI)) та інші неідентифіковані члени. Більше того, стали більш зрозумілими сигнальні шляхи від рецепторів інтерферонів до ядра клітини та механізми активації генів, необхідних для формування захисту клітини від вірусів та інших невірусних патогенних агентів. За останніми науковими даними, у відповідь на вірусну інфекцію епітеліальних клітин або фібробластів індукція інтерферону відбувається у три фази. У першій фазі PRRs вступають у взаємодію з консервативними вірусними структурами (PAMPs — pathogen-associated molecular patterns), що призводить до координованої активації факторів клітинної транскрипції –NF-kB, AP-1 та ІФН-регулюючого фактора-3 –(–IRF-3). Останній індукує продукцію ІФН-β у низьких концентраціях. Всі відомі PRRs передають сигнал через IRF-3 для індукції ІФН I типу. Активація –IRF-3 призводить, у свою чергу, до гомодимеризації та його переміщення з цитоплазми до ядра клітини. Там IRF-3 зв’язується з промотором ІФН-β. У другій фазі відбуваються такі процеси: синтезується ІФН-β і зв’язується з відповідними рецепторами і передає сигнал через Янус-активовану кіназу (JAK) та шляхи активації транскрипції (STAT). Білки, асоційовані з JAK, активуються та по черзі фосфорилюють білки STAT1 та STAT2. Утворені комплекси переміщуються у ядро і запускають транскрипцію інтерферон-стимулюючих генів і продукцію різних субтипів ІФН-α. В третій фазі (фазі ампліфікації) продукується велика кількість різних субтипів ІФН-α та ІФН-β, які пригнічують репродукцію вірусів та їх вихід з інфікованої клітини [18].
Існують також інші сигнальні шляхи для активації інтерферонів. Наприклад, інтерферон індукує транскрипцію гена 2’,5’-олігоаденілат-синтетази (2–5АС), що, в свою чергу, активує рибонуклеазу L, здатну викликати деградацію вірусних РНК і мРНК. Крім того, рибонуклеаза L активує синтез ще одного дуже важливого ферменту — протеїнкінази РКds. Протеїнкіназа фосфорилює α-субодиницю ініціюючого фактора трансляції (eIF2) та блокує ініціацію трансляції, як наслідок, блокується трансляція і вірусних мРНК, і клітинних мРНК. Отже, руйнування вірусних мРНК та блокування стадії ініціації трансляції забезпечують універсальність механізму противірусної дії інтерферонів для вірусів з будь-яким геномом [5, 10, 12, 16].
Препарати інтерферонів та їх противірусна активність
Інтерферони, що зараз у світі виробляють фармацевтичні компанії, умовно поділені за типом активного компонента на ІФН-α, ІФН-β, ІФН-γ, а за способом виготовлення — на природні (препарати першого покоління) та рекомбінантні (препарати другого покоління). Перші природні інтерферони медичного призначення були отримані практично відразу ж після відкриття А. Айзекса та Ж. Лінденманна. Уже в 1961 р. було проведено перше клінічне дослідження з використанням препарату природного ІФН, одержаного в лабораторії фірми Wellcome Ltd. Звичайно, перші препарати природних інтерферонів не відрізнялись високою противірусною активністю та рівнем стандартизації. До того ж на початку 60-х років природні інтерферони одержували з лейкоцитів донорської крові. І сьогодні природні ІФН-α, як правило, отримують при інфікуванні вірусами лімфобластоїдних клітин людини або лейкоцитів крові донорів. Для продукції природних ІФН-β використовують суперіндукцію культур фібробластів за допомогою синтетичних індукторів. Застосовують також методи, що дозволяють підвищити вихід природних інтерферонів, покращити ефективність очищення та концентрування кінцевого продукту. Проте останніми рокамии все більше уваги приділяється рекомбінантним препаратам, розробленим за допомогою генно-інженерних технологій (наприклад, з використанням гена ІФН-α2b людини та E.coli як продуцента). Відзначається стрімке розширення масштабів їх використання при скороченні виробництва природних інтерферонів, що значною мірою обумовлено дефіцитом і високою вартістю сировини (донорська кров) для їх виробництва. Крім рекомбінантних випускаються консенсусні інтерферони. Ці препарати являють собою нові задані комбінації амінокислотних послідовностей відомих субтипів ІФН-α. Такі консенсусні інтерферони можуть бути більш ефективними, ніж рекомбінантні. Новими є препарати пролонгованої дії з покращеними фармакокінетичними властивостями, що досягається шляхом приєднання ланцюга інертного полімеру, а саме поліетиленгліколю з молекулярною масою 12 або 40 кДа, до молекули ІФН (пегільовані інтерферони). Такі препарати характеризуються принципово новими параметрами фармакокінетики та фармакодинаміки, що дозволяє підтримувати відносно сталу концентрацію інтерферону в організмі впродовж усього проміжку часу між послідовними введеннями препарату, що здійснюються підшкірно приблизно один раз на тиждень [19, 20].
Таким чином, сучасні медичні препарати інтерферонів поділяються на природні, рекомбінантні, консенсусні та пегільовані інтерферони. До природних віднесені: альфаферони (ІФН-α), бетаферони (ІФН-β) та гаммаферони (ІФН-γ). Препарати другого покоління представлені рекомбінантними інтерферонами ІФН-α2а, ІФН-α2b, ІФН-α2c, ІФН-β та ІФН-γ. В цілому перелік природних альфаферонів, бетаферонів і гаммаферонів, що використовується в медичній практиці, невеликий. Більшість препаратів рекомбінантних ІФН-α відносяться до субтипів ІФН-α2а, ІФН-α2b або ІФН-α2c.
Перспективи застосування препаратів інтерферонів з позицій сучасної медичної практики розглядаються в трьох напрямках: вірусні інфекційні захворювання, онкологічні захворювання та інші види патології. Найбільш широко досліджені в плані їх клінічної ефективності лікарські форми природних і рекомбінантних препаратів інтерферонів при вірусних інфекціях. Це тисячі досліджень клінічної ефективності лікарських препаратів інтерферонів при лікуванні герпетичних кератитів, кератокон’юнктивітів, генітального герпесу, оперізуючого лишаю та вітряної віспи; гострих і хронічних гепатитів В і С; грипу та інших гострих респіраторно-вірусних інфекцій. Менше вивчено клінічну ефективність препаратів інтерферону при ВІЛ-інфекції/СНІДі, папіломавірусних інфекціях (ювенільний папіломатоз, генітальні бородавки), сказі, епідемічному паротиті, ротавірусних діареях [22–31]. До цього переліку важливо додати дослідження щодо застосування інтерферонів при післяопераційних ускладненнях вірусної природи при трансплантації органів на тлі лікування імунодепресантами, при гнійно-септичних захворюваннях у новонароджених та при різних захворюваннях бактеріальної етіології.
У цілому препарати інтерферонів показали себе як перспективні лікарські засоби, що мають широкий спектр противірусної активності та не викликають формування резистентних форм вірусів на відміну від багатьох відомих противірусних хіміопрепаратів. Інтерферони — це перша лінія захисту від вірусів та інших носіїв чужорідної інформації. Будучи одними з провідних чинників природного імунітету, вони синтезуються майже відразу (в перші 1–2 години) після проникнення вірусу в організм, клітину, і це негайна відповідь на проникнення. Встановлено, що інтерферони впливають на більшість реакцій інфекційного імунітету, але спрямованість цього впливу залежить від стану організму, дози та кратності введення лікарського засобу, а також від індивідуальних особливостей пацієнта. Успіх лікування залежить від правильності вибору курсу і лікарської форми інтерферонів, які в сучасній медичній практиці займають одне з провідних місць у хіміотерапії вірусних інфекцій. Безумовно, можливості застосування лікарських препаратів інтерферонів не вичерпуються тільки профілактикою та лікуванням вірусних інфекцій. В інтерферонів велике майбутнє у терапії злоякісних новоутворень та інших видів патології людини, а подальші наукові дослідження у найближчі роки ще відкриють нові перспективи їх застосування в теорії і практиці сучасної медицини.
Список литературы
1. Frederick A. Murphy. The foundations of virology. Discoverers and discoveries. Inventors and inventions // Developers and technologies. — Texas, USA, 2014. — 287 р.
2. Isaacs A., Lindenmann J. Virus interference. I. The interferon // Proc. Roy Soc. London Set. B. — 1957. — Vol. 147. — P. 258-273.
3. Феннер Ф., Мак-Ослен Б., Мимс С., Сэмбрук Дж., Уайт Д. Биология животных / Пер. с англ. — М.: Мир, 1977. — Т. 1. — С. 419-442.
4. Дзюблик И.В. Химиотерапия вирусных инфекций // Укр. химиотерапевтический журнал. — 1999. — № 3. — С. 68-72.
5. Посібник з хіміотерапії вірусних інфекцій: Навчально-методичний посібник для лікарів / За ред. І.В. Дзюблик. — К., 2004. — 176 с.
6. Ершов Ф.И. Система интерферона в норме и при патологии. — М.: Медицина, 1996. — 238 с.
7. Мейл Д. Иммунология / Мейл Д., Бростофф Дж., Рот А., Ройтт А.: Пер. с англ. — М.: Логосфера, 2007. — 568 с.
8. Дранник Г.М. Клиническая иммунология и аллергология. — К., 2010. — 552 с.
9. Медицинская вирусология: Руководство / Под ред. Д.К. Львова. — М.: ООО «Медицинское информационное агентство», 2008. — 656 с.
10. Вирусология: Учебное пособие для медицинских вузов / Под ред. А.Г. Букринской. — 2-е изд., стереотип. — 364 с.
11. Григорян С.С. Интерфероны лямбда (3-й тип интерферонов) и вирусные инфекции // Сб. мат. науч.-практ. конф. «Интерферон‑2011». — М., 2012. — С. 63-73.
12. Ершов Ф.И. Интерфероны и их индукторы (от молекул до лекарств). — М.: ГЭОТАР-Медиа, 2005. — 368 с.
13. Ершов Ф.И., Романцов М.Г. Лекарственные средства, применяемые при вирусных заболеваниях. — М.: ГЭОТАР-Медиа, 2005. — 368 с.
14. Белоцкий С.М., Спивак Н.Я. Иммунотропные препараты. — К.: Фитосоциоцентр, 2008. — 215 с.
15. Спивак Н.Я., Лазаренко Л.Н., Михайленко О.Н. Интерферон и система мононуклеарных фагоцитов. — К.: Фитосоцио–центр, 2002. — 164 с.
16. Абатуров А.Е. Роль интерферонов в защите респираторного тракта. Ч. 2. Механизм действия интерферонов / А.Е. Абатуров, Е.И. Юлиш // Здоровье ребенка. — 2007. — № 6 (9).
17. Киселев О.И., Ершов Ф.И., Деева Э.Г. Интерферон-γ: новый цитокин в клинической практике. — М.: Димиттрейд График Групп, 2007. — 348 с.
18. Ершов Ф.И., Наровлянский А.Н. Основные итоги изучения системы интерферона к 2011 году // Сб. мат. науч.-практ. конф. «Интерферон‑2011». — М., 2012. — С. 14-35.
19. Никитин И.Г., Сторожаков Г.И. Пегилированные лекарственные препараты: современное состояние проблемы и перспективы. Вирусные гепатиты: достижения и перспективы // Информационный бюллетень. — 2001. — № 3(13). — С. 3-8.
20. Петров В.И., Белан Э.Б. Противовирусные средства. — М.: ГЭОТАР-Медиа, 2012. — 244 с.
21. Ершов Ф.И. Антивирусные препараты. — М.: Медицина, 1998. — 192 с.
22. Дзюблик І.В., Харченко Н.В., Порохницький В.Г., Вороненко С.Г. Парентеральні вірусні гепатити: Навчальний посібник / За ред. І.В. Дзюблик. — К., 2005. — 168 с.
23. Блохіна Н. Нові стратегії інтерферонотерапії хворих на хронічний гепатит С // Медицина світу. — 2001. — Спец. вип. «Педіатрія». — С. 38-45.
24. Марушко Ю.В., Голубовська Ю.Є., Марушко Є.Ю. Застосування рекомбінантного інтерферону альфа‑2b у педіатричній практиці // Здоровье ребенка. — 2016. — № 2(70). — С. 81-86.
25. Няньковський С.Л., Няньковська О.С., Яцула М.С. Клінічні особливості використання інтерферонів при лікуванні ГРВІ у дітей // Здоровье ребенка. — 2015. — № 5(64). — С. 7-12.
26. Юлиш Е.И. Цитомегаловирусная инфекция у детей: подходы к лечению при различном течении инфекционного процесса // Здоровье ребенка. — 2015. — № 4(63). — С. 7-14.
27. Шадріна В.С. Роль імуномодуляторів у лікуванні патології шийки матки // Здоровье женщины. — 2014. — № 2(88). — С. 38-40.
28. Вдовиченко Ю.П., Гопчук Е.Н. Интерферон альфа‑2b рекомбинантный — местное применение в схемах лечения патологии шейки матки // Здоровье женщины. — 2012. — № 9(88). — С. 78-80.
29. Бекетова Г.В. Интерфероны в лечении острых респираторных инфекций у детей // Ліки України. — 2011. — № 3(149). — С. 106-109.
30. Дзюблик І.В., Вороненко С.Г., Міроненко А.П., Виноград Н.О. Діагностика, лікування та профілактика грипу / За ред. І.В. Дзюблик. — К.: Медкнига, 2011. — 190 с.
31. Дзюблик І.В., Ковалюк О.В. Папіломавірусна інфекція: погляд на проблему лікаря-вірусолога // Український хіміотерапевтичний журнал. — 2012. — № 1–2(25). — С. 98-106.
/80.jpg)

/80_2.jpg)
/81.jpg)