Украинский журнал хирургии 1-2 (30-31) 2016
Вернуться к номеру
Хірургічна корекція травм сечоводу при гінекологічних операціях
Авторы: Серняк Ю.П.(1), Рощин Ю.В.(2), Слободянюк Є.М.(3), Фуксзон О.С.(1), Мех В.А.(3) - (1) Міський урологічний центр, Олександрівська клінічна лікарня, м. Київ, Україна; (2) Харківська медична академія післядипломної освіти, м. Харків, Україна; (3) Донецький національний медичний університет ім. М. Горького, м. Лиман, Україна
Рубрики: Хирургия
Разделы: Клинические исследования
Версия для печати
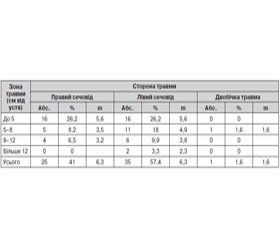
Частота пошкодження сечоводу при гінекологічних втручаннях, за даними різних авторів, становить 0,5–30 %, у середньому — 1–12 %. Існує велике різноманіття методів хірургічного лікування пошкоджень сечоводу, у тому числі із залученням сучасних малоінвазивних технологій. Вид хірургічного втручання залежить від тяжкості, протяжності та локалізації травми, а також загального стану пацієнтки. Проте істинні кордони поразки сечоводу часто відрізняються від візуально сприйманих, що може стати причиною невдачі хірургічної корекції. Інтраопераційне застосування електроуретерографії дозволяє об’єктивно визначити межі поразки сечоводу і, відповідно, рівень його резекції. У той же час оцінки застосування інтраопераційної електроуретерографії при виборі методу корекції травми сечоводу в літературі немає. Мета роботи: поліпшення результатів лікування травм сечоводу при акушерсько-гінекологічних операціях шляхом удосконалення методів хірургічної корекції. Матеріал та методи. В основу дослідження покладено результати клінічних спостережень 60 пацієнток, яким виконана хірургічна корекція травми сечоводу. Основна група хворих представлена 23 (38,3 ± 12,3 %) пацієнтками, у яких корекція травм виконувалася лапароскопічним і класичним відкритим доступом із застосуванням електроуретерографії. У першій контрольній групі оперативне лікування проведено 21 (35,0 ± 12,1 %) хворій, яким виконувалися аналогічні операції, але без застосування електроуретерографії. У другій контрольній групі у 16 (26,7 ± 11,2 %) пацієнток застосована уретероскопія з установкою JJ-стенту, а обов’язковою умовою була відсутність дефекту стінки сечоводу. Результати та обговорення. Результати лікування оцінювалися з урахуванням суб’єктивних та об’єктивних критеріїв за трибальною системою — як добрі, задовільні та незадовільні. Серед 16 пацієнток, яким виконувалася уретероскопія зі стентуванням сечоводу в 11 (68,8 ± 22,7 %) хворих результати оцінювалися нами як добрі. У 5 (31,2 ± 22,7 %) хворих результати відповідають задовільним. Поганих результатів не спостерігалося, що пов’язано з первісним легким ступенем пошкодження сечоводу в даної групи пацієнток (Grade I відповідно до класифікації Organ Injury Scaling System). У 21 пацієнтки, яким виконувалися операції лапароскопічним і відкритим доступом без застосування електроуретерографії, виявлено, що в 8 (38,1 ± 20,7 %) хворих результати відповідають добрим, у 9 (42,9 ± 21,1 %) хворих результати оцінювалися нами як задовільні, а в 4 (19,0 ± 16,8 %) пацієнток розцінені як погані. Серед 23 пацієнток, яким виконувалися операції із застосуванням електроуретерографії, у 20 (87,0 ± 13,7 %) хворих результати відповідають добрим. У 3 (13,0 ± 13,8 %) пацієнток результати лікування задовільні. Поганих результатів у даній групі хворих не спостерігалося. Висновки. Інтраопераційне застосування електроуретерографії під час реконструктивно-відновних операцій дозволило знизити погані результати на 19 % порівняно з аналогічними операціями без застосування даного методу. Це пояснюється тим, що інтраопераційна електроуретерографія дає можливість об’єктивно визначити істинні кордони функціонально активного сечоводу та виконати його резекцію в межах здорових тканин, що виключає формування анастомозу з неповноцінним у функціональному значенні сечоводом. Зі свого боку, ендоскопічна корекція травм сечоводу за допомогою уретероскопії та стентування має високу ефективність за умови, що застосовується у хворих із легким ступенем травми (Grade I відповідно до класифікації Organ Injury Scaling System).
Частота повреждения мочеточника при гинекологических вмешательствах, по данным различных авторов, составляет 0,5–30 %, в среднем — 1–12 %. Существует большое разнообразие методов хирургического лечения травм мочеточника, в том числе с привлечением современных малоинвазивных технологий. Вид хирургического вмешательства зависит от тяжести, протяженности и локализации травмы, а также общего состояния пациентки. Однако истинные границы поражения мочеточника часто отличаются от визуально воспринимаемых, что может стать причиной неудачи хирургической коррекции. Интраоперационное применение электроуретерографии позволяет объективно определить границы поражения мочеточника и, соответственно, уровень его резекции. В то же время оценки применения интраоперационной электроуретерографии при выборе метода коррекции травмы мочеточника в литературе нет. Цель работы: улучшение результатов лечения травм мочеточника при акушерско-гинекологических операциях путем усовершенствования методов хирургической коррекции. Материалы и методы. В основу исследования положены результаты клинических наблюдений 60 пациенток, которым выполнена хирургическая коррекция травмы мочеточника. Основная группа больных представлена 23 (38,3 ± 12,3 %) пациентками, у которых коррекция травм выполнялась лапароскопическим и классическим открытым доступом с применением электроуретерографии. В первой контрольной группе оперативное лечение проведено 21 (35,0 ± 12,1 %) больной, которым выполнялись аналогичные операции, но без применения электроуретерографии. Во второй контрольной группе у 16 (26,7 ± 11,2 %) пациенток выполнена уретероскопия с установкой JJ-стента, а обязательным условием было отсутствие дефекта стенки мочеточника. Результаты и обсуждение. Результаты лечения оценивались с учетом субъективных и объективных критериев по трехбалльной системе как хорошие, удовлетворительные и плохие. Среди 16 пациенток, которым выполнялась уретероскопия со стентированием мочеточника, у 11 (68,8 ± 22,7 %) больных результаты оценивались нами как хорошие. У 5 (31,2 ± 22,7 %) больных результаты соответствуют удовлетворительным. Плохих результатов не наблюдалось, что связано с изначально легкой степенью повреждения мочеточника у данной группы пациенток (Grade I соответственно классификации Organ Injury Scaling System). У 21 пациентки, которым выполнялись операции лапароскопическим и открытым доступом без применения электроуретерографии, выявлено, что у 8 (38,1 ± 20,7 %) больных результаты соответствуют хорошим, у 9 (42,9 ± 21,1 %) больных результаты оценивались нами как удовлетворительные, а у 4 (19,0 ± 16,8 %) пациенток расценены как плохие. Среди 23 пациенток, которым выполнялись операции с применением электроуретерографии, у 20 (87,0 ± 13,7 %) больных результаты соответствуют хорошим. У 3 (13,0 ± 13,8 %) пациенток результаты лечения удовлетворительные. Плохих результатов у данной группы больных не наблюдалось. Выводы. Интраоперационное применение электроуретерографии во время реконструктивно-восстановительных операций позволило снизить плохие результаты на 19 % в сравнении с аналогичными операциями без применения данного метода. Это объясняется тем, что интраоперационная электроуретерография дает возможность объективно определить истинные границы функционально активного мочеточника и выполнить его резекцию в пределах здоровых тканей, что исключает формирование анастомоза с неполноценным в функциональном отношении мочеточником. В свою очередь, эндоскопическая коррекция травм мочеточника при помощи уретероскопии и стентирования имеет высокую эффективность при условии, что применяется у больных с легкой степенью травмы (Grade I соответственно классификации Organ Injury Scaling System).
According to different authors the rate of ureteral injuries during gynecological interventions is 0.5–30 %, on the average 1–12 %. There is a great variety of methods of surgical treatment of ureteral injuries, including modern minimally invasive technologies. Type of surgery depends on the severity, extention and location of injury, and the general condition of the patient. But the real borders of ureteral lesion often differ from the visual ones, which may cause failures of surgical treatment. Intraoperative application of electroureterography can objectively determine the limits and discordance of the lesion and therefore the level of ureter resection. At the same time the literature have not data about intraoperative assessment by electroureterography while choosing a method of correction of ureteral injury. Objective. To improve the results of treatment of ureteral injury during obstetric-gynecological intervention by improving methods of surgical correction. Materials and methods. The research is based on the results of clinical observations of 60 patients who were performed surgical correction of ureteral injury. The main group involved 23 (38.3 ± 12.3 %) patients undergone laparoscopy and classical open access with electroureterography. In the first control group operative treatment consisted of 21 (35.0 ± 12.1 %) patients who were performed a similar surgery but without electroureterography. In the second control group of 16 (26,7 ± 11,2 %) patients ureteroscopy was made with JJ-stent installing, and mandatory condition was the absence of ureteral wall lesion. Results and discussion. The results of treatment were assessed considering the subjective and objective criteria by the three-points system as good, satisfactory and unsatisfactory. Among the 16 patients who were performed ureteroscopy with ureteral stenting, in 11 (68.8 ± 22.7 %) patients the results were evaluated as good. Five (31.2 ± 22.7 %) patients had satisfactory results. Bad results were observed in no one, it is connected with initially mild ureteral injury in this group of patients (grade I, by Organ Injury Scaling System). Among 21 patients who performed laparoscopic surgery and by open access without using of electroureterography 8 (38.1 ± 20.7 %) patients were found to have good results. The results of 9 (42.9 ± 21.1 %) patients were evaluated as satisfactory, and 4 (19.0 ± 16.8 %) patients had bad results. Among the 23 patients who were performed surgery with electroureterography, 20 (87.0 ± 13.7 %) patients had good results. 3 (13.0 ± 13.8 %) patients had satisfactory results. Bad results were observed in no one. Conclusions and practice recommendations. The intraoperative usage of electroureterography during the reconstructive operations has reduced the poor results by 19% compared to similar transactions without this method. This could be explained by the potential of intraoperative electroureterography to determine objectively the ureter real borders of functionally active ureter and perform its resection within healthy tissue, which eliminates the formation of anastomosis of defective ureter. Whereas endoscopic ureteral injury correction using ureteroscopy and stenting is highly effective if used in patients with mild injuries (grade I, by Organ Injury Scaling System).
травма сечоводу, лікування, гінекологічні операції, електроуретерографія.
травма мочеточника, лечение, гинекологические операции, электроуретерография.
ureteral injury, treatment, gynecological surgery, electroureterography.
Статтю опубліковано на с. 48-54
Травма сечоводу здебільшого (73 %) відбувається при виконанні гінекологічних операцій, що пов’язане з топографо-анатомічними зв’язками внутрішніх статевих органів і сечовивідних шляхів [3, 7, 13, 15, 16]. Частота пошкодження сечоводу при гінекологічних втручаннях, за даними різних авторів, становить 0,5–30 %, у середньому — 1–12 %, і залежить від складності оперативного втручання [9, 12, 14]. Найбільш часте ушкодження сечоводу відбувається при гістеректомії — 54 %. Характерним місцем травми при цьому є зона перехрещення сечоводу з клубовими судинами [11]. Особливо висока вірогідність пошкодження сечоводу за наявності спайкового процесу, порушення топографо-анатомічних зв’язків, вираженої кровотечі під час операції.
Матеріали та методи
Результати та обговорення
Висновки
1. Морозов А.В. Прямой уретероэнтероанастомоз (вперед в прошлое?) / А.В. Морозов, К.А. Павленко // Урология. — 2004. — № 4. — С. 23-27.
2. Мысько С.Я. Ятрогенная травма мочеточника — оптимальный выбор лечения / С.Я. Мысько // Проблеми безперервної медичної освіти та науки. — 2011. — № 3. — С. 80-85.
3. Рентгеноэндоскопическое лечение повреждений мочеточников после акушерско-гинекологических операций / А.Г. Мартов, С.А. Маслов, Р.В. Салюков [и др.] // Урология. — 2006. — № 1. — С. 11-15.
4. Стусь В.П. Отдаленные результаты лечения артифициальных повреждений мочеточника во время гинекологических и акушерских вмешательств / В.П. Стусь, Н.Н. Моисеенко, Н.В. Дубовская // Урология. — 2014. — Т. 18, № 2(69). — С. 11-19.
5. Эндотомия в лечении стриктур верхних мочевых путей / А.Г. Мартов, Б.Л. Гущин, Д.В. Ергаков [и др.] // Урология. — 2002. — № 5. — С. 39-44.
6. Clinical evaluation of double-pigtail stent inpatients with upper urinary tract diseases: report of 2685 cases / P. Нао, W. Li, C. Song [et al.] // J. Endourol. — 2008. — Vol. 22, № l. — P. 65-70.
7. European Association of Urology Guidelines. — Arnhem (The Netherlands), 2008. — 256 p.
8. Iatrogenic ureteric injuries: incidence, aetiological factors and the effect of early management on subsequent outcome / K. Al-Awadi, E. O. Kehinde, A. Al-Hunayan [et al.] // Int. Urol. Nephrol. — 2005. — Vol. 37, № 2. — P. 235-241.
9. Incidence and management of gynecological-related ureteric injuries / P. Asian, A. Brooks, M. Drummond [et al.] // J. Obstet. Gynaecol. — 1999. — Vol. 39, № 2. — P. 178-181.
10. Injuries of the renal pelvis and ureter. Diagnosis and management / M. Trottmann, S. Tritschler, A. Graser [et al.] // Urologe A. — 2007. — Vol. 46, № 8. — P. 927-934.
11. Laparoscopy-assisted ureter interposition by ileum / O.A. Castillo, R. Sanchez-Salas, G. Vitagliano [et al.] // J. Endourol. — 2008. — Vol. 22, № 4. — P. 687-692.
12. Mendez L.E. Iatrogenic injuries in gynecologic cancer surgery / L.E. Mendez // Surg. Clin. North Am. — 2001. — Vol. 81. — P. 897-923.
13. Ureteral injuries during gynecologic surgery: treatment with a minimally invasive approach / E.N. Liatsikos, D. Karnabatidis, K. Katsanos [et al.] // J. Endourol. — 2006. — Vol. 20, Issue 12. — P. 1062-1067.
14. Ureteral injury in gynecologic surgery: a 5-year review in a community hospital / J.H. Park, J.W. Park, K. Song [et al.] // Korean J. Urol. — 2012. — Vol. 53, № 2. — P. 120-125.
15. Ureteral injuries in gynaecologic surgery / S. Ghozzi, R. Khiari, K. Mlik [et al.] // Tunis Med. — 2006. — Vol. 84, Issue 10. — P. 617-620.
16. Ureteral injury in gynecologic laparoscopies / J.S. Gao, J.H. Leng, J.H. Lang [et al.] // Zhonghua Fu Chan KeZaZhi. — 2004. — Vol. 39, Issue 5. — P. 311-314.

/50.jpg)
/52.jpg)