Статтю опубліковано на с. 11-14
Актуальність проблеми
Оклюзійна хвороба периферійного артеріального русла являє собою поширений прояв системного атеросклерозу, асоціюється з високим ризиком серцево-судинної патології [6]. Сучасні хірургічні технології дали клініцистам широкі можливості в лікуванні атеросклеротичного ураження аорти та магістральних артерій нижніх кінцівок [2]. Проте зберігається високий рівень як ранніх, так і пізніх ускладнень після оперативних втручань на артеріальному руслі [3]. Серед них тромбози сегмента реконструкції — 20,9 % [4] та артеріальні тромбози раннього післяопераційного періоду — 2,4 % [7]. Реконструктивні операції супроводжуються розвитком післяопераційних венозних тромботичних ускладнень [1], частота яких знаходиться в межах від 1,8 до 20 % [8]. Післяопераційна тромботична оклюзія венозного русла погіршує перебіг післяопераційного періоду в пацієнтів після артеріальної реконструкції, посилюється ішемія нижньої кінцівки, можливі тромбози сегмента реконструкції [5]. Наведене вказує на необхідність звернути увагу на зміни згортальної системи, ініційовані оперативним втручанням.
Мета роботи: вивчити інтраопераційний стан системи гемостазу з метою опрацьовування напрямів впливу на отримані зміни гемокоагуляції.
Матеріал і методи
У роботу включено дані 86 пацієнтів, які були оперовані в судинному відділенні КЗТОР «Тернопільська університетська лікарня» з приводу атеросклеротичного ураження аорти та магістральних артерій нижніх кінцівок протягом 2014–2015 років.
За ступенем хірургічного стресу, який визначали за рівнім глікемії та кортизолу в крові за 1 год до оперативного втручання, на травматичному етапі оперативного втручання та на 24-ту год післяопераційного періоду пацієнти були розподілені на 3 групи: А — пацієнти із високим рівнем хірургічного стресу — 13 спостережень, В — пацієнти із помірним рівнем хірургічного стресу — 31 спостереження, С — пацієнти із низьким рівнем хірургічного стресу — 42 спостереження.
У групу А включено 13 пацієнтів, з них 8 спостережень — аневризма інфраренального сегмента черевного відділу аорти та 5 хворих з атеросклеротичною оклюзією біфуркації аорти й стенотичним ураженням магістральних артерій нижніх кінцівок, хронічна ішемія нижніх кінцівок (ХІНК) ІІБ-ІІІА за Покровським.
У групу В увійшов 31 пацієнт, з них 16 пацієнтів із атеросклеротичною оклюзією біфуркації аорти та стенотичним ураженням магістральних артерій нижніх кінцівок, ХІНК ІІБ-ІІІА за Покровським. В 11 спостереженнях діагностована лівобічна атеросклеротична оклюзія клубового сегмента, в 4 — правобічна атеросклеротична оклюзія клубового сегмента, ХІНК ІІБ-ІІІА за Покровським.
У групу С включені 42 пацієнти із стенотично-оклюзивним атеросклеротичним ураженням стегно-підколінно-гомілкового сегмента, ХІНК ІІБ-ІІІА за Покровським.
Чоловіків було 81 (94,19 %), жінок — 6 (6,97 %). Середній вік пацієнтів становив 63,4 ± 6,8 року. Тривалість захворювання — 7,8 ± 3,4 року. Серед супутньої патології захворювання серцево-судинної системи діагностовано у 83 (96,51 %) осіб, патологію дихальної системи — у 34 (38,37 %) пацієнтів.
Для діагностики використовували ультразвукове дуплексне ангіосканування, що проводили за допомогою апарата Ultima PA, Україна («Радмір») із застосуванням лінійного датчика з частотою 7 Мгц і конвексного датчика з частотою 3,5 Мгц, та комп’ютерну томографію в ангіорежимі, яку проводили за допомогою апарата Brilliance CT 64 фірми Philips. Площина зрізів була паралельна орбітомеатальній лінії, крок і товщина — 1–5 мм, загальна кількість зрізів залежала від зросту пацієнта.
Результати та обговорення
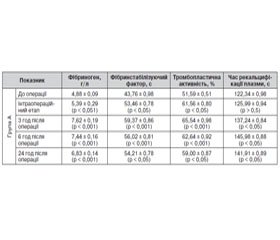
Досліджуючи стан згортальної системи крові, встановили, що на травматичному етапі оперативного втручання вміст фібриногену (ФГ) у крові зріс порівняно з доопераційним періодом на 10,5 % (р < 0,05). Одночасно відмічено підвищення активності фібриностабілізуючого фактора (ФСФ) і тромбопластичної активності (ТПА) на 22,1 % (р < 0,05) і на 19,3 % (р < 0,05) відповідно при утримуванні часу рекальцифікації плазми (ЧРП) на доопераційному рівні (табл. 1).
Оцінюючи подальші зміни згортальної системи, встановили, що на 3-тю год раннього післяопераційного періоду вміст у крові ФГ зріс у 1,4 раза (р < 0,05) порівняно з рівнем ФГ у крові на травматичному етапі. Подібні зміни спостерігали зі сторони ФСФ і ТПА, їх активність підвищилась на 11,1 % (р < 0,05) і 6,5 % (р < 0,5) відповідно порівняно з їх активністю на травматичному етапі. У той же час помічено незначне подовження — на 12,2 % (р < 0,05) — ЧРП порівняно з доопераційним періодом.
Якщо на 6-ту год післяопераційного періоду спостерігалось незначне зниження вмісту ФГ у крові та активності ФСФ, ТПА, то зі сторони ЧРП відмічено подальше його подовження — на 18,5 % (р < 0,05) порівняно з доопераційним періодом.
Під кінець першої доби післяопераційного періоду спостерігали зниження рівня показників, що характеризують стан згортальної системи, порівняно з їх рівнем на 6-ту год після хірургічного втручання. Воно було несуттєвим: вміст у крові ФГ знижувався лише на 4,3 % (р < 0,5), активність ФСФ, ТПА — на 3,2 % (р < 0,5) і 5,8 % (р < 0,5) відповідно. Зі сторони показника ЧРП відзначено малопомітне його (0,6 %) вкорочення. Наведені зміни в показниках згортальної системи крові можна трактувати як початок дії препарату НМГ, призначеного (6 або 12 год після хірургічного втручання) згідно з галузевими протоколами (табл. 1).
Що стосується двох інших груп пацієнтів (В і С), то рівень показників згортальної системи та їх зміни під впливом оперативного втручання відповідали ступеню прояву хірургічного стресу. Показники згортальної системи в пацієнтів із помірним рівнем хірургічного стресу (група В) були нижчими на 5,2–5,9 %, ніж у пацієнтів із високим рівнем хірургічного стресу. Показники згортальної системи в пацієнтів із низьким рівнем хірургічного стресу (група С) були нижчими на 4,4–5,2 %, ніж у пацієнтів з помірним рівнем хірургічного стресу.
Складові агрегаційного стану крові активно реагували на хірургічне втручання (табл. 2). Так, показник кількості тромбоцитів на інтраопераційному етапі незначно змінювався в бік його зниження — на 5,4 % (р < 0,5), а під кінець першої доби він був нижчим вже на 17,8 % (р < 0,05). Щодо швидкості агрегації тромбоцитів, то вона на інтраопераційному етапі хірургічного втручання сповільнюється порівняно з доопераційним періодом на 22,4 % (р < 0,05), а під кінець першої доби зростає в 1,6 (р < 0,05) раза. Подібні зміни спостерігали зі сторони ступеня агрегації тромбоцитів (САТ); на інтраопераційному етапі він порівняно із доопераційним рівнем знижувався в 1,3 (р < 0,05) раза, а на 24-ту год післяопераційного періоду порівняно з інтраопераційним етапом зростав у 1,6 (р < 0,05) раза. Що стосується часу агрегації тромбоцитів (ЧАТ), то протягом часу спостереження його показник коливався як у бік подовження, так і в бік вкорочення, вказані зміни були незначними й невірогідними (табл. 2).
/13.jpg)
При проведенні аналізу активності фібринолітичної системи крові встановлено депресивні прояви вказаної ланки гемостазу на інтраопераційному та ранньому післяопераційному періодах хірургічного процесу. Помірна її активація спостерігалась наприкінці першої доби післяопераційного періоду. Остання відбувалась за рахунок підвищення в крові рівня плазміну й плазміногену на фоні вкорочення часу лізису еуглобулінових згустків.
Підсумуємо отримані результати дослідження: оперативне втручання супроводжується посиленням гіперкоагуляційних та агрегаційних властивостей системи крові, їх рівень досягає максимальних значень на кінцевому етапі хірургічного втручання або ж у перші 2–3 год післяопераційного періоду. Вказані процеси відбуваються на фоні депресії фібринолітичної ланки гемостазу й таким чином створюються умови для формування тромботичного процесу у венозній системі. Усе це відбувається в проміжку часу між закінченням операції до введення першої ін’єкції НМГ (тромбопрофілактика). Потрібно вказати, що НМГ переважно діє на Ха-фактор гемокоагуляційного каскаду, тоді як на цей час наростають гіперкоагуляційні властивості крові за рахунок тромбін-фібриногенової фракції (ІІа-фактор). А на ІІа-фактор гемокоагуляційного каскаду переважно діє НФГ.
Вищевказане вимагає призначати тромбопрофілактику при реконструктивних оперативних втручаннях з приводу атеросклеротичного ураження аорти й магістральних артерій нижніх кінцівок, при якій необхідно вводити НФГ, що переважно діє на ІІа-фактор, відразу після закінчення оперативного втручання внутрішньовенним шляхом та в перші 3–5 діб післяопераційного періоду з дозуванням, що визначається рівнем хірургічного стресу, і продовжувати тромбопрофілактику НМГ, що переважно діють на Ха-фактор, згідно з галузевими протоколами.
Висновок
Тромбопрофілактику при реконструктивних оперативних втручаннях з приводу атеросклеротичного ураження аорти й магістральних артерій нижніх кінцівок необхідно проводити, застосовуючи введення НФГ, що переважно діє на ІІа-фактор, відразу після закінчення оперативного втручання внутрішньовенним шляхом та в перші 3–5 діб післяопераційного періоду й продовжувати тромбопрофілактику НМГ, що переважно діють на Ха-фактор, згідно з галузевими протоколами.
Список литературы
1. Вайда А.Р. Венозні тромбози після артеріальних реконструкцій / А.Р. Вайда, П.Я. Боднар // Шпитальна хірургія. — 2009. — № 2. — С. 72-74.
2. Белов Ю.В., Степаненко А.Б. Повторные реконструктивные операции на аорте и магистральных артериях. — М.: Медицинское информационное агентство, 2009. — 176 с.
3. Губка В.А. Повторные реконструкции у больных облитерирующим атеросклезом с отдаленными осложнениями / В.А. Губка // Патология. — 2012. — № 2. — С. 43-45.
4. Кобза І.І. Хірургічне лікування пацієнтів при інфікуванні протезів аортостегнової зони / Кобза І.І., Сорока Т.Г., Жук Р.А. // Клінічна хірургія. — 2004. — № 4–5. — С. 89-90.
5. Ковальчук Л.Я. Первентивна реконструкція дистального анастомозу аорто/клубово-стегнового алошунта/протеза у віддаленому післяопераційному періоді / Ковальчук Л.Я., Венгер І.К., Вайда А.Р., Костів С.Я. // Шпитальна хірургія. — 2014. — № 4. — С. 27-29.
6. Ковальчук Л.Я., Венгер І.К., Левицький А.В., Шідловський О.В., Шкробот Л.В. Гемостаз при реконструкції атеросклеротичної оклюзії артерій стегно-підколінного сегмента // Шпитальна хірургія. — 2001. — № 3. — С. 8-13.
7. Русин В.І. Повторні реконструктивні операції при реоклюзії судин стегно-підколінно-тібіального сегмента / Русин В.І., Корсак В.В., Левчан Ю.А. // Клінічна хірургія. — 2004. — № 4–5. — С. 104-105.
8. Angelides N.S. Deep venous thrombosis in patients having aorto-iliac reconstruction / N.S. Angelides et al. // British Journal of Surgery. — 1977. — V. 64. — P. 517-518.

/12.jpg)
/13.jpg)