Журнал «Травма» Том 17, №3, 2016
Вернуться к номеру
Консервативне лікування порушень метаболізму кісткової тканини у хворих на вітамін-D-залежний рахіт I типу
Авторы: Марциняк С.М. - ДУ «Інститут травматології та ортопедії НАМН України», м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Мета: визначити вплив консервативної терапії на генетично зумовлені порушення метаболізму кісткової тканини у хворих на вітамін-D-залежний рахіт (ВDЗР) І типу. Матеріал і методи. На базі консультативно-поліклінічного відділу ДУ «Інститут травматології та ортопедії НАМНУ» було обстежено та проліковано 48 пацієнтів із діагнозом «вітамін-D-залежний рахіт І типу». Консервативне лікування пацієнтів з рахітоподібними захворюваннями проводилось в 4 етапи. Перший етап включав в себе повне обстеження пацієнта на кальцій, фосфор крові та сечі, визначення рівня кальцидіолу та кальцитріолу крові, показників паратиреоїдного гормона та остеокальцину, а також маркера кісткоутворення P1NP і остеорезорбції B-CTx. На першому етапі в обов’язковому порядку діти проходили генетичне дослідження для виявлення змін (поліморфізму) в алелях рецепторів до вітаміну D та колагену першого типу. Обстеження на наступних етапах проводилось в повному обсязі, окрім генетичних досліджень. Результати. Всебічне вивчення метаболізму вітаміну D і біохімічних показників життєдіяльності кісткової тканини у хворих на ВDЗР І типу дозволило впритул підійти до розуміння деяких питань патогенезу та сутності остеомаляційних і в подальшому остеопоротичних змін різного ступеня, об’єктивувати ці зміни у відповідних показниках біохімічного дослідження та залежно від змін розробити різні схеми медикаментозної корекції порушень кісткового обміну за даного захворювання. Висновки. Для медикаментозного лікування ВDЗР І типу альфакальцидол є препаратом вибору, бо має можливість трансформуватись печінкою в кальцитріол, обійшовши генетично пошкоджене ниркове 1α-гідроксилювання. На підставі вивчення біохімічних показників у пацієнтів з вітамін-D-залежним рахітом І типу розроблено патогенетично обґрунтовану ефективну медикаментозну терапію ортопедичних проявів, що включає холекальциферол (80 000 Од/міс) та альфакальцидол
(7,5 мкг/міс). Запропоноване лікування дає значне покращення метаболізму кісткової тканини, що відображається в біохімічних і клінічних показниках вже після першого 3-місячного етапу лікування (p < 0,05).
Цель: определить влияние консервативной терапии на генетически обусловленные нарушения метаболизма костной ткани у больных с витамин-D-зависимым рахитом (ВDЗР) I типа. Материалы и методы. На базе консультативно-поликлинического отделения ГУ «Институт травматологии и ортопедии НАМНУ» было обследовано и пролечено 48 пациентов с диагнозом «витамин-D-зависимый рахит І типа». Консервативное лечение пациентов с рахитоподобными заболеваниями проводилось в 4 этапа. Первый этап включал в себя полное обследование пациента на кальций, фосфор крови и мочи, определение уровня кальцидиола и кальцитриола крови, показателей паратиреоидного гормона и остеокальцина, а также маркера костеобразования P1NP и остеорезорбции B-CTx. На первом этапе в обязательном порядке дети проходили генетическое исследование для выявления изменений (полиморфизма) в аллелях рецепторов к витамину D и коллагена первого типа. Обследование на следующих этапах проводилось в полном объеме, кроме генетических исследований. Результаты. Всестороннее изучение метаболизма витамина D и биохимических показателей жизнедеятельности костной ткани у больных ВDЗР I типа позволило вплотную подойти к пониманию некоторых вопросов патогенеза и сущности остеомаляционных и в дальнейшем остеопоротических изменений разного уровня, объективизировать эти изменения в соответствующих показателях биохимического исследования и в зависимости от изменений разработать разные схемы медикаментозной коррекции данного заболевания. Выводы. Для медикаментозного лечения ВDЗР I типа альфакальцидол является препаратом выбора, так как имеет возможность трансформироваться печенью в кальцитриол, минуя генетически поврежденную почечную 1α-гидроксиляцию. На основе изучения биохимических показателей у пациентов с витамин-D-зависимым рахитом I типа разработана патогенетически обоснованная эффективная медикаментозная терапия ортопедических проявлений, которая включает холекальциферол (80 000 Ед/мес) и альфакальцидол (7,5 мкг/мес). Предложенное лечение дает значительное улучшение метаболизма костной ткани, что выражается в биохимических и клинических показателях уже после первого 3-месячногоэтапа лечения (p < 0,05).
Objective is to determine the effects of medical therapy of genetically caused disorders of bone metabolism in patients with vitamin-D-dependent rickets (VDDR) type I. Materials and methods. On the basis of a consultative and outpatient department of SI «Institute of Traumatology and Orthopaedy of NAMSU» 48 patients with VDDR type I were observed and treated. Medical treatment of patients with rickets was performed in 4 steps. Stage 1 consisted of a full examination of the patient, including serum calcium, serum phosphorus, urine tests, determination of calcidiol and serum calcitriol, indicators of parathyroid hormone and osteocalcin, as well as a marker of bone formation P1NP and osteoresorbtion B-CTx. At the first stage, without fail, a genetic test was performed in the children to detect changes (polymorphisms) in alleles of receptors to vitamin D and type I collagen. At the next stages the survey was conducted in its entirety, except for genetic research. Results. Comprehensive study of vitamin D metabolism and biochemical indices of vital activity of bone tissue in patients with VDDR type 1 allowed come close to understanding of some issues of pathogenesis and nature of osteomalation changes and in future of osteoporotic changes on different levels, to objectify these changes in relevant indicators of biochemical research and, depending on changes, develop different schemes of medical treatment of this disease. Conclusion. For medical treatment of VDDR1 alfacalcidol is a drug of choice because it could be transformed by the liver into calcitriol, passing genetically damaged renal 1α hydroxylation. On the basis of biochemical indices in patients with vitamin-D-depended rickets type 1 pathogeneticall substantiated rational effective drug therapy of orthopedic manifestations that includes cholecalciferol (80.000 U per month) and alfacalcidol (7.5 mg per month). The proposed treatment provides significant improvement in bone metabolіsm by biochemical and clinical indicators after the first month of three-month treatment (p < 0.05).
D-залежний рахіт, рахіт, метаболізм вітаміну D, кальцидіол, кальцитріол, деформації нижніх кінцівок у дітей.
D-зависимый рахит, рахит, метаболизм витамина D, кальцидиол, кальцитриол, деформации нижних конечностей у детей.
vitamin-D-dependent rickets, rickets, vitamin D metabolism, calcidiol, calcitriol, lower extremities deformities in children.
Статтю опубліковано на с. 178-183
Вступ
Матеріали і методи
/179.jpg)
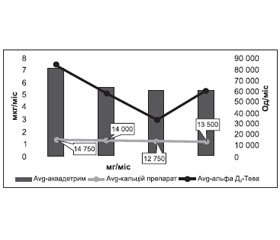
Результати та їх обговорення
Висновки
1. Гук Ю.М., Марциняк С.М., Кінча-Поліщук Т.А., Зотя А.В. Метаболізм кісткової тканини у хворих на вітамін-D-залежний рахіт 1-го типу // Вісник ортопедії, травматології та протезування. — 2015. — Т. 84, № 1. — С. 65-69.
2. Alzahrani A.S. A novel G102E mutation of CYP27B1 in a large family with vitamin D-dependent rickets type 1 / Alzahrani A.S, Zou M., Baitei E.Y. [et al.] // J. Clin. Endocrinol. Metab. — 2010. — P. 128-145.
3. Brooks M.H. Vitamin-D-dependent rickets type II. Resistance of target organs to 1,25-dihydroxyvitamin D / Brooks M.H., Bell N.H., Love L. [et al.] // New England J. Med. — 1978. — Vol. 298. — P. 996-999.
4. Econs M.J. Bone disease resulting from inherited disorders of renal tubule transport and vitamin D metabolism // Disorders of Bone and Mineral Metabolism / Ed. by F.L. Coe, M.J. Favus, M.J. Econs, M.K. Drezner. — New York: Raven Press, 1992. — Р. 935-950.
5. Fu G.K., Portale A.A., Miller W.L. Complete structure of the human gene for the vitamin D 1α-hydroxylase, P450c1α // DNA Cell Biol. — 1997.
6. Holick M.F. The use and interpretation of assays for vitamin D and its metabolites / M.F. Holick // J. Nutr. — 1990. — 120(Suppl. 11). — P. 1464-1469.
7. Katavetin P. A girl with a novel splice site mutation in VDR supports the role of a ligand-independent VDR function on hair cycling / Katavetin P., Wacharasindhu S., Shotelersuk V. // Horm. Res. — 2006. — P. 332-368.
8. Kimmel-Jehan C., De Luca H.F.Cloning of the mouse 25-hydroxyvitamin D3 1α-hydroxylase (CYP1α) gene // Biochim. Biophys. Acta. — 2000.
9. Kitanaka S., Takeyama K., Murayama A. et al. Inactivaiting mutations in the 25-hydroxyvitamin D3 1α-hydroxylase gene in patients with pseudovitamin D-deficiency rickets // N. Engl. J. Med. — 1998.
10. Panda D.K., Al Kawas S., Seldin M.F., Hendy G.N., Goltzman D. 25-hydroxyvitamin D 1alpha-hydroxylase: structure of the mouse gene, chromosomal assignment, and developmental expression // J. Bone Miner. Res. — 2001.
11. Silver J. Vitamin D-dependent rickets types I and II. Diagnosis and response to therapy / Silver J., Landau H., Bab I. [et al.] // Israel J. Med. Sci. — 1985. — Vol. 21. — P. 53-56.
12. Tohme J.F. Biochemical markers of bone metabolism / Tohme J.F., Seibel M.J., Silverberg S. J. [et al.] // Zietschr. Rheumatol. — 1991. — Vol. 50. — P. 133-141.
13. Yoshida T., Monkawa T., Tenenhouse H.S. et al. Two nowel 1α-hydroxylase mutations in French-Canadians with vitamin D dependency rickets type 1 // Kidney Int. — 1998.

/179_2.jpg)
/180.jpg)
/181.jpg)
/183.jpg)