Статья опубликована на с. 92-99
Введение
Основным антиоксидантным ферментом, который функционирует исключительно в бронхиальном секрете, является лактопероксидаза (LPO), катализирующая Н2О2-зависимое окисление галогенидов и тиоцианатов.
Лактопероксидаза на протяжении долгого времени была известна как компонент антибактериальной защиты молочной, слюнных и слезных желез [40]. Относительно недавно ее присутствие было идентифицировано и в респираторном тракте млекопитающих, в том числе и в органах дыхания человека [46]. Даже при физиологических условиях в бронхоальвеолярном секрете человека отмечается достаточно высокая концентрация LPO, функционирование которой предотвращает инфицирование респираторного тракта бактериями, вирусами и грибами [32].
Краткая характеристика лактопероксидазы
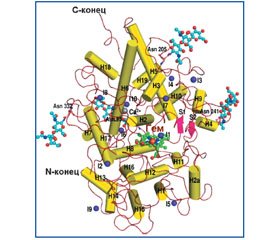
Металлоэнзим LPO (MGC129990, MGC129991, SPO) относится к суперсемейству железосодержащих пероксидаз млекопитающих, в которое также входят миелопероксидаза (MPO) и пероксидаза щитовидной железы [3, 31]. Молекула LPO (молекулярная масса 78,431 кДа) представляет собой железосодержащий мономерный гликопротеин, каталитическим центром которого является протопорфирин IX, ковалентно связанный при помощи дисульфидного мостика с полипептидной цепью [31]. Аминокислотная цепь лактопероксидазы состоит из 595 остатков. Вторичная структура LPO содержит 20 четко определенных альфа-спиралей различной длины, в том числе спираль H (2а), уникальную для молекулы LPO, и две коротких антипараллельных бета-нити. Канал, через который диффундируют субстраты, имеет цилиндрическую форму с диаметром около 6 A. В дистальной гемовой полости два гистидиновых остатка и шесть дополнительных молекул воды соединены водородными связями. В молекулярной структуре LPO также находится десять ионов иода. Из них один ион иода локализуется в дистальной гемовой полости (рис. 1) [12].
Гены, кодирующие LPO, расположены на хромосоме 17 (17q23.1) [44].
Лактопероксидаза синтезируется клетками слюнных желез и подслизистых серозных желез бронхиального дерева. В состоянии клинического здоровья человека среднее содержание LPO в 1 мг секретируемых белков бронхиального секрета составляет 0,65 ± 0,09 мкг [32]. До настоящего времени у людей не идентифицировано генетически детерминированного дефицита LPO [38].
Индукция синтеза лактопероксидазы и каталитический цикл
Продукция LPO может быть как конститутивной, так и индуцибельной. Продукция LPO индуцируется бактериальной адгезией, действием РАМР инфекционных агентов и сигналами с β-адренорецепторов. Участие перекиси водорода и тиоцианата в регуляции продукции LPO остается недостаточно изученным процессом [46]. Каталитический цикл пероксидаз, в том числе LPO, заключен в их уникальной способности активировать Н2О2-зависимое перекисное окисление галогенидов и тиоцианатов. Перекись водорода быстро и обратимо реагирует с LPO, которая находится в основном состоянии (Fe3+P), что приводит к окислению железа до Fe4+ за счет атома кислорода перекиси, в то время как один электрон пиррольного кольца затрачивается на образование молекулы воды и образуется π катион-радикал (Fe4+ = OP+•) так называемого промежуточного соединения I (Compound I), обладающего высокой окислительной способностью (реакция 1). Compound I окисляет тиоцианаты с образованием и гипотиоцианитовой кислоты (реакция 2, 3), и некоторых органических и неорганических молекул. Поскольку упомянутые соединения могут выступать донором только одного электрона, восстановление исходной структуры гема LPO происходит в два этапа. Сначала восстанавливается пиррольное кольцо, в то время как железо остается четырехвалентным — Fe4+ (реакция 2); данное соединение (Fe4+ = OP) обозначают как Compound II, являющееся в отличие от Compound I промежуточным долгоживущим соединением, распад которого лимитирует катализ. На следующем этапе (реакция 3) происходит перенос электрона на атом железа, что приводит к восстановлению исходной формы фермента (Fe3+P). Возможно также одномоментное двухэлектронное восстановление Compound I в исходную форму LPO, например, тиоцианатом, с образованием тиоцианогена (реакция 4), который быстро гидролизируется до гипотиоциановой кислоты и тиоцианата (реакция 5). При избытке перекиси водорода Compound II превращается в Compound III (Fe3+-О2P, реакция 6), образование которого ассоциировано с необратимой инактивацией фермента, скорее всего, связанной с повышенным образованием активированных кислородсодержащих метаболитов (АКМ) в ходе процессов с участием перекиси водорода, находящейся в избытке (рис. 2) [3, 23, 48].
/93.jpg)
В последнее время стали появляться данные, свидетельствующие о наличии сложных взаимоотношений между LPO и гипохлорной кислотой (HOCl). C.E. Souza и соавт. [25] предполагают, что при небольших физиологических концентрациях HOCl принимает участие в восстановлении исходной формы LPO из Compound III, способствуя тем самым защите слизистой дыхательных путей (рис. 3).
При развитии воспаления уровень HOCl повышается в несколько раз, что вызывает деструкцию гема LPO с последующим высвобождением железа. Увеличение концентрации свободного железа сопровождает такие респираторные заболевания, как бронхиальная астма, муковисцидоз и др. Предполагается, что свободное железо в тканях дополнительно стимулирует генерацию АКМ (например, реакция Фентона) [25].
В надэпителиальном слизистом слое LPO за счет электростатических взаимодействий связывается с гиалуронаном и удерживается в непосредственной близости от наружной апикальной поверхности цитоплазматической мембраны эпителиоцитов [24].
Механизм действия лактопероксидазы
Лактопероксидаза, используя H2O2, играет одну из основных ролей в противоинфекционной неспецифической защите просвета и слизистой оболочки трахеобронхиального дерева от бактерий, вирусов и грибов. Во время инфекционно-воспалительного поражения респираторного тракта происходит усиление продукции АКМ, в том числе H2O2. Перекись водорода является важнейшим компонентом в антимикробной системе неспецифической защиты респираторного тракта. В бронхиальном секрете местные системы генерации АКМ постоянно поддерживают концентрацию H2O2 на определенном уровне, соответствующем настоящим условиям [27].
Образование H2O2 эпителиоцитами респираторного тракта связано с работой двух представителей НАДФH-оксидазы (NOX семейства) — дуальными оксидазами (DUOX1, DUOX2), которые расположены на апикальной поверхности цитоплазматической мембраны клетки. Первоначально эти гомологичные ферменты NOX — DUOX1 и DUOX2 — были идентифицированы в ткани щитовидной железы и клонированы из эпителия щитовидной железы. В последующем установлено, что ферменты DUOX экспрессируются и в эпителиоцитах респираторного, пищеварительного трактов и предстательной железы (рис. 4) [6, 24, 37]. Несмотря на то что основным продуктом гомологов NOX семейства является супероксид радикал анион, DUOX генерируют H2O2, а не O2– [21].
Активация синтеза DUOX1, DUOX2 ассоциирована с действием интерлейкина-4 (IL-4), IL-13, интерферона-γ (IFN-γ). Экспрессия DUOX1 индуцируется IL-4 и IL-13, а DUOX2 — IFN-γ. Воздействие IL-4 и IL-13 увеличивает экспрессию DUOX1 почти в 4 раза, INF-γ усиливает экспрессию DUOX2 более чем в 20 раз [21, 24].
H. Fischer [21] показал, что DUOX экспрессируют реснитчатые клетки слизистой оболочки трахеобронхиального дерева, в то время как другие типы клеток эпителия (в частности, базальные и бокаловидные клетки) если и экспрессируют DUOX, то на таком низком уровне, при котором протеины DUOX не могут быть идентифицированы с помощью современных методов иммуногистохимии. Уровень экспрессии DUOX реснитчатыми клетками определяет общую бактерицидную активность слизистой оболочки респираторного тракта. Протеин DUOX1 на апикальной поверхности своей мембраны представляют и альвеолоциты II типа. Однако физиологическая роль DUOX1 альвеолоцитов до настоящего времени не известна [21].
В люмене респираторного тракта основным энзиматическим инактиватором H2O2 выступает LPO. Доля нейтрализующего эффекта, ассоциированного с действием LPO, в общем процессе ферментативной утилизации Н2О2 составляет не менее 60 % [26]. В процессе функционирования LPO, регулируя концентрацию Н2О2 в надэпителиальном пространстве, защищает эпителий от токсического воздействия [18].
Эпителиоциты активно секретируют анион тиоцианита (SCN–) и анион иода (I–). Трасмембранный транспорт анионов SCN– и I– осуществляется Na+I– симпортером (NIS) через базолатеральную поверхность мембраны эпителиоцита, аниона SCN– — трансмембранным регуляторным белком муковисцидоза (CFTR) через апикальную поверхность мембраны [43]. Анионы SCN– и I–, которые генерируются нейтрофилами в результате «оксидантного взрыва», из периферического русла крови транспортируются в эпителиоциты и накапливаются в просвете дыхательных путей. Показано, что концентрация анионов SCN– и I– в надэпителиальном пространстве респираторного тракта практически в 20 раз превышает их уровень в сыворотке крови [43, 46].
Концентрация анионов SCN– в бронхиальном секрете достигает 0,4 мкмоль/л и является достаточной для проявления анионом тиоцианита бактериостатического действия [46]. Нарушение транспортировки аниона SCN– трансмембранным регуляторным белком муковисцидоза через клеточную мембрану в эпителиальных клетках трахеобронхиального дерева сопровождается снижением бактерицидности бронхиального секрета и колонизацией Pseudomonas aeruginosa органов дыхания [37].
Лактопероксидаза непосредственно вступает в физический контакт с анионом SCN– (рис. 5) [45].
Лактопероксидаза катализирует окисление солей роданистоводородной кислоты — тиоцианатов и галогенидов — хлоридов, бромидов, иодидов. Лактопероксидаза, используя Н2О2, окисляет анионы SCN– и I–. Это приводит к образованию аниона гипотиоцианитовой кислоты (OSCN–) и OI–, которые взаимодействуют с тиольными группами (-SH) поверхностных протеинов инфекционных агентов. В результате данного взаимодействия клеточная стенка бактериальных и грибковых инфекционных агентов теряет pH-градиент, увеличивается ее проницаемость. Также действие OSCN– и OI– нарушает у микроорганизмов трансмембранный транспорт ионов K+, аминокислот, глюкозы. Анион OSCN– оказывает бактерицидное действие, блокируя гликолиз, НАДФ-зависимые реакции (рис. 6) [11, 17, 19, 20, 38, 41, 49].
/95.jpg)
В надэпителиальной жидкости респираторного тракта может находиться еще один фермент с пероксидазной активностью — миелопероксидаза (MPO), которая продуцируется фагоцитирующими клетками (нейтрофилы, макрофаги и моноциты) [30]. MPO в каталитическом процессе использует Н2О2, как и LPO, но в отличие от LPO катализирует две конкурирующие реакции: 1) окисление Cl–, Br–, I–; 2) окисление SCN– в OSCN–. Использование Н2О2 миелопероксидазой в процессе окисления хлоридов, бромидов, йодидов ведет к образованию HOCl, гипобромной (HOBr) и гипоиодной кислот (НОІ), обладающих мощным бактерицидным действием (рис. 7). Учитывая пространственное расположение ферментов по отношению к эпителиоцитам, считают, что LPO использует Н2О2, генерируемую DUOX эпителиальных клеток, а MPO — Н2О2, образование которой связано с действием НАДФH оксидазы макрофагов и нейтрофилов [13].
Необходимо отметить, что LPO не катализирует окисление Cl–. Высокая бактерицидная активность HOCl сочетается с выраженным эпителиотоксичным действием, которое значительно превышает активность токсического действия гипотиоцианита [13, 39].
Протекторная роль аниона SCN– в респираторном тракте обусловлена как минимум двумя механизмами: 1) образованием OSCN–, обладающего высокой антибактериальной активностью; 2) восстановлением оксидантов. Анион тиоцианита — это естественный и эффективный антиоксидант респираторного тракта. Содержание SCN– в жидкости носовой полости (400 мкмоль/л) в 30 раз выше, чем в сыворотке крови, а его концентрация в жидкости бронхоальвеолярного лаважа в среднем составляет 460 мкмоль/л у взрослых и 28–56 мкмоль/л — у детей младшего возраста [10]. Клетки животных, в том числе человека, не синтезируют SCN– [22]. Основным источником SCN– у человека являются овощи, особенно семейства крестоцветных (брокколи, капуста огородная и др.) и другая растительная пища. Учитывая данный факт, возможно, дефицит овощей в рационе питания может быть одной из причин неэффективности функционирования антиоксидантной системы. Показано, что снижение концентрации SCN– менее 100 мкмоль/л не исключает образование токсичной HOCl. Дефицит аниона тиоцианита, учитывая, что SCN– может ингибировать продукцию OCl– и участвует в инактивации OCl–, может сопровождаться гиперпродукцией OCl–, которая ведет к поражению эпителиоцитов и лейкоцитов. Однако уровень SCN– в сыворотке крови не зависит от приема цианидсодержащих овощей. Это связано с активным функционированием CFTR, NIS и пендрина (натрийнезависимого транспортера ионов хлора и иода), которые выводят SCN– в просвет респираторного или пищеварительного трактов [10]. Генетически обусловленные дефекты CFTR, наблюдаемые у больных муковисцидозом, приводят к снижению концентрации SCN– в бронхоальвеолярном секрете респираторного тракта, в результате чего эпителий не обеспечивается должным уровнем защиты от цитотоксического действия H2O2 и OCl–, что приводит к развитию хронического воспалительного процесса. Не исключено, что недостаточное содержание SCN– усугубляет цитотоксическое влияние, связанное с функционированием MPO, на ткань респираторного тракта и у больных с воспалительными заболеваниями органов дыхания. Кроме того, высокая активность MPO ассоциирована с развитием атеросклероза. У людей, которые отличаются высокой активностью MPO в сыворотке крови, в 15–20 раз выше риск развития стеноза коронарных артерий [51].
Несмотря на то что основной функцией LPO и MPO является поддержание «стерильности» респираторного тракта в условиях постоянного попадания в него инфекционных патогенов, они также играют определенную роль в защите тканей органов дыхания от окисидативного стресса. С данной точки зрения присутствие в просвете респираторного тракта LPO и MPO представляет особое значение, так как CAT в основном локализуется в пероксисомальной системе клеток, но не секретируется в жидкость люмена. Однако в целом взаимоотношение активности CAT и MPO во многом предопределяет результат процесса инактивации Н2О2.
Экспериментальное подавление активности LPO ингаляционными ингибиторами достоверно уменьшает скорость элиминации инфекционных агентов из респираторного тракта [50].
Участие лактопероксидазы и миелопероксидазы в антибактериальной и противогрибковой защите
Система LPO респираторного тракта обладает выраженной антибактериальной активностью в отношении грамположительных и грамотрицательных бактерий [11]. Показано, что под влиянием системы LPO ингибируется рост колоний Staphylococcus aureus, Streptococcus, Escherichia coli, Pseudomonas aeruginosa, Burkholderia cepacia, Haemophilus influenzae [11]. Антибактериальная эффективность системы LPO в случае адекватной концентрации H2O2 достигает максимума при значениях pH бронхиального секрета дыхательных путей 6,8 [29]. Функционирование системы LPO может сопровождаться бактерицидным эффектом, который обусловлен продукцией АКМ, вызывающих необратимое окисление белков бактериальных мембран [9].
Система LPO также обеспечивает противогрибковую [8, 33, 35] и противовирусную защиту респираторного тракта [19].
Показано, что у больных муковисцидозом наблюдается снижение активности системы LPO, что, по всей вероятности, является одной из определяющих причин хронической бактериальной колонизации респираторного тракта [4, 47].
Миелопероксидаза участвует в микробицидной активности нейтрофилов, особенно в ранний постфагоцитарный период или при высоком уровне микробной контаминации. Следует подчеркнуть, что микроорганизмы различаются по своей восприимчивости к кислородзависимому киллингу. Так, киллинг грибов в респираторном тракте преимущественно зависит от активности MPO, гибель стафилококков умеренно зависит от активности MPO, кишечная палочка достаточно быстро погибает и в условиях дефицита MPO [30]. Установлено, что мыши с нокаутом гена МРО отличаются высокой степенью восприимчивости к инфекциям, вызванным Pseudomonas aeruginosa, Candida albicans, Candida tropicalis, Trichosporon asahii и в какой-то степени Klebsiella pneumoniae и Aspergillus fumigatus. Но в то же время их восприимчивость к развитию заболеваний, вызванных Staphylococcus aureus, Streptococcus pneumoniae, Candida glabrata, Cryptococcus neoformans, сравнима с таковой диких мышей [5, 15].
/96.jpg)
Учитывая, что LPO располагается в непосредственной близости к эпителиоцитам и отличается конститутивной активностью, а продукт ее функционирования — гипотиоцианитовая кислота — обладает подавляющим действием в отношении широкого спектра инфекционных агентов и менее токсична для эпителиоцитов, чем гипохлорная кислота, система LPO является первой линией пероксидазной противоинфекционной защиты. При преодолении перекисью водорода лактопероксидазного барьера активируется MPO нейтрофилов, которая способствует образованию тканеагрессивных продуктов. Преимущественная локализация LPO в непосредственной близости к мембранам эпителиоцитов бронхов позволяет считать данную систему системой антимикробной защиты респираторного тракта, которая играет важнейшую роль в процессе элиминации «оседлых» бактериальных колоний — биопленок. Возможно, что заболевания, характеризующиеся хронической бактериальной колонизацией респираторного тракта, обусловлены нарушениями функционирования системы LPO.
Другие антиоксидантные ферменты жидкости бронхоальвеолярного лаважа
В жидкости бронхоальвеолярного лаважа также находятся такие антиоксиданты, как гемоксигеназа-1, глутатионредуктаза и глутатионпероксидаза-2, глутатион S-трансфераза, тиоредоксины, уровень которых повышается при гипероксии [7, 16, 36, 42]. Бронхоальвеолярный секрет содержит глутаредоксин-1, содержание которого значительно увеличивается в ответ на стимуляцию LPS [2]. Согласно данным Y. Guo и соавт. [14] и S.A. Gharib и соавт. [34], полученным в ходе протеомного анализа жидкости бронхоальвеолярного лаважа мышей и человека, она содержит пероксиредоксины — PRX1, PRX5 и PRX6. У больных с острым повреждением легких наблюдается повышение уровня PRX1 в жидкости бронхоальвеолярного лаважа [34].
Список литературы
1. Абатуров А.Е. Активированные кислородсодержащие метаболиты — компоненты системы неспецифической защиты респираторного тракта // Здоровье ребенка. — 2009. — № 2 (17). — С. 120-125.
2. Ablation of glutaredoxin‑1 attenuates lipopolysaccharide-induced lung inflammation and alveolar macrophage activation / S.W. Aesif, V. Anathy, I.A. Kuipers et al. // Am. J. Respir. Cell. Mol. Biol. — 2011. — Vol. 44, № 4. — P. 491-499. doi: 10.1165/rcmb.2009-0136OC. Epub 2010 Jun 10.
3. Active site structure and catalytic mechanisms of human peroxidases / P.G. Furtmüller, M. Zederbauer, W. Jantschko et al. // Arch. Biochem. Biophys. — 2006. — Vol. 445, № 2. — P. 199-213. PMID: 16288970.
4. Airway epithelial control of Pseudomonas aeruginosa infection in cystic fibrosis / V.L. Campodónico, M. Gadjeva, C. Paradis-Bleau et al. // Trends Mol. Med. — 2008. — Vol. 14, № 3. — P. 120-133. doi: 10.1016/j.molmed.2008.01.002. Epub 2008 Feb 11.
5. Aratani Y. Role of myeloperoxidase in the host defense against fungal infection // Nihon Ishinkin Gakkai Zasshi. — 2006. — Vol. 47, № 3. — P. 195-199. PMID: 16940954.
6. Babior B.M. NADPH oxidase // Curr. Opin. Immunol. — 2004. — Vol. 16. — P. 42-47. PMID: 14734109.
7. Benzo(a)pyrene-induced pulmonary inflammation, edema, surfactant dysfunction, and injuries in rats: alleviation by farnesol / W. Qamar, A.Q. Khan, R. Khan et al. // Exp. Lung Res. — 2012. — Vol. 38, № 1. — P. 19-27. doi: 10.3109/01902148.2011.632064. Epub 2011 Dec 14.
8. Candidacidal activities of the glucose oxidase-mediated lactoperoxidase system / H.S. Kho, Y.Y. Kim, J.Y. Chang et al. // Arch. Oral Biol. — 2012. — Vol. 57, № 6. — P. 684-688. doi: 10.1016/j.archoralbio.2011.11.007. Epub 2011 Nov 30.
9. Chen S.X. Hydroxyl-radical production in physiological reactions — a novel function of peroxidase / S.X. Chen, P. Schopfer // Eur. J. Biochem. — 1999. — Vol. 260. — P. 726-735. PMID: 10103001.
10. Concentration of the antibacterial precursor thiocyanate in cystic fibrosis airway secretions / D. Lorentzen, L. Durairaj, A.A. Pezzulo et al. // Free Radic. Biol. Med. — 2011. — Vol. 50, № 9. — P. 1144-1150. doi: 10.1016/j.freeradbiomed.2011.02.013. Epub 2011 Feb 18.
11. Conner G.E. Lactoperoxidase and Hydrogen Peroxide Metabolism in the Airway / G.E. Conner, M. Salathe, R. Forteza // Am. J. Respir. Crit. Care Med. — 2002. — Vol. 166, № 12 (Pt 2). — P. S57-S61. PMID: 12471090.
12. Crystal structure of lactoperoxidase at 2.4 A resolution / A.K. Singh, N. Singh, S. Sharma et al. // J. Mol. Biol. — 2008. — Vol. 376, № 4. — P. 1060-1075. doi: 10.1016/j.jmb.2007.12.012. Epub 2007 Dec 14.
13. Davies M.J. Myeloperoxidase-derived oxidation: mechanisms of biological damage and its prevention // J. Clin. Biochem. Nutr. — 2011. — Vol. 48, № 1. — P. 8-19. doi: 10.3164/jcbn.11-006FR. Epub 2010 Dec 28.
14. 1-DE MS and 2-D LC–MS analysis of the mouse bronchoalveolar lavage proteome / Y. Guo, S.F. Ma, D. Grigoryev et al. // Proteomics. — 2005. — Vol. 5, № 17. — P. 4608-4624. PMID: 16240291.
15. Differential host susceptibility to pulmonary infections with bacteria and fungi in mice deficient in myeloperoxidase / Y. Aratani, F. Kura, H. Watanabe et al. // J. Infect. Dis. — 2000. — Vol. 182, № 4. — P. 1276-1279. PMID: 10979934.
16. Differential proteomic analysis of bronchoalveolar lavage fluid in asthmatics following segmental antigen challenge / J. Wu, M. Kobayashi, E.A. Sousa et al. // Mol. Cell. Proteomics. — 2005. — Vol. 4, № 9. — P. 1251-1264. PMID: 15951573.
17. Effect of lactoperoxidase on the antimicrobial effectiveness of the thiocyanate hydrogen peroxide combination in a quantitative suspension test / A. Welk, Ch. Meller, R. Schubert et al. // BMC Microbiol. — 2009. — Vol. 9. — P. 134. doi: 10.1186/1471-2180-9-134.
18. Elevated levels of expired breath hydrogen peroxide in bronchiectasis / S. Loukides, I. Horvath, T. Wodehouse et al. // Am. J. Respir. Crit. Care Med. — 1998. — Vol. 158. — P. 991-994. PMID: 9731036.
19. Enhancement of respiratory mucosal antiviral defenses by the oxidation of iodide / A.J. Fischer, N.J. Lennemann, S. Krishnamurthy et al. // Am. J. Respir. Cell. Mol. Biol. — 2011. — Vol. 45, № 4. — P. 874-881. doi: 10.1165/rcmb.2010-0329OC. Epub 2011 Mar 25.
20. Exhalation of H2O2 and thiobarbituric acid reactive substances (TBARs) by healthy subjects / D. Nowak, S. Kalucka, P. Bialasiewicz, M. Krol // Free Radic. Biol. Med. — 2001. — Vol. 30. — P. 178-186. PMID: 11163535.
21. Fischer H. Mechanisms and function of DUOX in epithelia of the lung // Antioxid. Redox Signal. — 2009. — Vol. 11, № 10. — P. 2453-2465. doi: 10.1089/ARS.2009.2558.
22. Funderburk C.F. Thiocyanate physiologically present in fed and fasted rats / C.F. Funderburk, L. Van Middlesworth // Am. J. Physiol. — 1968. — Vol. 215, № 1. — P. 147-151. PMID: 5659326.
23. Ghibaudi E. Unraveling the catalytic mechanism of lactoperoxidase and myeloperoxidase. A reflection on some controversial features / E. Ghibaudi, E. Laurenti // Eur. J. Biochem. — 2003. — Vol. 270. — P. 4403-4412. PMID: 14622268.
24. Hyaluronan serves a novel role in airway mucosal host defense / R. Forteza, T. Lieb, T. Aoki et al. // FASEB J. — 2001. — Vol. 15. — P. 2179-2186. PMID: 11641244.
25. Hypochlorous acid-induced heme degradation from lactoperoxidase as a novel mechanism of free iron release and tissue injury in inflammatory diseases / C.E. Souza, D. Maitra, G.M. Saed et al. // PLoS One. — 2011. — Vol. 6, № 11. — P. e27641. doi: 10.1371/journal.pone.0027641. Epub 2011 Nov 22.
26. Hydrogen Peroxide — Scavenging Properties of Normal Human Airway Secretions / S. El-Chemaly, M. Salathe, S. Baier et al. // Am. J. Respir. Critic. Care Med. — 2003. — Vol. 167. — P. 425-430. PMID: 12446267.
27. Hydrogen peroxide in exhaled air of healthy children: reference values / Q. Jobsis, H.C. Raatgeep, S.L. Schellekens et al. // Eur. Respir. J. — 1998. — Vol. 12. — P. 483-485. PMID: 9727806.
28. Jooyandeh H. Application of Lactoperoxidase System in Fish and Food Products: A Review / H. Jooyandeh, A. Aberoumand, B. Naseh // American-Eurasian J. Agric. & Environ. Sci. — 2011. — Vol. 10, № 1. — P. 89-96.
29. Johansen C. Enzymatic removal and disinfection of bacterial biofilms / C. Johansen, P. Falholt, L. Gram // Appl. Environ. Microbiol. — 1997. — Vol. 63. — P. 3724-3728. PMID: 9293025.
30. Klebanoff S.J. Myeloperoxidase: friend and foe // J. Leukoc. Biol. — 2005. — Vol. 77, № 5. — P. 598-625. PMID: 15689384.
31. Kussendrager K.D. Lactoperoxidase: physico-chemical properties, occurrence, mechanism of action and applications / K.D. Kussendrager, A.C.M. van Hooijdonk // Brit. J. Nutrit. — 2000. — Vol. 84 (Suppl. 1) — P. S19-S25. PMID: 11242442.
32. Lactoperoxidase and human airway host defense / C. Wijkstrom-Frei, S. El-Chemaly, R. Ali-Rachedi et al. // Am. J. Respir. Cell. Mol. Biol. — 2003. — Vol. 29, № 2. — P. 206-212. PMID: 12626341.
33. Microbicidal efficacy of thiocyanate hydrogen peroxide after adding lactoperoxidase under saliva loading in the quantitative suspension test / A. Welk, P. Rudolph, J. Kreth et al. // Arch. Oral. Biol. — 2011. — Vol. 56, № 12. — P. 1576-1582. doi: 10.1016/j.archoralbio.2011.04.016. Epub 2011 May 28.
34. Of mice and men: comparative proteomics of bronchoalveolar fluid / S.A. Gharib, E. Nguyen, W.A. Altemeier et al. // Eur. Respir. J. — 2010. — Vol. 35, № 6. — P. 1388-1395. doi: 10.1183/09031936.00089409. Epub 2009 Dec 23.
35. Popper L. Inactivation of yeast and filamentous fungi by the lactoperoxidase hydrogen peroxide thiocyanate system / L. Popper, D. Knorr // Nahrung. — 1997. — Vol. 41. — P. 29-33. PMID: 9113668.
36. Proteome analysis of bronchoalveolar lavage fluid in chronic hypersensitivity pneumonitis / T. Okamoto, Y. Miyazaki, R. Shirahama et al. // Allergol. Int. — 2012. — Vol. 61, № 1. — P. 83-92. doi: 10.2332/allergolint.11-OA‑0315. Epub 2011 Oct 25.
37. Rada B. Oxidative innate immune defenses by Nox/Duox family NADPH oxidases / B. Rada, T.L. Leto // Contrib. Microbiol. — 2008. — Vol. 15. — P. 164-187. doi: 10.1159/000136357.
38. Ratner A.J. Lactoperoxidase. New Recognition of an «Old» Enzyme in Airway Defenses / A.J. Ratner, A. Prince // Am. J. Respir. Cell. Mol. Biol. — 2000. — Vol. 22, № 6. — Р. 642-644. PMID: 10837358.
39. Reaction of lactoperoxidase compound I with halides and thiocyanate / P.G. Furtmüller, W. Jantschko, G. Regelsberger et al. // Biochemistry. — 2002. — Vol. 41, № 39. — P. 11895-11900. PMID: 12269834.
40. Shin K. Identification of lactoperoxidase in mature human milk / K. Shin, M. Tomita, B. Lonnerdal // J. Nutr. Biochem. — 2000. — Vol. 11. — P. 94-102. PMID: 10715594.
41. Shin K. Inhibition of Escherichia coli respiratory enzymes by the lactoperoxidase-hydrogen peroxide-thiocyanate antimicrobial system / K. Shin, H. Hayasawa, B. Lonnerdal // J. Appl. Microbiol. — 2001. — Vol. 90. — P. 489-493. PMID: 11309058.
42. Surfactant protein D protects against acute hyperoxic lung injury / D. Jain, E.N. Atochina-Vasserman, Y. Tomer et al. // Am. J. Respir. Crit. Care Med. — 2008. — Vol. 178, № 8. — P. 805-813. doi: 10.1164/rccm.200804-582OC. Epub 2008 Jul 17.
43. Transcellular thiocyanate transport by human airway epithelia / M.A Fragoso, V. Fernandez, R. Forteza et al. // J. Physiol. — 2004. — Vol. 561, № 1 — Р. 183-194. PMID: 15345749.
44. The eosinophil peroxidase gene forms a cluster with the genes for myeloperoxidase and lactoperoxidase on human chromosome 17 / K. Sakamaki, N. Kanda, T. Ueda et al. // Cytogenet. Cell Genet. — 2000. — Vol. 88, № 3–4. — P. 246-248. PMID: 10828600.
45. Structural evidence of substrate specificity in mammalian peroxidases: structure of the thiocyanate complex with lactoperoxidase and its interactions at 2.4 A resolution / I.A. Sheikh, A.K. Singh, N. Singh et al. // J. Biol. Chem. — 2009. — Vol. 284, № 22. — P. 14849-14856. doi: 10.1074/jbc.M807644200. Epub 2009 Apr 1.
46. The Lactoperoxidase System Functions in Bacterial Clearance of Airways / C. Gerson, J. Sabater, M. Scuri et al. // Am. J. Respir. Cell Mol. Biol. — 2000. — Vol. 22, № 6. — Р. 665-671. PMID: 10837362.
47. The lactoperoxidase system links anion transport to host defense in cystic fibrosis / G.E. Conner, C. Wijkstrom-Frei, S.H. Randell et al. // FEBS Lett. — 2007. — Vol. 581, № 2. — P. 271-278. PMID: 17204267.
48. Thiocyanate modulates the catalytic activity of mammalian peroxidases / Y.R. Tahboub, S. Galijasevic, M.P. Diamond, H.M. Abu-Soud // J. Biol. Chem. — 2005. — Vol. 280, № 28. — P. 26129-26136. PMID: 15894800.
49. Travis S.M. Antimicrobial peptides and proteins in the innate defense of the airway surface / S.M. Travis, P.K. Singh, M.J. Welsh // Curr. Opin. Immunol. — 2001. — Vol. 13. — P. 89. PMID: 11154923.
50. Ultrastructural localization of endogenous peroxidase in the lower respiratory tract of the guinea pig / T.G. Christensen, G.C. Blanchard, G. Nolley, J.A. Hayes // Cell Tissue Res. — 1981. — Vol. 214. — P. 407-415. PMID: 7471186.
51. Xu Y. The antioxidant role of thiocyanate in the pathogenesis of cystic fibrosis and other inflammation-related diseases / Y. Xu, S. Szép, Z. Lu // Proc. Natl. Acad. Sci. USA. — 2009. — Vol. 106, № 48. — P. 20515-20519. doi: 10.1073/pnas.0911412106. Epub 2009 Nov 16.
/96.jpg)

/93.jpg)
/94.jpg)
/95.jpg)