Резюме
У статті наведено літературні дані щодо частоти, основних клінічних проявів, сучасних методів пренатальної та постнатальної діагностики і лікування дефекту міжшлуночкової перетинки в дітей, а також прогнозу при даному захворюванні. Згідно з міжнародною класифікацією хвороб 10-го перегляду дефект міжшлуночкової перетинки класифікують як Q 21.0 Дефект міжшлуночкової перетинки. Частота. У загальній структурі вроджених вад серцево-судинної системи близько 20 % припадає на дефект міжшлуночкової перетинки. Діагностика. Помірний дефект міжшлуночкової перетинки проявляється задишкою, швидкою стомлюваністю при годуванні, відставанням у фізичному розвитку. Виражений артеріально-венозний скид крові в перший місяць життя супроводжується тимчасовим різко вираженим ціанозом при годуванні та крику дитини. У дітей першого року життя розвиваються висока легенева гіпертензія, недостатність кровообігу, гіпотрофія. Для новонароджених характерна невелика інтенсивність шуму в перші тижні і навіть місяці життя, що обумовлено фізіологічно підвищеним внутрішньосудинним легеневим опором. Систолічний шум займає всю систолу з максимумом амплітуди біля лівого краю грудини на рівні III–IV міжребер’їв. Склеротична фаза легеневої гіпертензії при дефекті міжшлуночкової перетинки визначається як реакція Ейзенменгера. Клініка пороку залежить від ступеня порушення гемодинаміки, обумовленої параметрами дефекту, рівнем тиску в легеневій артерії, опором судин малого кола, величиною та напрямком скиду крові через дефект. Діагностика пороку підтверджується характерними змінами на електрокардіограмі, ехокардіоскопії та рентгенограмі. Лікування. Невеликі м’язові дефекти міжшлуночкової перетинки часто закриваються спонтанно в перші 2 роки життя. Медикаментозна корекція необхідна при розвитку застійної серцевої недостатності. Оптимальний для операції вік — 5–9 років.
В статье представлены литературные данные о частоте, основных клинических проявлениях, современных методах ранней неонатальной и постнатальной диагностики и лечении дефекта межжелудочковой перегородки у детей, а также прогнозе при данном заболевании. Согласно международной классификации болезней 10-го пересмотра дефект межжелудочковой перегородки классифицируют как Q 21.0 Дефект межжелудочковой перегородки. Частота. В общей структуре врожденных пороков сердечно-сосудистой системы около 20 % приходится на дефект межжелудочковой перегородки. Диагностика. Умеренный дефект межжелудочковой перегородки проявляется одышкой, быстрой утомляемостью при кормлении, отставанием в физическом развитии. Выраженный артериально-венозный сброс крови в первый месяц жизни сопровождается преходящим нерезко выраженным цианозом при кормлении и крике ребенка. У детей первого года жизни развиваются высокая легочная гипертензия, недостаточность кровообращения, гипотрофия. Для новорожденных характерна небольшая интенсивность шума в первые недели и даже месяцы жизни, что обусловлено физиологически повышенным внутрисосудистым легочным сопротивлением. Систолический шум занимает всю систолу с максимумом амплитуды у левого края грудины на уровне III–IV межреберий. Склеротическая фаза легочной гипертензии при дефекте межжелудочковой перегородки определяется как реакция Эйзенменгера. Клиника порока зависит от степени нарушения гемодинамики, обусловленной параметрами дефекта, уровнем давления в легочной артерии, сопротивлением сосудов малого круга, величиной и направлением сброса крови через дефект. Диагностика порока подтверждается характерными изменениями на электрокардиограмме, эхокардиоскопии и рентгенограмме. Лечение. Небольшие мышечные дефекты межжелудочковой перегородки часто закрываются спонтанно в первые 2 года жизни. Медикаментозная коррекция необходима при развитии застойной сердечной недостаточности. Оптимальный для операции возраст — 5–9 лет.
The article presents the literature data on the incidence, the main clinical manifestations, modern methods for early neonatal and postnatal diagnosis and treatment of ventricular septal defect in children, as well as the prognosis of this disease. According to the International Classification of Diseases, 10th revision, ventricular septal defect is classified as Q21.0 Ventricular septal defect. Incidence. In the overall structure of congenital malformations of the cardiovascular system, ventricular septal defect has about 20 %. Diagnosis. Moderate ventricular septal defect is manifested by shortness of breath, rapid fatigability during feeding, delay in physical development. Significant arterial-venous shunt in the first month of life is accompanied by a transient mild cyanosis when the baby is fed and cries. Infants develop high pulmonary hypertension, circulatory failure, malnutrition. Small noise intensity is typical for newborns in the first weeks or even months of life, which is due to physiologically increased intravascular pulmonary resistance. Systolic murmur is extended to the entire systole with maximum amplitude at the left edge of the sternum at the level of III–IV intercostal spaces. Sclerotic phase of pulmonary hypertension with ventricular septal defect is defined as Eisenmenger reaction. The clinical picture of this disorder depends on the degree of hemodynamic instability caused by the defect parameters, the pressure level in the pulmonary artery, vascular pulmonary resistance, the magnitude and direction of the shunt through the defect. Diagnosis is confirmed by characteristic changes in the electrocardiogram, echocardiography and chest radiograph. Treatment. Small muscular ventricular septal defects often close spontaneously during the first 2 years of life. Drug correction is needed in the development of congestive heart failure. The optimum age for surgery — 5–9 years.
Статья опубликована на с. 71-75
Публикация не имеет связи с плановыми научно-исследовательскими работами, фондами, грантами.
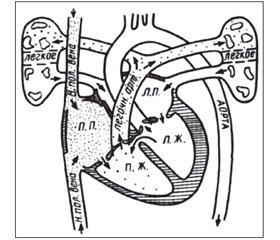
Дефект межжелудочковой перегородки (ДМЖП) — врожденная аномалия развития перегородки, при которой формируется сообщение между левым и правым желудочками (рис. 1).
Согласно международной классификации болезней 10-го пересмотра классифицируют как Q 21.0 Дефект межжелудочковой перегородки. Впервые ДМЖП был описан П. Толочиновым (1874) и Roger (1879).
Частота. ДМЖП составляет у доношенных 1,5–3,5 случая на 1000 новорожденных, у недоношенных — 4,5–7 случаев на 1000 детей. В общей структуре врожденных пороков сердца около 20 % приходится на ДМЖП, который является наиболее часто диагностируемым пороком. Частота мелких, гемодинамически незначимых мышечных ДМЖП достигает 53 случая на 1000 живорожденных. Около 90 % таких дефектов спонтанно закрываются к 10 мес. жизни и не оказывают влияния на прогноз для жизни и здоровья.
/72.jpg)
Сочетание с другими пороками. Чаще всего ДМЖП бывает изолированным, но может сочетаться с хромосомными аномалиями, генными нарушениями, синдромами множественных пороков развития. Порок описан более чем при 40 хромосомных дефектах, включающих трисомии 13, 18 и 21; полиплоидию; дупликации, делеции и др. Может встречаться как при синдромах с аутосомно-доминантным типом наследования (синдромы Холта — Орама и велокардиофасциальный), так и при аутосомно-рецессивных синдромах (синдромы Смита — Лемли — Опица и Карпентера). Описан более чем при 90 синдромах множественных пороков развития.
Классификация. Выделяют различные варианты топографического расположения дефектов межжелудочковой перегородки. Перимембранозные дефекты расположены в выходном тракте левого желудочка под аортальным клапаном и составляют от 61,4 до 80 % среди всех ДМЖП. Высокие перимембранозные дефекты чаще бывают средних и больших размеров (от 1 до 3 см), округлой либо элипсовидной формы. Субаортальная локализация ДМЖП в сочетании со склеротическими изменениями в легочных сосудах, дилатацией ствола легочной артерии, гипертрофией миокарда преимущественно правого желудочка носит название синдрома Эйзенменгера. Склеротическая фаза легочной гипертензии при другой локализации ДМЖП определяется как реакция Эйзенменгера. Мышечные (трабекулярные) ДМЖП, отмечающиеся в 5–20 % случаев изолированных ДМЖП, формируются на ранних стадиях развития мышечной части перегородки. Дефекты в средней и нижней частях мышечной трабекулярной перегородки обычно имеют небольшие размеры. Часто они выявляются множественными («дефект по типу швейцарского сыра») и во время систолы могут почти полностью перекрываться сокращающейся мышечной тканью межжелудочковой перегородки.
Приточные ДМЖП (8–10 % изолированных септальных дефектов) представляют собой предсердно-желудочковые ДМЖП и располагаются в зоне эндокардиальных подушечек позади септальной створки трехстворчатого клапана. Инфундибулярные (подлегочные, отточные) ДМЖП, составляющие 5–8 % изолированных ДМЖП, локализуются ниже клапана легочной артерии в отточной зоне правого желудочка. Размеры межжелудочковых дефектов могут быть от нескольких миллиметров до полного отсутствия с образованием общего желудочка.
Клиника порока зависит от степени нарушения гемодинамики, обусловленной параметрами дефекта, уровнем давления в легочной артерии, сопротивлением сосудов малого круга, величиной и направлением сброса крови через дефект. Гемодинамические расстройства выражаются в сбросе крови через дефект межжелудочковой перегородки слева направо. Внутриутробно дефект не оказывает значительного влияния на гемодинамику, так как малый круг кровообращения в этот период не функционирует. После рождения на фоне физиологического высокого сопротивления сосудов малого круга кровообращения при небольших дефектах (0,2–1 см) сброс крови слева направо невелик и существенно не влияет на гемодинамику. В этих случаях сброс крови небольшой и компенсация маловыраженных гемодинамических изменений реализуется незначительной гипертрофией левого желудочка.
При средних и больших размерах дефектов (l–3 см) давление в левом желудочке в 4 раза больше, чем в правом. Сброс может быть очень велик, и минутный объем малого круга кровообращения в несколько раз превышает минутный объем большого круга. Компенсация гемодинамических нарушений вначале осуществляется гипертрофией левого желудочка. Увеличенный легочный кровоток приводит к переполнению венозной части малого круга кровообращения, повышая давление в легочных венах и левом предсердии. В результате этого включается нейрогуморальный механизм (рефлекс Китаева), ведущий к спазму и последующей гипертрофии и склерозу легочных артериол. Развивается прогрессирующая гипертензия в малом круге кровообращения — легочная гипертензия, которая определяет тяжесть течения порока. По мере возрастания легочной гипертензии уменьшается сброс артериальной крови, и, когда сопротивление сосудов малого круга начинает превышать сопротивление сосудов большого круга кровообращения, артериально-венозный сброс меняет направление. Развивается венозно-артериальный сброс — через дефект межжелудочковой перегородки венозная кровь из правого желудочка сбрасывается в левый, появляется цианоз (реакция Эйзенменгера). Повышение давления в малом круге кровообращения ведет к гипертрофии миокарда правых отделов сердца. У некоторых больных гипертрофируются мышцы выходной части правого желудочка с формированием сужения путей оттока из него. Образованное таким образом сужение отверстия легочного ствола защищает легочные сосуды от гипертензии посредством увеличения нагрузки на правый желудочек.
Малые дефекты в мышечной части перегородки (болезнь Толочинова — Роже) часто протекают без нарушений гемодинамики и клинически проявляются лишь наличием грубого, скребущего систолического шума («много шума из ничего») с эпицентром в III–IV межреберьях слева от грудины. Величина шума не пропорциональна величине дефекта.
При дефектах средней величины (0,5–2 см в диаметре) у больных появляются симптомы гемодинамических расстройств, склонность к частным бронхолегочным заболеваниям.
Ранняя неонатальная и постнатальная диагностика. Небольшие ДПМЖ выявляются на 3-и — 5-е сутки после рождения, не оказывая воздействия на развитие ребенка. Умеренный ДМЖП проявляется одышкой, быстрой утомляемостью при кормлении, отставанием в физическом развитии. Выраженный артериально-венозный сброс крови в первый месяц жизни сопровождается преходящим нерезко выраженным цианозом при кормлении и крике ребенка, так как повышение давления в правых отделах сердца при этом вызывает венозно-артериальный сброс крови. У детей первого года жизни развиваются высокая легочная гипертензия, недостаточность кровообращения, гипотрофия. Для новорожденных характерна небольшая интенсивность шума в первые недели и даже месяцы жизни, что обусловлено физиологически повышенным внутрисосудистым легочным сопротивлением. Особенностью шумовой картины при ДМЖП в раннем неонатальном периоде является нарастание шумовой картины.
На электрокардиограмме у новорожденного ребенка определяются признаки гипертрофии левых и правых отделов сердца, на фонокардиографии — интенсивный высокочастотный ромбовидный систолический шум, занимающий всю систолу. При этом характерно увеличение интенсивности систолического шума от 1-х до 7-х суток жизни.
Ультразвуковые данные: непосредственная визуализация дефекта межжелудочковой перегородки, патологический кровоток при цветной допплерокардиографии, признаки объемной перегрузки левого желудочка (усиление экскурсии межжелудочковой перегородки и миокарда задней стенки левого желудочка), увеличение амплитуды диастолической экскурсии передней створки митрального клапана, увеличение размеров левого желудочка и левого предсердия, изменение характера движения межжелудочковой перегородки при М-сканировании на уровне края дефекта.
Критерии постнатальной диагностики следующие:
I. Анамнестические: наличие в генеалогическом анамнезе врожденных либо приобретенных заболеваний сердечно-сосудистой системы, заболевания матери во время беременности, особенно в первом триместре, воздействие на беременную токсических, химических и др. факторов, радиоактивного излучения; неблагоприятный акушерский анамнез (аборты, выкидыши), ранняя либо поздняя беременность, большая разница в возрасте родителей, кровнородственные браки; приступы цианоза, асфиксии в периоде новорожденности, отставание в физическом развитии, частые пневмонии, бронхиты у ребенка.
II. Клинические: быстрая утомляемость, одышка при нагрузке; деформация грудной клетки в области грудины («сердечный горб»), усиленный, разлитой верхушечный толчок, систолическое дрожание, максимально выраженное в III–IV межреберьях слева у края грудины; смещение границ относительной сердечной тупости влево (за счет расширения сосудистого пучка, выбухания сердечной талии, гипертрофии и смещения левого желудочка) и вправо; первый тон на верхушке слышен плохо, так как сливается с грубым, интенсивным систолическим шумом над областью сердца с максимальным звучанием в III–IV межреберьях у левого края грудины, проводящимся за его пределы влево в подмышечную и межлопаточную области; второй тон над легочной артерией усилен и расщеплен; отмечается тенденция к снижению систолического артериального давления.
III. Параклинические: на электрокардиограмме имеются признаки перегрузки и гипертрофии левых отделов сердца, позднее — и правых отделов по мере развития легочной гипертензии; на фонокардиографии: высокоамплитудный систолический шум, занимающий всю систолу с максимумом амплитуды у левого края грудины на уровне III–IV межреберий (рис. 2).
/73.jpg)
Форма шума при этих пороках различна: при низких дефектах он имеет форму ленты, а при высоких — неправильного ромба; увеличение амплитуды легочного компонента второго тона. Эхокардиографические: увеличение объемов правого желудочка, левого предсердия и левого желудочка; исчезновение визуализации дефекта межжелудочковой перегородки при ДМЖП больших диаметров. Рентгенологические: усиление легочного сосудистого рисунка (рис. 3), увеличение размеров сердца за счет расширения легочного ствола (выбухание дуги легочной артерии) и гипертрофии правого желудочка. В передней прямой проекции талия сердца сглажена или выбухает, верхушка закруглена и приподнята над диафрагмой, правый контур смещен вправо. В левой и правой передних косых проекциях сужено ретростернальное пространство.
/74.jpg)
Необходимо подчеркнуть, что недостаточное знание клиники дефекта межжелудочковой перегородки приводит к неверной трактовке динамики симптомов, имеющей роковые последствия. Иногда постепенное уменьшение грубого систолического шума педиатры рассматривают как положительную динамику и не обращают внимание на усиление акцента второго тона над легочной артерией, а в действительности это обусловлено нарастающей легочной гипертензией. В результате больные поступают в кардиохирургическую клинику с тяжелой легочной гипертензией, выраженным склерозированием сосудов малого круга кровообращения. При этом рентгенологически отмечаются расширение главного ствола и крупных ветвей легочной артерии в сочетании с обеднением сосудистого рисунка в периферических отделах легких (симптом «обрубленного дерева»), свидетельствующие о глубоких анатомических изменениях легочных сосудов, когда хирургическое лечение уже невозможно.
Дифференциальную диагностику при ДМПЖ необходимо проводить с открытым артериальным протоком с одним систолическим шумом при легочной гипертензии, с атриовентрикулярной коммуникацией, общим артериальным стволом, изолированным стенозом легочной артерии, недостаточностью митрального клапана, стенозом аорты.
Лечение. Небольшие мышечные ДМЖП довольно часто закрываются спонтанно (80–90 %) в первые 2 года жизни и не требуют медицинского и хирургического вмешательства. Медикаментозная коррекция необходима детям с умеренным и большим ДМПЖ при развитии застойной сердечной недостаточности. Назначаются дигоксин в качестве инотропного средства, мочегонные (фуросемид) для снижения объемной перегрузки. При снижении уровня калия в крови в лечение включают спиронолактон или препараты калия. Для снижения легочного сосудистого сопротивления рекомендуют ингибиторы ангиотензинпревращающего фермента (каптоприл). При назначении этих препаратов необходим контроль за уровнем калия в крови, спиронолактон и препараты калия назначают в меньших дозах. Неэффективность медикаментозной коррекции в первые 6 месяцев требует хирургического лечения мышечного ДМЖП. Хирургическое лечение заключается в ушивании или пластике дефекта, которые проводятся в большинстве возрастных групп с показателем смертности до 3 %.
У новорожденных с массой тела менее 3 кг более низкий риск с выполнением паллиативной операции — сужение легочной артерии. У больных с множественными мышечными ДМЖП на первом этапе также выполняется паллиативная коррекция — сужение легочной артерии, которое ограничивает величину лево-правого сброса. В последующем возможно уменьшение размеров дефектов или их спонтанное закрытие. Оптимальный для операции возраст — 5–9 лет.
Прогноз. У детей с маленьким ДМЖП прогноз благоприятный. При больших ДМЖП и своевременно проведенной медикаментозной и хирургической коррекцией порока прогноз хороший. Позднее распознавания порока и позднее хирургическое лечение ухудшают отдаленный прогноз, обусловливая возникновение легочного сосудистого обструктивного заболевания. При благоприятном течении заболевания существенных ограничений физических нагрузок не требуется.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Берман Р.Э. Педиатрия по Нельсону: В 5 т.: Пер. с англ. / Р.Э. Берман, Р.М. Клигман, Х.Б. Дженсон; под ред. А.А. Баранова. — М.: ООО «Рид Элсивер», 2009. — Т. 4. — 1112 с.: ил. — Перевод изд. Nelson Textbook of Pediatrics, 17th edition / Richard E. Behrman, Robert M. Kliegman, Hal B. Jenson. — С. 603-744.
2. Болезни сердца и сосудов: Руководство Европейского общества кардиологов / Под ред. А. Дж. Кэмма, Т.Ф. Люшера, П.В. Серруиса: Пер. с англ. / Под ред. Е.В. Шляхто. — М.: –ГЭОТАР-Медиа, 2011. — 2294 с.
3. Волосовець О.П. Стан надання медичної допомоги дітям із кардіоревматологічною патологією / О.П. Волосовець // Здоровье ребенка. — 2015. — № 5. — С. 125-133.
4. Воробьев А.С. Амбулаторная эхокардиография у детей: Руководство для врачей / А.С. Воробьев. — СПб.: СпецЛит, 2010. — 643 с.: ил.
5. Врожденные пороки развития: доклад Секретариата: ЕВ 126/10 // 126-я сессия Исполнительного комитета ВОЗ: пункт 4.7 предварительной повестки дня, 3 декабря 2009 г., Женева. — Женева, 2009. — 9 с.
6. Врожденные пороки развития: Практ. рук. / В.Н. Запорожан, И.Л. Бабий, С.Р. Галич и др. — Одесса: ОНМедУ, 2012. — 320 с.
7. Діагностика та моніторинг вроджених вад серця у новонароджених: Навч. посібник / О.П. Волосовець, Г.С. Сенаторова, М.О. Гончарь, А.Д. Бойченко. — Х., 2013. — 108 с.
8. Кардиология детского возраста / Под ред. А.Д. Царегородцева, Ю.М. Белозерова, Л.В. Брегель. — М.: ГЭОТАР-Медиа, 2014. — 784 с.
9. Кардиология и ревматология детского возраста / Под ред. Г.А. Самсыгиной, М.Ю. Щербаковой. — 2-е изд. — М.: Медпрактика, 2009. — 319 с.
10. Мутафьян О.А. Детская кардиология / О.А. Мутафьян. — М.: ГЭОТАР-Медиа, 2009. — 504 с.
11. Мутафьян О.А. Пороки сердца у детей и подростков / О.А. Мутафьян. — М.: ГЭОТАР-Медиа, 2009. — 560 с.
12. Райдинг Э. Эхография: Практическое руководство / Э. Райдинг: Пер. с англ. — М.: МЕДпресс-информ, 2010. — 169 с.
13. Черная Н.Л. Новорожденный ребенок. Основы оценки состояния здоровья и рекомендации по профилактике его нарушений: Рук-во для врачей / Н.Л. Черная, В.В. Шилкин. — СПб.: СпецЛит, 2009. — 352 с.
14. Шарыкин А.С. Врожденные пороки сердца: Руководство для педиатров, кардиологов, неонатологов / А.С. Шарыкин. — 2-е изд. — М.: Бином, 2009. — 384 с.
15. Nisli K. Prevalence of congenital heart defects in patients with Down’s syndrome / K. Nisli // Jornal de pediatria (Rio J). — 2009 Sep — Oct. — 85(5). — 377-8. — doi: 10.2223/JPED.1940.
16. Levels and trends in child mortality: report UNISEF/WHO, World Bank, UN. — New York: UNISEF, 2012.
/72.jpg)
/73.jpg)
/74.jpg)