Статтю опубліковано на с. 43-48
Останніми роками значно підвищилася зацікавленість педіатрів і лікарів загальної практики — сімейної медицини питанням вегетативної дисфункції (ВД) у дітей, що обумовлено збільшенням частоти вегетативних порушень у дитячому віці, різким «омолодженням» даної патології (страждають діти віком 4–7 років). Так, за даними Київського міського центру вегетативних дисфункцій у дітей, кількість госпіталізованих хворих із ВД збільшилася у 3 рази за останні роки, поширеність цієї патології досягла показника 7,5 на 1000 дитячого населення, що в структурі захворювань пацієнтів віком до 18 років становить майже 20 % усієї патології [15, 19]. Наразі ВД є одним із найбільш поширених захворювань серед підлітків. За даними різних авторів, частота її серед хлопчиків коливається від 54,6 до 72,6 %, а серед дівчаток — від 62,4 до 78,2 %, що зумовлено пубертатною гормональною перебудовою організму, психоемоційним та розумово-фізичним навантаженням [19]. Зацікавленість цією проблемою пов’язана також із тим, що ВД є фактором, який може стати підґрунтям для розвитку багатьох соматичних захворювань, насамперед артеріальної гіпертензії з подальшим розвитком гіпертонічної хвороби.
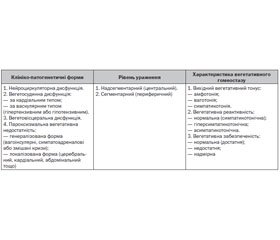
На сьогодні ВД зараховується до психосоматичних захворювань. В сучасній класифікації (МКХ 10-го перегляду) дана патологія подана в окремій рубриці F45.3 (соматоформна вегетативна дисфункція). Вегетативна дисфункція визначається як захворювання організму, що характеризується cимптомокомплексом розладу психоемоційної і вегетативної активності, пов’язане з надсегментарними та сегментарними порушеннями вегетативної регуляції діяльності різних органів і систем [15, 19]. З 2000 року в педіатричній практиці України використовується класифікація за В.Г. Майданником зі співавт. (табл. 1).
Вегетосудинна дисфункція (ВСД) — це клініко-патогенетична форма ВД, при якій первинними та домінуючими є поліморфні клінічні прояви, пов’язані з порушеннями нейрогуморальної регуляції серцевої діяльності та системного кровообігу внаслідок функціонального ушкодження вегетативних структур різного рівня.
Під впливом факторів, що викликають розвиток ВСД (спадково-конституціональні особливості діяльності вегетативної нервової системи (ВНС), несприятливий перебіг вагітності та пологів, ендокринна перебудова організму, психоемоційне, розумове, фізичне напруження, ураження головного мозку різного походження, гострі та хронічні інфекційні, соматичні захворювання, хронічні вогнища інфекцій, патологічний вплив токсичних продуктів, несприятливі метеорологічні умови, порушення мінерального обміну та багато іншого), формуються такі синдроми:
— синдром порушення функції збудливості міокарда, що проявляється тахі-, брадикардією, екстрасистолією, прискоренням атріовентрикулярної провідності, сповільненням внутрішньошлуночкової провідності. У механізмі розвитку лежить порушення збудливості кіркових структур, глибинних вегетативних відділів мозку, нейросекреції, гормональні відхилення, реципрокні порушення між симпатичною нервовою системою (СНС) і парасимпатичною нервовою системою (ПСНС);
— гіперкінетичний синдром: артеріальна гіпертензія, підвищення ударного об’єму крові. Патофізіологічна сутність полягає в активації симпатоадреналової системи, гормонів гіпофіза, кори надниркових залоз;
— синдром скоротливої дисфункції міокарда, що суб’єктивно представлений неприємними відчуттями в ділянці серця, задишкою при фізичному навантаженні, артеріальною гіпотензією. Його прояви пов’язані з розладом функції підсилювального нерва, підвищенням кінцевого діастолічного тиску з порушенням розслаблення міокарда;
— синдром тонічної дисфункції міокарда: пролапс клапанів серця, порушення тонічності папілярних і хордальних м’язів серця. Патофізіологічна сутність полягає в порушенні рецепторних відношень СНС і ПСНС, зміні тонічності серцевого м’яза;
— міокардіальний (міокардіодистрофічний) синдром, який проявляється стійкими кардіалгіями, що підсилюються при фізичному навантаженні, ознаками порушення реполяризації. В механізмі розвитку лежать зміни мембранного потенціалу та каналів іонного транспорту, зниження ударного об’єму крові [15].
Значне місце в порушенні вегетативної регуляції організму, особливо в діяльності серцево-судинної системи, належить стресу. З англійської слово «stress» перекладається як «напруження». Концепцію стресу сформулював канадський дослідник Н. Selye (Г. Сельє) в 1936 р. Наразі поняття «стрес» визначається як сукупність неспецифічних адаптаційних реакцій організму на дію різноманітних несприятливих факторів (фізичних або психологічних), що порушують гомеостаз. Цей термін увійшов у наше життя як слово загального вжитку. Більшість людей у нього вкладають значення нервового перенапруження, проте нервовий стрес є тільки одним із компонентів змін в організмі людини у відповідь на сильний подразник. Так, поняття про стрес самим же Г. Сельє (1960) було змінене. Ним було виявлено, що навіть такі стимули, як короткочасне м’язове напруження чи психічне збудження, викликають стимуляцію кори надниркових залоз. Г. Сельє (1960) поєднав всі ці реакції під загальним терміном «стрес». Отже, виникли поняття «еустрес» — позитивна реакція на подразник і «дистрес» — негативна реакція на подразник [20].
Фізичний, розумовий і соціальний стрес, який не перевищує певного індивідуального рівня (еустрес), необхідний для підтримки розумових і фізичних функцій, запобігання погіршенню здоров’я [9]. У випадку надлишкового чи тривало діючого стресору, який перевищує адаптаційні можливості даного організму, виникає дистрес, що призводить до порушення взаємодії між емоційним і вегетативним забезпеченням дитини та до запуску патогенетичних механізмів ВСД як за кардіальним, так і за васкулярним типом [3].
До провокуючих факторів, що викликають дистрес з подальшим виникненням ВСД у дітей, належать: надмірне психоемоційне напруження, пов’язане з несприятливою обстановкою в сім’ї, школі; розумова перевтома, що загострюється негативною дією гаджетів на мозкові процеси, гіподинамією та недостатньою тривалістю нічного сну [9, 14, 22].
Зважаючи на вищеозначене, правомірним є вислів Г. Сельє: «Стрес з медичної, соціологічної і філософської точки зору є найбільш значущим предметом для людства» [32]. Разом із тим доведена надзвичайно важлива роль мікроелементів у адекватному функціонуванні нашого організму. Техногенні впливи, з одного боку, та патологічні зміни в умовах стресової адаптації — з другого можуть сприяти порушенню обміну окремих макро- та мікроелементів в організмі людини: виникає їх надлишок, недостатність або дисбаланс [12]. Подібні метаболічні зміни, без сумніву, можуть змінювати характер діяльності органів і систем, викликаючи появу клінічної симптоматики, за відсутності структурної патології організму, що характерно для ВСД. Так, динамічна стабільність мікроелементного статусу є однією з необхідних ланок підтримання гомеостазу [11, 13].
Одним з основних елементів, що підтримує баланс процесів збудження-гальмування в нашому організмі, є магній [4, 6], що розглядається як периферичний компонент стрес-лімітуючої системи організму, тому що всі його ефекти спрямовані на зменшення проявів стресу та нормалізацію адаптаційних процесів [18]. Доведено, що майже завжди стресові стани, як фізичні, так і психоемоційні, супроводжуються дефіцитом магнію [8, 21, 25, 26], оскільки підвищене виділення адреналіну і норадреналіну в стані стресу сприяє виведенню магнію з клітин, зменшенню його внутрішньоклітинного вмісту та високій концентрації у первинній сечі у вигляді нерозчинних солей, що практично реабсорбуються, виділяючись із сечею [4]. Чітко встановлено, що магній втрачається після гострих переживань, станів страху, хвилювання (екзамен, змагання) [25]. Зменшення рівня іонізованого магнію крові призводить до виходу катіону з депо, спричиняючи розвиток внутрішньоклітинної магнієвої недостатності (дві третини внутрішньоклітинного магнію присутні у кістковій тканині, а інша третина — у гладкій або поперечносмугастій мускулатурі та в еритроцитах).
У роботі I. Sendowski (2006) показано, що стресова ситуація, викликана інтенсивним шумовим впливом, призводить до значного підвищення екскреції магнію з сечею (p = 0,017), також при цьому збільшується рівень іону в крові (p < 0,001). Відзначено, що переносимість шуму як стресового фактора при терапії магнієм підвищується, його використовують навіть після травматичних шумових впливів [31].
Проведені останніми роками багатоцентрові дослідження показали, що серед дітей віком до 4 років низький рівень магнію в сироватці крові виявляється у 12 %, 5–11 років — у 28 % [28]. За нормою вміст магнію в сироватці крові дітей варіює від 0,66 до 1,03 ммоль/л. У дітей віком 12–19 років дефіцит магнію був більш виражений, ніж дефіцит міді, цинку та заліза, і виявлявся у 40 % дівчаток і 35 % хлопчиків. Ці діти та підлітки відрізняються більш високим рівнем стресу функції [27].
Встановлено, що вміст магнію в сечі прямо корелює з внутрішньоклітинним умістом цього катіону [33]. Добова екскреція магнію з сечею за нормою знаходиться в межах 2,1–6,4 ммоль/добу, її зменшення є одним із компенсаторних механізмів, що необхідний для підтримання його сталого рівня в крові, тканинах і дає можливість діагностувати дефіцит магнію більш точно, навіть на ранніх стадіях. Так, за даними Ю.В. Марушко, Т.В. Гищак (2010–2014) [16, 17], зниження рівня магнію в сироватці крові виявляється у 13,4–18,7 % дітей віком 8–16 років з астенічним синдромом на фоні різної соматичної патології, а в добовій сечі — у 94,4 % випадків. У дітей з вираженою астенією спостерігається в 1,8 раза менша екскреція магнію з сечею порівняно з дітьми без астенічного синдрому (табл. 2).
/45.jpg)
Експериментальні дослідження показали, що дефіцит магнію викликає порушення сну. В роботі Вillyard et al. (2006) тварини з дефіцитом магнію (порушення в дієті протягом 4 тижнів) мали рівні мелатоніну (з 4-ї по 7-му годину темної частини доби) 50 ± 5 пг/мл, а у групі порівняння — 75 ± 7 пг/мл [24]. Це пов’язано з тим, що дефіцит магнію викликає порушення вироблення мелатоніну внаслідок зниження активності відповідного магнійзалежного ферменту — серотоніну-N-ацетилтрансферази, в той час як магній збільшує активність цього ферменту і сон нормалізується. Роль мелатоніну є значною у підтриманні адаптаційних можливостей організму при стресі, оскільки він належить до стрес-лімітуючої системи [18].
Згідно з даними М.В. Хайтовича (2003), єдиним універсальним механізмом відповіді на несприятливі фактори є зміни нейроендокринної регуляції та інтенсифікація процесів перекисного окислення ліпідів [23]. Разом із тим Y. Rayssiguier із співавт. [29, 30] показали, що у тварин з дефіцитом магнію збільшується чутливість до оксидантного стресу, що супроводжується збільшенням продуктів перекисного окислення ліпідів, накопичення яких сприяє ранньому старінню клітин.
З вищенаведеного варто запам’ятати, що стрес і магнієва недостатність є взаємообумовленими процесами, що поглиблюють один одного та викликають на початкових етапах зміни у функціонуванні органів і систем без органічних порушень, як, наприклад, при ВСД у дітей. Це підтверджує і той факт, що для визначення рівня стресу використовують шкалу оцінки дефіциту магнію (О.А. Громова, 2012) [7].
Магній є фізіологічним регулятором збудливості клітини, виявляє мембраностабілізуючу дію. Магнієвмісні ферменти й іони магнію регулюють нейрохімічні процеси, зокрема синтез нейропептидів у головному мозку, синтез і деградацію катехоламінів й ацетилхоліну. Магній як кофактор бере участь у багатьох ферментативних процесах, зокрема в гліколізі, гідролітичному розщепленні аденозинтрифосфату (АТФ). Перебуваючи в комплексах з АТФ, іони магнію забезпечують вивільнення енергії через активність магнійзалежних АТФаз і необхідні для всіх енергоспоживчих процесів в організмі. Як кофактор піруватдегідрогеназного комплексу, іони магнію забезпечують надходження продуктів гліколізу до циклу Кребса і перешкоджають накопиченню лактату. Крім того, магній активно бере участь в анаболічних процесах: синтезі та розпаді нуклеїнових кислот, синтезі білків, жирних кислот і ліпідів. Застосування препаратів магнію необхідне з метою активації ферментів, утворення високоенергетичних зв’язків, посилення в клітинах організму біохімічних процесів, що забезпечує поліпшення переносимості фізичних і психологічних навантажень, підвищення витривалості, припинення спазмів і болю в м’язах, зниження рівня неспокою, нервозності, дратівливості [15].
Потреба в магнії у дітей від народження до статевого дозрівання становить 10–30 мг/кг маси тіла на добу. В осінньо-зимовий період спостерігається мінімальна забезпеченість організму магнієм (А.В. Скальний, 2009).
Отже, магній є одним з ефективних антистресових компонентів, що істотно підвищують адаптаційні резерви організму дитини, при цьому є природним, ендогенним субстратом, що не викликає побічних ефектів, звикання, залежності. Дане твердження доведено в роботах О.С. Акарачкової [1, 2], де показано, що підвищення рівня внутрішньоклітинних макроергічних сполук сприяє зростанню функціональних резервів систем організму та розвитку адекватних адаптаційних реакцій.
Привертають увагу і вітаміни групи В, що, як відомо, забезпечують нормалізацію обмінних процесів у мозку, впливають на неспецифічну реактивність організму, підвищують опір до психоемоційних, фізичних навантажень. Так, піридоксин гідрохлорид (вітамін B6) бере участь в обміні білків, вуглеводів, жирних кислот, синтезі нейромедіаторів і багатьох ферментів, має нейро-, кардіо-, гепатотропний і гемопоетичний вплив, сприяє поповненню енергетичних ресурсів. Також доведено антистресові ефекти піридоксину, зумовлені активацією ряду В6-залежних білків [7].
Лікування дітей із ВСД повинно починатися із загальних заходів, спрямованих на нормалізацію показників вегетативного статусу. Перш за все корекція режиму дня — достатній нічний сон (8–10 годин), чергування розумових і фізичних навантажень, профілактика гіподинамії, з подальшим загартовуванням, заняттями лікувальною фізкультурою (підбір вправ проводиться так, аби їх інтенсивність була достатньою в оздоровчому і тренувальному плані, поруч із цим не були перевищені функціональні можливості пацієнта) та фізіотерапевтичним лікуванням.
Необхідно підтримувати нормальний психологічний клімат у родині дитини, намагатися усувати конфліктні ситуації та нервово-психічні перевантаження в сім’ї, школі. Чітко регламентувати час перегляду телепередач, ігор і роботи з гаджетами.
Велике значення має правильне харчування. Потрібно намагатися збільшити надходження солей магнію та калію в організм, бо вони сприяють відновленню порушеного балансу між відділами ВНС. Особливо багата на магній рослинна їжа (свіжі або приготовлені на пару овочі), крупи (гречана, пшенична, перлова, вівсяна), бобові, горіхи. В шлунково-кишковому тракті абсорбується до 40–50 % магнію, що надходить із їжею. Недостатність магнію певною мірою зумовлена сучасними технологіями обробки харчових продуктів (рафінуванням), застосуванням мінеральних добрив у сільському господарстві (останні призводять до дефіциту магнію у ґрунті, зменшення його вмісту у харчових продуктах), надлишок кальцію в їжі, запальна патологія травного каналу з порушенням всмоктування, стрес, фізичні перевантаження (В.Г. Бурчинський, 2004).
Зважаючи на вищеозначене, патогенетично обґрунтованим у комплексному лікуванні ВСД у дітей є призначення препаратів магнію. Час насичення тканинних депо при терапії магнієм — 2 місяці та більше. Вибір засобів для корекції магнієвого дефіциту добре відомий — це неорганічні й органічні солі магнію. Перше покоління магнійумісних препаратів включало неорганічні солі, що засвоювалися не більше ніж на 5 %, стимулювали перистальтику кишечника, нерідко призводячи до діареї. Всмоктування магнію в шлунково-кишковому тракті підвищують молочна, підолова й оротова кислоти, вітамін В6 і деякі амінокислоти.
Друге покоління препаратів магнію (органічні солі) значно краще засвоюється (всмоктування в шлунково-кишковому тракті близько 50 %), не викликаючи диспепсії та діареї. До сучасних комбінованих препаратів належить Магне-В6. Висока активність останнього обумовлена синергізмом дії компонентів: піридоксин збільшує концентрацію магнію у плазмі та еритроцитах, знижуючи кількість магнію, що виводиться з організму, покращує всмоктування магнію в ШКТ, його проникнення в клітини з подальшою фіксацією. Магній, у свою чергу, активізує процес трансформації піридоксину в його активний метаболіт піридоксаль-5-фосфат у печінці. Магній і піридоксин потенціюють дію один одного, що дозволяє успішно використовувати їх комбінацію для нормалізації магнієвого балансу і профілактики нестачі цього мікроелементу [15].
Перевагою препарату Магне-В6 є його випуск у двох лікарських формах: таблетки та розчин для перорального застосування. Таблетки призначаються пацієнтам від 6 років, розчин для перорального застосування — дітям усіх вікових груп, маса яких від 10 кг. Розчин в ампулах має запах карамелі, добова доза становить від 1 до 4 ампул з розподілом дози на 2–3 прийоми під час їжі. Вміст магнію в кожній ампулі еквівалентний вмісту 100 мг Mg++ (у вигляді магнію лактату дигідрату та магнію підолату), в кожній таблетці Магне-В6 — 48 мг Mg++ (у вигляді магнію лактату дигідрату), у кожній таблетці Магне-В6 Антистрес (у вигляді магнію цитрату) — 100 мг Mg++. Більший вміст Mg++ у препараті Магне-В6 Антистрес дозволяє приймати у 2 рази менше таблеток, ніж при застосуванні Магне-В6. Так, дітям віком 6–12 років розрахунок 10–30 мг/кг магнію на добу, 4–6 таблеток Магне-В6 на добу за 2–3 прийоми під час їжі; старше 12 років та дорослі — 6–8 таблеток на добу. При цьому дозування таблеток Магне-В6 Антистрес відповідно у дітей віком 6–12 років становить 2–4 таблетки на добу, розподілені на 2–3 прийоми, понад 12 років — 3–4 таблетки [10].
Як показало дослідження О.А. Громової [5], застосування питної ампульної форми Магне-В6 забезпечує стрімке підвищення рівня магнію в плазмі крові (протягом 2–3 годин), що важливо для швидкої ліквідації магнієвого дефіциту. У той же час прийом таблеток Магне-В6 сприяє більш тривалому (протягом 6–8 годин) утриманню підвищеної концентрації магнію в еритроцитах, тобто його депонуванню.
У роботах Ю.В. Марушко, Т.В. Гищак (2010–2014) [16, 17] виявлена висока ефективність комбінованого препарату Магне-В6 у дітей з астенічним синдромом, що є наслідком хронічних стресових станів. Прийом Магне-В6 у цієї категорії пацієнтів, призводячи до стимуляції синтоксичних (стрес-лімітуючих) програм адаптації, здатний нормалізувати адаптаційні порушення, підвищити стійкість організму до тривалої дії стресових факторів, поліпшити загальний рівень здоров’я та якість життя в цілому. У дітей із незначними проявами астенії достатнім є застосування препарату протягом одного місяця. Дітям із більш вираженими проявами астенії для нормалізації самопочуття і настрою необхідне продовження терміну терапії препаратами магнію.
У роботі О.С. Акарачкової (2008) показано сприятливий вплив терапії препаратом Магне-В6 на стан пацієнтів (64 жінки віком від 20 до 49 років) з проявами ВСД та нейроциркуляторної дисфункції. Незалежно від початкового рівня дефіциту магнію, у більшості досліджуваних із вираженими симптомами хронічного стресу позитивні результати ставали помітними, починаючи з середини другого тижня терапії, і досягали яскраво виражених значень до кінця першого місяця. Разом із тим для досягнення стійкого результату рекомендується терапія протягом не менше двох місяців з повторенням курсу двічі на рік. Препарат Магне-В6 дозволяє краще справлятися з хронічними стресами та адаптуватися до них [2].
Висновки
1. Психоемоційні та розумово-фізичні навантаження призводять до запуску патогенетичних механізмів ВСД у дітей.
2. Доведено, що майже завжди стресові стани, як фізичні, так і психоемоційні, супроводжуються дефіцитом магнію.
3. Магній є одним з ефективних засобів управління стрес-реакцією організму, що істотно підвищує адаптивні резерви організму дитини.
4. Застосування препаратів магнію, особливо комбінованих, є патогенетично обґрунтованим, ефективним і безпечним у комплексному лікуванні ВСД у дітей.
Список литературы
1. Акарачкова Е.С. Дефицит магния: клиника, диагностика, терапия / Е.С. Акарачкова // Фарматека. — 2007. — № 20. — С. 25-30.
2. Акарачкова Е.С. Оценка эффективности применения Магне-В6 у пациентов с клиническими проявлениями стресса / Е.С. Акарачкова // Трудный пациент. — 2008. — Т. 6, № 2–3. — С. 34-39.
3. Вегетативные расстройства: клиника, лечение, диагностика / Под ред. А.М. Вейна. — М.: Мед. информ. агентство, 1998. — 746 с.
4. Громова О.А. Дефицит магния как проблема стресса и дезадаптации у детей / О.А. Громова, Л.Э. Федотова, А.Г. Калачева [и др.] // Педиатрия. — 2013. — № 5. — С. 110-121.
5. Громова О.А. Динамика концентрации магния в крови после приема различных магнесодержащих препаратов / О.А. Громова, И.Ю. Торшин, А.Г. Калачева [и др.] // Фарматека. — 2009. — № 10. — С. 63-68.
6. Громова О.А. Магия магния / О.А. Громова // Новая аптека. — 2014. — № 6. — С. 18-20.
7. Громова О.А. Магний и пиридоксин: основы знаний / Громова О.А. — М., 2006. — 223 с.
8. Громова О.А. Перспективы применения магния в педиатрии и детской неврологии / О.А. Громова, А.Н. Скоромец, Е.Ю. Егорова [и др.] // Педиатрия. — 2010. — Т. 89, № 5. — С. 142-149.
9. Зозуля I.С. Синдром вегетосудинної дистонiї (клiнiкa, дiагностика, лiкування) / I.С. Зозуля // Український медичний часопис. — 1997. — № 2. — С. 17-21.
10. Інструкції до застосування препарату Магне-В6 в таблетках, розчині для перорального застосування та препарату Магне-В6 Преміум.
11. Каладзе Н.Н. Итоги и перспективы изучения физиологических, патогенетических и фармакологических эффектов мелатонина / Н.Н. Каладзе, Е.М. Соболева, Н.Н. Скоромная // Здоровье ребенка. — 2010. — № 2(23). — С. 156-166.
12. Каладзе Н.Н. Роль эпифиза в хронобиологических особенностях артериальной гипертензии у детей / Н.Н. Каладзе, И.Б. Зюкова // Современная педиатрия. — 2014. — № 3(59). — С. 94-97.
13. Квашніна Л.В. Мікроелементози та їх значення у формуванні порушень адаптації у дітей молодшого шкільного віку / Л.В. Квашніна, В.П. Родіонов, В.В. Рачковська [та ін.] // Актуальні питання педіатрії: тези 8-ї Всеукраїнської наук.-практ. конференції 16–18 листопада, 2006. — С. 34.
14. Леонова Л.А. Гигиеническое нормирование длительности работы детей на персональных компьютерах / Л.А. Леонова, А.А. Бирюкович, С.С. Совватеева // Гигиена и санитария. — 1996. — № 2. — С. 25-28.
15. Майданник В.Г. Клініко-патогенетична характеристика вегетативних дисфункцій та їх лікування у дітей: навчальний посібник / В.Г. Майданник, О.І. Сміян, Т.П. Бинда, Н.О. Савельєва-Кулик; за ред. В.Г. Майданника. — Суми: Сумський державний університет, 2013. — 173 с.
16. Марушко Ю.В. Ефективність застосування Магне-В6 при астенічному синдромі і порушеннях нічного сну у дітей / Ю.В. Марушко, Т.В. Гищак // Современная педиатрия. — 2013. — № 6(53). — С. 37-44.
17. Марушко Ю.В. Корекція дефіциту магнію у дітей та підлітків з астенічним синдромом / Ю.В. Марушко, Т.В. Гищак // Проблемні питання діагностики та лікування дітей з соматичною патологією: Мат-ли наук.-практ. конференції з міжнародною участю, Харків, 28 березня 2013 р. — С. 20-22.
18. Марушко Ю.В. Системні механізми адаптації. Стрес у дітей / Ю.В. Марушко, Т.В. Гищак — К., 2014. — 158 с.
19. Педіатрія: національний підручник: у 2 т. — Т. 1 / За ред. професора В.В. Бережного. — К., 2013. — 1040 с.
20. Селье Г. Стресс без дистресса. — Рига: Виеда, 1992. — 109 с.
21. Торшин И.Ю. Молекулярные механизмы магния и пиридоксина при стрессе / И.Ю. Торшин, О.А. Громова, Е.И. Гусев // Журн. неврологии и психиатрии им. С.С. Корсакова. — 2008. — № 5. — С. 53-57.
22. Усенко С.А. Гiгiєнiчнi проблеми охорони здоров’я навчающихся пiдлiткiв / С.А. Усенко // Медицина сьогодні і завтра. — 1998. — № 1. — С. 174-176.
23. Хайтович М.В. Мітохондріальна недостатність у дітей з вегетативними дисфункціями: діагностика та лікування: автореф. дис… д-ра мед. наук: спец. 14.01.10 «Педіатрія» / М.В. Хайтович. — К., 2006. — 36 с.
24. Billyard A.J. Dietary magnesium deficiency decreases plasma melatoninin rats, magnesium research / A.J. Billyard, D.L. Eg–gett, K.B. Franz // Magnesium Research. — 2006. — Vol. 19(3). — P. 157-161.
25. Grases G. Anxiety and stress among science students. Study of calcium and magnesium alterations / G. Grases, J.A. Pérez-Castelló, P. Sanchis [et al.] // Magnes Res. — 2006. — Vol. 19(2). — Р. 102-106.
26. Libako P. Phagocyte priming by low magnesium status: input to the enhanced inflammatory and oxidative stress responses / P. Libako, W. Nowacki, E. Rock [et al.] // Magnes Res. — 2010. — Vol. 23(1). — Р. 1-4.
27. Morales-Ruan Mdel C. Iron, zinc, copper and magnesium nutritional status in Mexican children aged 1 to 11 years / Mdel C. Morales-Ruan, S. Villalpando, A. Garcia-Guerra [et al.] // Slud Publica Mex. — 2012. — Vol. 54(2). — Р. 125-134.
28. Ozmen H. The levels of calcium and magnesium, and of selected trace elements, in whole blood and scalp hair of children with growth retardation / H. Ozmen, S. Akarsu, F. Polat, A. Cukurovali / Iran J. Pediatr. — 2013. — Vol. 23(2). — Р. 125-130.
29. Rayssiguier Y. Commentary to the letter to the editor re: role of magnesium in metabolic syndrome / Y. Rayssiguier, E. Rock // Magnes. Res. — 2010. — Vol. 23(3). — Р. 146.
30. Rayssiguier Y. Magnesium deficiency and metabolic syndrome: stress and inflammation may reflect calcium activation / Y. Rayssiguier, P. Libako, W. Nowacki, E. Rock // Magnes. Res. — 2010. — Vol. 23(2). — Р. 73-80.
31. Sendowski І. Magnesium therapy in acoustic trauma, magnesium research / І. Sendowski // Magnesium Research. — 2006. — Vol. 19(4). — P. 244-254.
32. Szabo S. The legacy of Hans Selye and the origins of stress research: a retrospective 75 years after his landmark brief «letter» to the editor of nature / S. Szabo, Y. Tache, A. Somogyi // Stress. — 2012. — № 15(5). — Р. 472-478.
33. Witkowski M. Methods of assessment of magnesium status in humans: a systematic review / M. Witkowski, J. Hubert, A. Mazur // Magnes. Res. — 2011. — № 24(4). — Р. 163-180.

/44.jpg)
/45.jpg)