Журнал «Актуальная инфектология» 2 (11) 2016
Вернуться к номеру
Механизмы действия пробиотиков на основе Bacillus subtilis
Авторы: Савустьяненко А.В. - к.м.н.
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
Бактерія B.subtilis є одним iз найбільш перспективних пробіотиків, вивчених в останні десятиріччя. Механізми її пробіотичної дії пов’язані iз синтезом протимікробних речовин, посиленням неспецифічного і специфічного імунітету, стимуляцією росту нормальної мікрофлори кишечнику та виділенням травних ферментів. B.subtilis виділяє рибосомально синтезовані пептиди, нерибосомально синтезовані пептиди і непептидні речовини iз широким спектром протимікробної активності, що охоплює грампозитивнi, грамнегативнi бактерії, віруси і гриби. Резистентність до цих протимікробних речовин виникає рідко. Посилення неспецифічного імунітету пов’язане з активацією макрофагів і вивільненням iз них прозапальних цитокінів, підвищенням бар’єрної функції слизової оболонки кишечнику, виділенням вітамінів і амінокислот (включаючи незамінні). Посилення специфічного імунітету проявляється активацією Т- і В-лімфоцитів та вивільненням з останніх імуноглобулінів — IgG та IgA. B.subtilis стимулює ріст нормальної мікрофлори кишечника, зокрема бактерiй родiв Lactobacillus і Bifidobacterium. Крім того, пробіотик збільшує різноманітність мікрофлори кишечника. Пробіотик виділяє в просвіт кишечника всі основні травні ферменти: амілази, ліпази, протеази, пектинази і целюлази. На додаток до переварювання їжі ці ферменти руйнують антихарчові фактори і алергенні речовини, що містяться в спожитій їжі. Перераховані механізми дії роблять обґрунтованим застосування B.subtilis у складі комплексної терапії для боротьби з кишковими інфекціями; профілактики респіраторних інфекцій у холодну пору року; профілактики антибіотикасоційованої діареї; для корекції порушень переварювання і просування їжі різного генезу (погрішності в дієті, зміна раціону харчування, хвороби шлунково-кишкового тракту, порушення вегетативної нервової системи та ін.). B.subtilis зазвичай не викликає побічні ефекти. Для цього пробіотика характерне високе співвідношення ефективності й безпеки.
Бактерия B.subtilis является одним из наиболее перспективных пробиотиков, изученных в последние десятилетия. Механизмы ее пробиотического действия связаны с синтезом противомикробных веществ, усилением неспецифического и специфического иммунитета, стимуляцией роста нормальной микрофлоры кишечника и выделением пищеварительных ферментов. B.subtilis выделяет рибосомально синтезируемые пептиды, нерибосомально синтезируемые пептиды и непептидные вещества с широким спектром противомикробной активности, охватывающим грамположительные, грамотрицательные бактерии, вирусы и грибы. Резистентность к данным противомикробным веществам возникает редко. Усиление неспецифического иммунитета связано с активацией макрофагов и высвобождением из них провоспалительных цитокинов, повышением барьерной функции слизистой оболочки кишечника, выделением витаминов и аминокислот (включая незаменимые). Усиление специфического иммунитета проявляется активацией Т- и В-лимфоцитов и высвобождением из последних иммуноглобулинов — IgG и IgA. B.subtilis стимулирует рост нормальной микрофлоры кишечника, в частности бактерий родов Lactobacillus и Bifidobacterium. Кроме того, пробиотик увеличивает разнообразие микрофлоры кишечника. Пробиотик выделяет в просвет кишечника все основные пищеварительные ферменты: амилазы, липазы, протеазы, пектиназы и целлюлазы. В дополнение к перевариванию пищи данные ферменты разрушают антипищевые факторы и аллергенные вещества, содержащиеся в поступающей пище. Перечисленные механизмы действия делают обоснованным применение B.subtilis в составе комплексной терапии для борьбы с кишечными инфекциями; профилактики респираторных инфекций в холодное время года; профилактики антибиотикассоциированной диареи; для коррекции нарушений переваривания и продвижения пищи различного генеза (погрешности в диете, изменение рациона питания, болезни желудочно-кишечного тракта, нарушения вегетативной нервной системы и др.). B.subtilis обычно не вызывает побочные эффекты. Для данного пробиотика характерно высокое соотношение эффективности и безопасности.
The bacterium B.subtilis is one of the most promising probiotics studied in recent decades. Mechanisms of its probiotic action are associated with the synthesis of antimicrobial agents, increasing of non-specific and specific immunity, stimulation of growth of normal microflora of the intestine and the releasing of digestive enzymes. B.subtilis releases ribosomally synthesized peptides, non-ribosomally synthesized peptides and non-peptide substances with a broad spectrum of antimicrobial activity covering Gram-positive, Gram-negative bacteria, viruses and fungi. Resistance to these antimicrobial agents is rare. Enhancement of non-specific immunity is associated with macrophage activation and the release of pro-inflammatory cytokines from them, increasing of barrier function of the intestinal mucosa, releasing of vitamins and amino acids (including essential ones). Enhancement of specific immunity manifests by activation of T- and B-lymphocytes and the release from the latter of immunoglobulins — IgG and IgA. B.subtilis stimulates the growth of normal intestinal flora, in particular, bacteria of the genus Lactobacillus and Bifidobacterium. Furthermore, probiotic increases the diversity of intestinal microflora. Probiotic secretes all major digestive enzymes to the intestinal lumen: amylases, lipases, proteases, pectinases and cellulases. In addition to digestion, these enzymes destroy antinutritional factors and allergenic substances contained in the food. These mechanisms of action make reasonable the use of B.subtilis in the combination therapy to treat intestinal infections; prevention of respiratory infections during the cold season; prevention of antibiotic-associated diarrhea; for the correction of food digestion and movement impairments of various origin (errors in the diet, changes in the diet, diseases of the gastrointestinal tract, disorders of the autonomic nervous system, etc.). B.subtilis does not usually cause side effects. This probiotic is characterized by a high efficacy and safety ratio.
Bаcillus subtilis, пробіотик, механізми дії.
Bacillus subtilis, пробиотик, механизмы действия.
Bacillus subtilis, probiotic, mechanisms of action.
Статья опубликована на с. 35-44
К пробиотикам относят «живые микроорганизмы, которые при введении в адекватных количествах оказывают положительное влияние на здоровье хозяина» [1]. В то время как применению некоторых из них (Lactobacillus, Bifidobacterium) было уделено много внимания, другие были изучены позже, и их важное лечебное действие становится ясным только сейчас. Одним из пробиотиков является грамположительная палочка Bacillus subtilis (B.subtilis).
/36.jpg)
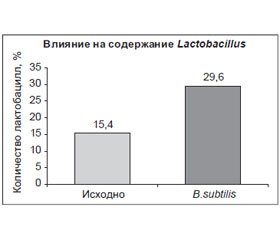
Механизмы пробиотической активности B.subtilis
/39.jpg)
Примеры клинических исследований
/40.jpg)
Безопасность
Выводы
1. FAO/WHO (2001) Health and Nutritional Properties of Probiotics in Food including Powder Milk with Live Lactic Acid Bacteria. Food and Agriculture Organization of the United Nations and World Health Organization Expert Consultation Report / FAO/WHO. — 2001. — ftp://ftp.fao.org.
2. Sorokulova I. Modern Status and Perspectives of Bacillus Bacteria as Probiotics // J. Prob. Health. — 2013. — Vol. 1, № 4. — Numb. of publ. 1000e106.
3. Olmos J., Paniagua-Michel J. Bacillus subtilis A Potential Probiotic Bacterium to Formulate Functional Feeds for Aquaculture // J. Microb. Biochem. Technol. — 2014. — Vol. 6, № 7. — P. 361-365.
4. Evaluation of Bacillus subtilis R0179 on gastrointestinal viability and general wellness: a randomised, double-blind, placebo-controlled trial in healthy adults / Hanifi A., Culpepper T., Mai V. et. al. // Benef. Microbes. — 2015. — Vol. 6, № 1. — P. 19-27.
5. Leser T.D., Knarreborg A., Worm J. Germination and outgrowth of Bacillus subtilis and Bacillus licheniformis spores in the gastrointestinal tract of pigs // J. Appl. Microbiol. — 2008. — Vol. 104, № 4. — P. 1025-1033.
6. Jadamus A., Vahjen W., Simon O. Growth behaviour of a spore forming probiotic strain in the gastrointestinal tract of broiler chicken and piglets // Arch. Tierernahr. — 2001. — Vol. 54, № 1. — P. 1-17.
7. Fate and Dissemination of Bacillus subtilis Spores in a Murine Model / Hoa T.T., Duc L.H., Isticato R. et al. // Applied and Environmental Microbiology. — 2001. — Vol. 67, № 9. — P. 3819-3823.
8. The Intestinal Life Cycle of Bacillus subtilis and Close Relatives / Tam N.K.M., Uyen N.Q., Hong H.A. et al. // Journal of Bacteriology. — 2006. — Vol. 188, № 7. — P. 2692-2700.
9. Stein T. Bacillus subtilis antibiotics: structures, syntheses and specific functions // Mol. Microbiol. — 2005. — Vol. 56, № 4. — P. 845-857.
10. Production of Antimicrobial Metabolites by Bacillus subtilis Immobilized in Polyacrylamide Gel / Awais M., Pervez A., Yaqub Asim, Shah M.M. // Pakistan J. Zool. — 2010. — Vol. 42, № 3. — P. 267-275.
11. Леляк А.А., Штерншис М.В. Антагонистический потенциал сибирских штаммов Bacillus spp. в отношении возбудителей болезней животных и растений // Вестник Томского государственного университета. Биология. — 2014. — № 1. — С. 42-55.
12. Antimicrobial Compounds Produced by Bacillus spp. and Applications in Food / Baruzzi F., Quintieri L., Morea M., Caputo L. // Science against Microbial Pathogens: Communicating Current Research and Technological Advances (Vilas A.M., ed.). — Badajoz, Spain: Formatex, 2011. — P. 1102-1111.
13. Two different lantibiotic-like peptides originate from the ericin gene cluster of Bacillus subtilis A1/3 / Stein T., Borchert S., Conrad B. et al. // J. Bacteriol. — 2002. — Vol. 184, № 6. — P. 1703-1711.
14. Wang G. Human Antimicrobial Peptides and Proteins // Pharmaceuticals. — 2014. — Vol. 7, № 5. — P. 545-594.
15. Antimicrobial peptides of the genus Bacillus: a new era for antibiotics / Sumi C.D, Yang B.W., Yeo I.C., Hahm Y.T. // Can. J. Microbiol. — 2015. — Vol. 61, № 2. — P. 93-103.
16. Effects of Bacillus subtilis B10 spores on viability and biological functions of murine macrophages / Huang Q., Xu X., Mao Y.L. et al. // Anim. Sci. J. — 2013. — Vol. 84, № 3. — P. 247-252.
17. Modulatory Effects of Bacillus subtilis BS02 on Viability and Immune Responses of RAW 264.7 Murine Macrophages / Huang Q., Li Y.L., Xu X. et al. // Journal of Animal and Veterinary Advances. — 2012. — Vol. 11, № 11. — P. 1934-1938.
18. Immunomodulatory effects of Bacillus subtilis (natto) B4 spores on murine macrophages / Xu X., Huang Q., Mao Y. et al. // Microbiol. Immunol. — 2012. — Vol. 56, № 12. — P. 817-824.
19. Bacillus subtilis-based direct-fed microbials augment macrophage function in broiler chickens / Lee K.W., Li G., Lillehoj H.S. et al. // Res. Vet. Sci. — 2011. — Vol. 91, № 3. — P. e87-e91.
20. Protection from intestinal inflammation by bacterial exopolysaccharides / Jones S.E., Paynich M.L., Kearns D.B., Knight K.L. // J. Immunol. — 2014. — Vol. 192, № 10. — P. 4813-4820.
21. The Bacillus subtilis quorum-sensing molecule CSF contributes to intestinal homeostasis via OCTN2, a host cell membrane transporter / Fujiya M., Musch M.W., Nakagawa Y. et al. // Cell Host Microbe. — 2007. — Vol. 1, № 4. — P. 299-308.
22. Zhang Y., Begley T.P. Cloning, sequencing and regulation of thiA, a thiamin biosynthesis gene from Bacillus subtilis // Gene. — 1997. — Vol. 198, № 1–2. — P. 73-82.
23. Crystal structure of thiamin phosphate synthase from Bacillus subtilis at 1.25 A resolution / Chiu H.J., Reddick J.J., Begley T.P., Ealick S.E. // Biochemistry. — 1999. — Vol. 38, № 20. — P. 6460-6470.
24. YaaD and yaaE are involved in vitamin B6 biosynthesis in Bacillus subtilis / Sakai A., Kita M., Katsuragi T. et al. // J. Biosci. Bioeng. — 2002. — Vol. 93, № 3. — P. 309-312.
25. Glycolaldehyde-forming route in Bacillus subtilis in relation to vitamin B6 biosynthesis / Sakai A., Katayama K., Katsuragi T., Tani Y. // J. Biosci. Bioeng. — 2001. — Vol. 91, № 2. — P. 147-152.
26. Investigation of 1-deoxy-D-xylulose 5-phosphate synthase and transketolase of Bacillus subtilis in relation to vitamin B6 biosynthesis / Sakai A., Kinoshita N., Kita M. et al. // J. Nutr. Sci. Vitaminol. (Tokyo). — 2003. — Vol. 49, № 1. — P. 73-75.
27. Ikeda H., Doi Y. A vitamin-K2-binding factor secreted from Bacillus subtilis // Eur. J. Biochem. — 1990. — Vol. 192, № 1. — P. 219-224.
28. Structure and reactivity of Bacillus subtilis MenD catalyzing the first committed step in menaquinone biosynthesis / Dawson A., Chen M., Fyfe P.K. et al. // J. Mol. Biol. — 2010. — Vol. 401, № 2. — P. 253-264.
29. Bentley R., Meganathan R. Biosynthesis of vitamin K (menaquinone) in bacteria // Microbiological Reviews. — 1982. — Vol. 46, № 3. — P. 241-280.
30. Extracellular amino acids of aerobic spore-forming bacteria / Smirnov V.V., Reznik S.R., Kudriavtsev V.A. et al. // Mikrobiologiia. — 1992. — Vol. 61, № 5. — P. 865-872.
31. Chattopadhyay S.P., Banerjee A.K. Production of valine by a Bacillus sp. // Z. Allg. Mikrobiol. — 1978. — Vol. 18, № 4. — P. 243-254.
32. Expression of activation markers on peripheral-blood lymphocytes following oral administration of Bacillus subtilis spores / Caruso A., Flamminio G., Folghera S. et al. // Int. J. Immunopharmacol. — 1993. — Vol. 15, № 2. — P. 87-92.
33. Immunostimulatory activity of Bacillus spores / Huang J.M., La Ragione R.M., Nunez A., Cutting S.M. // FEMS Immunol. Med. Microbiol. — 2008. — Vol. 53, № 2. — P. 195-203.
34. Sebastian A.P., Keerthi T.R. Immunomodulatory effect of probiotic strain Bacillus subtilis MBTU PBBMI spores in Balb/C Mice // International Journal of Engineering and Technical Research (IJETR). — 2014. — Vol. 2, № 11. — P. 258-260.
35. Räsänen L., Mustikkamäki U.P., Arvilommi H. Polyclonal response of human lymphocytes to bacterial cell walls, peptidoglycans and teichoic acids // Immunology. — 1982. — Vol. 46, № 3. — P. 481-486.
36. Effect of Bacillus subtilis natto on growth performance in Muscovy ducks / Sheng-Qiu T., Xiao-Ying D., Chun-Mei J. et al. // Rev. Bras. Cienc. Avic. — 2013. — Vol. 15, № 3. — P. 191-197.
37. Assessment of a probiotic based on Bacillus subtilis and its endospores in the obtainment of healthy lungs of pigs / Ayala L., Bocourt R., Milián G. et al. // Cuban Journal of Agricultural Science. — 2012. — Vol. 46, № 4. — P. 391-394.
38. Probiotic strain Bacillus subtilis CU1 stimulates immune system of elderly during common infectious disease period: a randomized, double-blind placebo-controlled study / Lefevre M., Racedo S.M., Ripert G. et al. // Immun. Ageing. — 2015. — Vol. 12. — Numb. of publ. 24.
39. Eerola E., Ling W.H. Intestinal microflora // Encyclopedia of Life Support Systems (EOLSS); http://www.eolss.net.
40. Horosheva T.V., Vodyanoy V., Sorokulova I. Efficacy of Bacillus probiotics in prevention of antibiotic-associated diarrhoea: a randomized, double-blind, placebo-controlled clinical trial // JMM Case Reports. — 2014. — DOI: 10.1099/jmmcr.0.004036.
41. Jeong J.S., Kim I.H. Effect of Bacillus subtilis C‑3102 spores as a probiotic feed supplement on growth performance, noxious gas emission, and intestinal microflora in broilers // Poult. Sci. — 2014. — Vol. 93, № 12. — P. 3097-3103.
42. Screening of Bacillus strains as potential probiotics and subsequent confirmation of the in vivo effectiveness of Bacillus subtilis MA139 in pigs / Guo X., Li D., Lu W. et al. // Antonie Van Leeuwenhoek. — 2006. — Vol. 90, № 2. — P. 139-146.
43. Effects of Bacillus subtilis KN‑42 on Growth Performance, Diarrhea and Faecal Bacterial Flora of Weaned Piglets / Hu Y., Dun Y., Li S. et al. // Asian-Australas J. Anim. Sci. — 2014. — Vol. 27, № 8. — P. 1131-1140.
44. Effects of Bacillus subtilis KD1 on broiler intestinal flora / Wu B.Q., Zhang T., Guo L.Q., Lin J.F. // Poult. Sci. — 2011. — Vol. 90, № 11. — P. 2493-2499.
45. Effect of Feeding Bacillus subtilis natto on Hindgut Fermentation and Microbiota of Holstein Dairy Cows / Song D.J., Kang H.Y., Wang J.Q. et al. // Asian-Australasian Journal of Animal Sciences. — 2014. — Vol. 27, № 4. — P. 495-502.
46. Yang J.J., Niu C.C., Guo X.H. Mixed culture models for predicting intestinal microbial interactions between Escherichia coli and Lactobacillus in the presence of probiotic Bacillus subtilis // Benef. Microbes. — 2015. — Vol. 6, № 6. — P. 871-877.
47. Zhang Y.R., Xiong H.R., Guo X.H. Enhanced viability of Lactobacillus reuteri for probiotics production in mixed solid-state fermentation in the presence of Bacillus subtilis // Folia Microbiol. (Praha). — 2014. — Vol. 59, № 1. — P. 31-36.
48. Improved growth and viability of lactobacilli in the presence of Bacillus subtilis (natto), catalase, or subtilisin / Hosoi T., Ametani A., Kiuchi K., Kaminogawa S. // Can. J. Microbiol. — 2000. — Vol. 46, № 10. — P. 892-897.
49. Helping Patients Make Informed Choices About Probiotics: A Need For Research / Sharp R.R., Achkar J.-P., Brinich M.A., Farrell R.M. // The American journal of gastroenterology. — 2009. — Vol. 104, № 4. — P. 809-813.
50. Crislip M. Probiotics // 2009; https://www.sciencebasedmedicine.org.
51. Chan K.Y., Au K.S. Studies on cellulase production by a Bacillus subtilis // Antonie Van Leeuwenhoek. — 1987. — Vol. 53, № 2. — P. 125-136.
52. Sharma A., Satyanarayana T. Microbial acid-stable α-amylases: Characteristics, genetic engineering and applications // Process Biochemistry. — 2013. — Vol. 48, № 2. — P. 201-211.
53. Guncheva M., Zhiryakova D. Catalytic properties and potential applications of Bacillus lipases // Journal of Molecular Catalysis B: Enzymatic. — 2011. — Vol. 68, № 1. — P. 1-21.
54. Gupta R., Beg Q.K., Lorenz P. Bacterial alkaline proteases: molecular approaches and industrial applications // Appl. Microbiol. Biotechnol. — 2002. — Vol. 59, № 1. — P. 15-32.
55. Khan M., Nakkeeran E., Umesh-Kumar S. Potential application of pectinase in developing functional foods // Annu. Rev. Food Sci. Technol. — 2013. — Vol. 4. — P. 21-34.
56. Biological treatments affect the chemical composition of coffee pulp / Ulloa Rojas J.B., Verreth J.A., Amato S., Huisman E.A. // Bioresour. Technol. — 2003. — Vol. 89, № 3. — P. 267-274.
57. Identification of proteolytic bacteria from thai traditional fermented foods and their allergenic reducing potentials / Phromraksa P., Nagano H., Boonmars T., Kamboonruang C. // J. Food Sci. — 2008. — Vol. 73, № 4. — P. M189-M195.
58. Похиленко В.Д., Перелыгин В.В. Пробиотики на основе спорообразующих бактерий и их безопасность // Химическая и биологическая безопасность. — 2007. — № 2–3. — С. 32-33.
59. Liu Y.P., Liu X., Dong L. Lactulose plus live binary Bacillus subtilis in the treatment of elders with functional constipation // Zhonghua Yi Xue Za Zhi. — 2012. — Vol. 92, № 42. — P. 2961-2964.
60. Hao Q., Dong B.R., Wu T. Probiotics for preventing acute upper respiratory tract infections // Cochrane Database of Systematic Reviews. — 2015. — Iss. 2. — Art. No.: CD006895.
61. Cartwright P. Bacillus subtilis-Identification & Safety // Probiotic news. — 2009. — № 2. — www.protexin.com.
62. Opinion of the Scientific Committee on a request from EFSA related to a generic approach to the safety assessment by EFSA of microorganisms used in food/feed and the production of food/feed additives // EFSA Journal. — 2005. — Vol. 3, № 6. — DOI: 10.2903/j.efsa.2005.226.
63. Sanders M.E., Morelli L., Tompkins T.A. Sporeformers as Human Probiotics: Bacillus, SporoLactobacillus, and BreviBacillus // Comprehensive Reviews in Food Science and Food Safety. — 2003. — Vol. 2, № 3. — P. 101-110.
64. Chitra N. Bacteremia associated with probiotic use in medicine and dentistry // International Journal of Innovative Research in Science, Engineering and Technology. — 2013. — Vol. 2, № 12. — P. 7322-7325.
65. Fuller R. Probiotics in man and animals // J. Appl. Bacteriol. — 1989. — Vol. 66, № 5. — P. 365-378.

/37.jpg)
/38.jpg)