Статтю опубліковано на с. 95-100
За даними Всесвітньої організації охорони здоров’я (ВООЗ), при аналізі структури причин звернення до педіатра чи лікаря загальної практики — сімейної медицини близько 70 % випадків припадає на гострі респіраторні захворювання (ГРЗ) [2]. Значну роль серед них відіграють гострі респіраторні вірусні інфекції (ГРВІ), що є найбільш поширеною групою інфекційних захворювань та об’єднуються за принциповою спільністю епідеміологічних, патогенетичних, клінічних характеристик.
За даними різних авторів, на ГРВІ припадає від 70 до 90 % усієї інфекційної патології дитячого віку [3, 20]. В Україні серед дитячого населення щороку реєструється 4,5–5 млн випадків ГРВІ, які, з одного боку, призводять до порушення безперервності навчального процесу в дошкільнят та школярів, а з іншого — до тимчасової непрацездатності в дорослих унаслідок потреби догляду за хворою дитиною. У середньому частота ГРВІ в дітей становить 4–6 випадків на рік, а в дітей, які часто хворіють, — 6–10 випадків на рік [1, 2, 11]. Така висока захворюваність у дітей пояснюється численністю тропних до респіраторного епітелію вірусів (понад 200 типів, що належать до 9 різних нозологічних груп), легкістю передачі збудника, його значною мінливістю та циклічністю циркуляції в популяції, особливостями імунітету дитини (імунодефіцит дозрівання). Часто ГРВІ є причиною вторинних бактеріальних ускладнень та загострення існуючої хронічної патології. Часті ГРВІ призводять до ослаблення захисних сил дитячого організму, спричиняють алергізацію, перешкоджають проведенню профілактичних щеплень, затримують фізичний та нервово-психічний розвиток дитини [14]. Усе вищезазначене вказує на те, що вдосконалення підходів до профілактики та лікування ГРВІ залишається актуальною проблемою педіатрії.
Найчастішими збудниками ГРВІ у дітей є:
— ортоміксовіруси (вірус грипу);
— параміксовіруси (вірус парагрипу, респіраторно-синцитіальний вірус);
— аденовіруси;
— пікорнавіруси (віруси ЕСНО, віруси Коксакі, риновіруси);
— реовіруси;
— коронавіруси.
Для усіх ГРВІ клінічно характерне поєднання інтоксикаційного синдрому (лихоманка, зниження апетиту, слабкість, міалгії, головний біль та інше) з катаральним. Перший з них найбільш виражений при сезонному грипі А, катаральний синдром при цьому має переважно ознаки ураження трахеї, при аденовірусних захворюваннях це фарингокон’юнктивіт, при парагрипі — ларингіт, при респіраторно-синцитіальній інфекції — бронхіт і/або бронхіоліт.
Патогенез усіх ГРВІ має багато спільного, що зумовлене епітеліотропністю вірусів, їх токсичною дією, віремією. При недостатності місцевого імунітету (вміст у секреті верхніх дихальних шляхів секреторного IgA, лізоциму, пропердину, інтерферону (IFN)) вірус починає швидко реплікуватися, інфікуючи нижні дихальні шляхи та спричинюючи ларингіт, трахеїт, бронхіт чи пневмонію. При цьому відзначають дегенеративно-десквамативний процес з частковим некрозом клітин циліндричного епітелію. Слизова оболонка залишається без захисту та стає вхідними воротами для вторинної бактеріальної флори. У патологічний процес втягуються розташовані нижче тканини, розвиваються набряк, гіперемія, що клінічно проявляється катаром дихальних шляхів. З верхніх дихальних шляхів вірус потрапляє в кров та призводить до віремії. Віремія разом із токсичними продуктами взаємодії вірусу й клітин сприяє розвитку синдрому інтоксикації. Особливо чутливі до токсикозу центральна нервова та серцево-судинна системи [14].
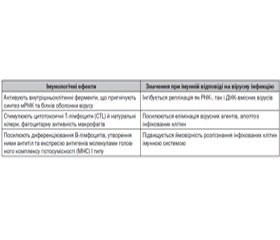
Визначну роль в захисті дитячого організму від вірусних інфекцій, особливо у ранньому віці, відіграють неспецифічні фактори захисту імунної системи, до яких також належать інтерферони. Так, при потраплянні респіраторного вірусу в епітелій слизових оболонок дихальних шляхів повітряно-крапельним чи контактним шляхами відбувається первинна його репродукція з розвитком місцевої реакції. При цьому активуються відповідні Toll-подібні та цитозольні рецептори епітеліоцитів, дендритних клітин, альвеолярних макрофагів респіраторного тракту макроорганізму патоген-асоційованими молекулярними структурами (pathogen-associated molecular patterns) вірусного агента, відбувається активація інтерферонрегулюючих факторів, що контролюють продукцію лейкоцитами інтерферонів I виду, а саме інтерферону альфа. Останні, у свою чергу, індукують транскрипцію великої групи генів, що відіграють провідну роль у процесах саногенезу при вірусних інфекціях [1, 10, 15]. Інтерферон α спричиняє такі зміни в клітині, що запобігають розмноженню вірусів (табл. 1).
/96.jpg)
Як видно з наведеного вище, система інтерферонів є ключовим елементом противірусного захисту дитячого організму. Особливу роль відіграє інтерферон альфа, що починає визначатися в тканинах плода з 10-го тижня гестації. Надалі має місце висока здатність до інтерфероноутворення протягом усього терміну вагітності. Після народження дитини рівень інтерферону альфа знижується, а в більш пізньому віці починає поступово наростати та досягає максимального рівня у 12 років [10]. Особлива його роль підтверджується результатами досліджень різних авторів, які вказують на те, що зниження продукції інтерферону альфа є однією з вагомих причин частих вірусних інфекцій, що мають тенденцію до затяжного перебігу та розвитку бактеріальних ускладнень [10–12, 15, 19]. Саме тому з метою етіотропного лікування ГРВІ використовують препарати інтерферону чи препарати, що підвищують синтез власного інтерферону (індуктори інтерфероногенезу). Останні зареєстровані та широко використовуються лише в країнах СНД. При їх призначенні необхідно пам’ятати:
— вірус є потужним інтерфероногеном, що підвищує у хворого власний інтерфероногенез, а додаткова штучна стимуляція може призвести до зриву компенсаторних можливостей імунної системи, ймовірного розвитку алергічних та автоімунних захворювань. Особливо це стосується стимуляції продукції γ-інтерферону [21]. Згідно з результатами досліджень Є.І. Юліша та співавт. (2010), у часто хворіючих дітей (ЧХД) на фоні персистуючого перебігу респіраторної вірусної інфекції має місце значне підвищення у крові рівня γ-інтерферону та зниження в 1,5 раза рівня α-інтерферону порівняно зі здоровими дітьми [25, 28];
— наявність гіпореактивності — прогресивного зниження рівня продукції інтерферону при введенні кожної наступної дози індуктора інтерфероногенезу аж до повної відсутності відповіді. Це явище є захисним механізмом, що запобігає гіперпродукції інтерферону. Воно здійснюється за принципом негативного зворотного зв’язку [37].
Отже, додаткова стимуляція інтерфероногенезу медикаментозно не завжди є ефективною, а іноді буває небезпечною.
Другу групу медикаментів становлять власне препарати інтерферонів. Ще до їх відкриття в 1935 році вірусологи зіткнулися з малозрозумілим тоді феноменом інтерференції (взаємного пригнічення) вірусів: після зараження клітин вірусом одного типу вони стають несприйнятливими до зараження іншими вірусами протягом усього інфекційного процесу, викликаного першим вірусом. Це пов’язано з продукцією зараженими клітинами низькомолекулярного білка, який у 1957 році відкрили англієць Alick Isaacs та швейцарець Jean Lindenmann та назвали інтерфероном [31].
Інтерферони — це група цитокінів з контрольно-регуляторними функціями, що за структурою та біологічними властивостями поділяються на 3 типи — альфа, бета та гамма (α, β, γ), які об’єднані у 2 види: 1-й — α і β, 2-й — γ. Належать до класу індуцибельних білків та являють собою глікопротеїни з молекулярною масою 20–30 кД. Інтерферони α і β продукуються лейкоцитами й фібробластами у відповідь на вірусну інфекцію, інтерферон γ — Т-клітинами у відповідь на антиген чи міоген [9, 10]. Пізніше було виявлено ще 2 типи інтерферонів — омега (ω) і тау (τ). Встановлено, що різні клітини чутливі до інтерферонів різних типів. Так, інтерферони α, β, ω на поверхні клітин мають спільний рецептор IFNAR, інтерферон γ — окремий IFNGR. Вплив інтерферонів на функції клітин дуже широкий, він включає:
1) інгібування:
— проліферації клітин;
— росту пухлин;
— диференціювання фібробластів-адипоцитів;
2) стимуляцію:
— диференціювання промієлоцитів і монобластних лейкозних клітин;
— фагоцитозу макрофагами;
— індуковану ендотоксинами секрецію макрофагами інтерлейкіну-1;
— генерації цитотоксичних Т-лімфоцитів;
— активності натуральних кілерів;
— експресії антигенів МНС I і II типів та Fc-рецепторів;
3) змішані ефекти:
— диференціювання клітин еритролейкозу;
— продукцію антитіл за рахунок посилення диференціювання В-лімфоцитів;
— феномен клітинного імунітету — інтерферони α і β, що виділяються з уражених вірусом клітин, діють на сусідні клітини, перешкоджаючи реплікації вірусу в них і створюючи таким чином противірусний статус [9, 35].
Клітина, що зазнала дії інтерферону в невеликій концентрації, у майбутньому після відповідної стимуляції виробляє його вже більше — явище priming [26].
Окрім противірусної, імуномодулюючої та антипроліферативної дії доведено ще й антибактеріальну дію інтерферонів, яка пов’язана з індукцією NO-синтетази, що призводить до зменшення вмісту L-триптофану, негативно впливаючи на метаболізм бактеріальної клітини [10]. Усе це дозволяє ефективно використовувати інтерферони в лікуванні більше ніж 50 видів інфекційних, запальних, онкологічних захворювань [3].
Протягом існування препаратів інтерферону змінювалися підходи до їх виробництва. Так, перші препарати виділялися з лейкоцитів донорської крові, були досить дорогими, алергенними, мали ризик інфікування пацієнта вірусами (ВІЛ, гепатити В та С, цитомегаловірус). Однак із розвитком генної інженерії було впроваджено три основних методики отримання інтерферонів для клінічного використання. Один з них, рекомбінантний інтерферон альфа-2b, продукується E.coli, у ДНК якої вбудований ген інтерферону людини. Це значно зменшує вартість виробництва й зводить до нуля ймовірність передачі інфекції від донора [9]. Ген α-2b IFN, використаний для виготовлення препарату, домінує в людській популяції, тому до нього не синтезуються антитіла, що забезпечує стійкий терапевтичний ефект. Інтерферон, продукований бактерією, не має вуглеводневої частини, та це не впливає на його біологічну активність [1, 10, 19, 29].
Рандомізоване дослідження з оцінки клініко-імунологічної ефективності рекомбінантного інтерферону альфа-2b у дітей від 1 до 14 років, проведене під керівництвом проф. В.П. Тиміної (1998–2000 рр.), переконливо довело доцільність його використання при ГРВІ 5-денним курсом. Було виявлено такі клінічні ефекти інтерферонотерапії: пришвидшення закінчення лихоманки, зменшення термінів тривалості інтоксикації, нежитю, кашлю, крупу. У роботі наголошується, що інтерферонотерапія сприяє швидшому регресуванню клінічних ознак ГРВІ у дітей, а це на 1–2 дні скорочує тривалість стаціонарного лікування та дає значний економічний ефект [23].
Показано, що інтерферон альфа у дітей має ад’ювантні властивості при проведенні протигрипозної вакцинації [22, 38]. Крім того, у період пандемії грипу в противірусну терапію дітей рекомендоване включення рекомбінантного інтерферону альфа-2β як обов’язкового засобу лікування та профілактики [6, 7, 24].
У дослідженнях на тваринах доведено, що інтерферон альфа знижує вірусне навантаження в легеневій тканині при інфекційному процесі, викликаному вірусами грипу А типів H5N1 та H1N1, запобігає летальному кінцю в мишей при інфікуванні їх вірусом грипу А типу H5N1, при цьому не чинить токсичного впливу на печінку та селезінку [30].
В одному іноземному дослідженні було показано, що інтерферон альфа має широку антивірусну дію, пригнічує реплікацію вірусу пташиного грипу А (H7N9) — як дикого штаму, так і штаму, резистентного до дії інгібіторів нейрамінідази [34].
На сьогодні на фармацевтичному ринку України є препарати рекомбінантного інтерферону альфа-2b людини у формі інтраназальних крапель (спреїв), порошків для приготування розчинів для парентерального введення, ректальних супозиторіїв.
У широкій педіатричній практиці ін’єкційні форми інтерферону не знайшли широкого застосування через ряд недоліків. Найбільш частий — це розвиток грипоподібного синдрому, що спостерігається протягом 3 годин після введення препарату і проявляється лихоманкою, ознобом, швидкою втомлюваністю, головним болем, міалгією, артралгією та анорексією [9]. Також для маленьких пацієнтів є травматичним саме проведення ін’єкції.
Інтраназальне введення рекомбінантного інтерферону альфа-2b людини широко застосовується з позитивним ефектом у клінічній практиці для профілактики та лікування ГРВІ, особливо на початковому етапі при появі перших симптомів. Так, результати досліджень показують, що застосування IFN в епідемічний період ГРВІ дозволяє зменшити захворюваність більше ніж на 75–76 % порівняно з використанням плацебо. Інтраназальне застосування інтерферонів при появі перших симптомів ГРВІ дозволяє уникнути маніфестації захворювання у 80 % випадків [16]. У дослідженні Kugel та співавт. (2009) доведено, що інтраназальне призначення альфа-інтерферону вірогідно зменшує захворюваність на сезонний грип А у тхорів [32].
Назальна форма інтерферонів у вигляді спрея та крапель є дуже зручною для використання. Проте при тяжкому перебігу ГРЗ, при подальшому розвитку інфекції, її системних проявах є необхідність застосування препаратів, що впливають системно, потрапляючи в організм дитини.
У цьому плані інтерес становить лікарська форма препаратів рекомбінантних інтерферонів у вигляді ректальних супозиторіїв. Ректальне введення лікарської речовини (ЛР) має ряд переваг: завдяки інтенсивному кровопостачанню прямої кишки ЛР швидко надходить у системний кровотік; відсутній метаболічний ефект першого проходження через печінку (кров від прямої кишки через нижні ректальні вени потрапляє в нижню порожнисту вену, минаючи портальну вену печінки, де відбувається модифікація та інактивація значної кількості ЛР); можливість уникнути подразнення ЛР слизової оболонки шлунка, безболісний шлях введення, можливість застосування при утрудненні ковтання (підвищення блювотного рефлексу). Завдяки першим двом перевагам досягається висока біодоступнісь ЛР, що забезпечує швидкий терапевтичний ефект та знижує ризик небажаної взаємодії з іншими препаратами [5, 33]. При ректальному введенні інтерферону альфа:
— біодоступність становить понад 80 %;
— максимальна концентрація INF у сироватці крові досягається через 5 годин після введення препарату;
— основним шляхом виведення є нирковий катаболізм;
— період напіввиведення становить 12 годин, що обумовлює необхідність застосування препарату 2 рази на добу;
— усуваються побічні ефекти (грипоподібний синдром), характерні для парентеральних форм препарату [18, 24, 33].
У дослідженнях В.Г. Бекетової (2011) та А.Н. Васильєва (2010) продемонстровано: комбінація інтерферону з антиоксидантом має більш високу противірусну активність порівняно з терапією монопрепаратом інтерферону. Це дозволяє знизити курсову дозу препарату та час прийому антибактеріальних медикаментів [4, 8].
Представником ректальної форми рекомбінантного інтерферону альфа-2b на фармацевтичному ринку України є Лаферобіон® (ТОВ «ФЗ «Біофарма»), що широко використовується в педіатричній практиці. Один супозиторій містить інтерферону альфа-2b рекомбінантного людини 150 000 МО або 500 000 МО, що має виражену антивірусну, антипроліферуючу та імуномодулюючу дію. Комплексний склад препарату обумовлює ряд нових ефектів: завдяки поєднанню з токоферолу ацетатом та аскорбіновою кислотою антивірусна активність інтерферону альфа-2b рекомбінантного збільшується в 10–14 разів, підсилюється його імуномодулююча дія на Т- та В-лімфоцити, нормалізується вміст імуноглобуліну Е. Не утворюються антитіла, що нейтралізують антивірусну активність інтерферону альфа-2b рекомбінантного, навіть при його застосуванні протягом 2 років, нормалізується функціонування ендогенної системи [13].
Свічки Лаферобіон® виготовлені на основі твердого жиру, що дозволяє легко ввести супозиторій до того, як він почне танути в руках (це пов’язано з високою температурою плавлення) та знижує ймовірність алергічних реакцій (на відміну від ректальних форм на основі масла какао) [3, 10, 19].
Згідно з інструкцією Лаферобіон® супозиторії призначається дітям у комплексній терапії ГРВІ, він дозується так:
— новонародженим і недоношеним дітям препарат призначають ректально ректально по 150 000 МО 2 рази на добу з 12-годинною перервою. Курси лікування й перерви між курсами — по 5 днів;
— недоношеним новонародженим дітям з гестаційним віком менше ніж 34 тижні призначають препарат по 150 000 МО 3 рази на добу (через 8 годин), курс становить 5 днів;
— дітям віком від 1 до 7 років — по 500 000 МО 2 рази на добу протягом 5 днів;
— дітям від 7 до 14 років — по 1 000 000 МО 2 рази на добу протягом 5 днів.
Усі побічні реакції, пов’язані із застосуванням Лаферобіону®, є незначними або середньої тяжкості. Після закінчення лікування вони зазвичай зникають.
Ефективність використання Лаферобіону® для профілактики гострих респіраторних захворювань у дітей 1–3 років вивчалася О.Б. Безкаравайним та співавт. (2011). Під спостереженням перебували 30 дітей з групи ЧХД, у яких середня частота ГРЗ становила 7,05 ± 0,42 випадку на рік, а середня тривалість — 8,35 ± 0,45 доби. Для профілактики ГРЗ пацієнтам призначався Лаферобіон® у супозиторіях за такою схемою: по 150 000 МО двічі на добу 10 днів. Було проведено 2 курси з 5-денною перервою у вересні за 1–2 місяці до передбачуваного росту захворюваності на ГРЗ. Протягом року за даною групою дітей проводилося спостереження. Було встановлено, що захворюваність дітей на ГРЗ вірогідно знизилася на 24,8 % (p < 0,05), становлячи при цьому 5,30 ± 0,37 випадку на рік. Аналогічна тенденція відмічалась відносно показників середньої тривалості одного випадку ГРЗ, що зменшилася на 21,6 % (p < 0,05) та становила 6,55 ± 0,38 доби. Авторами зроблений висновок, що ректальна форма Лаферобіону® є ефективним засобом профілактики ГРЗ у дітей раннього віку [3].
У роботі проф. А.П. Юрцевої та співавт. (2014) зазначено, що застосування ректальної форми Лаферобіону® в дітей, які часто хворіють на ГРВІ, ускладнені бронхообструктивним синдромом, сприяє модуляції імунної відповіді клітинною й гуморальною ланками, під його впливом підвищується вміст інтерферону γ та IL-4, знижується концентрація загального IgE. Крім того, автори зазначають, що під впливом лікування Лаферобіоном® відзначаються зменшення інтенсивності процесів перекисного окислення ліпідів та позитивна динаміка показників антиоксидантного захисту. Свідченням цього є зниження вмісту продуктів перекисного окислення ліпідів та тенденція до нормалізації активності антиоксидантних ферментів глутатіонового блоку (глутатіонредуктази й глутатіонпероксидази) та церулоплазміну. У висновках автори зазначають, що профілактичне призначення Лаферобіону® сприяє зниженню частоти ГРВІ та нападів бронхообструкції. Використання препарату є перспективним засобом профілактики бронхообструктивного синдрому в дітей на тлі ГРВІ. Дослідниками було встановлено, що включення Лаферобіону® в комплекс лікування та профілактики в цієї групи пацієнтів сприяє зменшенню частоти ГРВІ у 2,6 раза, зниженню частоти нападів бронхообструкції на тлі ГРВІ у 2,8 раза, зменшенню тривалості бронхообструкції [29].
Професор Є.І. Юліш у своїх наукових публікаціях (2013) розглядає клінічну ефективність застосування Лаферобіону® та зазначає, що застосування рекомбінантних інтерферонів альфа-2b є перспективним напрямком для профілактики й лікування вірусно-бактеріальних захворювань у дітей усіх вікових груп, включаючи недоношених новонароджених і дітей раннього віку. Це пов’язано зі здатністю альфа-2b інтерферонів не тільки блокувати розмноження інфекційних агентів, зокрема вірусів, але й оберігати від інфікування здорові клітини, що сприяє зменшенню тяжкості захворювань, зниженню частоти ускладнень і рецидивів інфекції [27].
У публікаціях С.Л. Няньковського та співавт. (2015) підтверджується клінічна ефективність і безпечність препарату Лаферобіон® у свічках при лікуванні гострих вірусних інфекцій у дітей різного віку [20].
Отже, з огляду на вищевикладене можна зробити такі висновки:
1. Система інтерферонів є ключовим елементом противірусного захисту дитячого організму, що етіопатогенетично обґрунтовує застосування препаратів рекомбінантного інтерферону альфа-2b з метою профілактики та лікування ГРВІ у дітей.
2. Назальні форми препаратів рекомбінантного інтерферону альфа-2b доцільно застосовувати для профілактики ГРВІ та при появі перших ознак захворювання, ректальні — з перших годин хвороби при наявності вираженої симптоматики.
3. Перевагами ректальних форм препаратів рекомбінантного інтерферону альфа-2b є зручність застосування, відсутність грипоподібного синдрому, високий рівень абсорбції лікарської речовини, відсутність метаболічного ефекту першого проходження через печінку.
Список литературы
1. Абатуров А.Е. Роль интерферонов в защите респираторного тракта. Часть 2. Механизмы действия интерферонов / А.Е. Абатуров, Е.И. Юлиш // Здоровье ребенка. — 2007. — № 6(9).
2. Баранов А.А. Педиатрия: Национальное руководство: В 2 томах. — М.: ГЭОТАР-Медиа, 2009.
3. Безкаравайный Б.А. Актуальные аспекты профилактики острых респираторных заболеваний у детей раннего возраста / Б.А. Безкаравайный, А.Н. Волошин, Т.В. Гибнер, Е.Л. Войлова // Здоровье ребенка. — 2011. — № 6(33). — С. 64-66.
4. Бекетова Г.В. Интерфероны в лечении острых респираторных инфекций у детей / Г.В. Бекетова // Ліки України. — 2011. — № 3. — С. 106-109.
5. Белоусов Ю.В., Гуревич К.Г. Клиническая фармакология. Практика дозирования лекарств. — М.: Литтера, 2005. — 38 с.
6. Булгакова В.А. Противовирусная терапия острых респираторных инфекций у детей / В.А. Булгакова // Лечащий врач. — 2012. — № 8.
7. Бурцева Е.И. Мониторинг чувствительности эпидемических штаммов вирусов гриппа, изолированных в России, к этиотропным препаратам / Е.И. Бурцева, Е.С. Шевченко, Н.В. Белякова и др. // Вопр. вирусол. — 2009. — Т. 54, № 5. — С. 24-87.
8. Васильев А.Н. Оценка влияния антиоксидантов на специфическую противовирусную активность интерферона альфа-2b человеческого рекомбинантного в отношении вируса простого герпеса в культуре клеток / А.Н. Васильев // Антибиотики и химиотерапия. — 2010. — № 7. — С. 20-25.
9. Дитяча імунологія / За ред. Л.І. Чернишової, А.П. Волохи. — К.: Медицина, 2013. — 720 с.
10. Дранник Н.Г., Дудник В.М. Клиническая иммунология и аллергология. — К., 2010. — 552 с.
11. Заплатников А.Л. Иммунопрофилактика и иммунотерапия острых респираторных инфекций у детей / А.Л. Заплатников // Лечащий врач. — 2006. — № 9. — С. 50-56.
12. Знаменская А.А. Лечение и профилактика острых респираторных инфекций у часто болеющих детей / А.А. Знаменская, В.Л. Фомина, В.Ф. Учайкин и др. // Лечащий врач. — 2011. — № 1.
13. Інструкція із застосування препарату Лаферобіон® супозиторії.
14. Інфекційні хвороби у дітей: Клінічні лекції / За ред. C.О. Крамарева. — К.: Моріон, 2003. — С. 69-82.
15. Казмирчук В.Е., Мальцев Д.В. Пособие по клинической иммунологии для практических врачей. — К.: Здоров’я України, 2012. — 368 с.
16. Крамарев С.О. Оцінка ефективності рекомбінантного інтерферону альфа для профілактики та лікування гострих респіраторних вірусних інфекцій у дітей / С.О. Крамарев, В.В. Євтушенко // Здоров’я України. — 2008. — № 18/1. — С. 49-50.
17. Лыткина И.Н. Профилактика и лечение гриппа и острых респираторных вирусных инфекций среди эпидемиологически значимых групп населения / И.Н. Лыткина, Н.А. Малышев // Лечащий врач. — 2010. — № 10. — С. 65-69.
18. Марушко Ю.В. Клінічні аспекти використання лаферобіону в педіатрії / Ю.В. Марушко, О.С. Мовчан // Современная педиатрия. — 2012. — № 7(47). — С. 1-4.
19. Намазова Л.С. Часто болеющие дети мегаполисов: лечение и профилактика острых респираторных инфекций / Л.С. Намазова, Р.М. Торшхоева, В.В. Ботвиньева // Педиатр. фармакология. — 2005. — № 1. — С. 3-7.
20. Няньковський С.Л. Клінічні особливості використання інтерферонів при лікуванні ГРВІ у дітей / С.Л. Няньковський, О.С. Няньковська, М.С. Яцула // Здоровье ребенка. — 2015. — № 5(65). — С. 77-82.
21. Свистушкин В.М. Возможности лечения больных с острыми респираторными вирусными инфекциями в настоящее время / В.М. Свистушкин, Г.Н. Никифорова, Н.П. Власова // Лечащий врач. — 2013. — № 1.
22. Чеботарева Т.А. Эффективность Виферона® в терапии и профилактике гриппа и других ОРВИ у детей / Т.А. Чеботарева, Л.Н. Мазанкова // Новини медицини та фармації. — 2010. — № 2 (307). — С. 15-19.
23. Чеботарева Т.А. Применение Виферона при гриппе и других острых респираторных вирусных инфекциях у детей / Т.А. Чеботарева, В.П. Тимина, В.В. Малиновская // Детский доктор. — 2000. — 5. — С. 16-18.
24. Чеботарева Т.А. Современная интерферонотерапия гриппа и острых респираторных инфекций у детей / Т.А. Чеботарева, Е.Н. Выжлова, И.Н. Захарова, А.Л. Заплатников // Лечащий врач. — 2013. — № 4.
25. Юлиш Е.И. Клинико-иммунологический статус детей, воспитывающихся в доме ребенка / Е.И. Юлиш, И.В. Балычевцева, С.Г. Гадецкая // Совр. педиатрия. — 2010. — № 1(29). — С. 63-71.
26. Юлиш Е.И. Подходы к терапии острых респираторных заболеваний у часто и длительно болеющих детей / Е.И. Юлиш, Б.И. Кривущев, С.Я. Ярошенко // Здоровье ребенка. — 2011. — № 2(29). — С. 85-89.
27. Юлиш Е.И. Противовирусная терапия в лечении острых респираторных заболеваний у детей / Е.И. Юлиш // Совр. педиатрия. — 2013. — № 5(53). — С. 75-78.
28. Юлиш Е.И. Реабилитация часто и длительно болеющих детей при различном течении персистирующих инфекций / Е.И. Юлиш, С.Я. Ярошенко // Вестн. физиотерапии и курортол. — 2010. — Т. 16, № 6. — С. 193.
29. Юрцева А.П. Ефективність застосування Лаферобіону в дітей із рецидивуючим бронхообструктивним синдромом, які часто хворіють на гострі респіраторні захворювання / А.П. Юрцева, О.В. Фофанова, Н.Б. Осадець, О.П. Боднар // Здоровье ребенка. — 2014. — № 5(56). — С. 81-86.
30. Haasbach E. Low-dose interferon Type treatment is effective against H5N1 and swine-origin H1N1 influenza A viruses in vitro and in vivo / E. Haasbach, K. Droebner, A. Vogel et al. // J. Interferon Cytokine Res. — 2011. — 31(6). — Р. 515-525.
31. Isaacs A. Virus interference. I. The interferon / A. Isaacs, J. Lindenmann // Proc. R. Soc. London B. Biol. Sci. — 1957. — Vol. 147. — P. 258-267.
32. Kugel D. Intranasal Administration of Alpha Interferon Reduces Seasonal Influenza A Virus Morbidity in Ferrets / D. Kugel, G. Kochs, K. Obojes // J. Virol. — April 2009. — Vol. 83. — P. 3843-3851.
33. Lakshmi Prasanna J. Rectal drug delivery: A promising route for enhancing drug absorption / J. Lakshmi Prasanna, B. Deepthi, N. Rama Rao // Asian J. Res. Pharm. Sci. — 2012. — Vol. 2, Issue 4. — P. 143-149.
34. Liu Q. Emergence of a novel drug resistant H7N9 influenza virus: evidence based clinical potential of a natural INF-α for infection control and treatment / Q. Liu, J. Ma, D.R. Strayer et al. // Expert review of Anti-infective Therapy. — 2014. — 12(2). — Р. 165-169.
35. Randall R.E. Interferons and viruses: an interplay between induction, signalling, antiviral responses and virus countermeasures / R.E. Randall, S. Goodbourn // J. Gen. Virol. — 2008. — Vol. 89. — P. 1-47.
36. Stites D.P., Terr A.I. Review of Basic and Clinical Immunology. — 7th ed. — Norwalk, CT: Apleton & Lange, 1990. — Р. 93.
37. Stringfellow D.A. Production of the interferon protein: hyporesponsiveness // Tex. Rep. Biol. Med. — 1997. — Vol. 35. — P. 126-131.
38. Tovey M.G. Adjuvant activity of interferon alpha in influenza vaccination / M.G. Tovey, F. Bloch, O. Launay et al. // Cytokines. — 2006. — 17. — 132.

/96.jpg)